서론
산업혁명에서부터 시작된 기술의 빠른 발전은 인류에게 편리함과 더불어 환경오염, 에너지 고갈 등의 여러 문제점 또한 가져다주었다. 대표적인 문제로는 화석 연료 사용으로 인한 지구온난화가 거론되고 있는데, 지구온난화의 주요 원인인 이산화 탄소 배출을 감소할 수 있는 정책이 현재 세계적으로 화두이다. 그중 화석 연료의 사용을 줄이는 방법으로 신재생 에너지의 활용을 늘리는 방안이 제시되고 있으며, 이러한 신재생 에너지원의 가장 효율적인 저장장치로서 이차 전지가 꼽히고 있다.
이차 전지는 기존의 일차 전지처럼 일회성의 에너지 사용이 아닌 외부 전하로 전지를 다시 충전하여 반복적인 사용이 가능케 한 전지를 말한다. 전극 소재의 선택에 따라 전지의 명칭이 달라지는데 대표적인 이차 전지는 전자의 이동에 대한 보상으로서 리튬 이온을 사용하는 리튬 이온 전지가 가장 대표적인 이차 전지로 알려져 있다.[1] 리튬 이온 이차전지의 특징으로는 높은 작동 전압과 긴 수명, 그리고 낮은 자가 방전 속도 등을 가지고 있다. 특히 카드뮴, 납과 같은 중금속의 사용이 배제되며, 용량 대비 소형화가 가능하다는 점, 500회 이상의 충·방전이 가능하다는 점에서 많은 관심을 받고 있다. 리튬 이차 전지는 양극과 음극의 산화 환원 반응을 통해 화학에너지를 전기에너지로 변환할 수 있는 장치이다. 이차 전지를 구성하는 요소는 크게 양극, 음극, 분리막, 전해질로 이루어져 있다. 이 중 양극 소재는 리튬 이온이 삽입되는 반응에서 음극 대비 작은 용량을 가지기 때문에 전지의 용량을 결정하는 데에 가장 개선의 여지가 크다.[2] 현재 양극 소재는 단일 혹은 여러 가지 금속을 혼합한 산화물을 사용한다.
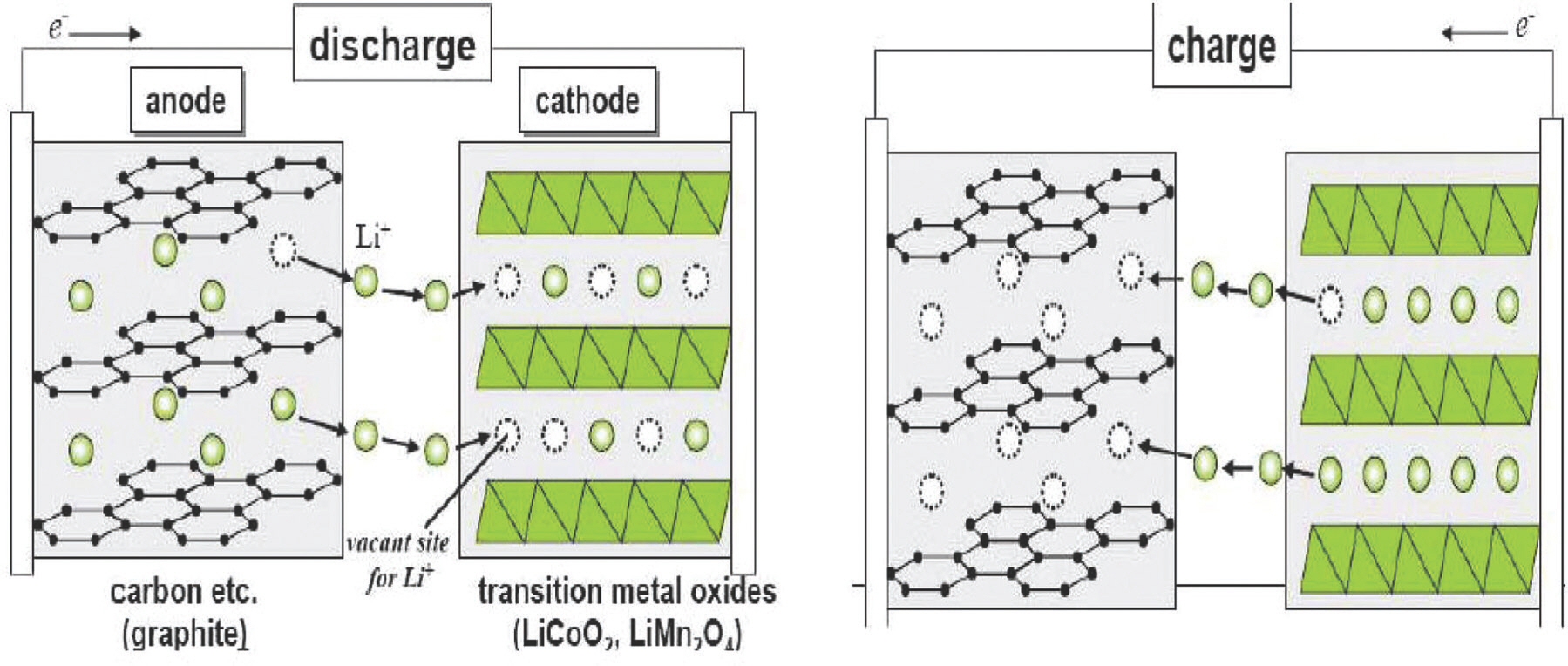
산화 환원 반응은 전자의 이동을 기준으로, 전자가 이동하여 전자 수가 적어지는 현상인 ‘산화’ 반응과 전자가 이동되어 전자 수가 많아지는 현상인 ‘환원’ 반응으로 구분된다. 전지에서는 이러한 산화 환원 과정동안, 외부 도선을 통하여 양극과 음극 사이의 전자 이동이 일어나고 전기에너지로 변환된다. 리튬 이차 전지에서 리튬 이온은 전지 내의 전해질 물질을 통해 이동하고 전자는 양극과 음극 사이의 도선을 통해 이동하면서 전기에너지를 만들어낸다.[3] Figure 1.은 리튬 이온 전지의 산화 환원 반응을 통해 이동하는 리튬 이온과 전자로 충전과 방전을 보여주는 그림이다.
충전 시에는 리튬 이온과 전자가 양극에서 음극으로 이동하고 방전 시에는 리튬 이온과 전자가 음극에서 양극으로 이동한다. 대표적인 리튬 이차 전지는 코발트를 사용한 LiCoO2를 양극으로, 탄소로 구성된 흑연을 음극으로 사용한다. 아래는 각 전극의 산화 환원 반응식과 전체적인 반응식이다.

금속 산화물은 금속 원자와 산소 원자의 배열 방법에 따라 다양한 결정학적 구조를 가지게 된다.[4] 리튬 이차 전지에 쓰이는 양극 소재에는 층상 구조, 올리빈 구조, 스피넬 구조, 암염 구조가 있다.
코발트를 주 원소로 한 LiCoO2는 가장 먼저 알려진 층상 구조의 양극 소재로 이에 대한 에너지 저장 특성 연구가 활발하게 진행이 되어 왔다. 하지만 코발트는 전 세계적으로 매장량이 적은 희토류 금속이기에 수요 대비 공급에 난항을 겪고 있고, 채굴 과정에서는 환경 적인 문제가 있으며, 강한 독성을 지니고 있어 사용 시에 주의가 필요하다는 점이 있다. 또한, 최근 채굴과정의 비윤리성에 대한 사회적 문제가 대두됨에 따라 코발트의 함량을 줄이거나 대체하는 방향의 연구가 진행되고 있다.
코발트를 대체하기 위해 연구된 분야로는 LiCoO2의 형태에서 코발트 자리에 니켈과 망간이 들어가는 3성분계 산화물인 Li(Nix Coy Mn1-x-y)O2 (NCM)가 있다. Li(Nix Coy Mn1-x-y)O2는 각각 구성 금속의 특성인 니켈의 가역적인 용량, 코발트의 충·방전 안정성, 망간의 구조적 안정성을 높이는 역할을 하며 세 가지 전이 금속을 적절히 조합해서 만든 산화물이다. NCM 양극 소재는 LCO와 비슷한 이론 용량을 가지고 있지만, 실제 산소와 코발트의 에너지 밴드가 겹쳐있는 전자 에너지 중첩 문제로 50% 이상의 리튬이 탈리되면 층상 구조는 유지되지 않는다. 따라서 LCO는 이론 용량의 반 정도만 가용할 수 있다. 앞서 설명한 단점으로 인하여 니켈의 양을 증가시킨 고 니켈 산화물을 사용한 양극 소재가 활발히 연구 개발되고 있다. 고 니켈 산화물을 사용한 양극은 더 높은 용량을 나타내지만 여러 번의 충·방전 시 일어나는 층상 구조의 붕괴로 전지의 수명을 늘리기 위해 추 가적인 연구가 필요하다.
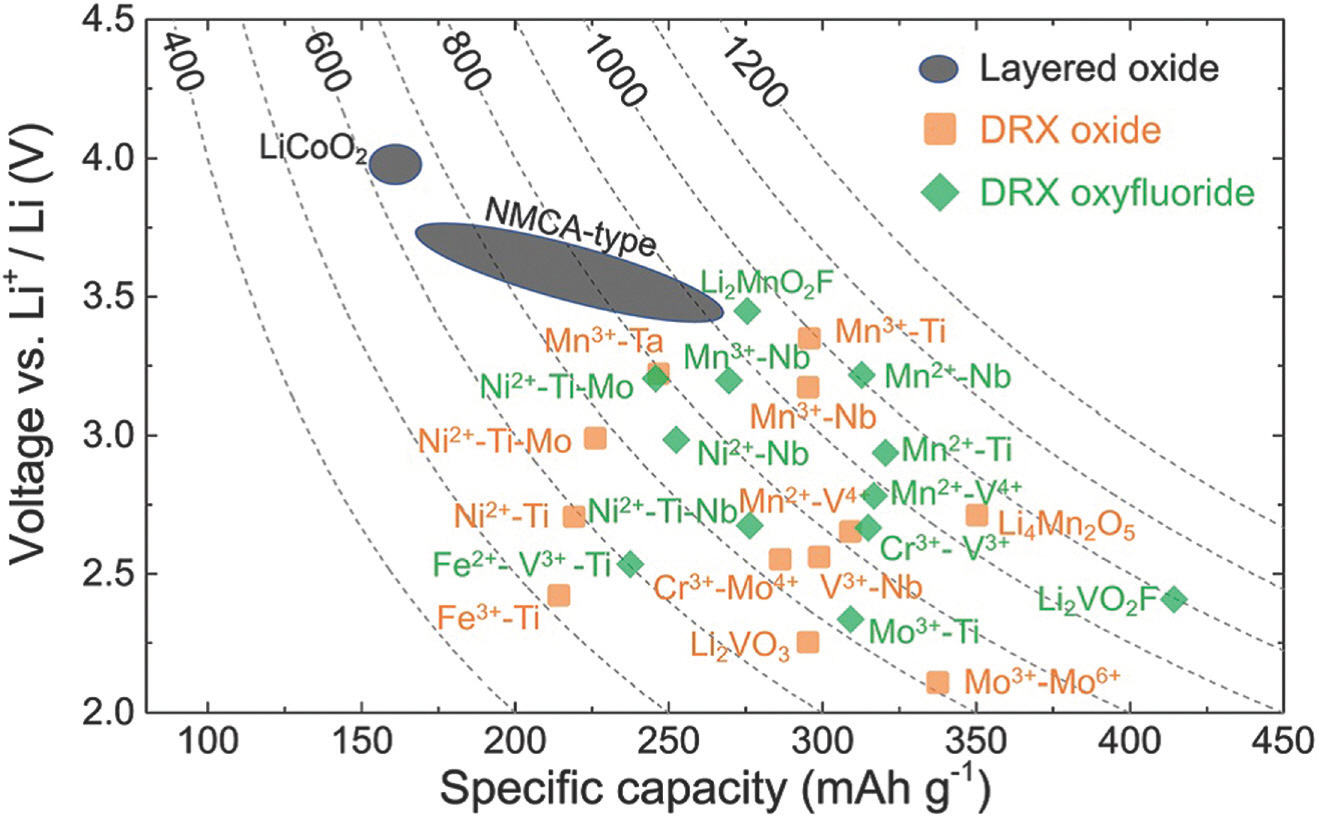
Figure 2.는 층상 구조와 무질서한 암염 구조 양극 소재의 방전 전압, 용량과 에너지 밀도를 나타낸 개략도이다. 무질서한 암염 구조 양극 소재는 층상 구조에 비해 낮은 방전 전압을 보이지만, 일반적으로 비슷하거나 높은 방전 용량을 구현할 수 있다는 장점이 있다. 에너지 산업이 대두되면서 층상 구조 양극 소재에 사용되는 전이 금속 니켈과 코발트의 가격이 비싸지며 소재의 개발에 한계가 생기고 있다. 하지만 기존의 양극 소재에 다른 금속을 첨가하거나 대체하여 합성하는 고 엔트로피 세라믹을 이용한 양극 소재를 개발하게 된다면, 이러한 소재의 제약에서 벗어날 수 있고 충분한 개발 후엔 층상 구조보다 더 높은 용량을 구현한다. 또한 층상 구조와 다르게 무질서한 암염 구조는 양이온과 음이온이 격자에 번갈아 가면서 존재하는 구조적인 특징을 갖고 있고 열역학적, 화학적 안정성까지 지닌 소재를 기대해볼 수 있다.
Figure 2.
Average discharge potential (V vs. Li+/Li) and gravimetric capacity (mA h g−1) of selected layered and DRX cathodes. Contour lines represent the gravimetric energy density (W h kg−1). NMCA = NMC(Li-Ni-Mn-Co-O2) and NCA (Li-Ni-Co-Al-O2).[5]
본 논문에서 소개할 무질서한 암염 구조를 갖는 고 엔트로피 양극 소재는 고 엔트로피 합금에서 착안한 것이며, 고 엔트로피 합금은 다섯 가지 이상의 금속을 혼합하여 합성하였을 때 에너지적으로 안정화됨과 동시에 각 금속 원소들의 개별적인 특성으로 에너지 밀도 상승효과를 기대할 수 있다.
본론
고엔트로피 합금의 배경과 이론적 개념
일반적인 합금 계는 철, 구리, 알루미늄, 주석, 마그네슘, 티타늄과 같은 주된 원소와 다양한 소량의 원소로 구성된다. 구조재료적인 관점에서 합금은 강도를 높이면 연성이 떨어지는 상관관계를 갖고 있어 강도와 연성 사이의 절충안이 요구되었다.[6] 2004년도에 Fe20 Cr20 Mn20 Ni20 Co20이란 다성분 합금 시스템에 관한 연구를 시작으로[7] 고 엔트로피 합금의 개념은 재료 공학 분야에서 새로운 방향성을 제시했다.[8] 고 엔트로피 합금(High-entropy alloy)은 두 가지 정의가 있는데, 하나는 구성 원소를 기반으로 하고 다른 하나는 구성 엔 트로피를 기반으로 한다. 첫 번째 정의에 따르면 기존 합금과는 달리 5원 계 이상의 원소가 5~35 at. % 사이의 비슷한 비율로 혼합됨에도 불구하고 단상 또는 이상 고용체를 이루는 합금을 이르고, 두 번째 정의에 따르면 실온에서 상의 개수와 상관없이 무작위 상태에서 구성 엔트로피가 1.5R보다 클 때 고 엔트로피 합금으로 정의할 수 있다.

이상적으로 주어진 성분 수 n에 대해 R은 기체 상수, xi는 i번째 원소의 몰 분율을 나타낸다. 구성 원소가 등몰로 존재할 때 구성 엔트로피는 최대가 되고, 깁스 헬름홀츠 방정식에 근거해 구성 엔트로피가 커지면 깁스 자유 에너지가 낮아지기 때문에 화합물이 에너지적으로 안정하다.
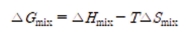
고 엔트로피 합금은 한 가지 기반 원소와 다른 미량 원소를 포함하는 전통적인 합금과는 달리 비슷한 비율로 혼합되기 때문에 이 두 가지를 구별하기 어렵고, 한 가지 지배적인 요소를 기반으로 하는 합금에 비해 뛰어난 특성을 갖는 물질들이 많이 보고되었다. 예를 들어, 내마모성이 강한 Co1.5 CrFeNi1.5 Ti 와 Al0.2Co1.5CrFeNi1.5Ti 합금, 상온에서 높은 강도를 갖는 체심 입방체 AlCoCrFeNi 그리고 304 스테인리스 스틸보다 훨씬 좋은 내부식성을 갖는 물질인 Cu0.5 NiAlCoCrFeSi가 보고되었다.[8]
Yeh[10]는 등 몰 농도로 인해 복잡한 고 엔트로피 합금을 (1) 열역학: 혼합 엔트로피의 효과, (2) 동역학: 느린 확산, (3) 구조: 격자 변형, (4) 칵테일 효과로 4가지 핵심 효과로 요약했다.
먼저 깁스 상 법칙에 따르면 주어진 압력에서 6성분 시스템의 경우, 깁스 상 법칙에 따라 최대 7개의 평형 상을 기대할 수 있다. 그러나 고 엔트로피 합금은 혼합 엔트로피 효과로 인해 깁스 에너지가 낮아져 규칙적인 금속 간 화합물이 형성되지 않고 깁스 상 법칙이 허용하는 상 수보다 훨씬 적은 면심 입방 구조 또는 체심 입방 구조의 단상을 형성했다.[11] 이 특징으로 합금의 높은 엔트로피가 원소 사이 용액의 용해 한계를 확장하는 경향이 있음을 확인할 수 있다. 이는 무질서한 암염 구조가 기저 상태가 아님에도 불구하고 무작위로 섞일 수 있음을 설명했다.
Figure 3.
Schematic of high-entropy materials for applications in energy storage and conversion. Some compounds have been omitted for clarity.[9]

다음은 느린 확산 효과이다. 이는 원자의 움직임을 방해함으로써 고 엔트로피 합금에서 유효 확산 속도를 제한한다.[12] 느린 확산 효과는 기존 주조에서 냉각 중에 발생하는 상 분리가 고온에서 억제되어 저온까지 지연되어 일반적인 합금과 비교해 더 높은 농도의 고용체를 만들 수 있다. 농도가 높아진 고용체는 고온에서 낮은 변형을 보여주며 고용체 내 공공의 농도가 줄어들게 되어 크리프 변형에 대한 저항이 증가한다. 느린 확산 속도는 핵 생성은 쉬우나 느린 성장 때문에 나노 크기의 침전물을 형성을 설명하는 데 사용되며, 구조를 나노 단위 수준에서 균일하게 조절하는 전기화학 촉매 분야로 활용될 수 있다.
심한 격자 변형 효과는 기계적 특성을 증가시킬 수 있다. 고 엔트로피 합금은 기존 합금과 비교해 보았을 때 화학적 배열을 무시할 경우 각각의 원소들이 격자를 차 지하는 확률은 같다. 다른 원소가 치환 또는 침입 되었을 때 원소의 원자 반지름의 크기가 다르기에 심한 격자 뒤틀림이 발생한다. 이는 인장 취성 및 느린 확산과 관련이 있고,[13,14] 고 엔트로피 합금에 큰 격자 변형이 생기면서 사면체와 팔면체 자리 모두 수소를 흡착할 수 있어 수소 에너지 저장에도 활용할 수 있다.[15]
금속 합금에서 칵테일 효과란 많은 원소가 원자 단위로 혼합된 합금에서 독립적인 한 요소에서 나타나는 게 아닌 예상하지 못한 효과가 나타나는 것이다.[8,11] 예를 들면 Al0.5 CoCrCuFeNi로 구성된 고 엔트로피 합금은 기본적으로 면심 입방 구조를 가지지만 알루미늄의 함량을 높이면 체심 입방 구조로 바뀌게 된다. 이처럼 고 엔트로피 합금에서는 설계하는 원소의 종류와 양에 따라 합금의 구조가 바뀔 수 있고 특성이 달라질 수 있다는 것을 알려주게 되었다.
이와 같은 영향으로 고 엔트로피 합금들에 대한 근본적인 이해, 구조와 특성에 있어 성분 금속 원소들의 영향에 관한 연구가 진행되고 있으며 고 엔트로피 합금이 이온 결합 화합물인 세라믹에도 적용되어 새로운 영역으로 응용 확대에 관한 연구가 활발하게 진행 중이다.[16]
고 엔트로피 양극 소재
최근 에너지 관련 기술에 관심도가 높아지고 있다. 그중 새로운 접근법인 고 엔트로피 세라믹은 여러 원소가 합쳐지면서 커진 배열 엔트로피로 인해 구성 원소들의 용해도를 증가시키고, 이는 특성들을 동시에 최적화할 수 있을 뿐만 아니라 특정 금속 공급원에 대한 의존도를 완화할 수 있다는 장점이 있다. 고 엔트로피 세라믹은 앞서 설명한 고 엔트로피 합금과 같이 많은 종류의 금속 이온이 단상으로 결정화할 수 있으며 암염 구조, 스피넬 구조, 페로브스카이트 같은 구조가 있다. 이는 기존 지배적인 원소로 구성된 재료와는 다른 성질을 보여주며 열전 소재, 전기화학 촉매, 초 이온 전도체 그리고 에너지 저장 시스템 등 많은 연구 분야에서 관심을 보였다.[17] 특히 에너지 저장 시스템인 이차 전지 소재에서도 고 엔트로피 세라믹을 이용한 연구들이 진행되고 있다.
고 엔트로피 세라믹 구조에서 양극 소재는 리튬의 삽 입, 탈리 반응이 가능한 호스트 격자에 여러 종류의 금속 원소들이 무작위로 섞여 에너지적으로 안정화되고 충·방전 동안 암염 구조를 유지한다. 이렇게 만들어진 무질서한 암염 구조의 양극 소재는 충·방전 사이클링 동안 구조를 유지해야 한다는 기존의 층상 구조 양극 소재의 틀을 깨면서 층상 구조 양극 소재로 많이 사용되던 전이 금속인 니켈, 코발트, 망간 이외에 다른 금속 원소를 사용할 수 있어 소재 설계 시 폭넓은 선택을 할 수 있는 장점이 있다. 무질서한 암염 구조는 큰 음이온이 가장 조밀하게 쌓이는 배열을 하고, 모든 팔면체 구멍에 양이온이 채워진 구조로 음이온과 양이온이 번갈아 있는 형태로 층상 구조보다 전기적인 반발력이 줄어 구조적인 안정성이 있다. 따라서 이는 충·방전 시 부피 변화가 적고 리튬 과잉 산화물(Li-rich)과 비슷한 충방전 기구로 리튬 이온의 삽입과 탈리를 나타내고 있다.
Figure 4.
The identified crystal structures of (a) high-entropy alloys and (b) high-entropy ceramics used in ener-gy-related fields.[9]

암염 구조
Fm-3m의 공간군을 가지는 암염 구조 화합물은 면심 입방 구조 격자에 양이온과 음이온이 모두 팔면체 위치에 존재하고 사면체 위치는 비어있으며 음이온이 6개의 양이온들과 팔면체를 이루면서 각각의 팔면체들 이 모서리를 공유한다. 무질서한 암염 구조는 호스트 자리에 리튬과 전이 금속이 무질서한 배열을 하는 결정이다. 무질서한 암염 구조는 이온 반경이 작은 리튬 이온 (A) 과 이온 반경이 큰 전이 금속 (B) 이 무작위로 섞여야 한다. 또한 이온 B가 암염 구조에서 안정화 되기 위해선 반경비 rB/rA가 1.414 이상이 되어야 한다. 음이온과 비교하여, 리튬 이온과 전이 금속 이온의 큰 이온 반지름 차이에도 불구하고 무질서한 암염 구조를 형성하기 위해선 d 궤도에 전자가 없는 d0, 전자가 가득 찬 d10 전자 구조를 갖는 금속 이온 B가 필요하다. 각각 빈 d궤도와 s, p궤도에 산소 음이온의 전자를 받을 수 있어 격자 왜곡에 둔감하며, 팔면체 구조를 낮은 에너지로 안정화 시킬 수 있다.[5] Naoaki Yabuuchi 그룹의 연구에 따르면 Li3 NbO4은 절연 특성을 갖지만 Nb/Li 이온에 대한 d0 전이 금속 이온 Mn3+, V3+의 치환으로 합성 된 Li1.3 Nb0.3 Me0.4 O2 (Me = Mn3+, V3+)는 전도성이 향상된 무질서한 암염 구조로 합성된 연구 결과를 보고했다.[18]
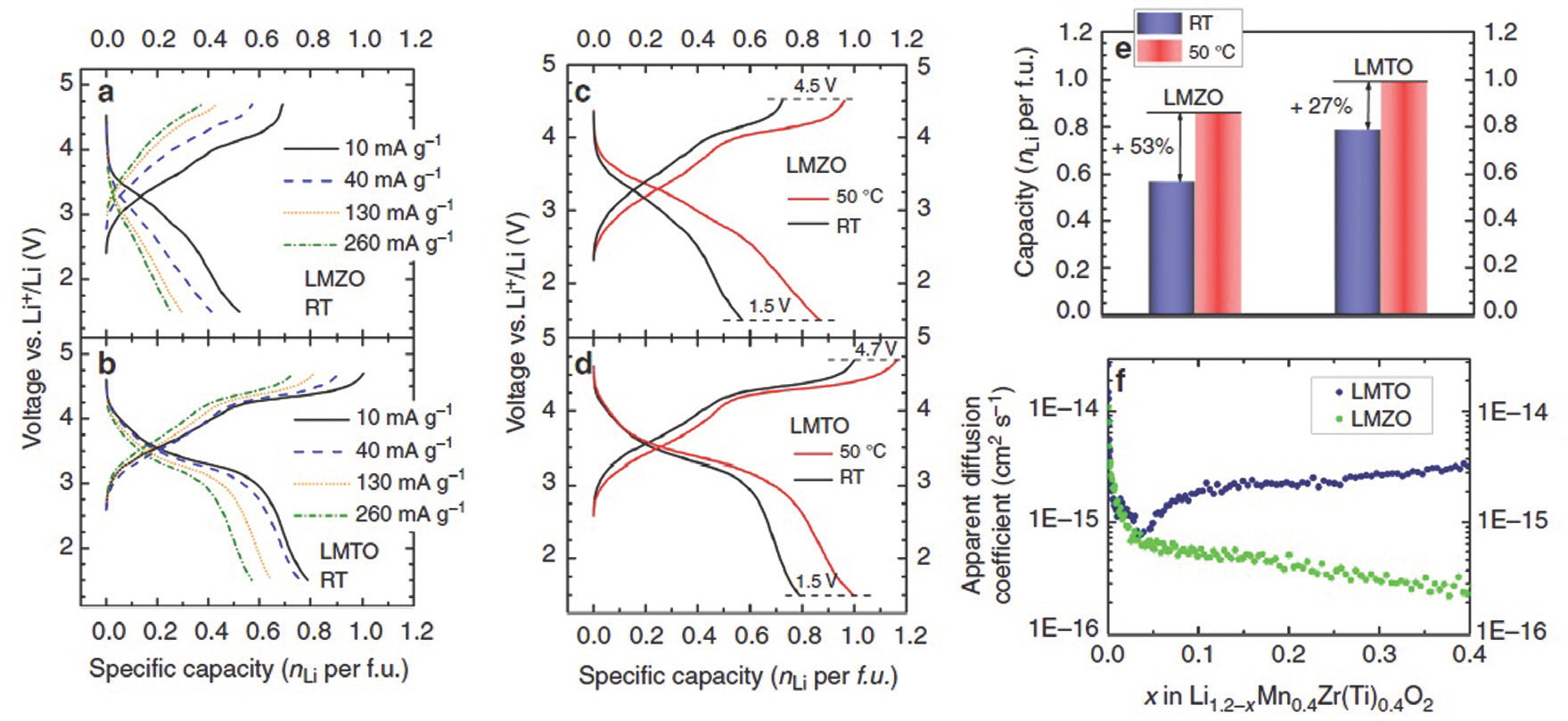
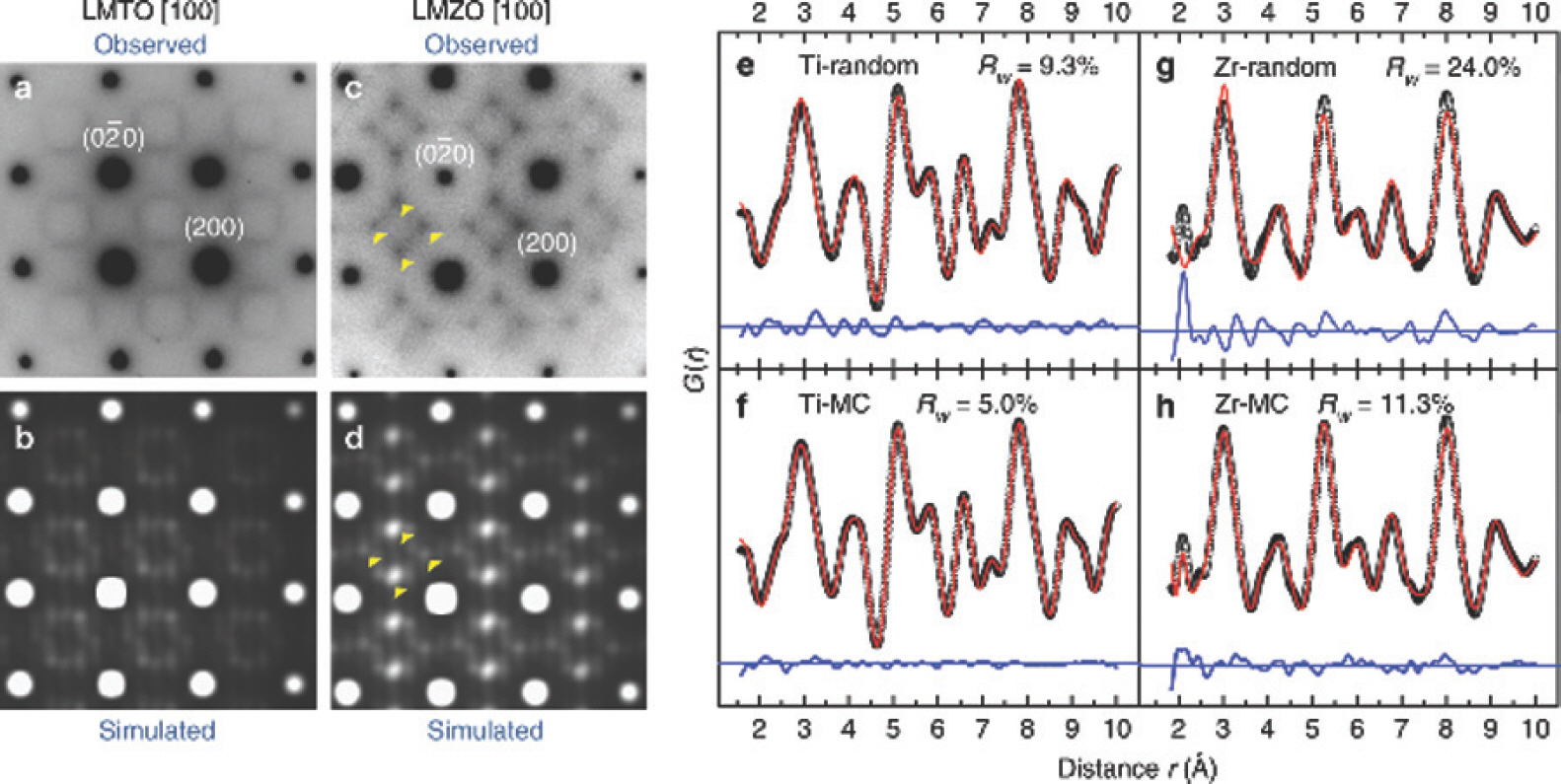
이론 및 실험에서 리튬 이온과 전이 금속이 무질서한 배열을 하는 암염 구조의 양극 소재 화합물을 사용할 수 있다는 것이 지속적으로 연구되고 있다. Ceder 그룹에서는 무질서한 암염 구조의 리튬 전이 금속 산화물이 고에너지 밀도의 리튬 이온 전지의 양극 소재가 될 수도 있다고 보고하고 있다. 특히 무질서한 암염 구조의 장점은 층상 구조 산화물만 사용하던 기존의 양극 소재에 대비해 광범위한 전이 금속 종류를 사용할 수 있어 전지의 수명 증가와 경제적인 이점을 기대할 수 있다. Yabuuchi 그룹 연구와 유사하게 d0와 d10 전자 구조를 갖는 원소(Ti4+, Zr4+, Nb5+)가 전기음성도와 이온 반지름 차이가 큰 원소들로 구성되어 있음에도 불구하고 낮은 에너지로 안정한 상태의 무질서한 암염 구조의 합성이 가능함을 증명하였다.[5] 특히, Ceder 그룹에서는 암염 구조에서 리튬 확산에 큰 영향을 끼치는 단거리 규칙도 (short-range order, SRO)에 대한 연구 결과를 보고하였다. 단거리 규칙도란 원자 주위 짧은 거리에서 나타나며, 하나 또는 두 개의 원자 배열 간 규칙성을 말한다. 많은 연구에서 단거리 규칙도가 리튬의 느린 확산과 연관이 있고 화합물의 합성 시 최대한 단거리 규 칙도의 생성을 줄여야 된다고 보고하고 있다.[19] Ceder 그룹은 화학적으로 비슷한 Li1.2 Mn0.4 Ti0.4 O2(LMTO)와 Li1.2 Mn0.4 Zr0.4 O2(LMZO)의 아연 이온과 티타늄 이온의 원자 크기를 비교해 리튬의 함량과 평균 전이 금속의 이온 반경 사이에 산화 관계를 관찰했다. Figure 6.은 화합물 내에 거리에 따른 리튬 이온의 확산 계수를 나타낸 것이다. 이 관찰을 통해 합성되는 이온의 반지름의 크기가 리튬의 확산 통로에 영향을 미친다는 연구 결과를 얻어냈다.
Figure 5.
Characterization and electrochemical performance of Li1.2 Mn0.4 Zr0.4 O2 (LMZO) and Li1.2 Mn0.4 Ti0.4 O2 (LMTO). a Crystal structure of an ideal cation-disordered rocksalt-type lithium metal oxide. The black spheres represent metal cations (including lithium and TMs), and the red spheres represent oxygen anions. Both cations and anions are in octahedral coordination. The highlighted blue tetrahedral site represents a typical migration pathway for Li diffusion. b Schematic energy landscape of Li migration from its octahedral coordination through a tetrahedral vacancy into another octahedron. The energy barrier depends on the local environment and size of the tetrahedron. The migrating Li ion is highlighted in cyan. c XRD patterns of LMZO and LMTO indexed according to the rocksalt structure. The low-angle shift in the pattern of LMZO compared with that of LMTO indicates the larger lattice parameter of LMZO. d, e SEM images (scale bars, 500 nm) of shaker-milled LMTO (s-LMTO) and LMZO (s-LMZO) with similar particle sizes of ~100 nm. f, g Voltage profiles of LMZO and LMTO between 1.5 and 4.7 V for the first 10 cycles at room temperature[20]

기존 양극 소재로 널리 사용되는 층상 구조의 양극 소재는 정렬이 잘 되어 있어 명백한 리튬 이온의 확산 경로를 나타내지만 무질서한 암염 구조는 격자의 팔면체 자리에 있던 리튬 이온은 금속이 존재하지 않는 사면체(TM-0) 채널을 따라 확산하며 이는 다시 암염 구조의 팔면체 자리로 이동한다. 격자 자리에 있던 리튬 이온이 이동할 때 에너지 장벽은 사면체의 높이와 주변 전이 금속 이온의 수에 따라 결정된다.[21] 또 무질서한 암염 구조의 독특한 특징으로는 충·방전 사이클링 동안 체적의 변화가 작다는 것이다.[22] 몬테 카를로 시뮬레이션을 통해 확인한 결과 일반적으로 무질서한 암염 구조에서 단거리 규칙도가 많이 존재할수록 리튬의 확산을 저하하며 삼차원 네트워크를 통해 동역학적으로 빠지는 리튬의 이동은 배터리의 용량과 직접적인 연관이 있다.
X선 회절로도 확인할 수 없는 단거리 규칙도는 무작위 상태와 정렬된 기저 상태의 중간 상태로 셀 특성에 많은 영향을 끼치며 장거리 리튬 이동을 제한한다.[20] 이는 전이 금속 수가 늘어나면서 단일적으로 지배하던 단거리 규칙도의 형성을 방지하고 리튬 이동 특성이 향상 될 것으로 예측한다. 한 연구에서는 C/10 속도에서 161 mA h g−1 용량을 보였지만 방전 용량은 120 mA h g−1으로 큰 비가역 용량을 보였다.[17] 성공적으로 고 엔트로피 산화물을 합성하였으나 암염 구조 양극 소재가 충·방전 사이클 동안 모든 양이온이 산화 환원 반응에 관여하는 것이 아니기에 이론 용량보다 낮은 용량을 문제로 나타내었다.
Figure 6.
Rate capability tests, comparison between high temperature and room temperature galvanostatic cycling of LMTO and LMZO, and PITT measurements. First cycle voltage profiles of LMZO (a) and LMTO (b) when cycled between 1.5 and 4.7 V at 10, 40, 130, and 260 mA g-1. First cycle galvanostatic voltage profiles of (c) LMZO and (d) LMTO at 50°C and room temperature at 10 mA g-1. First cycle reversible capacities of LMZO and LMTO at high temperature and room temperature. (f) Li chemical diffusion coefficients of LMZO (green) and LMTO (blue) obtained from fitting the room temperature PITT data at various Li contents.[20]
최근 시뮬레이션을 통해 무질서한 암염 구조 양극 소재도 보고 중이다. Ceder 그룹은 Mn2+, Fe2+, Co2+, Ni2+, Mg2+, Zn2+, Cr3+, V3+, Mn3+, Fe3+, Co3+, Ni3+, Ga3+, Al3+, Ti4+, Zr4+, Mn4+, V4+, Sn4+, Mo4+, Nb5+, V5+ 과 Sb5+ 23개의 다른 전이 금속을 이용해 7,965개의 화합물을 단일 상의 고 엔트로피 산화물로 조합하는 데 성공했다. 양극 소재의 전이 금속 종류를 늘렸을 때 장거리 규칙도는 똑같이 유지되는 반면 단거리 규칙도가 억제되는 것을 확인했으며, 단거리 규칙도가 억제되었을 때 20 mA g−1 전류 밀도에서 최대 307 mA h g−1의 고용량을 낼 수 있다는 것 또한 확인했다. 논문에서 보고된 대로 전이 금속의 수가 두 개에서 여섯 개로 늘어 남에 따라 전자 회절 패턴의 강도가 낮아지면서 단거리 규칙도가 줄어든다.[23] 또한, 구성 원소 간에 정전기적 인력과 이온 반경 크기에 큰 영향을 받는다.[20]
합성 방법
고 엔트로피 세라믹을 합성하는 기술로는 기상 반응 공정에 스퍼터링, 펄스 레이저 증착, 스파크 플라즈마 열처리, 액상 반응 공정에 분무 열분해, 졸 겔 합성법, 용액 연소 합성법, 고상 반응 공정에는 기계적인 밀링 등이 있다. 고 엔트로피 세라믹을 합성하는 방법 중 가장 많이 사용하는 방법인 기계적인 밀링 합성법은 2성분 산화물 및 탄산염을 이용해 전구체로 합성한다. 마그네슘, 코발트, 니켈, 구리, 아연과 같은 양이온을 원하는 조성의 몰 비율로 계량한 다음 고에너지 밀링을 이용하여 섞어준다. 섞어준 혼합물은 가압하여 알맞은 열처리 조건에서 소성한다. 소성 시에 전이 금속과 리튬의 무작위로 한 배열을 위해선 고온이 필요하다. 고상 합성법은 다른 합성법에 비해 간단하고 비용이 적게 들어간다는 장점이 있으나 액상 합성법인 졸 겔 합성법이나 수열 합성법과 비교해 더 큰 입자로 합성되며 균일하게 섞이지 않아 리튬 이온과 전자의 이동에 불리하다. 다음으로 사용되는 합성법으로는 졸 겔 합성법이 있다. 졸 겔 합성법은 화합물을 가수 분해 및 축합 반응을 통해 젤 상태로 만들고 이를 건조하여 금속 산화물을 얻는 방법이다. 이렇게 합성한 세라믹은 기계적인 밀링으로 합성했을 때 보다 균일한 입자를 만들 수 있고 기계적 물성의 증가와 높은 화학적 순도로 인해 점차 연구의 응용이 증가하고 있으나 공정 제어의 어려움과 낮은 대량생산성으로 연구단계에서만 사용하고 있다.
Figure 7.
Experimental observation and computational simulation of short-range order (SRO) in LMTO and LMZO. ED patterns of LMTO (a) and LMZO (c) along the zone axis [100]. The round spots are indexed to the Fm–3m space group, while the diffuse scattering patterns nearby are attributed to SRO. Several intensity maxima in the diffuse scattering patterns are highlighted with yellow arrows in LMZO. Simulation of ED patterns for LMTO (b) and LMZO (d) along the same zone axis shows good agreement with experimental observation. Refinement of NPDF data of LMTO (e, f) and LMZO (g, h) using the random model (e, g) and MC-equilibrated structural models (f, h). The experimental data are plotted as black open circles. The calculated values are plotted as solid red lines. The difference between observation and calculation is plotted as solid blue lines.[20]
리튬 이온 전지의 대표적인 양극 합성 공정은 공침법이다. 공침법은 여러 가지 금속화합물을 수용액 상태에서 작은 크기로 균일하게 합성할 수 있다는 점과 제어가 쉽고 대량생산이 가능하다는 점이 특징이다. 고상 합성법과 비교해 작은 크기의 화합물을 만들게 되면 리튬 이온의 확산 거리가 짧아 전기화학적으로 높은 성능을 기대할 수 있다. 또 낮은 온도에서 합성이 이뤄져 고 엔트로피 세라믹의 합성에도 적용하면 저온에서 무작위로 한 배열을 합성할 수 있다고 기대할 수 있다.
분석
주사 전자 현미경(Scanning Electron Microscopy)을 이용하면 합성된 입자 표면의 정보나 크기 등 전반적인 입자의 형상을 알 수 있고, X선 회절(X-ray Diffraction) 또는 중성자 회절(Neutron Diffraction) 방법은 입자에 특정 파장의 빔을 쏘아 상쇄 간섭과 보강 간섭을 이용해 굴절되어 나오는 각도와 강도를 통해 측정한 입자의 결정 구조와 기타 성질을 알 수 있다. 이를 이용하여 합성된 입자에 대한 단상의 무질서한 암염 구조의 생성 여부를 확인할 수 있다. 주사 에너지 분산 분광법(Energy Dispersive Spectroscopy)은 시료에 × 선을 조사했을 때 방출되는 고유한 에너지 값을 갖는 × 선을 통해 합성된 원소에 대해 정성적인 분석을 할 수 있다.
X선 흡수 분광법(X-ray Absorption Spectroscopy)은 작동 전압(충전 정도)에 따라 어떤 원소가 전기화학 반응에 참여하는지 알 수 있고, 비가역적인 원소도 알 수 있으며, 정량 분석을 통하여 전이 금속의 산화가 수의 비율을 확인할 수 있다. 또한, 쌍 분포 함수(Atomic pair distribution function)분석은 주어진 원자로부터 거리 r에 있는 원자를 찾을 확률을 제공한다. 이는 일반적인 X선 회절로 관측하기 어려운 나노 구조, 비정질 그리고 단거리 규칙도에 대한 정보를 얻을 수 있다. 원자 쌍 분포 함수는 원자 쌍 간의 강도를 측정해 단거리 구조에 대한 정보를 알 수 있다. 이러한 정보는 X선 회절의 높은 산란각에서 퓨리에 변환을 이용하여 확보가 가능하나, 높은 산란각에서 낮은 회절 강도로 인하여 주로 방사광 등을 이용한 고에너지 X선 회절 혹은 중성자 회절을 통하여 분석이 가능하다. 특히, 원자 주변의 정보는 X선 흡수 미세구조 분석 (X-ray Fine Structure Analysis, XAFS)을 통한 정보와 동일하다.
투과 전자 현미경(Transmission Electron Microscopy)은 전자빔을 시료에 투과시켜 얻은 회절 패턴을 통해 소재의 공간군에 대한 정보를 생성하여 물질 구조를 파악하는 분석 방법이다. 이 중 물질 구조가 완전히 규칙적인 격자 구조에서 이탈할 때 발생하는 회절 패턴의 산란을 관측할 수 있는데 이는 단거리 규칙도에서 기인한 것이다. 주사 투과 전자 현미경(Scanning Transmission Electron Microscopy) 분석법은 투과 전자 현미경 보다 낮은 에너지의 전자 빔을 시료에 투과하지 않고 사용해 시료의 손상을 줄일 수 있다. 또한 두꺼운 시료의 비 탄성 산란에 의한 전자 렌즈의 색 수차의 영향 없이 원자 단위의 격자 평면, 결함 및 전위를 식별하는 분석 방법이다.
전이 금속의 호환성
단거리 규칙도는 양극 소재 내에서 리튬 이온의 확산을 감소시키는 악영향을 준다.[20] 층상 구조 양극 소재에 경우 리튬이 이동할 수 있는 층을 통해 움직이며 이때 이온의 크기 차이에서 기인하는 탄성 에너지가 중요한 역할을 하기에 충·방전 사이클을 동안 구조를 유지하는 것이 중요하다. 이는 리튬 이온이 전이 금속이 존재하지 않는 사면체를 통해 확산이 가능할 것으로 예측하 는 무작위의 배열을 하는 양극 소재에도 적용된다. 따라서 양이온의 단거리 규칙도를 줄이는 것은 재료 설계에 중요하며 전기화학 성능에 영향을 미친다. Ceder그룹은 전이 금속 종류와 양에 따라 단거리 질서도와 전기화학 성능을 평가하였는데 첨가하는 전이 금속의 수가 많아질수록 고 엔트로피 양극 소재의 단결정 질서도가 줄어듦과 동시에 전기화학 특성 또한 향상된 논문을 발표한 바 있다.
9가지의 전이 금속 원소를 첨가하여 합성한 고 엔트로피 산화물 양극 소재인 NaNi0.12 Cu0.12 Mg0.12 Fe0.15 Co0.15 M n0.1Ti0.1Sn0.1Sb0.04O2는 2가부터 5가까지 다양한 산화가 수를 갖는다. 고 엔트로피의 구조적 안정화는[24] 양극 소재의 사이클 안정성과, 뛰어난 알칼리 금속의 저장 능력을 보인다. 각각의 전이 금속마다 다른 특성을 보이는데 Ni2+, Cu2+, Fe3+ 그리고 Co3+는 Li+, Na+과 같은 알칼리 금속이 삽입 탈리 과정에 따른 전하 보상을 통해 용량을 구현한다. Mg2+, Ti4+는 호스트 구조를 안정화하고 Mn4+는 구조를 형성할 수 있으며 Sn4+와 Sb5+는 양극 소재의 작동 전압을 증가시킬 수 있다.[24] 고전압에서 크롬은 넓은 산화 수 범위 (Cr3+/Cr6+) 를 가져 산화 환원 반응을 하면서 많은 용량을 확보할 수 있지만, 무작위로 한 암염 구조를 갖는 화합물에서 용해도를 제한하여 층상 구조를 형성하는 경향이 있다.[23] Ti4+와 Nb5+는 산화 환원 반응이 높은 전이 금속과 상응한다. 충·방전 동안 암염 구조는 고전압에서 격자를 유지할 수 있지만, 양극과 전해액 계면의 반응이 발생해 용량 저하를 초래할 수 있다. 이렇게 전이 금속이 서로 다른 역할을 하기에 용도에 맞게 조합하여 합성이 가능하단 장점이 있어 양극 소재에 사용 시에도 긍정적인 결과를 도출할 수 있을 것이라 예상했다.
음이온을 이용한 안정화
고 엔트로피 세라믹에서 격자의 양이온을 포함하며 다중 음이온으로 합성한 소재는 더 큰 혼합 엔트로피를 갖는다. 음이온을 이용한 도핑은 주로 할로겐 원소를 이용해 합성하는데, 가장 활용도가 높은 할로겐 원소는 불소이다. 2가 산소 음이온이 위치하는 격자에 1가인 불소 를 도핑하면 양이온 격자의 1가 알칼리 금속이 전하 보상한다. 산소 이온은 1.4 Å, 불소 이온은 1.33 Å의 이온 반지름을 갖고 있어 두 이온 반경의 차이가 크지 않기 때문에 단상의 암염 구조 격자에 큰 변형을 주지 않는다. 음이온이 도핑된 활물질을 합성하는 방법은 앞서 설명한 고 엔트로피 세라믹 합성 시에 전구체와 플루오린화 리튬이나 염화나트륨을 반응물로 사용하여 고 에너지 볼 밀링을 이용해 고상 합성법으로 합성한다. 불소를 도핑하게 되어 얻는 이점으로는 높은 전압에서 충·방전 사이클 동안 양극 소재와 전해액 계면에서 산소가 산화 환원 반응에 참여하는 산소 손실이 발생하는데 불소가 산소보다 강한 이온 결합을 형성하여 불소의 도핑으로 이를 억제할 수 있기에 더 높은 전압에서 장기간 용량 유지를 보인다. 이러한 장점과 더불어 구성 엔트로피를 높여 에너지를 안정화할 수 있기에 고 엔트로피 양극 소재를 최적화할 수 있다.
Figure 8.
STEM–EDS analysis of E1. (a) HAADF image. Panels labelled as Zn, Ni, Cu, Mg and Co are intensity maps for the respective characteristic X-rays. The individual EDS maps show uniform spatial distributions for each element and are atomically resolved.[25]

결론
본 논문은 고 엔트로피 합금에서 착안한 무질서 암염 구조를 갖는 고 엔트로피 세라믹 양극 소재 연구 동향에 대하여 고찰하였다. 처음으로 재충전이 가능한 양극 소재로 소개된 LiCoO2는 코발트의 희소성에 따른 가격이나 독성 등의 문제점 때문에 Li(Nix Coy Mn1-x-y)O2를 사용하는 3성 분계 양극 소재를 연구했다. 이에 반하여, 고 엔트로피 세라믹은 다섯 가지 이상의 금속을 혼합하여 깁스 자유 에너지가 낮아 안정해지며, 소재선택에 있어 유연해짐과 동시에 소재의 특성을 최적화하여 에너지 밀도를 증기 시킬 수 있다. 엔트로피 안정화 메커니즘으로 인해 고 엔트로피 양극 소재는 층상 구조의 양극 소재와 비교하였을 때 충·방전 사이클링 동안 체적 변화가 적어 구조적으로 안정하다.
본론에 서술한 바와 같이 고상 합성법 이외에도 액상에서 합성하는 공침법을 이용하여 고 엔트로피 양극 소 재를 합성하는 연구가 진행되고 있다. 공침법은 고상 합성법과 비교해 보았을 때 더욱 균일하고 작은 크기의 결정을 합성할 수 있으며 이는 리튬 이온의 확산 거리가 짧아져 전기화학적 특성이 향상될 것으로 사료 된다. 초기 연구단계에 있는 고 엔트로피 세라믹 소재의 특성과 공정방법의 추가적인 연구/개발이 동반된다면, 기존의 양극 소재를 개선하는 것을 넘어 새로운 특성의 양극 소재를 개발하는 방향으로 이어질 수 있다.