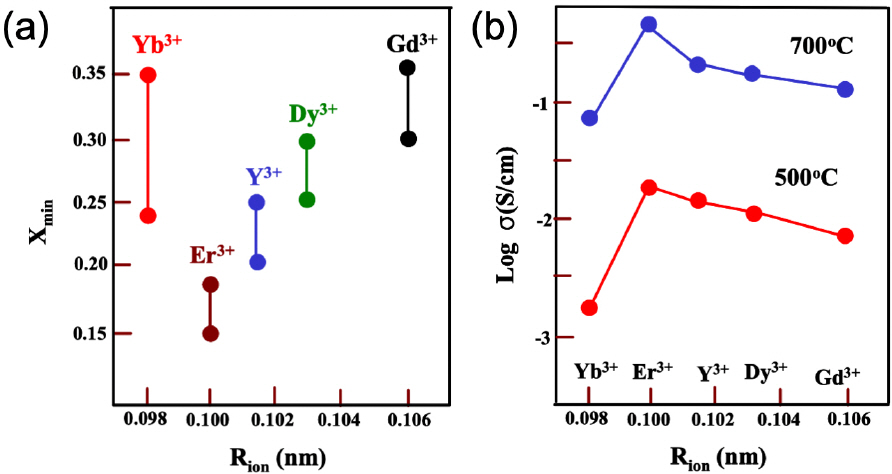
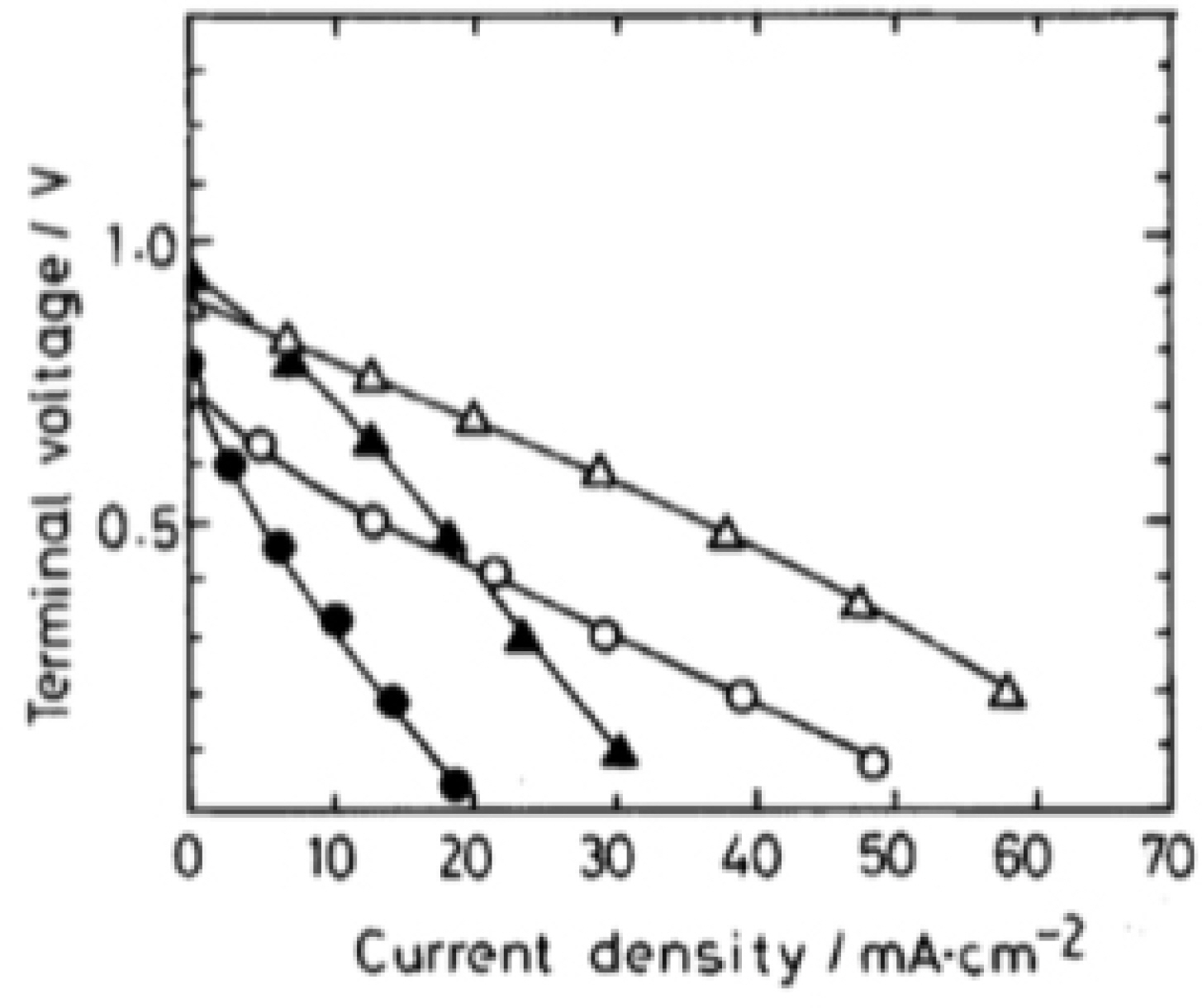
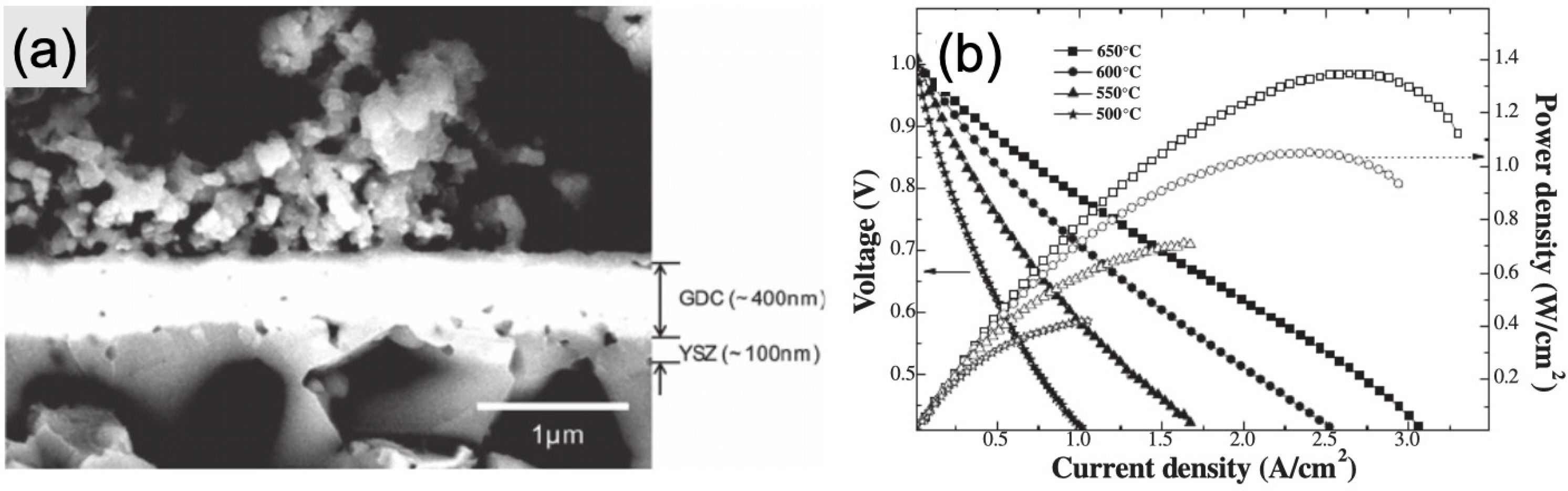
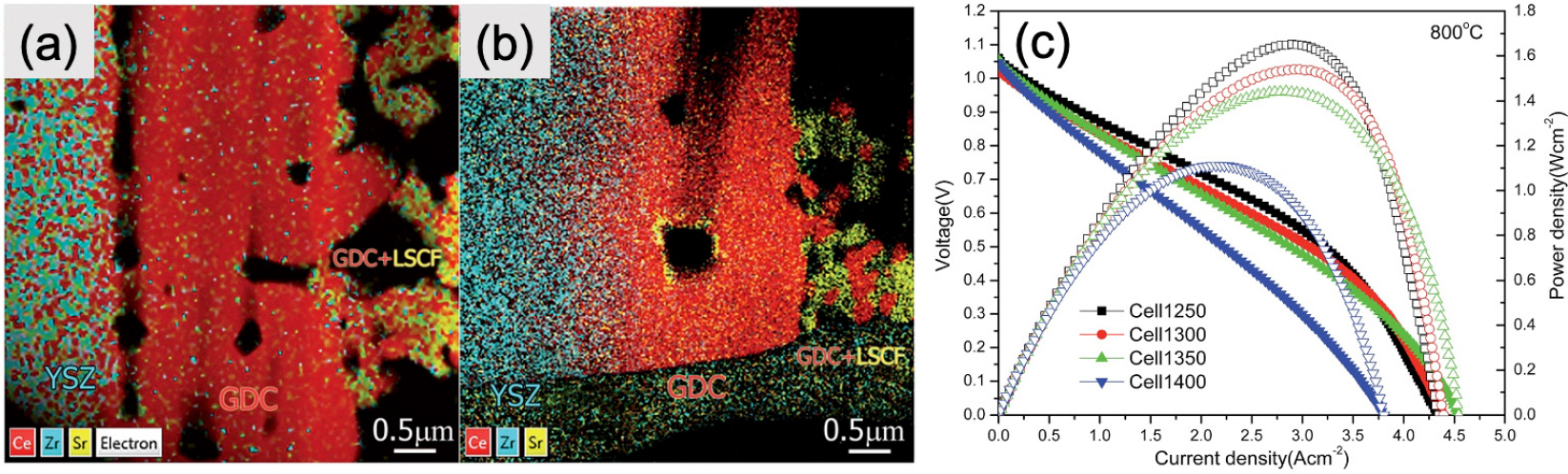
1. E. D. Wachsman, K. T. Lee, ““Lowering the temperature of solid oxide fuel cells”.”
Science.
334(6058): 935–939 (2011).


2. S.-H. Choe, W.-S. Park, ““고체산화물 연료전지(SOFC) 핵심 소재 및 단전지 연구개발”.” Ceramist. 13(4): 21–14 (2010).
3. H.-Y. Lee, B.-K. Kang, H.-C. Lee, Y.-W. Heo, J.-J. Kim, J.-H. Lee, ““Effects of Co-doping on Densification of Gd-doped CeO2 Ceramics and Adhesion Characteristics on a Yttrium Stabilized Zirconia Substrate”.”
J. Korean Ceram. Soc..
55(6): 576–580 (2018).


4. H.-W. Lee, H.-I. Ji, J.-H. Lee, B.-K. Kim, K. J. Yoon, J.-W. Son, ““Powder Packing Behavior and Constrained Sintering in Powder Processing of Solid Oxide Fuel Cells (SOFCs)”.”
J. Korean Ceram. Soc..
56(2): 130–145 (2019).


5. K. T. Lee, H. S. Yoon, E. D. Wachsman, ““The evolution of low temperature solid oxide fuel cells”.”
J. Mater. Res..
27(16): 2063–2078 (2012).

6. N. Mahato, A. Banerjee, A. Gupta, S. Omar, K. Balani, ““Progress in material selection for solid oxide fuel cell technology: A review”.”
Prog. Mater. Sci..
72, 141–337 (2015).

7. D. W. Joh, J. H. Park, D. Y. Kim, B.-H. Yun, K. T. Lee, ““High performance zirconia-bismuth oxide nanocomposite electrolytes for lower temperature solid oxide fuel cells”.”
J. Power Sources.
320, 267–273 (2016).

8. B.-H. Yun, C.-W. Lee, I. Jeong, K. T. Lee, “Dramatic enhancement of long-term stability of erbia-stabilized bismuth oxides via quadrivalent Hf doping.”
Chem. Mater..
29, 10289–10293 (2017).

9. B.-H. Yun, K. J. Kim, D. W. Joh, M. S. Chae, J. J. Lee, D.-W. Kim, S. Kang, D. Choi, S.-T. Hong, K. T. Lee, ““Highly active and durable double-doped bismuth oxide-based oxygen electrodes for reversible solid oxide cells at reduced temperatures”.”
J. Mater. Chem., A.
7, 20558–20566 (2019).

10. A. Chroneos, B. Yildiz, A. Tarancón, D. Parfitt, J. A. Kilner, ““Oxygen diffusion in solid oxide fuel cell cathode and electrolyte materials: mechanistic insights from atomistic simulations”.”
Energy Environ. Sci..
4, 2774–2789 (2011).

11. J.-H. Kim, ““SOFC의 전해질 종류와 특성”.” Ceramist. 3(5): 34–40 (2000).
12. N. Q. Minh, ““Ceramic fuel cells”.”
J. Am. Ceram. Soc..
76(3): 563–588 (1993).

13. J. W. Fergus, ““Electrolytes for solid oxide fuel cells”.”
J. Power Sources.
162, 30–40 (2006).

14. D. A. Andersson, S. I. Simak, N. V. Skorodumova, I. A. Abrikosov, B. Johansson, “Optimization of ionic conductivity in doped ceria.”
PNAS.
103(10): 3518–3521 (2006).



15. S. Omar, E. D. Wachsman, J. C. Nino, ““Higher conductivity Sm3+ and Nd3+ co-doped ceria-based electrolyte materials”.”
Solid State Ionics.
178, 1890–1987 (2008).

16. A. Pesaran, A. Jaiswal, E. D. Wachsman, “Bilayer Electrolytes for Low Temperature and Intermediate Temperature Solid Oxide Fuel Cells–A Review.”; in
Energy Storage and Conversion Materials. The Royal Society of Chemistry; 2019.

17. S. boyapati, E. D. Wachsman, N. Jiang, ““Effect of oxygen sublattice ordering on interstitial transport mechanism and conductivity activation energies in phase-stabilized cubic bismuth oxides”.”
Solid State Ionics.
140, 149–160 (2001).

18. H. A. Harwig, A.G. Gerards, ““Electrical properties of the α, β, γ, and δ phases of bismuth sesquioxide”.”
J. Solid State Chem..
26, 265–274 (1978).

19. M. J. Verkerk, K. Keizer, A. J. Burggraaf, ““High oxygen ion conduction in sintered oxides of the Bi2O3-Er2O3 system”.”
J. Appl. Electrochem..
10, 81–90 (1980).


20. T. Takahashi, H. Iwahara, T. Arao, ““High oxide ion conduction in sintered oxides of the system Bi2O3-Y2O3”.”
J. Appl. Electrochem..
5, 187–195 (1975).


21. M. J. Verkerk, A.J. Burggraaf, ““High Oxygen Ion Conduction in Sintered Oxides of the Bi2O3-Dy2O3 System”.”
J. Electrochem. Soc..
128, 75–82 (1981).

22. P.-N. Huang, A. Petric, ““Superior oxygen ion conductivity of lanthanum gallate doped with strontium and magnesium”.”
J. Electrochem. Soc..
143(5): 1644–1647 (1996).

23. H. Yahiro, Y. Baba, K. Eguchi, H. Arai, ““High Temperature fuel cell with ceria-yttria solid electrolyte”.”
J. Electrochem. Soc..
135, 2077–2080 (1988).

24. F. M. B. Marques, L. M. Navarro, ““Performance of double layer electrolyte cells Part II: GCO/YSZ, a case study”.”
Solid State Ionics.
100, 29–38 (1997).

25. A. V. Virkar, ““Theoretical Analysis of Solid Oxide Fuel Cells with Two-Layer, Composite Electrolytes: Electrolyte Stability”.”
J. Electrochem. Soc..
138, 1481–1487 (1991).

26. T.-H. Kwon, T. Lee, H.-I. Yoo, ““Partial electronic conductivity and electrolytic domain of bilayer electrolyte Zr0.84Y0.16O1.92/Ce0.9Gd0.1O1.95”.”
Solid State Ionics.
195, 25–35 (2011).

27. D.-H. Myung, J. Hong, K. Yoon, B.-K. Kim, H.-W. Lee, J.-H. Lee, J.-W. Son, ““The effect of an ultra-thin zirconia blocking layer on the performance of a 1-μm-thick gadolinia-doped ceria electrolyte solid-oxide fuel cell”.”
J. Power Sources.
206, 91–96 (2012).

28. Z. Gao, V. Y. Zenou, D. Kennouche, L. Marks, S. A. Barnett, ““Solid oxide cells with zirconia/ceria Bi-Layer electrolytes fabricated by reduced temperature firing”.”
J. Mater. Chem. A.
3, 9955–9964 (2015).

29. A. Infortuna, A. S. Harvey, L. J. Gauckler, ““Microstructures of CGO and YSZ thin films by pulsed laser deposition”.”
Adv. Funct. Mater..
18, 127–135 (2008).

30. E.-O. Oh, C.-M. Whang, Y.-R. Lee, S.-Y. Park, D. H. Prasad, K. J. Yoon, J.-W. Son, J.-H. Lee, H. W. Lee, ““Extremely thin bilayer electrolyte for solid oxide fuel cells (SOFCs) fabricated by chemical solution deposition (CSD)”.”
Adv. Mater..
24, 3373–3377 (2012).


31. I. Jang, S. Kim, C. Kim, H. Lee, H. Yoon, T. Song, U. Paik, ““Interface engineering of yttrium stabilized zirconia/gadolinium doped ceria bi-layer electrolyte solid oxide fuel cell for boosting electrochemical performance”.”
J. Power Sources.
435, 226776–226784 (2019).

32. C. Nicollet, J. Waxin, T. Dupeyron, A. Flura, J.-M. Heintz, J. P. Ouweltjes, P. Piccardo, A. Rougier, J.-C. Grenier, J.-M. Bassat, ““Gadolinium doped ceria interlayers for Solid Oxide Fuel Cells cathodes: Enhanced reactivity with sintering aids (Li, Cu, Zn), and improved densification by infiltration”.”
J. Power Sources.
372, 157–165 (2017).

33. S. Lee, S. Lee, H.-J. Kim, S. M. Choi, H. An, M. Y. Park, J. Shin, J. H. Park, J. Ahn, D. Kim, H.-I. Ji, H. Kim, J.-W. Son, J.-H. Lee, B.-K. Kim, H.-W. Lee, J. Hong, D. Shin, K. J. Yoon, ““Highly durable solid oxide fuel cells: suppressing chemical degradation via rational design of a diffusion-blocking layer”.”
J. Mater. Chem. A.
6, 15083–15094 (2018).

34. C. Kim, S. Kim, I. Jang, H. Yoon, T. Song, U. Paik, ““Facile fabrication strategy of highly dense gadolinium-doped ceria/yttria-stabilized zirconia bilayer electrolyte via cold isostatic pressing for low temperature solid oxide fuel cells”.”
J. Power Sources.
415, 112–118 (2019).

35. K. T. Lee, D. W. Jung, M. A. Camaratta, H. S. Yoon, J. S. Ahn, E. D. Wachsman, ““Gd0.1Ce0.9O1.95/Er0.4Bi1.6O3 bilayered electrolytes fabricated by a simple colloidal route using nano-sized Er0.4Bi1.6O3 powders for high performance low temperature solid oxide fuel cells”.”
J. Power Sources.
205, 122–128 (2012).

36. J. S. Ahn, D. Pergolesi, M. A. Camaratta, H. Yoon, B. W. Lee, K. T. Lee, D. W. Jung, E. Traversa, E. D. Wachsman, ““High-performance bilayered electrolyte intermediate temperature solid oxide fuel cells”.”
Electrochem. Commun..
11, 1504–1507 (2009).

37. D. W. Joh, J. H. Park, D. Kim, E. D. Wachsman, K. T. Lee, ““Functionally Graded Bismuth Oxide/Zirconia Bilayer Electrolytes for High-Performance Intermediate-Temperature Solid Oxide Fuel Cells (IT-SOFCs)”.”
ACS Appl. Mater. Interfaces.
9, 8443–8449 (2017).


38. K.-N. Kim, J. Moon, J.-W. Son, J. Kim, H.-W. Lee, J.-H. Lee, B.-K. Kim, ““Introduction of a Buffering Layer for the Interfacial Stability of LSGM-Based SOFCs”.”
J. Korean Ceram. Soc..
42, 637–644 (2005).


39. K.-N. Kim, J. Moon, H. Kim, J.-W. Son, J. Kim, H.-W. Lee, J.-H. Lee, B.-K. Kim, ““Effect of Interfacial Reaction Layer on the Electrochemical Performance of LSGM-Based SOFCs”.”
J. Korean Ceram. Soc..
42, 665–671 (2005).


40. K. Huang, J.-H. Wan, J. B. Goodenough, ““Increasing power density of LSGM-based solid oxide fuel cells using new anode materials”.”
J. Electrochem. Soc..
148(7): A788–A794 (2001).

41. K.-J. Kim, S.-W. Choi, M.-Y. Kim, M.-S. Lee, Y.-S. Kim, H.-S. Kim, ““Fabrication characteristics of SOFC single cell with thin LSGM electrolyte via tape-casting and co-sintering”.”
J. Ind. Eng. Chem..
42, 69–74 (2016).

42. E. H. Song, T. J. Chung, H.-R. Kim, J.-W. Son, B. K. Kim, J.-H. Lee, H.-W. Lee, ““Effect of the LDC Buffer Layer in LSGM-based Anode-supported SOFCs”.”
J. Korean Ceram. Soc..
44, 710–714 (2007).


43. J. Bi, B. Yi, Z. Wang, Y. Dong, H. Wu, Y. She, M. Cheng, ““A high-performance anode-supported SOFC with LDC-LSGM bilayer electrolytes”.”
Electrochem. Solid-State Lett..
7(5): A105–A107 (2004).

44. J. Bi, Y. Dong, M. Cheng, B. Yi, ““Behavior of lanthanum-doped ceria and Sr-, Mg-doped LaGaO3 electrolytes in an anode-supported solid oxide fuel cell with a La0.6Sr0.4CoO3 cathode”.”
J. Power Sources.
161, 34–39 (2006).