ņä£ļĪĀ
ņŗżļ”¼ņ╣┤ļŖö ļīĆĒæ£ņĀüņØĖ ļ¼┤ĻĖ░ņ×¼ļŻīļĪ£, ņŚ┤ņĀü ņä▒ņ¦łĻ│╝ ĻĖ░Ļ│äņĀü Ļ░ĢļÅä Ē¢źņāüņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤Ļ│Ā ļé«ņØĆ ņ£ĀņĀäņāüņłśļź╝ Ļ░Ćņ¦ĆļŖö ĒŖ╣ņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¢┤ ņ┤ēļ¦ż, ņĀäņ×Éņ×¼ļŻī ļō▒ņŚÉ ņĀüņÜ®ļÉśĻ│Ā ņ׳ļŗż.1) ņŗżļ”¼ņ╣┤ļŖö ņĀäņ×ÉļČĆĒÆł, ĻĖ░Ļ│äņ×¼ļŻī, ĒÖöĒĢÖņ┤ēļ¦ż ļō▒ ņŚ¼ļ¤¼ ļČäņĢ╝ņŚÉ ļäÉļ”¼ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŖö ņ×¼ļŻī ņżæ ĒĢśļéśņØ┤ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ņŗżļ”¼ņ╣┤ļŖö ņĪĖ-Ļ▓öļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĀ£ņĪ░ļÉ£ļŗż. ņØ┤ ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢĀ Ļ▓ĮņÜ░ ļ»ĖĒü¼ļĪĀ ĻĖēņØś Ēü¼ĻĖ░ļĪ£ ĻĘĀņØ╝ĒĢ£ ņŗżļ”¼ņ╣┤ ĻĄ¼ĒśĢļČäļ¦ÉņØä ņĀ£ņĪ░ĒĢĀ ņłś ņ׳Ļ│Ā, ņāüņś©ņŚÉņä£ ņĀ£ņĪ░Ļ░Ć Ļ░ĆļŖźĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ļäÉļ”¼ ņō░ņØ┤Ļ│Ā ņ׳ļŗż2). ĻĘĖļ¤¼ļéś ņ┤ēļ¦żņØś Ļ▓ĮņÜ░ ļ»ĖĒü¼ļĪĀ ļŗ©ņ£äļĪ£ļŖö ņ┤ēļ¦żņØś ņä▒ļŖźņØä ņČ®ļČäĒ׳ ļ░£Ē£śĒĢśĻĖ░ ņ¢┤ļĀĄĻĖ░ ļĢīļ¼ĖņŚÉ ļŹö ņ×æņØĆ ĻĘ£ļ¬©ņØś ņŗżļ”¼ņ╣┤ ņĀ£ņĪ░Ļ░Ć ĒĢäņÜöĒĢśļŗż. TEOSņÖĆ ņĢöļ¬©ļŗłņĢäņØś ļ╣äņ£©ņŚÉ ļö░ļØ╝ ņŗżļ”¼ņ╣┤ņØś ņ¦Ćļ”äņØ┤ ļŗ¼ļØ╝ņ¦äļŗżļŖö ņŚ░ĻĄ¼ņŚÉ ļö░ļØ╝. ņĢöļ¬©ļŗłņĢäļź╝ ņŗżļ”¼ņ╣┤ ĒĢ®ņä▒ņŚÉņä£ņØś ņ┤ēļ¦żļĪ£ ņé¼ņÜ®ĒĢśņśĆļŗż.3) ņĄ£ĻĘ╝ ņäżĒÅ░ĒÖö Ēāäņåī, ņäżĒÅ░ĒÖö ņŗżļ”¼ņ╣┤, ņäżĒÅ░ĒÖö ņĀ£ņś¼ļØ╝ņØ┤ĒŖĖņÖĆ Ļ░ÖņØ┤ ļŗżņ¢æĒĢ£ ņóģļźśņØś ļČłĻĘĀņØ╝ ņ┤ēļ¦żļōżņØ┤ ņŚ░ĻĄ¼ņżæņŚÉ ņ׳ļŗż4ŌĆō7). ņØ┤ļōż ļīĆļČĆļČäņØĆ ļéśļģĖ ļŗ©ņ£äņØś ĻĄ¼ņĪ░ļź╝ Ļ░Ćņ¦Ćļ®░ ĒŖ╣Ē׳ ļ®öņĪ░Ēżļ¤¼ņŖż(mesoporous) ņŗżļ”¼ņ╣┤ļŖö ļČłĻĘĀņØ╝ ņ┤ēļ¦żņØś Ļ░ĆļŖźņä▒ņØä Ēü¼Ļ▓ī ĒÖĢņןņŗ£ņ╝░ļŗż. ņØ┤ļ¤¼ĒĢ£ ļ®öņĪ░Ēżļ¤¼ņŖż ņŗżļ”¼ņ╣┤ņØś Ēü░ ĻĖ░Ļ│ĄņØĆ ļŗżņ¢æĒĢ£ ņ×¼ļŻīņŚÉ ņØśĒĢ┤ ņäĀĒāØņĀüņ£╝ļĪ£ ņ┤ēļ¦żņØś ņĀ£ņĪ░Ļ░Ć Ļ░ĆļŖźĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņ┤ēļ¦żņŚÉņä£ ļäÉļ”¼ ņō░ņØ┤Ļ│Ā ņ׳ļŗż8).
ņØ┤ļ¤¼ĒĢ£ ņĀÉņŚÉ ņ░®ņĢłĒĢśņŚ¼ ņØ┤ ņŗżĒŚśņŚÉņä£ļŖö ļŹö ļø░ņ¢┤ļé£ ņä▒ļŖźņØś ņŗżļ”¼ņ╣┤ļź╝ ņĀ£ņĪ░ĒĢśĻĖ░ ņ£äĒĢ┤ ĒöīļØ╝ņ”łļ¦ł Ļ│Ąļ▓ĢņØä ņØ┤ņÜ®ĒĢĀ ņśłņĀĢņØ┤ļŗż. ĒöīļØ╝ņ”łļ¦łļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņŗżļ”¼ņ╣┤ļź╝ ņĀ£ņĪ░ĒĢĀ Ļ▓ĮņÜ░ ļŹö ņ¦¦ņØĆ ņŗ£Ļ░äņŚÉ ņŗżļ”¼ņ╣┤ļź╝ ņĀ£ņĪ░ĒĢĀ ņłś ņ׳ņØä ļ┐É ņĢäļŗłļØ╝, Ēü¼ĻĖ░Ļ░Ć ļŹö ņ×æĻ│Ā ĻĖ░Ļ│ĄņØ┤ ļ¦ÄņØĆ ņŗżļ”¼ņ╣┤ļź╝ ņĀ£ņĪ░Ļ░Ć Ļ░ĆļŖźĒĢśļŗż. ņØ┤ļ¤¼ĒĢ£ ņןņĀÉņ£╝ļĪ£ ņØĖĒĢ┤ ĒöīļØ╝ņ”łļ¦łļź╝ ņØ┤ņÜ®ĒĢ┤ ļ¦īļōĀ ņŗżļ”¼ņ╣┤ļŖö ņ┤ēļ¦żļĪ£ņä£ņØś ļŹö ņóŗņØĆ ņä▒ļŖźņØ┤ ĻĖ░ļīĆļÉ£ļŗż.
ņ┤ēļ¦żņØś ņä▒ļŖźņØä ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢ┤ņä£ ņ╗żĒö╝ ņ░īĻ║╝ĻĖ░ļź╝ ļČäĒĢ┤ĒĢĀ Ļ▓āņØ┤ļŗż. ņĄ£ĻĘ╝ ņĀäņäĖĻ│äņĀüņ£╝ļĪ£ ņ╗żĒö╝ņØś ņāØņé░ļ¤ēĻ│╝ ņåīļ╣äļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ╗żĒö╝ ņ░īĻ║╝ĻĖ░ņØś ņ▓śļ”¼ ņŚŁņŗ£ Ēü░ ņé¼ĒÜīņĀü ļ¼ĖņĀ£ļĪ£ ļīĆļæÉļÉśĻ│Ā ņ׳ļŗż. ĒĢ£ĻĄŁņØĖņØś Ļ▓ĮņÜ░ ņ╗żĒö╝ ņłśņ×ģņŗ£ņןņØĆ 2014ļģä ĻĖ░ņżĆ 5.9ņ¢Ą ļŗ¼ļ¤¼ļĪ£, ņä▒ņØĖ 1ņØĖļŗ╣ ņ╗żĒö╝ ņåīļ╣äļ¤ēņØĆ 341ņ×ö ņłśņżĆņ£╝ļĪ£ ņĪ░ņé¼ļÉśņŚłļŗż.9) ņ╗żĒö╝ ņåīļ╣äļ¤ēņØĆ ĒĢ┤Ļ░Ć ņ¦ĆļéĀņłśļĪØ ņ”ØĻ░ĆĒĢśļŖö ņČöņäĖļĪ£, ņ╗żĒö╝ ĒĢ£ņ×öņØä ņČöņČ£ĒĢśĻ│Ā ļéśļ®┤ ļīĆļČĆļČäņØś ņ╗żĒö╝ ņ░īĻ║╝ĻĖ░ļŖö ĻĘĖļīĆļĪ£ ņō░ļĀłĻĖ░ļĪ£ ņ▓śļ”¼ĒĢ┤ņĢ╝ ĒĢśļŖöļŹ░, Ļ▓ĮņĀ£ņĀü ĒÖśĻ▓ĮņĀüņ£╝ļĪ£ Ēü░ ļ¼ĖņĀ£Ļ░Ć ļÉ£ļŗż. ņ╗żĒö╝ ņ░īĻ║╝ĻĖ░ļŖö ņģĆļŻ░ ļĪ£ņśżņŖż(Cellulose), ĒŚżļ»ĖņģĆļŻ░ļĪ£ņśżņŖż(hemicellulose), ņ¦Ćļ░®ņé░Ļ│╝ Ļ░ÖņØĆ ņ£ĀĻĖ░ĒÖöĒĢ®ļ¼╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņĀĖņ׳ļŗż. ĒŖ╣Ē׳ ņģĆļŻ░ļĪ£ņśżņŖżņÖĆ ĒŚżļ»ĖņģĆļŻ░ļĪ£ņśżņŖżļź╝ Ļ░ĆņłśļČäĒĢ┤ĒĢśļ®┤ ņ£ĪĒāäļŗ╣ņØś ĻĖĆļŻ©ņĮöņŖż(Glucose)ņÖĆ ņśżĒāäļŗ╣ņØś ņ×ÉņØ╝ļĪ£ņŖż(Xylose)ļØ╝ļŖö ļŗ©ļŗ╣ļźśļĪ£ ļČäĒĢ┤Ļ░Ć Ļ░ĆļŖźĒĢśļŗż. ņāØņä▒ļÉ£ ļŗ©ļŗ╣ļźśļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņŚÉĒāäņś¼ņØś ņāØņä▒ņØ┤ Ļ░ĆļŖźĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņäØņ£Āļź╝ ļīĆņ▓┤ ĒĢĀ ņłś ņ׳ļŖö ņāłļĪ£ņÜ┤ ņ╣£ĒÖśĻ▓Į ņŚÉļäłņ¦Ć ņ×¼ļŻī, ņ”ē ļ░öņØ┤ņśżļööņĀżņØś ņ×¼ļŻīļĪ£ Ļ░üĻ┤æ ļ░øĻ│Ā ņ׳ļŗż.10)
ņØ┤ ņŗżĒŚśņŚÉņä£ļŖö ĒöīļØ╝ņ”łļ¦łļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļ¦īļōĀ ņŗżļ”¼ņ╣┤ ņé░ņ┤ēļ¦żļź╝ ĒåĄĒĢ┤ ņ╗żĒö╝ ņ░īĻ║╝ĻĖ░ļź╝ ļČäĒĢ┤ĒĢśņŚ¼ ļ░öņØ┤ņśżļööņĀżņØś ņāØņé░ņØä ņ£äĒĢ£ ļŗ©ļŗ╣ļźśļź╝ ņāØņä▒ĒĢĀ Ļ▓āņØ┤ļŗż. ĒöīļØ╝ņ”łļ¦ł Ļ│Ąļ▓ĢņØä ĒåĄĒĢ┤ ļø░ņ¢┤ļé£ ņä▒ļŖźņØś ņ┤ēļ¦żļź╝ ņāØņé░ĒĢśņŚ¼, ņ╗żĒö╝ ņ░īĻ║╝ĻĖ░ņØś ĒÜ©ņ£©ņĀüņØĖ ļČäĒĢ┤Ļ░Ć Ļ░ĆļŖźĒĢ┤ņ¦Ćļ®┤, ņĀä ņäĖĻ│äņĀüņ£╝ļĪ£ ļ¼ĖņĀ£Ļ░Ć ļÉśĻ│Ā ņ׳ļŖö ĒÖśĻ▓Į ļ¼ĖņĀ£ļź╝ ĒĢ┤Ļ▓░ĒĢśļŖöļŹ░ Ēü░ ĻĖ░ņŚ¼ļź╝ ĒĢĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
ļ│ĖļĪĀ
2.1 ņŗżļ”¼ņ╣┤ ņĀ£ņĪ░
2.1.1 ņ×¼ļŻī
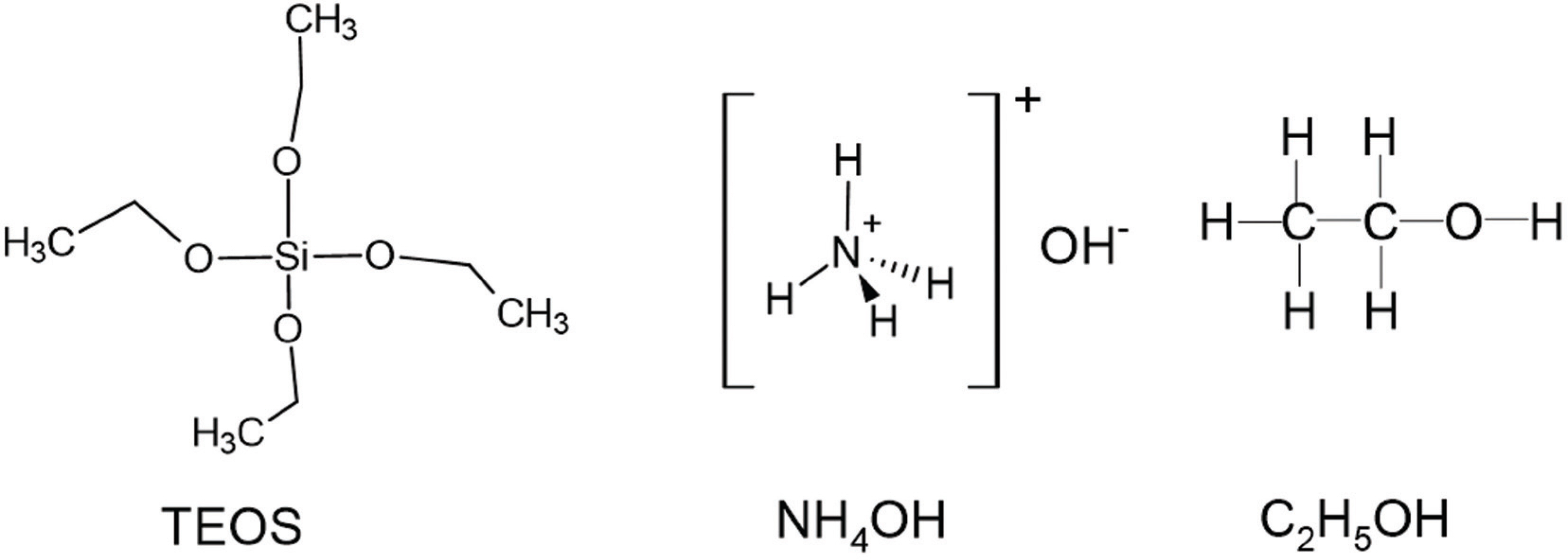
ļéśļģĖ Ēü¼ĻĖ░ņØś ņŗżļ”¼ņ╣┤ļź╝ ņĀ£ņĪ░ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ ĒĢäņÜöĒĢ£ ņ×¼ļŻīļōżņØĆ ļŗżņØīĻ│╝ Ļ░Öļŗż. ņŻ╝ņ×¼ļŻīņØĖ Tetraethyl orthosilicate (TESOS 95%)ņÖĆ ņĢöļ¬©ļŗłņĢä ņłśņÜ®ņĢĪ (Ammonia solution, NH4 OH 30%)ņØĆ SAMCHUNņØś ņŗ£ņĢĮņØä ņé¼ņÜ®ĒĢśņśĆĻ│Ā, ņŚÉĒāäņś¼ (Ethyl alcohol, C2 H5 OH 99.9%)ļŖö DUKSANņŚÉņä£ ĻĄ¼ļ¦żĒĢśņśĆļŗż. ņØ┤ ņ×¼ļŻīļōżņŚÉ ļīĆĒĢ£ ĻĄ¼ņĪ░ļŖö Fig 1ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ņØ┤ ņŗ£ņĢĮļōżņØä ĻĖ░ņĪ┤ ņĪĖ-Ļ▓öļ▓ĢĻ│╝ ĒöīļØ╝ņ”łļ¦ł Ļ│Ąļ▓Ģ ļ¬©ļæÉ ļŗżņØīĻ│╝ Ļ░ÖņØĆ ļ╣äņ£©ļĪ£ ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆļŗż.
TEOS: NH4 OH: C2 H5 OH ŌĆō 1: 10: 20
2.1.2 Sol-Gel ļ░śņØæ
ņĪĖ-Ļ▓öļ▓ĢņØĆ ĻĖłņåŹņØś ņ£ĀĻĖ░ ļ░Å ļ¼┤ĻĖ░ĒÖöĒĢ®ļ¼╝ņØś ņÜ®ņĢĪņØä Ļ▓öĒÖöņŗ£ĒéżĻ│Ā Ļ▓öņØś ņŚ┤ņ▓śļ”¼ļź╝ ĒåĄĒĢśņŚ¼ ņé░ĒÖöļ¼╝ Ļ│Āņ▓┤ļź╝ ņĀ£ņĪ░ĒĢśļŖö ļ░®ļ▓Ģņ£╝ļĪ£ ļČäņ×Éļŗ©ņ£äņØś ĻĄ¼ņĪ░ļź╝ ņĪ░ņĀłĒĢĀ ņłś ņ׳ļŖö ņ┤łļ»ĖņäĖĻĄ¼ņĪ░Ļ│ĄņĀĢ(ultra structure processing)ņØä ĒåĄĒĢśņŚ¼ ļČäļ¦ÉņØ┤ļéś ņä¼ņ£Ā, ļ░Ģļ¦ē ļ░Å Ļ▓ö ļ¬©ļģĖļ”¼ņŖż(monolith)ļō▒ņØś ņĀ£ņĪ░Ļ░Ć Ļ░ĆļŖźĒĢśņŚ¼ ņŚ¼ļ¤¼ ļČäņĢ╝ņŚÉ ņō░ņØ┤Ļ│Ā ņ׳ļŖö ļ░®ļ▓ĢņØ┤ļŗż. ņĪĖ-Ļ▓öļ▓Ģ ņŚÉ ņØśĒĢ£ ļ¼┤ĻĖ░ņ×¼ļŻī ĒĢ®ņä▒ņØś ņŚŁņé¼ļŖö 1946ļģäļČĆĒä░ ņŗ£ņ×æĒĢśņŚ¼ 1959ļģäņŚÉ ļÅģņØ╝ņØś Shottņé¼ņŚÉņä£ ĻĖłņåŹ ņĢīņĮĢņé¼ņØ┤ļō£ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ SiO2 ļ¦ē ļō▒ņØä ĒīÉņ£Āļ”¼ņŚÉ ĒśĢņä▒ņŗ£ĒéżļŖö ņŚ░ĻĄ¼ļĪ£ ļ│ĖĻ▓®ĒÖöļÉśĻĖ░ ņŗ£ņ×æĒ¢łļŗż11).
ņŗżļ”¼ņ╣┤ļź╝ ĒĢ®ņä▒ĒĢśļŖö ĻĖ░ļ│ĖņĀüņØĖ ņĪĖ-Ļ▓öļ▓ĢņØĆ ļŗżņØīĻ│╝ Ļ░ÖņØĆ Ļ░ĆņłśļČäĒĢ┤ ļ░śņØæņØä ļö░ļźĖļŗż.
Si(OC2 H5)4 + xH2 O ŌåÆ Si(OC2 H5)4-x(OH) x + xC2 H5 OH
ŌēĪSi-OC2 H5 + HO-SiŌēĪ ŌåÆ ŌēĪSi-O-SiŌēĪ + C2 H5 OH
ŌēĪSi-OH + HO-SiŌēĪ ŌåÆ ŌēĪSi-O-SiŌēĪ + H2 O
ņĀäņ▓┤ņĀüņØĖ ļ░śņØæņŗØņØä ņĀĢļ”¼ĒĢśļ®┤ ļŗżņØīĻ│╝ Ļ░Öļŗż.
Si(OC2 H5)4 + 2H2 O ŌåÆ SiO2 + 4C2 H5 OH
ņĢ×ņä£ 2.1.2ņŚÉņä£ ļ¦ÉĒ¢łļŹś TEOS: NH4 OH: C2 H5 OH ŌĆō 1: 10: 20 ņØś ļ╣äņ£©ļĪ£ 30ļČäĻ░ä ĒĢ®ņä▒ņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ņØ┤Ēøä 80ŌäāņśżļĖÉņŚÉņä£ 24ņŗ£Ļ░ä ļÅÖņĢł Ļ▒┤ņĪ░ĒĢśņśĆĻ│Ā, ņłśļōØļ¤ēņØä ņĖĪņĀĢĒĢśņśĆļŗż.
2.1.3 ĒöīļØ╝ņ”łļ¦łĻ│Ąļ▓Ģ
ĒöīļØ╝ņ”łļ¦łļĪ£ ņŗżļ”¼ņ╣┤ļź╝ ņĀ£ņĪ░ĒĢśĻĖ░ ņ£äĒĢ┤ ņ×Éņ▓┤ ņĀ£ņ×æĒĢ£ ļ╣äņ╗żņŚÉ ĒģģņŖżĒģÉ ņĀäĻĘ╣ņØä ĒåĄĒĢ┤ ņĀäļźśļź╝ ĒØśļ¤¼ ņŻ╝ņŚłļŗż. ņØ┤ņŚÉ ļīĆĒĢ£ ļīĆļץņĀüņØĖ ĻĘĖļ”╝ņØĆ Fig 2ņÖĆ Ļ░Öļŗż. ņĀäņĢĢĻĖ░ļĪ£ļČĆĒä░ Ļ░ĆĒĢ┤ņ¦ä ņĀäļźśĻ░Ć ĒģģņŖżĒģÉ ņĀäĻĘ╣ņØä ĒåĄĒĢ┤ ņÜ®ņĢĪ ļé┤ņŚÉņä£ ĒöīļØ╝ņ”łļ¦ł ļ░śņØæņØä ņØ╝ņ£╝ĒéżĻ│Ā, ĒöīļØ╝ņ”łļ¦ł ņŻ╝ļ│ĆļČĆņŚÉ Ļ│Āņś©ņØä ļ╣äļĪ»ĒĢ£ ņČöĻ░ĆņĀüņØĖ ņŚÉļäłņ¦ĆņØś Ļ│ĄĻĖē ļČäņ£äĻĖ░Ļ░Ć ņāØĻ▓© ĻĖ░ņĪ┤ ņĪĖ-Ļ▓öļ▓ĢĻ│╝ ļŗżļźĖ ļ░®ļ▓Ģņ£╝ļĪ£ ņŗżļ”¼ņ╣┤ņØś ĒĢ®ņä▒ņØ┤ Ļ░ĆļŖźĒĢśļŗż. ņĪĖ-Ļ▓öļ▓ĢĻ│╝ ļÅÖņØ╝ĒĢ£ ņĪ░Ļ▒┤ņ£╝ļĪ£ 30ļČäņØś ĒĢ®ņä▒ ņŗ£Ļ░äĻ│╝ 80ŌäāņśżļĖÉņŚÉņä£ 24ņŗ£Ļ░ä ļÅÖ ņĢł Ļ▒┤ņĪ░ Ēøä ņłśļōØļ¤ēņØä ņĖĪņĀĢĒĢśņśĆļŗż. ĒöīļØ╝ņ”łļ¦łļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ĒĢ®ņä▒ĒĢśļŖö Ļ▓ĮņÜ░ ĒöīļØ╝ņ”łļ¦łņŚÉ ņØśĒĢ£ Ļ│ĀņŚ┤ņØ┤ ļ░£ņāØĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ, ņāüņś©ņŚÉņä£ ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢ£ ņĪĖ-Ļ▓öļ▓ĢĻ│╝ ļÅÖņØ╝ĒĢ£ ņĪ░Ļ▒┤ņØä ļ¦×ņČöĻĖ░ ņ£äĒĢśņŚ¼ ņś©ļÅäļź╝ ņĖĪņĀĢĒĢśļ®░ ĒöīļØ╝ņ”łļ¦łņÖĆ ļāēĻ░üņØä ļ▓łĻ░łņĢä ņ¦äĒ¢ēĒĢśļ®░ ņŗżĒŚśĒĢśņśĆļŗż.
2.1.4 ņŗżļ”¼ņ╣┤ ņłśļōØļ¤ē ļ╣äĻĄÉ
ņłśļōØļ¤ēņØś ĒÅēĻĘĀņØä ņĢäļל Table 1 ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. Ļ░ÖņØĆ ņŗ£Ļ░ä, Ļ░ÖņØĆ ņĪ░Ļ▒┤ņŚÉņä£ ņāØņä▒Ē¢łņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā, ĒöīļØ╝ņ”łļ¦łļź╝ ņØ┤ņÜ®ĒĢśņśĆņØä ļĢī ņĢĮ 1.5ļ░░ņØś ņłśļōØļźĀņØä ļ│┤ņśĆļŗż. ņØ┤ Ļ▓░Ļ│╝ļź╝ ĒåĄĒĢ┤ ļ┤żņØä ļĢī, ĒöīļØ╝ņ”łļ¦ł Ļ│Ąļ▓ĢņØä ņØ┤ņÜ®ĒĢĀ Ļ▓ĮņÜ░ ļŹö ļ¦ÄņØĆ ņ¢æņØś ņŗżļ”¼ņ╣┤ļź╝ ņāØņé░ĒĢĀ ņłś ņ׳ņØīņØä ņĢī ņłś ņ׳ļŗż.
2.2 ņé░ņ┤ēļ¦ż ņĀ£ņĪ░, ņäżĒÅ░ĒÖö ļ░śņØæ
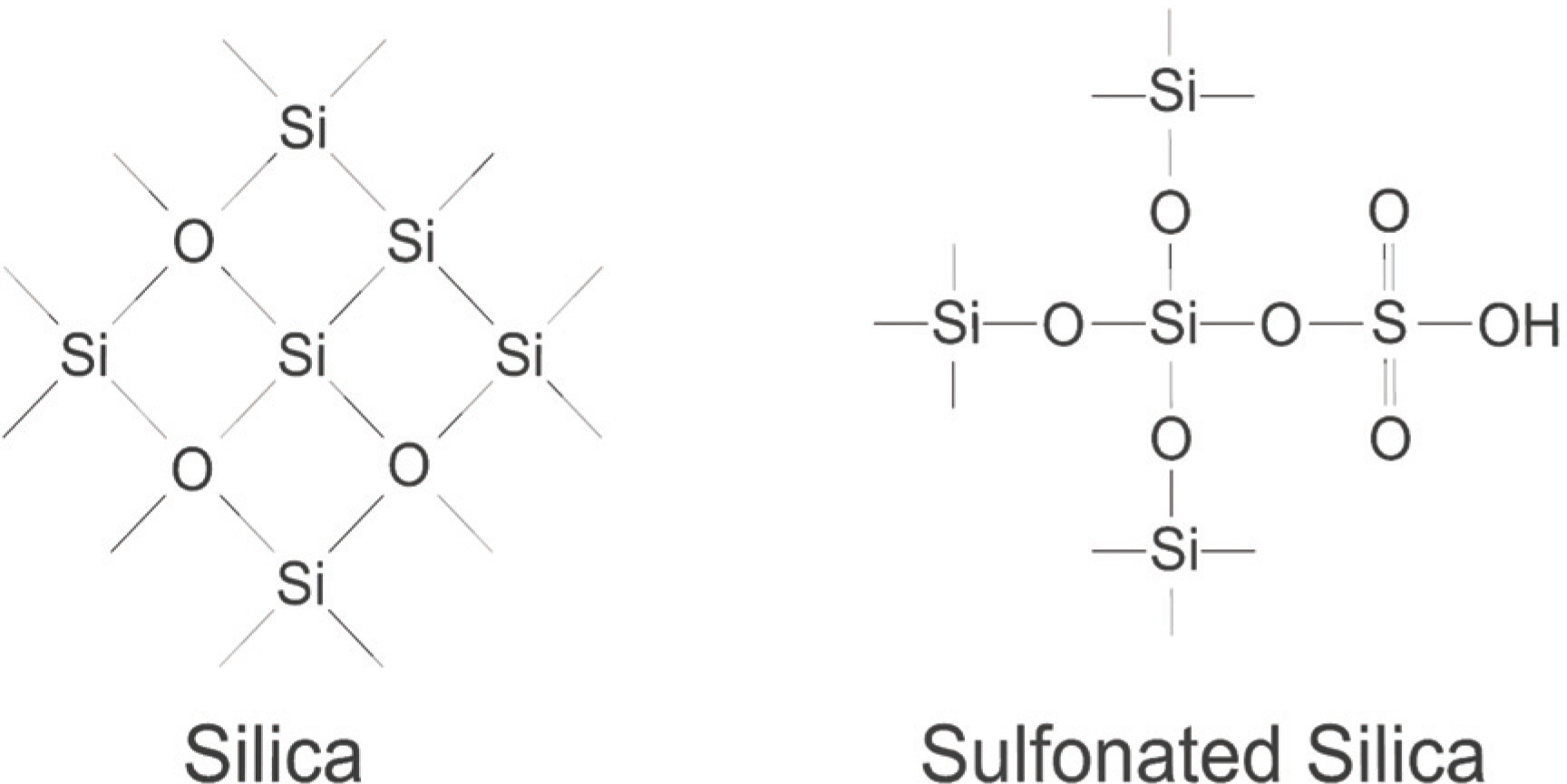
ņé░ņ┤ēļ¦żļź╝ ņĀ£ņĪ░ĒĢśļŖö ņØ╝ļ░śņĀüņØĖ ļ░®ļ▓Ģņ£╝ļĪ£ļŖö ĒÖöĒĢ®ļ¼╝ņŚÉ ĒÖ®ņé░(H2 SO4)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒÖ®ņé░ņŚÉ ņ׳ļŖö ņäżĒÅ░ĻĖ░ (ŌłÆSO3 H)ļź╝ ļÅäņ×ģĒĢśņŚ¼ ņäżĒÅ░ņé░ņØä ņāØņä▒ĒĢ£ļŗż. ņØ┤ļĢī ņé¼ņÜ®ĒĢśļŖö ĒÖ®ņé░ņ£╝ļĪ£ļŖö ņ¦äĒĢ£ ĒÖ®ņé░(99%)ļź╝ ņé¼ņÜ®ĒĢ£ļŗż. ņäżĒÅ░ņé░ ņ┤ēļ¦żļŖö ņäżĒÅ░ņé░ ņ×æņÜ®ĻĖ░ (SO3 H)ņÖĆ ņ╣┤ļź┤ļ│ĄņŗżĻĖ░ (ŌłÆOH)ļź╝ Ēæ£ļ®┤ņŚÉ ĒżĒĢ©ĒĢśĻ│Ā ņ׳ļŗż12). ņØ┤ ņ×æņÜ®ĻĖ░ļōżļĪ£ ņ╗żĒö╝ ļČäņ×ÉņØś Ēāäņåī Ļ▓░ĒĢ®ņØä ļüŖņ¢┤ ļŗ©ļŗ╣ļźśņØś ņāØņé░ņØ┤ Ļ░ĆļŖźĒĢśļŗż. ņØ┤ ņŗżĒŚśņØä ņ£äĒĢ┤ņä£ ņłśņŚ┤ĒĢ®ņä▒ĻĖ░ņŚÉ 50mgņØś ņŗżļ”¼ņ╣┤ņÖĆ 5mlņØś ņ¦äĒĢ£ ĒÖ®ņé░ņØä ņ▓©Ļ░ĆĒĢśņśĆļŗż. ņłśņŚ┤ ĒĢ®ņä▒ĻĖ░ņŚÉņä£ņØś ļ░śņØæņØĆ Fig 3ņŚÉņä£ ļéśĒāĆļé┤ņŚłļŗż. ņØ┤Ēøä 180ŌäāņØś ņśżļĖÉņŚÉņä£ 18ņŗ£Ļ░äņØä ļ░śņØæņŗ£Ēé© Ēøä ņČ®ļČäĒ׳ ļāēĻ░üņŗ£ Ēé©ļŗż. ņāüņś©Ļ│╝ ļ╣äņŖĘĒĢ£ ņś©ļÅäĻ░Ć ļÉśļ®┤, ņŚ¼Ļ│╝ņןņ╣śņŚÉ ĒÖ®ņé░ņØä Ļ▒Ėļ¤¼ļéĖļŗż. Ļ▒Ėļ¤¼ļé┤Ļ│Ā ļé©ņØĆ ņ┤ēļ¦żļŖö ĒÖ®ņé░ņØä ņÖäņĀäĒ׳ ņŚåņĢĀņŻ╝ĻĖ░ ņ£äĒĢ┤ 80ŌäāņØś ņ”ØļźśņłśņŚÉņä£ 2ņŗ£Ļ░ä ļŹö ņäĖņ▓ÖĒĢśĻ│Ā ļŗżņŗ£ ĒĢ£ļ▓ł ņŚ¼Ļ│╝ņןņ╣śļĪ£ Ļ▒Ėļ¤¼ļéĖļŗż. ņØ┤ Ļ│╝ņĀĢņØ┤ ļüØļéśļ®┤ 80Ōäā ņśżļĖÉņŚÉņä£ 24ņŗ£Ļ░ä Ļ▒┤ņĪ░ ņŗ£Ēé©ļŗż. ņØ┤ Ļ│╝ņĀĢņØ┤ ļüØļéśļ®┤ ņäżĒÅ░ĒÖö ņŗżļ”¼ņ╣┤ ņ┤ēļ¦żĻ░Ć ļ¦īļōżņ¢┤ņ¦äļŗż. Fig 4.ļŖö ņŗżļ”¼ņ╣┤ņÖĆ ņäżĒÅ░ĒÖö ņŗżļ”¼ņ╣┤ ņ┤ēļ¦żņØś ļČäņ×É ĻĄ¼ņĪ░ņØ┤ļŗż.
2.3 ļŗ©ļŗ╣ļźś ņāØņä▒ ņŗżĒŚś
ņĢ×ņä£ 2.2ņŚÉņä£ ļ¦īļōżņ¢┤ņ¦ä ņé░ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ╗żĒö╝ ļČäņ×Éļź╝ ļČäĒĢ┤ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņŚ¼ļ¤¼ Ļ│╝ņĀĢņØ┤ ĒĢäņÜöĒĢśļŗż. ļ©╝ņĀĆ ņ╗żĒö╝ņÖĆ ņé░ņ┤ēļ¦żĻ░Ć ņČ®ļČäĒ׳ ļ░śņØæ ĒĢĀ ņłś ņ׳Ļ▓ī, ļ│╝ļ░ĆĻĖ░(Ball-Mill)ļź╝ ņØ┤ņÜ®ĒĢ£ļŗż. ņ╗żĒö╝ņ░īĻ║╝ĻĖ░ 150mgĻ│╝ ņé░ņ┤ēļ¦ż 150mgņØä ļ│╝ļ░ĆĻĖ░ļź╝ ĒåĄĒĢ┤ Ēś╝ĒĢ®ņŗ£Ēé© ļŗżņØī, ņ¢╗ņ¢┤ļéĖ ļ¼┤Ļ▓īņŚÉ ļ¦×ņČöņ¢┤ ņ”Øļźśņłśļź╝ ņ▓©Ļ░ĆĒĢ£ļŗż. ļ│╝ļ░Ć Ļ│╝ņĀĢ ņżæ Ēś╝ĒĢ®ļ¼╝ņØś ņåÉņŗżņØ┤ ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ, ļ¼┤Ļ▓īļź╝ ņ×¼Ļ│Ā ļé£ Ēøä ņ”Øļźśņłśļź╝ ļäŻņ¢┤ņżśņĢ╝ ĒĢ£ļŗż. Ēś╝ĒĢ®ļ¼╝Ļ│╝ ņ”ØļźśņłśņØś ļ╣äņ£©ņØĆ 20:1ļĪ£ ļäŻņ¢┤ņżĆļŗż. ņØ┤ļĀćĻ▓ī ļ¦īļōżņ¢┤ņ¦ä Ēś╝ĒĢ®ļ¼╝ņØä ņłśņŚ┤ĒĢ®ņä▒ĻĖ░ņŚÉ ļäŻņ¢┤ 150Ōäā ņśżļĖÉņŚÉņä£ 12ņŗ£Ļ░ä ļ░śņØæņŗ£Ēé© Ēøä ļāēĻ░üņØ┤ ļüØļéśļ®┤ ņŚ¼Ļ│╝ņןņ╣śļź╝ ĒåĄĒĢ┤ ņŚ¼Ļ│╝ņŗ£Ēé©ļŗż. ņŚ¼Ļ│╝Ļ░Ć ļüØļéśļ®┤ ņĢ×ņäĀ ņŗżĒŚśļōżĻ│╝ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ 80Ōäā ņśżļĖÉņŚÉņä£ 24ņŗ£Ļ░ä Ļ▒┤ņĪ░ ņŗ£Ēé©ļŗż. ņłśņŚ┤ĒĢ®ņä▒ņØä ĒåĄĒĢ£ Ļ░ĆņłśļČäĒĢ┤ņŚÉ ļīĆĒĢ£ ĻĘĖļ”╝ņØĆ Fig 5ņŚÉ ļéśĒāĆļé┤ņŚłļŗż.
ļČäņäØ
3.1 Structural Analysis
Fig 6ņØĆ ņŗżļ”¼ņ╣┤ņÖĆ ņäżĒÅ░ĒÖö ņŗżļ”¼ņ╣┤ņŚÉ ļīĆĒĢ£ X-ray Diffraction (XRD)ņØ┤ļŗż. ļæÉ XRD ĻĘĖļלĒöäļź╝ ļ│┤ņĢśņØä ļĢī ņŗżļ”¼ņ╣┤ņÖĆ ņäżĒÅ░ĒÖö ņŗżļ”¼ņ╣┤ ņé¼ņØ┤ņŚÉ Ēü░ ņ░©ņØ┤Ļ░Ć ļ│┤ņØ┤ņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņŚÉ ņäżĒÅ░ĒÖöļĪ£ ņØĖĒĢ£ Ļ▓░ņĀĢĻĄ¼ņĪ░ņØś ļ│ĆĒÖöļŖö ņŚåļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ļæÉ ĻĘĖļלĒöä ļ¬©ļæÉ Ļ│ĄĒåĄņĀüņ£╝ļĪ£ 20 Ōł╝ 25ļÅä ņ¦ĆņŚŁņŚÉņä£ ļäōņØĆ ļ®┤ņĀüņØś Ēö╝Ēü¼Ļ░Ć ļéśĒāĆļéśĻ│Ā, ņØ┤Ēøä ņČöĻ░ĆņĀüņØĖ ņśüņŚŁņŚÉņä£ļŖö Ļ▓░ņĀĢ ĒÅēļ®┤ņØ┤ ļéśĒāĆļéśņ¦Ć ņĢŖļŖöļŗż. JCPDS ņ╣┤ļō£ņØś ņŗżļ”¼ņ╣┤ Ļ│Āņ£Ā ņŗØļ│ä ļ▓łĒśĖ (No.47-0715)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ļ╣äņĀĢņ¦ł ĻĄ¼ņĪ░ņØś ĒśĢĒā£ļź╝ Ļ░Ćņ¦ä ņ×ģņ×ÉļōżņØ┤ ĒśĢņä▒ļÉ£ Ļ▓āņØä ņĢī ņłś ņ׳ļŗż.
3.2 Morphology analysis
Fig 7 (a)ļŖö ĒöīļØ╝ņ”łļ¦łļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĀ£ņĪ░ĒĢ£ ņŗżļ”¼ņ╣┤, (b) ļŖö ņĪĖ-Ļ▓öņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĀ£ņĪ░ĒĢ£ ņŗżļ”¼ņ╣┤, (c),(d)ļŖö ņäżĒÅ░ĒÖö ņŗżļ”¼ņ╣┤ņŚÉ ļīĆĒĢ£ SEM ņé¼ņ¦äņØ┤ļŗż. SEM ņé¼ņ¦äņŚÉņä£ XRD ļŹ░ņØ┤Ēä░ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņäżĒÅ░ĒÖö Ļ│╝ņĀĢ ņĀäĒøäņŚÉ Ēü░ ņ░©ņØ┤Ļ░Ć ļ│┤ņØ┤ņ¦Ć ņĢŖļŖöļŗż. ļśÉĒĢ£ ņĪĖ-Ļ▓öļ▓Ģņ£╝ļĪ£ ņāØņä▒ļÉ£ ņŗżļ”¼ņ╣┤ņÖĆ ĒöīļØ╝ņ”łļ¦łļź╝ ņØ┤ņÜ®ĒĢ£ ņŗżļ”¼ņ╣┤ ņŚŁņŗ£ ņ£ĪņĢłņ£╝ļĪ£ļŖö Ēü░ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖļŖöļŗż. ņāØņä▒ļÉ£ ņŗżļ”¼ņ╣┤ņØś Ēü¼ĻĖ░ļź╝ ļ│┤ļ®┤ ņĢĮ 500 Ōł╝ 600nmļĪ£ ļéśļģĖ Ēü¼ĻĖ░ņØś ĻĄ¼ĒśĢ ņ×ģņ×ÉĻ░Ć ĒśĢņä▒ļÉ£ Ļ▓āņØä ņĢī ņłś ņ׳ņ£╝ļ®░, ĻĘĀņ¦łĒĢ£ ĒśĢĒā£ņØś ņ×ģņ×ÉĻ░Ć ĒśĢņä▒ļÉśņŚłļŗż. FIg 8ņÖĆ Table 2ņØĆ ņŗżļ”¼ņ╣┤ņŚÉ ļīĆĒĢ£ EDSļĪ£ ņŗżļ”¼ņ╣┤Ļ░Ć ņל ņāØņä▒ļÉśņŚłļŖöņ¦Ć ņĢīņĢäļ│┤ņĢśļŗż. Ļ▓ēļ│┤ĻĖ░ ļåŹļÅäļŖö Si: O ņØś ļ╣äņ£©ņØ┤ ņĢĮ 1: 2 ļĪ£ ņŗżļ”¼ņ╣┤ņØś ļČäņ×ÉņŗØņØĖ SiO2ļź╝ ļ¦īņĪ▒ĒĢśņśĆļŗż.
3.3 Textural Properties
SEM ņé¼ņ¦äļ¦īņ£╝ļĪ£ļŖö ņŗżļ”¼ņ╣┤ņØś ņ×ģņ×É Ēü¼ĻĖ░ ņĀĢļÅäļ¦ī ĒÖĢņØĖņØ┤ Ļ░ĆļŖźĒĢśĻ│Ā, ĻĖ░Ļ│ĄņØś Ēü¼ĻĖ░ņÖĆ ĻĖ░Ļ│ĄņØś ļČĆĒö╝ ļō▒ ņ┤ēļ¦ż ņä▒ļŖźņØä ĒīÉļŗ©ĒĢśĻĖ░ļŖö ņ¢┤ļĀĄļŗż. ĻĘĖļĀćĻĖ░ņŚÉ Brunauer-Emmett-Teller (BET) ļČäņäØņØä ĒåĄĒĢśņŚ¼ ņ┤ēļ¦ż ņä▒ļŖźņØä ĒīÉļŗ©ĒĢśĻĖ░ ņ£äĒĢ£ ĻĖ░ņżĆļōżņØä ļČäņäØĒĢ┤ ļ│┤ņĢśļŗż. BET ļŹ░ņØ┤Ēä░ļŖö Fig 8ļĪ£ ļéśĒāĆļé┤ņŚłļŗż. (a)ņÖĆ (b)ļŖö ĒöīļØ╝ņ”łļ¦łļĪ£ ņāØņä▒ļÉ£ ņŗżļ”¼ņ╣┤ļź╝, (c)ņÖĆ (d)ļŖö ņĪĖ-Ļ▓öļ▓Ģņ£╝ļĪ£ ņāØņä▒ļÉ£ ņŗżļ”¼ņ╣┤ņØ┤ļŗż. Ēæ£ļ®┤ņĀüņØĆ Ļ░üĻ░ü 5.99ņŚÉņä£ 6.44ļĪ£ ĻĘ╝ņåīĒĢśĻ▓ī ņ”ØĻ░ĆĒ¢łļŗż. (b)ņÖĆ (d) ĻĘĖļלĒöäļź╝ ļ╣äĻĄÉĒĢ┤ ļ│┤ļ®┤ ĒöīļØ╝ņ”łļ¦łļĪ£ ņāØņä▒ļÉ£ ņŗżļ”¼ņ╣┤ļŖö 10nmņØś ĻĖ░Ļ│ĄņØ┤ ļ¦ÄņØ┤ ņāØņä▒ļÉśņŚłĻ│Ā, ņĪĖ-Ļ▓öļ▓Ģņ£╝ļĪ£ ņāØņä▒ļÉ£ ņŗżļ”¼ņ╣┤ļŖö 10nmļ│┤ļŗż ņ×æņØĆ ĻĖ░Ļ│ĄņØ┤ ņāØņä▒ļÉśņŚłļŗż. ņØ┤ļĪ£ ņØĖĒĢ┤ Ēæ£ļ®┤ņĀüņØś ļ│ĆĒÖöĻ░Ć ļ░£ņāØĒĢśņśĆĻ│Ā ņØ┤ļŖö ņ┤ēļ¦ż ņä▒ļŖźņŚÉņä£ņØś ņ░©ņØ┤Ļ░Ć ļ░£ņāØĒĢĀ Ļ▓āņ×äņØä ņśłņāüĒĢĀ ņłśņ׳ļŗż.
3.4 Total Acid and sulfonic density (ņĀüņĀĢ)
ņĀüņĀĢņØ┤ļ×Ć ĒŖ╣ņĀĢ ĒÖöĒĢÖņóģņ£╝ lshdehļź╝ Ļ▓░ņĀĢĒĢśĻĖ░ ņ£äĒĢ┤ ņé¼ņÜ®ĒĢśļŖö ņĀĢļ¤ē ļČäņäØļ▓ĢņØś ņØ╝ņóģņØ┤ļŗż. ņØ┤ ņŗżĒŚśņŚÉņä£ ņé¼ņÜ®ļÉ£ ņĀüņĀĢļ▓ĢņØĆ ņé░ņŚ╝ĻĖ░ ņĀüņĀĢņØä ņé¼ņÜ®ĒĢśņŚ¼ ņé░Ļ│╝ ņŚ╝ĻĖ░ņØś ļåŹļÅäļź╝ ņĢīĻ│Āņ×É ĒĢĀ ļĢī ņĀĢĒÖĢĒĢ£ ļåŹļÅäļź╝ ņĢīĻ│Ā ņ׳ļŖö ņŚ╝ĻĖ░ļéś ņé░ņØś Ēæ£ņżĆ ņÜ®ņĢĪņ£╝ļĪ£ ņżæĒÖöļ░śņØæņØä ņØ╝ņ£╝ņ╝£ ĻĘĖ ļåŹļÅäļź╝ Ļ▓░ņĀĢĒĢśļŖö ļ░® ļ▓ĢņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ņĀäņ▓┤ ņé░ļ░ĆļÅä (Total acid density)ļŖö SO3 H ņ×æņÜ®ĻĖ░ņØś ļ░ĆļÅäņÖĆ COOH ņ×æņÜ®ĻĖ░ņØś ļ░ĆļÅä, OH ņ×æņÜ®ĻĖ░ņØś ļ░ĆļÅäļĪ£ Ēæ£ĒśäņØ┤ Ļ░ĆļŖźĒĢśļŗż. NaOH 0.01M 30mlļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ┤ēļ¦żņØś ņé░ņä▒ņ×æņÜ®ĻĖ░ļź╝ NaOHņÖĆ ļ░śņØæņŗ£Ēé© Ēøä ļ░śņØæĒĢ£ ņ×æņÜ®ĻĖ░ņØś ņ¢æņØä ĻĄ¼ĒĢśĻĖ░ ņ£äĒĢ┤ HClņØä ņé¼ņÜ®ĒĢ┤ ņĀüņĀĢņØä ĒĢśņśĆļŗż. ņ▓©Ļ░ĆĒĢ£ HClņØś ņ¢æņØä xļØ╝Ļ│Ā ĒĢśļ®┤, ņŗØņØĆ ļŗżņØīĻ│╝ Ļ░Öļŗż. ņŚ¼ĻĖ░ņä£ xļŖö ĒÄśļåĆĒöäĒāłļĀłņØĖ ņÜ®ņĢĪņØś ņāē ļ│ĆĒÖöļź╝ ĒåĄĒĢ┤ ĻĄ¼ĒĢĀ ņłś ņ׳Ļ│Ā, AļŖö ņĀüņĀĢ ņŗ£ ņé¼ņÜ®ĒĢ£ ņ┤ēļ¦żņØś ņ¢æņØ┤ļŗż.
SO3 HņØś ļ░ĆļÅäļŖö NaCl 0.01M 30mlļź╝ ņØ┤ņÜ®ĒĢ£ļŗż. ņ┤ēļ¦żņØś OHņ×æņÜ®ĻĖ░ņÖĆ COOH ņ×æņÜ®ĻĖ░ļŖö SO3 H ņ×æņÜ®ĻĖ░ņŚÉ ļ╣äĒĢ┤ Ļ▓░ĒĢ®ņØ┤ ņĢĮĒĢśļŗż. NaCl ņÜ®ņĢĪņØĆ SO3 H ņ×æņÜ®ĻĖ░ņÖĆļ¦ī ļ░śņØæĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ SO3 H ņ×æņÜ®ĻĖ░ņØś ļ░ĆļÅäļź╝ ĻĄ¼ĒĢĀ ņłś ņ׳ļŗż. ņāØņä▒ļÉ£ HClņØś ņ¢æņØä ĻĄ¼ĒĢśĻĖ░ ņ£äĒĢ┤ NaOHļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĀüņĀĢņØä ņ¦äĒ¢ēĒĢ£ļŗż. ņ▓©Ļ░ĆĒĢ£ NaOHņØś ņ¢æņØä yļØ╝Ļ│Ā ĒĢśļ®┤ ņŗØņØĆ ļŗżņØīĻ│╝ Ļ░Öļŗż.
ņ£äņØś ņŗØņ£╝ļĪ£ ĻĄ¼ĒĢśņśĆņØä ļĢī, ņé░ļ░ĆļÅäļź╝ Table 3. ņ£╝ļĪ£ ļéśĒāĆļé┤ņŚłļŗż.
Table┬Ā3.
ņĀüņĀĢļ▓ĢņØä ĒåĄĒĢ£ ņ┤ēļ¦żņØś ņé░ ļ░ĆļÅä
| ┬Ā | Total acid density | SO3H acid density |
|---|---|---|
| ņĪĖ-Ļ▓öļ▓Ģ ņäżĒÅ░ĒÖö ņŗżļ”¼ņ╣┤ | 5.46 ┬▒ 0.2 | 0.7 ┬▒ 0.1 |
| ĒöīļØ╝ņ”łļ¦ł ņäżĒÅ░ĒÖö ņŗżļ”¼ņ╣┤ | 5.48 ┬▒ 0.2 | 0.86 ┬▒ 0.2 |
Total acid densityļŖö ņĪĖ-Ļ▓öļ▓ĢĻ│╝ ĒöīļØ╝ņ”łļ¦ł Ļ│Ąļ▓ĢņØä ņØ┤ņÜ®ĒĢ£ ņ┤ēļ¦ż ĻĘ╝ņåīĒĢ£ ņ░©ņØ┤Ļ░Ć ļé¼ņ¦Ćļ¦ī, SO3 HņØś Ļ▓ĮņÜ░ 0.1mol/ gņ£╝ļĪ£ ņ£ĀņØśļ»ĖĒĢ£ ņ░©ņØ┤Ļ░Ć ļé¼ļŗż. ņĢ×ņä£ ņäżļ¬ģĒĢ£ BET ļŹ░ņØ┤Ēä░ņŚÉņä£ņØś Ēæ£ļ®┤ņĀü Ēü¼ĻĖ░ ņ░©ņØ┤Ļ░Ć SO3 H Ļ▓░ĒĢ®ņØś ņ░©ņØ┤ņØś ņøÉņØĖņØ┤ļØ╝Ļ│Ā ļ│┤ņŚ¼ņ¦äļŗż.
3.5 Catalytic performance
HPLC (High-Performance Liquid Chromatography)ļØ╝ļŖö ļČäņäØļ▓ĢņØĆ Ļ│ĀņĀĢņāüĻ│╝ ņŗ£ļŻī ļ░Å ņØ┤ļÅÖņāüĻ│╝ņØś ņāüĒśĖņ×æņÜ®ņ£╝ļĪ£ Ēś╝ĒĢ®ļ¼╝ņØä ļŗ©ņØ╝ņä▒ļČäņ£╝ļĪ£ ļČäļ”¼ņŗ£ņ╝£ ļČäņäØĒĢśļŖö ļ░®ļ▓ĢņØ┤ļŗż. ņĢĪņ▓┤ Ēü¼ļĪ£ļ¦łĒåĀĻĘĖļלĒö╝ļŖö ĻĖ░ņ▓┤ Ēü¼ļĪ£ļ¦łĒåĀĻĘĖļלĒö╝ņÖĆ ļŗżļź┤Ļ▓ī ļČäņäØĒĢĀ ņłś ņ׳ļŖö ļČäņ×Éļ¤ēņØś ņĀ£ĒĢ£ņØ┤ ņŚåĻĖ░ ļĢīļ¼ĖņŚÉ Ē£śļ░£ņä▒ņØ┤ ņŚåļŖö ņŗ£ļŻīļź╝ ļČäņäØĒĢĀ ņłś ņ׳ņØä ļ┐É ņĢäļŗłļØ╝ ļČäņ×Éļ¤ēņØ┤ Ēü░ ņŗ£ļŻīļÅä ļČäņäØņØ┤ Ļ░ĆļŖźĒĢśļŗż. ņØ┤ ņŗżĒŚśņŚÉņä£ļŖö ņ┤ēļ¦żļź╝ ĒåĄĒĢ┤ ļČäĒĢ┤ļÉ£ ņ╗żĒö╝Ļ░Ć ņ¢┤ļ¢ĀĒĢ£ ņä▒ļČäņ£╝ļĪ£ ļČäĒĢ┤Ļ░Ć ļÉśņŚłļŖöņ¦Ć ņĢīĻĖ░ ņ£äĒĢ┤ņä£ ņØ┤ ļČäņäØļ▓ĢņØä ņé¼ņÜ®ĒĢśņśĆļŗż.
Fig 10ņØĆ HPLC ļČäņäØņØä ĒåĄĒĢ┤ ĻĖĆļŻ©ņĮöņŖż, ņ×ÉņØ╝ļĪ£ņŖżņŚÉ ļīĆĒĢ£ Ēö╝Ēü¼ļź╝ ļéśĒāĆļéĖ Ļ▓āņØ┤ļŗż. HPLC ļČäņäØņØä ĒåĄĒĢ┤ ņ¢╗ņØĆ ņä▒ļČäņ£╝ļĪ£ļŖö ĻĖĆļŻ©ņĮöņŖż, ņ×ÉņØ╝ļĪ£ņŖż, ĻĖĆļ”¼ņäĖļĪż, ņĢäņäĖĒŖĖņé░ļō▒ņØ┤ ņ׳ļŗż. ņØ┤ ļĢī Ēö╝Ēü¼ļź╝ ĒåĄĒĢ┤ ņ¢╝ļ¦łļ¦īĒü╝ņØś ņä▒ļČäņØä ņāØņä▒Ē¢łļŖöņ¦Ć ņĢīĻĖ░ ņ£äĒĢ┤ņä£ ļŗżņØīĻ│╝ Ļ░ÖņØĆ ņŗØņØä ĒåĄĒĢ┤ ĻĄ¼ĒĢĀ ņłś ņ׳ļŗż.
ņØ┤ ļĢī AņØś ļåŹļÅäļŖö Ļ░ĆņłśļČäĒĢ┤Ļ░Ć ļüØļé£ Ēøä HPLCļź╝ ĒåĄĒĢ┤ ĻĄ¼ĒĢ£ ļåŹļÅäņØ┤Ļ│Ā, ļ¼╝ņØĆ Ļ░ĆņłśļČäĒĢ┤ ļŗ╣ņŗ£ ļäŻņ¢┤ņŻ╝ņŚłļŹś ņ”ØļźśņłśņØś ņ¢æņØ┤ļŗż. ņ£ä ņŗØņØä ĒåĄĒĢ┤ Ļ░ü ņä▒ļČäņØś Ēāäņåī ļ¬░ļåŹļÅäļź╝ ĻĄ¼ĒĢ£ Ēøä ņ╗żĒö╝ņŚÉņä£ ņ¢╝ļ¦ł ļ¦īĒü╝ ļ│ĆĒÖśņØ┤ ļÉśņŚłļŖöņ¦Ć ĻĄ¼ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņĢäļל ņŗØņØä ņØ┤ņÜ®ĒĢ£ļŗż.
ņØ┤ļź╝ ĒåĄĒĢ┤ ņ×ÉņØ╝ļĪ£ņŖżņØś ņĀäĒÖśņ£©Ļ│╝, ņ×ÉņØ╝ļĪ£ņŖżņØś ņäĀĒāØļźĀ(selectivity) ĻĘĖļ”¼Ļ│Ā ņ┤Ø ņĀäĒÖśņ£©ņØä Ļ│äņé░ĒĢśņśĆļŗż. ņØ┤ļŖö Table 4ļĪ£ ļéśĒāĆļé┤ņŚłļŗż. ĻĘĖ Ļ▓░Ļ│╝ ņ×ÉņØ╝ļĪ£ņŖżņØś ņäĀĒāØļźĀĻ│╝ ņĀäĒÖśņ£© ļ¬©ļæÉ ņāüņŖ╣ĒĢśņśĆņ£╝ļ®░, ņĀäņ▓┤ ņłśņ£© ņŚŁņŗ£ ņ”ØĻ░ĆĒĢśņśĆļŗż.
Ļ▓░ļĪĀ
Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ĒöīļØ╝ņ”łļ¦łļź╝ ĒåĄĒĢ£ ņŗżļ”¼ņ╣┤ļŖö ņ┤ēļ¦żļĪ£ņä£ņØś ņāłļĪ£ņÜ┤ Ļ░ĆļŖźņä▒ņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. ļÅÖņØ╝ĒĢ£ ņŗ£Ļ░ä ļÅÖņĢł ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņŚ¼ ņ¢╗ņØĆ ņ¢æņØä ļ│┤ļ®┤, ĒöīļØ╝ņ”łļ¦ł Ļ│Ąļ▓ĢņØś ņ¢æņØ┤ ļŹö ļ¦ÄņĢśļŗż. SEMņØś ņé¼ņ¦äņ£╝ļĪ£ ļ│┤ņĢśņØä Ļ▓ĮņÜ░ ņŗżļ”¼ņ╣┤ņØś ņ×ģņ×É Ēü¼ĻĖ░ļŖö Ēü░ ņ░©ņØ┤Ļ░Ć ļéśņ¦Ć ņĢŖņĢśņ¦Ćļ¦ī, BET ļŹ░ņØ┤Ēä░ļź╝ ļ│┤ļ®┤ ĒöīļØ╝ņ”łļ¦łļź╝ ņé¼ņÜ®ĒĢĀ Ļ▓ĮņÜ░ ĻĖ░Ļ│ĄņØś Ēü¼ĻĖ░Ļ░Ć ņ╗żņ¦Éņ£╝ļĪ£ ņØĖĒĢ┤ ļ╣äĒæ£ļ®┤ņĀüņØ┤ ņ░©ņØ┤Ļ░Ć ļ░£ņāØĒĢ© ņĢī ņłś ņ׳ņŚłļŗż. ļ╣äĒæ£ļ®┤ņĀüņØś ņ░©ņØ┤ļŖö ĻĘĖļĀćĻ▓ī Ēü░ ņ░©ņØ┤Ļ░Ć ļéśņ¦Ć ņĢŖņĢśņ¦Ćļ¦ī, ņ┤ēļ¦żņØś ņä▒ļŖźņ£╝ļĪ£ ļ│┤ņĢśņØä ļĢī ņĀäĒÖśņ£©Ļ│╝ ņäĀĒāØņ£©ņØĆ ņĪĖ-Ļ▓öļ▓ĢņØä ņé¼ņÜ®ĒĢśņśĆņØä ļĢī 10.7%, 69%ņØĖļŹ░ ļ░śĒĢ┤, ĒöīļØ╝ņ”łļ¦łĻ│Ąļ▓ĢņØä ņé¼ņÜ®ĒĢĀ Ļ▓ĮņÜ░ 16.2%ņÖĆ 73%ļĪ£ Ļ░üĻ░ü ņĢĮ 6%. 4%ņØś ņ”ØĻ░ĆĒĢ©ņØä ņĢī ņłś ņ׳ņŚłļŗż. ļŗ©ņł£ ņŗżĒŚśņĀü ņłśņ╣śļĪ£ ļ│Ėļŗżļ®┤ ļ¦żņÜ░ ļåÆņØĆ ņä▒ļŖźņØś Ē¢źņāüņØĆ ņĢäļŗłņ¦Ćļ¦ī, ņé░ņŚģ ĻĘ£ļ¬©ņØś ļīĆĻĘ£ļ¬© Ļ│ĄņĀĢņ£╝ļĪ£ ņāØĻ░üĒĢĀ Ļ▓ĮņÜ░ ņČ®ļČäĒ׳ Ļ░Ćņ╣ś ņ׳ļŖö Ļ▓░Ļ│╝ļØ╝Ļ│Ā ņāØĻ░üļÉ£ļŗż. ņŗżļ”¼ņ╣┤ņØś ņ×ģņ×É Ēü¼ĻĖ░ļŖö TEOSņÖĆ NH4 OHņØś ļ╣äņ£©ņŚÉ ļö░ļØ╝ Ēü¼Ļ▓ī ļŗ¼ļØ╝ņ¦Ćļ»ĆļĪ£ ņØ┤ļź╝ ņóĆ ļŹö ņĄ£ņĀüĒÖöņŗ£Ēé©ļŗżļ®┤ ļŹö ņ×æņØĆ ņ×ģņ×É Ēü¼ĻĖ░ņØś ņŗżļ”¼ņ╣┤ļź╝ ņ¢╗ņØä ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņśłņāüļÉ£ļŗż. ĒöīļØ╝ņ”łļ¦łļź╝ ĒåĄĒĢ£ ĻĖ░Ļ│Ą ņāØņä▒ņØś Ļ▓ĮņÜ░ ņŚ¼ĻĖ░ ĒöīļØ╝ņ”łļ¦łņØś ņäĖĻĖ░ņŚÉ ļö░ļØ╝ ņśüĒ¢źņØä ļ░øĻĖ░ ļĢīļ¼ĖņŚÉ ņØ┤ ņŚŁņŗ£ļÅä ņĄ£ņĀüĒÖö Ļ│╝ņĀĢņØ┤ ņĢäņ¦ü ĒĢäņÜöĒĢśļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż. ņ░©Ēøä ņĄ£ņĀüĒÖöņŚÉ ņä▒Ļ│ĄĒĢ£ļŗżļ®┤, ļŹö ļåÆņØĆ ņä▒ļŖźņØś ņŗżļ”¼ņ╣┤ ņé░ņ┤ēļ¦żļź╝ ņāØņä▒ Ļ░ĆļŖźĒĢśņŚ¼ ĒÖśĻ▓Į ļ¼ĖņĀ£ ĒĢ┤Ļ▓░ņŚÉ ĻĖ░ņŚ¼ĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.