1. ņä£ļĪĀ
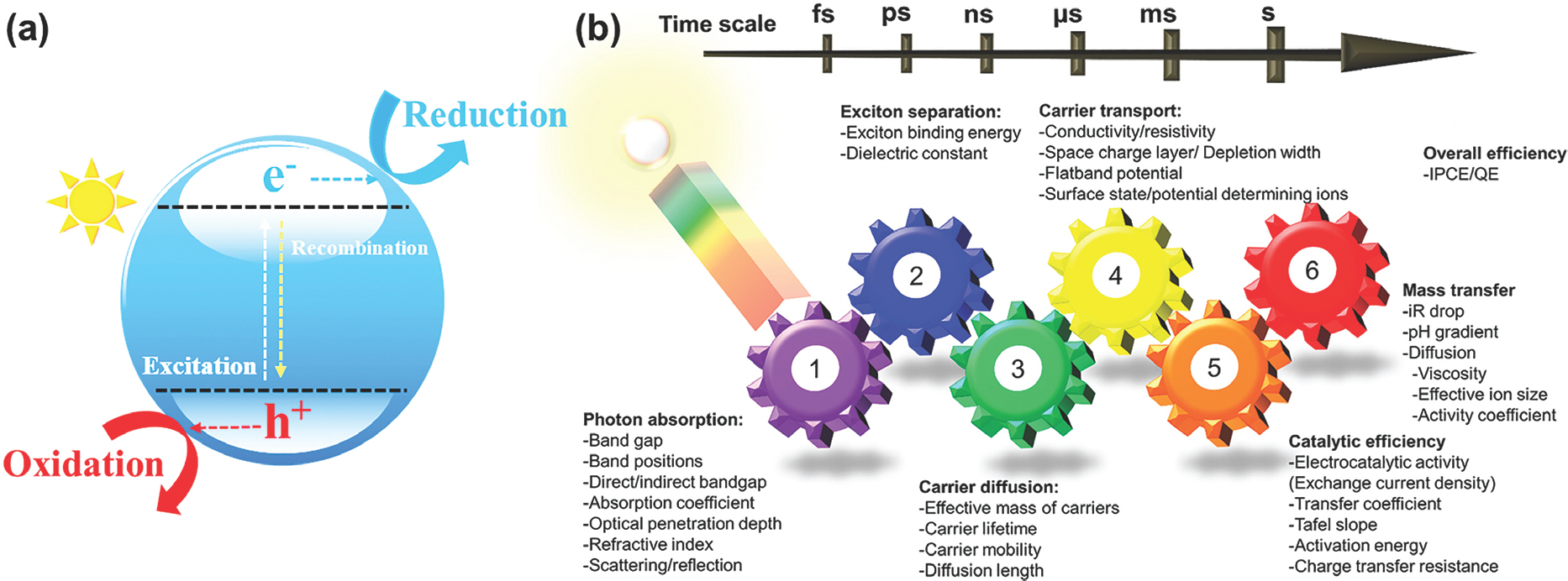
Ļ│╝ņé░ĒÖöņłśņåī(hydrogen peroxide, H2 O2)ļŖö Ļ░ĆņĀĢ ļ░Å ņé░ņŚģņŚÉņä£ ļ¦ÄņØ┤ ņé¼ņÜ®ļÉśļŖö ĒÖöĒĢ®ļ¼╝ ņżæ ĒĢśļéśļĪ£ ĻĖ░ņĪ┤ņŚÉļŖö ņŻ╝ļĪ£ Ēæ£ļ░▒ ļ░Å ņé░ĒÖöņĀ£ļĪ£ ņØ┤ņÜ®ļÉśņŚłņ¦Ćļ¦ī, Ēśäņ×¼ņŚÉļŖö ļ░ĢĒģīļ”¼ņĢä ļ®ĖĻĘĀ(disinfection)ņØä ņ£äĒĢ£ ņåīļÅģņĀ£, ņŚ░ļŻīņĀäņ¦Ć(fuel cell) ļ░Å ļĪ£ņ╝ōņØś ņŚ░ļŻī, Ļ│ĀļÅäņé░ĒÖöĻ│ĄņĀĢ(advanced oxidation process; AOP)ņØä ņ£äĒĢ£ ļØ╝ļööņ╣╝(radical)ņØś ņøÉļŻī ļō▒ ļ│┤ļŗż ĒÅŁ ļäōĻ▓ī ņØæņÜ®ļÉśĻ│Ā ņ׳ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ Ļ│╝ņé░ĒÖöņłśņåīļŖö ņĢłĒŖĖļØ╝ĒĆ┤ļģ╝(anthraquinone) Ļ│Ąļ▓ĢņŚÉ ņØśĒĢ┤ ņĀ£ņĪ░ļÉśļŖöļŹ░ Ļ│ĄņĀĢņØś ĻĄ¼ņä▒ņØä ņé┤ĒÄ┤ļ│┤ļ®┤ ņĢłĒŖĖļØ╝ĒĆ┤ļģ╝ņØś ņłśņåīĒÖö ļ░śņØæ(hydrogenation), ņé░ĒÖö ļ░śņØæ(oxidation), Ļ│╝ņé░ĒÖöņłśņåī ņČöņČ£ (H2 O2 extraction), ņÜ®ņĢĪņØś ņ▓śļ”¼ ļŗ©Ļ│äļĪ£ ļéśļēśļ®░, ĒīöļØ╝ļōÉĻ│ä ņ┤ēļ¦żņØś ņĪ┤ņ×¼ ĒĢśņŚÉ ņłśņåīņÖĆ ņé░ņåīļź╝ ļ▓łĻ░łņĢä ņŻ╝ņ×ģĒĢśņŚ¼ ņé░ĒÖö/ĒÖśņøÉ ļ░śņØæņØä ņ£ĀļÅäĒĢ£ļŗż.[1] ĒĢśņ¦Ćļ¦ī ņłśņåīņÖĆ ņé░ņåīļŖö ĒÅŁļ░£ņØś ņ£äĒŚśņØ┤ ņ׳Ļ│Ā Ļ│ĄņĀĢņŚÉ ļ¦ÄņØĆ ņŚÉļäłņ¦ĆĻ░Ć ĒĢäņÜöĒĢśļ®░, ĒŖ╣Ē׳ ņłśņåīļŖö ĒÖöņäØņŚ░ļŻī(fossil fuel)ļĪ£ļČĆĒä░ ļ¦īļōżņ¢┤ņ¦ĆĻĖ░ ļĢīļ¼ĖņŚÉ ņ╣£ĒÖśĻ▓Į/ņĀĆļ╣äņÜ®/Ēāäņåīņżæļ”Į ĻĖ░ļ░ś ļīĆņ▓┤ ĻĖ░ņłĀņØś Ļ░£ļ░£ņØĆ ļ¦ÄņØĆ Ļ┤Ćņŗ¼ņØä ļ░øĻ│Āņ׳ļŗż. Ļ┤æņ┤ēļ¦ż(photocatalyst)ļź╝ ņØ┤ņÜ®ĒĢ£ Ļ│╝ņé░ĒÖöņłśņåī ņāØņé░ ņŚŁņŗ£ ĒĢśļéśņØś ņŻ╝ņĀ£ļĪ£ Ļ│ĄņĀĢņØś Ļ░Ćņן Ēü░ ņןņĀÉņ£╝ļĪ£ļŖö ņāüņś©/ņāüņĢĢ ĒĢśņŚÉ ļ¼╝Ļ│╝ ņé░ņåī ĻĘĖļ”¼Ļ│Ā Ēā£ņ¢æĻ┤æļ¦ī ņ׳ņ£╝ļ®┤ ņÜ┤ņśüņØ┤ Ļ░ĆļŖźĒĢśļŗżļŖö Ļ▓āņØ┤ļŗż.[2] ņ┤ēļ¦ż(catalysis)ņØś ņĀĢņØśļŖö ļ░śņØæ Ļ│╝ņĀĢņŚÉņä£ ļ│ĆĒÖöļÉśņ¦Ć ņĢŖņ£╝ļ®░ ļ░śņØæņåŹļÅäļź╝ ņ”ØĻ░Ć ļśÉļŖö Ļ░Éņåīņŗ£ĒéżļŖö ļ¼╝ņ¦łņØä ļ¦ÉĒĢśļ®░, Ļ┤æņ┤ēļ¦żļŖö Ļ┤æņŚÉļäłņ¦ĆņŚÉ ņØśĒĢ┤ ņ┤ēļ¦ż ļ░śņØæņØ┤ ņØ╝ņ¢┤ļéśļŖö ņåīņ×¼ļź╝ ņØ╝ņ╗½ļŖöļŗż. Ļ┤æņ┤ēļ¦żļŖö ĻĘĀņØ╝Ļ│ä(homogeneous)ņÖĆ ļČłĻĘĀņØ╝Ļ│ä(heterogenenous)ļĪ£ ļéśļēśļ®░ ņĀäņ×ÉļŖö ņ£Ā/ļ¼┤ĻĖ░ ņŚ╝ļŻīĻ░Ć ļīĆĒæ£ņĀüņØ┤Ļ│Ā Ēøäņ×ÉņØś Ļ▓ĮņÜ░ ļ░śļÅäņ▓┤(semiconductor) ĒŖ╣ņä▒ņØä Ļ░¢Ļ│Ā ņ׳ļŖö ņåīņ×¼ļōżņØ┤ ņŻ╝ļź╝ ņØ┤ļŻ¼ļŗż. ņāüņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ highest occupied molecular orbital (HOMO)ņÖĆ lowest unoccupied molecular orbital (LUMO) ņé¼ņØ┤ņØś ņŚÉļäłņ¦ĆĻ░Ł ļśÉļŖö ņĀäļÅäļīĆ(conduction band)ņÖĆ Ļ░ĆņĀäņ×ÉļīĆ(valence band)ņØś ļ░┤ļō£Ļ░Ł(bandgap) ņØ┤ņāüņØś ņŚÉļäłņ¦Ćļź╝ Ļ░¢ļŖö ļ╣øņØä ņĪ░ņé¼ĒĢśļ®┤ ņĀäņ×É(electron)ņÖĆ ņĀĢĻ│Ą(hole)ņØ┤ ņāØņä▒ļÉśņ¢┤ ņé░ĒÖö ĒÖśņøÉ ļ░śņØæņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ņ£╝ļ®░, ļ░śļÅäņ▓┤ ņåīņ×ÉņØś ļ¼╝ļ”¼ņĀü ĒŖ╣ņä▒ņŚÉ ņØśĒĢ┤ ņāØņä▒ļÉśļŖö ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØś ņłśļŖö Ļ▓░ņĀĢļÉ£ļŗż. Fig. 1aņÖĆ Ļ░ÖņØ┤ Ļ┤æņ┤ēļ¦ż ĻĄ¼ļÅÖ ņøÉļ”¼ļź╝ Ļ░äļץĒĢśĻ▓ī ļÅäņŗØĒÖö ĒĢĀ ņłś ņ׳ņ¦Ćļ¦ī ņŗżņĀ£ Ļ│ĀļĀżĒĢ┤ņĢ╝ ļÉĀ ņÜöņåīļŖö ļ¦żņÜ░ ļ¦Äņ£╝ļ®░ ņŚ¼ĻĖ░ņŚÉ ņŗ£Ļ░äņØ┤ļØ╝ļŖö ĒĢŁļ¬®ņØ┤ ļōżņ¢┤Ļ░Ćļ®┤ ņŗ£ņŖżĒģ£ņØĆ ļŹöņÜ▒ ļ│Ąņ×ĪĒĢ┤ņ¦äļŗż (Fig. 1b). ņśłļź╝ ļōżņ¢┤ ļ░śļÅäņ▓┤ ņåīņ×¼ ļé┤ņŚÉņä£ ņØ╝ņ¢┤ļéśļŖö (1) photon absorption, (2) exciton separation, (3) carrier diffusion, (4) carrier transport, ņ┤ēļ¦ż Ēæ£ļ®┤ņŚÉņä£ ņĀäņ×É ļ░Å ņĀĢĻ│ĄņØś ņĀäļŗ¼ņŚÉ ņØśĒĢ┤ Ļ▓░ņĀĢļÉśļŖö (5) catalytic efficiency, ļ¦łņ¦Ćļ¦ēņ£╝ļĪ£ ļ░śņØæļ¼╝Ļ│╝ ņāØņä▒ļ¼╝ņØś Ļ│ĄĻĖēĻ│╝ ņĀ£Ļ▒░ņÖĆ ņŚ░Ļ┤ĆļÉ£ (6) mass transfer of reactants and products ļō▒ Ļ┤æņ┤ēļ¦żņØś ĒÜ©ņ£©ņØä ĻĘ╣ļīĆĒÖöņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņØ┤ ļ¬©ļōĀ ņÜöņåīļōżņØä Ļ│ĀļĀżĒĢ┤ņĢ╝ ļÉ£ļŗż.[3]
Fig.┬Ā1.
(a) Ļ┤æņ┤ēļ¦ż ļ░śņØæ ļ¬©ņŗØļÅä. (b) time scaleņØ┤ Ēæ£ĻĖ░ļÉ£ ņäĖļČĆņĀüņØĖ Ļ┤æņ┤ēļ¦ż ĻĄ¼ļÅÖ ņøÉļ”¼. Reproduced with permission. Copyright 2017, American Chemical Society.3
Ļ┤æņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ│╝ņé░ĒÖöņłśņåī ņāØņä▒ņØĆ ņé░ĒÖö ļ░śņØæĻ│╝ ĒÖśņøÉ ļ░śņØæņ£╝ļĪ£ ļéśļłī ņłśĻ░Ć ņ׳ņ£╝ļ®░, ļ©╝ņĀĆ ņé░ĒÖö ļ░śņØæņØś Ļ▓ĮņÜ░ ļ¼╝ņØ┤ ņé░ĒÖöļÉśņ¢┤ ņāØņä▒ļÉ£ ņłśņé░ĻĖ░ ļØ╝ļööņ╣╝ (hydroxyl radical, ŌĆóOH) (H2 O + h+ ŌåÆ ŌĆóOH + H+) ļæÉ Ļ░£Ļ░Ć Ļ▓░ĒĢ®ĒĢśņŚ¼ Ļ│╝ņé░ĒÖöņłśņåīĻ░Ć ņāØņä▒(ŌĆóOH + ŌĆóOH ŌåÆ H2 O2)ļÉśļ®░, ĒÖśņøÉ ļ░śņØæņØś Ļ▓ĮņÜ░ ņé░ņåīĻ░Ć ļæÉ Ļ░£ņØś ņĀäņ×Éļź╝ ļÅÖņŗ£ņŚÉ ļ░øņĢä(O2 + 2H+ + 2eŌłÆ ŌåÆ H2 O2) ļśÉļŖö ĒĢ£ Ļ░£ņØś ņĀäņ×Éļź╝ ļ░øņĢä ņ┤łņé░ĒÖöļ¼╝(superoxide)ņØ┤ ņāØņä▒ļÉśĻ│Ā ņŚ¼ĻĖ░ņŚÉ ĒĢ£ Ļ░£ņØś ņĀäņ×ÉĻ░Ć ļŹö ņØ┤ļÅÖĒĢśņŚ¼ Ļ│╝ņé░ĒÖöņłśņåīļź╝ ļ¦īļōĀļŗż(O2 + eŌłÆ ŌåÆ O2ŌłÆ; O2ņØ┤ ņé░ĒÖöļÉśņ¢┤ ļ░£ņāØĒĢśļŖö ņé░ņåī(2H2 O + 4h+ ŌåÆ O2 + 4H+), ļ¼╝ņØ┤ ĒÖśņøÉļÉśņ¢┤ ļ░£ņāØĒĢśļŖö ņłśņåī(2H+ + 2eŌłÆ ŌåÆ H2) ļ░Å ņé░ņåīĻ░Ć ĒÖśņøÉļÉśņ¢┤ ņāØņä▒ļÉśļŖö ļ¼╝(O2 + 4H+ + 4eŌłÆ ŌåÆ 2H2 O)ŌłÆ + H+ ŌåÆ HO2; HO2 + eŌłÆ + H+ ŌåÆ H2 O2). ņØ┤ ļĢī ļ¼╝ņØĆ Ļ▓Įņ¤ü ļ░śņØæņ£╝ļĪ£ ĒÖ£ņä▒ņØä ņ”ØļīĆĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņØ┤ļź╝ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņĀ£ņ¢┤ĒĢ┤ņĢ╝ĒĢ£ļŗż.[4] ņØ┤ņÖĆ ļÅÖņŗ£ņŚÉ ņāØņä▒ļÉ£ Ļ│╝ņé░ĒÖöņłśņåīļĪ£ ņČöĻ░ĆņĀüņØĖ ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØś ņĀäļŗ¼ (H2 O2 + eŌłÆ ŌåÆ ŌĆóOH +OHŌłÆ; H2 O2 + h+ ŌåÆ HO2 + H+)ņØä ņ¢ĄņĀ£ĒĢśņŚ¼ Ļ│╝ņé░ĒÖöņłśņåī ļČäĒĢ┤ļź╝ ņĄ£ņåīĒÖöņŗ£ņ╝£ņĢ╝ ĒĢ£ļŗż. ļ│Ė ņ┤ØņäżņŚÉņä£ļŖö Ļ┤æņ┤ēļ¦żņØś ĒĢ®ņä▒ļ▓Ģ ļ░Å ņåīņ×¼ļź╝ ļČäņäØĒĢśļŖöļŹ░ ņ¦Ćļ®┤ņØä ĒĢĀņĢĀĒĢśĻĖ░ ļ│┤ļŗżļŖö ņ×ÉņÖĖņäĀ ļ░Å Ļ░Ćņŗ£Ļ┤æ Ļ░ÉņØæ Ļ┤æņ┤ēļ¦ż, ļ░śņØæ ĒÜ©ņ£©ņØä ļåÆņØ┤ĻĖ░ ņ£äĒĢ£ Ēæ£ļ®┤ Ļ░£ņ¦ł ļ░®ļ▓Ģ, Ļ┤æņ┤ēļ¦żņÖĆ ņĀäĻĖ░ĒÖöĒĢÖ ņŗ£ņŖżĒģ£ņØ┤ ņ£ĄĒĢ®ļÉ£ Ļ┤æņĀäĻĘ╣ņØä ĒÖ£ņÜ®ĒĢ£ ļ¬ć Ļ░Ćņ¦Ć ņŚ░ĻĄ¼Ļ▓░Ļ│╝ļź╝ Ļ░äļץĒ׳ ņé┤ĒÄ┤ļ│┤Ļ│Ā Ļ░üĻ░üņØś ļŹ░ņØ┤Ēä░ļōżņØ┤ ņØśļ»ĖĒĢśļŖö ļ░öļź╝ ņØ┤ĒĢ┤ĒĢśĻ│Āņ×É ĒĢ£ļŗż. ļśÉĒĢ£, Ļ┤æņ┤ēļ¦ż ņŗ£ņŖżĒģ£ņØ┤ Ļ░¢ļŖö ĒĢ£Ļ│äļź╝ ņĢīņĢäļ│┤Ļ│Ā ņØ┤ļź╝ ĻĘ╣ļ│ĄĒĢśĻĖ░ ņ£äĒĢ£ ļ░®ļ▓ĢņØä Ļ▓░ļĪĀņŚÉņä£ ļ¬©ņāēĒĢśĻ│Āņ×É ĒĢ£ļŗż.
2. Ļ┤æņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ│╝ņé░ĒÖöņłśņåī ņāØņé░
2.1. ņ×ÉņÖĖņäĀ Ļ░ÉņØæ Ļ┤æņ┤ēļ¦żņØĖ ņØ┤ņé░ĒÖöĒŗ░Ēāä(titanium dioxide, TiO2)
ņ×ÉņÖĖņäĀ Ļ░ÉņØæ Ļ┤æņ┤ēļ¦żļŖö ņĀäļÅäļīĆ ļśÉļŖö Ļ░ĆņĀäņ×ÉļīĆ ņŚÉļäłņ¦Ć ļĀłļ▓©ņØ┤ ļ│┤ļŗż Ļ╣ŖĻ▓ī ĒśĢņä▒ļÉśņ¢┤ ņ׳ņ¢┤ ĒÖśņøÉļĀź ļśÉļŖö ņé░ĒÖöļĀźņØ┤ ļåÆņØĆ ņןņĀÉņØ┤ ņ׳ņ¦Ćļ¦ī, ļäōņØĆ ļ░┤ļō£Ļ░Łņ£╝ļĪ£ ņØĖĒĢ┤ Ēā£ņ¢æĻ┤æņ£╝ļĪ£ļČĆĒä░ ĒØĪņłśĒĢĀ ņłś ņ׳ļŖö ļ╣øņØ┤ ĒĢ£ņĀĢļÉ£ļŗżļŖö ļŗ©ņĀÉņØä Ļ░¢Ļ│Ā ņ׳ļŗż (ņ░ĖĻ│ĀļĪ£ Ēā£ņ¢æĻ┤æņŚÉņä£ ņ×ÉņÖĖņäĀņØĆ 3-5 %). ĒĢśņ¦Ćļ¦ī ņłśļ¬ģņØ┤ ļ░śņśüĻĄ¼ņĀüņØ┤ļ®░ ņĀĆļĀ┤ĒĢ£ UV LED ļשĒöäņØś ĻĖēĻ▓®ĒĢ£ ĻĖ░ņłĀ ļ░£ņĀä ļ░Å ļ│┤ĻĖēņØĆ ņØ┤ļ¤¼ĒĢ£ ļŗ©ņĀÉņØä ņĀÉņ░© ņāüņćäņŗ£ĒéżĻ│Ā ņ׳ļŗż. ņ×ÉņÖĖņäĀ Ļ░ÉņØæ Ļ┤æņ┤ēļ¦żļĪ£ ņĢīļĀżņ¦ä Ļ░Ćņן ļīĆĒæ£ņĀüņØĖ ļ¼╝ņ¦łņØ┤ TiO2ņØ┤ļ®░, Ļ┤æĒÖ£ņä▒, ļé┤ĻĄ¼ņä▒, ļé┤ĒÖöĒĢÖņä▒ņØ┤ ļø░ņ¢┤ļé©Ļ│╝ ļŹöļČłņ¢┤ ņĀäļÅäļīĆņÖĆ Ļ░ĆņĀäņ×ÉļīĆ ņŚÉļäłņ¦Ć ļĀłļ▓©ņØś ņ£äņ╣śĻ░Ć ņŚ┤ņŚŁĒĢÖņĀüņ£╝ļĪ£ ļŗżņ¢æĒĢ£ ļ░śņØæņØä ņ£ĀļÅäĒĢśĻĖ░ ņÜ®ņØ┤ĒĢśņŚ¼ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØņŚÉļÅä ņŚ░ĻĄ¼Ļ░Ć ļÉśņ¢┤ņÖöļŗż. ĒĢśņ¦Ćļ¦ī ņØ┤ļ¤¼ĒĢ£ ņÜ░ņłśĒĢ£ ņä▒ņ¦łņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā Ļ│╝ņé░ĒÖöņłśņåīņØś ņāØņä▒ļ¤ēņØĆ ļ¦żņÜ░ ļé«ņØĆļŹ░ ĻĘĖ ņØ┤ņ£ĀļŖö Ļ┤æņ×Éļź╝ ĒØĪņłśĒĢśļŖö ņ¢æņØ┤ ņāüļīĆņĀüņ£╝ļĪ£ ņ×æĻ│Ā, ņāØņä▒ļÉ£ Ļ│╝ņé░ĒÖöņłśņåīĻ░Ć ņØ┤ņé░ĒÖöĒŗ░ĒāäņØś Ēæ£ļ®┤ņŚÉ ņ░®ļ¼╝Ļ│╝ Ļ░ÖņØĆ ĒśĢĒā£ļĪ£ ĒØĪņ░®ļÉśņ¢┤ ļČäĒĢ┤Ļ░Ć ņ┤ēņ¦äļÉśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ Ļ┤æņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ ņśżņŚ╝ļ¼╝ņ¦ł ļČäĒĢ┤ ļ░śņØæņŚÉņä£ļŖö Ēæ£ļ®┤ņŚÉ ĒśĢņä▒ļÉ£ ļØ╝ļööņ╣╝ ņóģļōżņØ┤ ņé░ĒÖö ļ░śņØæņØä ņ┤ēņ¦äĒĢśņ¦Ćļ¦ī,[5] Ļ│╝ņé░ĒÖöņłśņåīļź╝ ņäĀĒāØņĀüņ£╝ļĪ£ ņāØņä▒ĒĢśĻ│Ā ĒÜīņłśĒĢśļŖö ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØ┤ļź╝ ņĄ£ļīĆĒĢ£ ņ¢ĄņĀ£ĒĢ┤ņĢ╝ ļÉ£ļŗż. ĻĘĖļ¤╝ ņ¦ĆĻĖłļČĆĒä░ TiO2 ĻĖ░ļ░ś Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØ ĒÜ©ņ£©ņØä ļåÆņØ┤ĻĖ░ ņ£äĒĢ£ Ļ░£ņ¦ł ļ░®ļ▓ĢņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤ĻĖ░ļĪ£ ĒĢ£ļŗż.
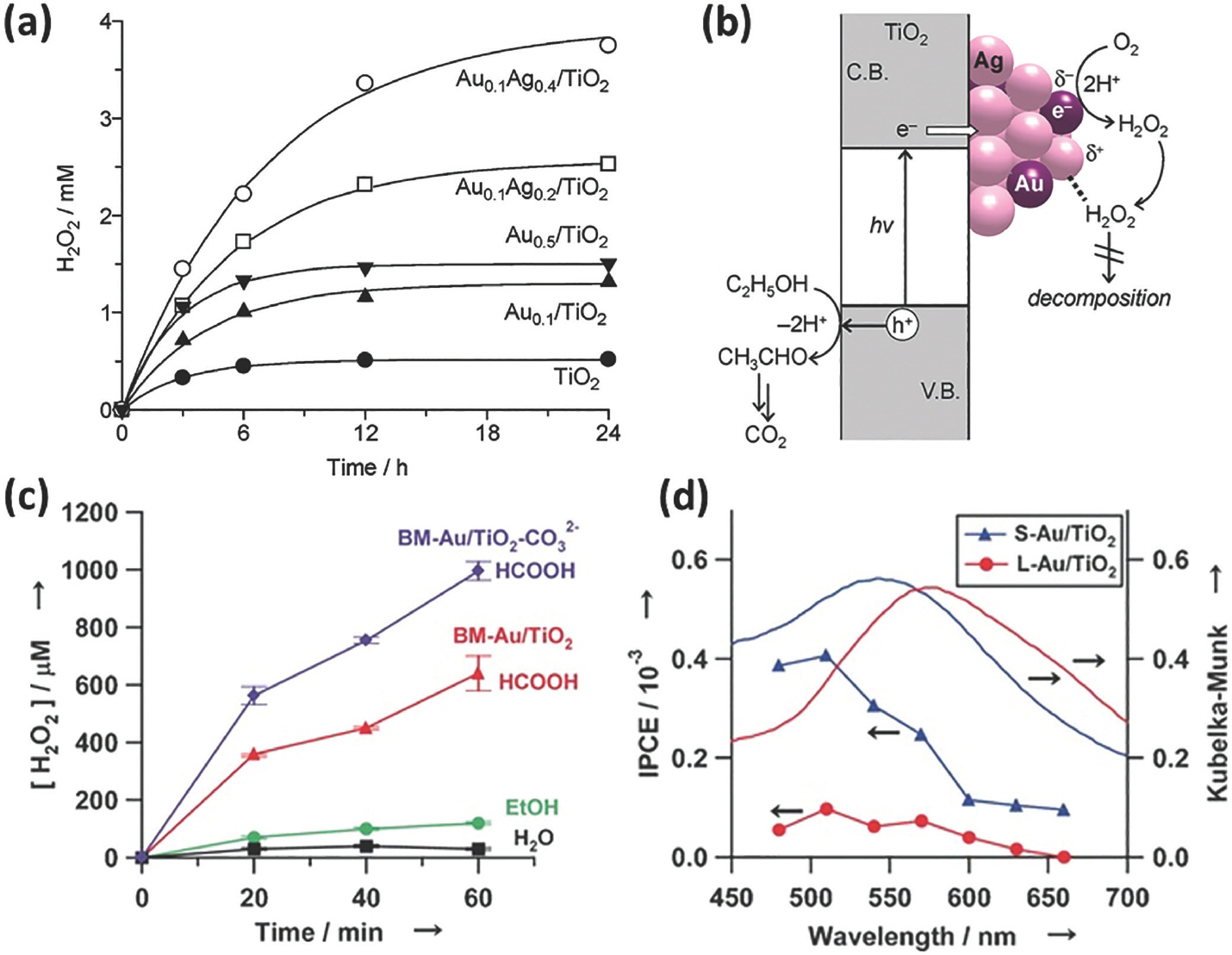
ĻĖłņåŹļéśļģĖņ×ģņ×É(metal nanoparticle)ļź╝ TiO2ņØś Ēæ£ļ®┤ņŚÉ ļŗ┤ņ¦Ć(deposition)ĒĢśļ®┤ TiO2ņÖĆ ĻĖłņåŹļéśļģĖņ×ģņ×É Ļ│äļ®┤(interface)ņŚÉ Schottky barrierĻ░Ć ĒśĢņä▒ļÉśņ¢┤ ņĀäļÅäļīĆņŚÉņä£ ļäśņ¢┤Ļ░ä ņĀäņ×ÉņØś back electron transferļź╝ ņ¢ĄņĀ£ĒĢśņŚ¼ ņĀĢĻ│ĄĻ│╝ņØś ņ×¼Ļ▓░ĒĢ®(recombination)ņØä ļ¦ēĻ▓ī ļÉ£ļŗż. Ļ░ü ĻĖłņåŹļéśļģĖņ×ģņ×Éļ¦łļŗż ņĀäņ×ÉņĀü ņä▒ņ¦ł(electronic property)ņØ┤ ļŗżļź┤ĻĖ░ ļĢīļ¼ĖņŚÉ Ļ│Āņ£ĀņØś ļÅģĒŖ╣ĒĢ£ ļ¼╝ņä▒ņØä ļéśĒāĆļé┤Ļ│Ā ņØ┤ļŖö ļŗżļźĖ ņ┤ēļ¦żņĀü ĒŖ╣ņä▒ņØä ņ£Āļ░£ĒĢ£ļŗż. ļśÉĒĢ£ ĻĖłņåŹļéśļģĖņ×ģņ×ÉņØś Ēü¼ĻĖ░ņŚÉ ļö░ļØ╝ ļ╣øĻ│╝ņØś ņāüĒśĖņ×æņÜ®ņØ┤ ļŗ¼ļØ╝ņ¦ĆĻ│Ā Ēæ£ļ®┤ ĒöīļØ╝ņ”łļ¬¼ Ļ│Ąļ¬ģ ĒÜ©Ļ│╝(surface plasmon resonance (SPR) effect)ļź╝ ņØ╝ņ£╝ņ╝£ Ļ░Ćņŗ£Ļ┤æ ņśüņŚŁņØś ļ╣ø ĒØĪņłśļź╝ ļÅäņÜĖ ņłś ņ׳ņØä ļ┐É ņĢäļŗłļØ╝ hot electron ņāØņä▒ņŚÉļÅä Ļ┤ĆņŚ¼ĒĢĀ ņłśļÅä ņ׳ļŗż. ņŚ¼ļ¤¼ ĻĖłņåŹ ņżæ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØņŚÉ ĻĖłĻ│╝ ņØĆņØ┤ ņóŗļŗżĻ│Ā ņĢīļĀżņĪīņ£╝ļ®░, ĻĖłĻ│╝ ņØĆņØś ĒĢ®ĻĖł(bimetallic Ag-Au alloy)ņØä ļ¦īļōżņ¢┤ TiO2ņŚÉ ļŗ┤ņ¦ĆĒĢ£ ņŚ░ĻĄ¼[6]ņÖĆ ĻĖł ļéśļģĖņ×ģņ×Éļź╝ ļŗ┤ņ¦ĆĒĢśņŚ¼ SPRņØä ņ£ĀļÅäĒĢ£ ņŚ░ĻĄ¼[7]ļź╝ ļīĆĒæ£ņĀüņ£╝ļĪ£ ņé┤ĒÄ┤ļ│┤Ļ│Āņ×É ĒĢ£ļŗż. ļ©╝ņĀĆ, ĻĖł-ņØĆ ĒĢ®ĻĖł ņ×ģņ×Éļź╝ ļŗ┤ņ¦ĆĒĢ£ ņŗżĒŚśņØĆ ņŚÉĒāäņś¼ņØä ņĀäņ×É ņŻ╝Ļ░£ (hole scavenger)ļĪ£ ņé¼ņÜ®ĒĢśņśĆĻ│Ā, ņé░ņåīĻ░Ć ĒżĒÖöļÉ£ ņĪ░Ļ▒┤ņŚÉņä£ ņłśņÜ®ņĢĪ ņāüņŚÉ ļČäņé░ļÉ£ Ļ┤æņ┤ēļ¦żņŚÉ ņ×ÉņÖĖņäĀ Ļ┤æņäĀņØä ņĪ░ņé¼ĒĢśņŚ¼ ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. Fig. 2aņŚÉņä£ ļ│┤ļŖö ļ░öņÖĆ Ļ░ÖņØ┤ TiO2ņŚÉ ļ╣äĒĢ┤ ĻĖłņåŹļéśļģĖņ×ģņ×ÉĻ░Ć ļŗ┤ņ¦ĆļÉ£ ņāśĒöīņØś ĒÖ£ņä▒ņØĆ ļŹö ļåÆņ£╝ļ®░, ļŗ©ņØ╝ ĻĖłņåŹļéśļģĖņ×ģņ×É ļ│┤ļŗżļŖö ĻĖł-ņØĆ ĒĢ®ĻĖł ņ×ģņ×ÉĻ░Ć Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØņŚÉ ļŹö ņ£Āļ”¼ĒĢ£ Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ņ░ĖĻ│ĀļĪ£ ĻĖłņåŹļéśļģĖņ×ģņ×ÉņØś ļŗ┤ņ¦ĆņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØņØ┤ ņŗ£Ļ░äņŚÉ ļö░ļØ╝ ĒżĒÖö(saturation)ļÉśļŖö ņØ┤ņ£ĀļŖö Ļ│╝ņé░ĒÖöņłśņåīĻ░Ć ņāØņä▒ļÉśļŖö ņåŹļÅäņÖĆ ņāØņä▒ļÉ£ Ļ│╝ņé░ĒÖöņłśņåīĻ░Ć ļČäĒĢ┤ļÉśļŖö ņåŹļÅäĻ░Ć ĒÅēĒśĢņØä ņØ┤ļŻ©ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ļŗ©ņØ╝ ņŗ£ņŖżĒģ£ņŚÉ ļ╣äĒĢ┤ ĒĢ®ĻĖłņØ┤ ļ░śņØæņŚÉ ņ£Āļ”¼ĒĢ£ ņØ┤ņ£ĀļŖö Schottky barrierĻ░Ć Ag/TiO2ņØś ļ╣äĒĢ┤ ļŹö Ēü¼Ļ│Ā ļ░śļīĆļĪ£ Au/TiO2ļ│┤ļŗż ņ×æņĢä back electron transfer ļź╝ ņ¢ĄņĀ£ĒĢśļŖö ļÅÖņŗ£ņŚÉ ņĀäņ×ÉĻ░Ć ĻĖłņåŹņ£╝ļĪ£ ņØ┤ļÅÖĒĢśļŖöļŹ░ ņŚÉļäłņ¦Ć ņĀĆĒĢŁņØä ņ×æĻ▓ī ļ¦īļōż ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ļ┐Éļ¦ī ņĢäļŗłļØ╝ Ag ņØś ļÅäņ×ģņ£╝ļĪ£ Au ņøÉņ×ÉņØś ņĀäņ×É ļ░ĆļÅä(electron density)Ļ░Ć ņ”ØĻ░ĆĒĢśņŚ¼ AuņøÉņ×É ņ£äņŚÉņä£ Ļ│╝ņé░ĒÖöņłśņåīņØś ĒØĪņ░®ņØ┤ ņżäņ¢┤ļōżņ¢┤ ļČäĒĢ┤ļÉśļŖö ņ¢æņØ┤ Ļ░ÉņåīĒĢśĻ│Ā Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ£ļŗż. Ļ│╝ņé░ĒÖöņłśņåīļŖö ņé░ņåīĻ░Ć ĒÖśņøÉļÉśņ¢┤ ņāØņä▒ļÉśļŖö ļ®öņ╗żļŗłņ”śņØä ļö░ļź┤ļ®░ ņŚÉĒāäņś¼ņØ┤ ņĀĢĻ│ĄņŚÉ ņØśĒĢ┤ ņé░ĒÖöļÉśļ®░ ņĀäņ×Éļź╝ Ļ│ĄĻĖēĒĢśļŖö ņŗ£ņŖżĒģ£ņØ┤ļŗż(Fig. 2b). SPR ĒÜ©Ļ│╝ļź╝ ĒåĄĒĢ£ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØ ņŗżĒŚśņØĆ ņŚÉĒāäņś¼ ļśÉļŖö Ēżļ”ä ņé░(formic acid, HCOOH)ņØä ņĀäņ×É ņŻ╝Ļ░£ļĪ£ ņ▓©Ļ░ĆĒĢśņśĆņ£╝ļ®░, ņé░ņåīĻ░Ć ĒżĒÖöļÉ£ ņĪ░Ļ▒┤ņŚÉņä£ ņłśņÜ®ņĢĪ ņāüņŚÉ ļČäņé░ļÉ£ Ļ┤æņ┤ēļ¦żņŚÉ Ļ░Ćņŗ£Ļ┤æ ļ╣øņØä ņĪ░ņé¼ĒĢśņŚ¼ ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. Ēü¼ĻĖ░Ļ░Ć ļŗżļźĖ 10.6 nmņÖĆ 2.3 nmņØś ĻĖł ļéśļģĖņ×ģņ×Éļź╝ TiO2(bimodal Au/TiO2)ņŚÉ ļŗ┤ņ¦ĆĒĢśņŚ¼ ņżĆļ╣äĒĢśņśĆļŗż. Fig. 2cļź╝ ļ│┤ļ®┤ ļ¼╝ņØĆ ņóŗņØĆ ņĀäņ×É ņŻ╝Ļ░£Ļ░Ć ņĢäļŗłĻĖ░ ļĢīļ¼ĖņŚÉ ļé«ņØĆ ĒÖ£ņä▒ņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ćļ¦ī ņ£ĀĻĖ░ļ¼╝ ņĀäņ×É ņŻ╝Ļ░£ļź╝ ņ▓©Ļ░ĆĒĢśļ®┤ ļ░śņØæņä▒ņØä Ēü¼Ļ▓ī ņ”ØĻ░ĆĒĢśĻ▓ī ļÉ£ļŗż. ņłśņåī ņØ┤ņś©(proton)ņØ┤ ļ░śņØæņŚÉ Ļ┤ĆņŚ¼ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ pHĻ░Ć ļé«ņØäņłśļĪØ ļ░śņØæņØĆ ņ£Āļ”¼ĒĢ£ļŹ░ Ēżļ”äņé░ņØś ņ▓©Ļ░ĆļŖö pHļź╝ ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ļé«ņČöļŖö ļÅÖņŗ£ņŚÉ TiO2 Ēæ£ļ®┤ņŚÉ Ļ░ĢĒĢśĻ▓ī ĒØĪņ░®ļÉśņ¢┤ ņŚÉĒāäņś¼ņŚÉ ļ╣äĒĢ┤ ļø░ņ¢┤ļéś ļ░śņØæņä▒ņØä ļ│┤ņØ┤Ļ▓ī ļÉ£ļŗż. TiO2ņØś Ēæ£ļ®┤ņØä Ēāäņé░ņŚ╝(carbonate, CO32-)ņ£╝ļĪ£ Ēæ£ļ®┤ņØä Ēī©ņŗ£ļ░░ņØ┤ņģś(passivation)ņŗ£Ēéżļ®┤ ņāØņä▒ļÉ£ Ļ│╝ņé░ĒÖöņłśņåīņØś ļČäĒĢ┤Ļ░Ć ņżäņ¢┤ļōżĻĖ░ ļĢīļ¼ĖņŚÉ ĒÜ©ņ£©ņØĆ ļŹöņÜ▒ Ē¢źņāüļÉ£ļŗż. Fig. 2dļŖö ĻĖł ļéśļģĖņ×ģņ×ÉņØś Ēü¼ĻĖ░ņŚÉ ļö░ļźĖ incident photon-to-current efficiency (IPCE)ņÖĆ ĒØĪĻ┤æļÅäņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņŚ¼ņŻ╝ļŖö ĻĘĖļלĒöäļĪ£ IPCEļŖö Ēü¼ĻĖ░Ļ░Ć ņ×æņØĆ ĻĖł ļéśļģĖņ×ģņ×É(S-Au)Ļ░Ć ļŗ┤ņ¦Ć ļÉśņŚłņØä ļĢīĻ░Ć Ēü░ ĻĖł ļéśļģĖņ×ģņ×É(L-Au)ņŚÉ ļ╣äĒĢ┤ 475-660 nm ņśüņŚŁņŚÉņä£ ļåÆņØĆ Ļ░ÆņØä ļ│┤ņØĖļŗż. ļ╣øņØ┤ ņĪ░ņé¼ļÉśļŖö ĒīīņןņØ┤ ņżäņ¢┤ļōżņłśļĪØ IPCEļŖö ņ”ØĻ░ĆĒĢśļŖöļŹ░ ņØ┤ļŖö bimodal Au/TiO2 ņŗ£ņŖżĒģ£ņŚÉņä£ ĻĖł ļéśļģĖņ×ģņ×ÉņØś 5d-6sp transitionņØś ņŚ¼ĻĖ░(excitation)ņŚÉ ņØśĒĢ┤ ņĀäņ×ÉĻ░Ć S-AuņŚÉņä£ TiO2ļź╝ ĒåĄĒĢ┤ L-AuļĪ£ ņĀäļŗ¼ļÉśņ¢┤ Ļ│╝ņé░ĒÖöņłśņåīĻ░Ć ļ░£ņāØĒ¢łņØä Ļ░ĆļŖźņä▒ņØä ņĢöņŗ£ĒĢ£ļŗż.
Fig.┬Ā2.
(a) ņ×ÉņÖĖņäĀ ļ╣øņØś ņĪ░ņé¼ ĒĢśņŚÉ TiO2, Au/TiO2, Ag/TiO2, Au-Ag alloy/TiO2ņØś Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØļ¤ē ļ╣äĻĄÉ. (2) ĒĢ®ĻĖłņØ┤ ļŗ┤ņ¦ĆļÉ£ TiO2ņŚÉņä£ ņØ╝ņ¢┤ļéśļŖö ņĀäņ×É ņĀäļŗ¼ ļ®öņ╗żļŗłņ”ś ļ¬©ņŗØļÅä. Reproduced with permission. Copyright 2012, American Chemical Society.[6] (c) Ļ░Ćņŗ£Ļ┤æ ļ╣øņØś ņĪ░ņé¼ ĒĢśņŚÉ ņĀäņ×É ņŻ╝Ļ░£ ļ░Å Ēæ£ļ®┤ Ēī©ņŗ£ļ▓ĀņØ┤ņģśņŚÉ ļö░ļźĖ Au/TiO2 ņØś Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØļ¤ē ļ╣äĻĄÉ. (d) ĻĖł ļéśļģĖņ×ģņ×ÉņØś Ēü¼ĻĖ░ņŚÉ ļö░ļźĖ ĒØĪĻ┤æļÅäņÖĆ IPCEņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļéśĒāĆļéĖ ĻĘĖļלĒöä. Reproduced with permission. Copyright 2016, Wiley.[7]
ĻĖłĻ│╝ ņØĆņØĆ ļ¬©ļæÉ ĻĘĆĻĖłņåŹņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ ņØ┤ļź╝ ļīĆņ▓┤ĒĢĀ Ļ░Æ ņŗ╝ ņåīņ×¼ņØś ĒĢäņÜöņä▒ņØ┤ ļīĆļæÉļÉśņŚłĻ│Ā, ņĀäĻĖ░ ņĀäļÅäļÅä(electrical conductivity)Ļ░Ć ļø░ņ¢┤ļéśĻ│Ā ņé░ņåīļź╝ ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ĒÖśņøÉņŗ£Ēé¼ ņłś ņ׳ļŖö Ēāäņåī Ļ│äņŚ┤ņØś ņåīņ×¼Ļ░Ć Ēü░ Ļ┤Ćņŗ¼ņØä ļ░øĻĖ░ ņŗ£ņ×æĒĢśņśĆļŗż. ĻĘĖ ņżæ ļīĆĒæ£ņĀüņØĖ ņåīņ×¼Ļ░Ć 2ņ░©ņøÉ ĻĄ¼ņĪ░ņØś ļäōņØĆ ļ╣äĒæ£ļ®┤ņĀüņØä Ļ░¢Ļ│Ā Ēł¼ļ¬ģĒĢśļ®░ ļåÆņØĆ ņĀäĻĖ░ņĀäļÅäļÅäļź╝ Ļ░¢ļŖö ĻĘĖļלĒĢĆ(graphene) ņŚäļ░ĆĒ׳ ļ¦ÉĒĢ┤ ņé░ĒÖö ĻĘĖļלĒĢĆņØ┤ ĒÖśņøÉļÉ£ ĒśĢĒā£ņØĖ reduced graphene oxide(rGO)ņØ┤ļ®░, ņØ┤ļź╝ TiO2ņÖĆ ļ│ĄĒĢ®ĒÖöĒĢśņŚ¼ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØņŚÉ ņĀüņÜ®ĒĢśņśĆļŗż.[8] ļ░śņØæ ņĪ░Ļ▒┤ņØĆ ņĢäņØ┤ņåīĒöäļĪ£ĒīÉņś¼(isopropyl alcohol)ņØä ņĀäņ×É ņŻ╝Ļ░£ļĪ£ ņ▓©Ļ░ĆĒĢśņŚ¼ ņé░ņåīĻ░Ć ĒżĒÖöļÉ£ Ļ┤æņ┤ēļ¦ż ļČäņé░ ņÜ®ņĢĪņŚÉ ņ×ÉņÖĖņäĀņØä ņĪ░ņé¼ĒĢśņŚ¼ ņŗżĒŚśĒĢśņśĆļŗż. Fig. 3aļź╝ ļ│┤ļ®┤ ņĢ×ņŚÉņä£ ņ¢ĖĻĖēĒĢ£ ļ░öņÖĆ Ļ░ÖņØ┤ TiO2ņŚÉ ļ╣äĒĢ┤ ĻĘĆĻĖłņåŹņØ┤ ļŗ┤ņ¦ĆļÉ£ Au/TiO2, Ag/TiO2ņŚÉņä£ Ļ│╝ņé░ĒÖöņłśņåīņØś ļ░£ņāØļ¤ēņØĆ Ēü¼Ļ▓ī ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ņØ┤ņÖĆ ļ░śļīĆļĪ£ Pt/TiO2ņŚÉņä£ļŖö ņśżĒ׳ļĀż ĒÜ©ņ£©ņØ┤ Ļ░ÉņåīļÉśļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ļ░▒ĻĖł ļéśļģĖņ×ģņ×ÉļŖö ņé░ņåī ļ┐Éļ¦ī ņĢäļŗłļØ╝ ļ¼╝ņØä ĒÖśņøÉņŗ£ĒéżļŖö ļŖźļĀźņØ┤ ļø░ņ¢┤ļéś ņØ┤ļ»Ė Ļ▓Įņ¤ü ļ░śņØæņØ┤ ņŗ¼ĒĢśĻ▓ī ņØ╝ņ¢┤ļéśļŖö ņĪ░Ļ▒┤ņØ┤ ĒśĢņä▒ļÉśļ®░, proton-exchange membrane fuel cell(PEMFC)ņŚÉ ņé¼ņÜ®ļÉĀ ņĀĢļÅäļĪ£ 2ņĀäņ×É ņĀäļŗ¼ ļ░śņØæļ│┤ļŗżļŖö 4ņĀäņ×É ņĀäļŗ¼ ļ░śņØæņØ┤ ļ╣Āļź┤Ļ▓ī ņØ╝ņ¢┤ļéś ņé░ņåīļź╝ ļ¼╝ļĪ£ ĒÖśņøÉņŗ£ĒéżļŖöļŹ░ ĒāüņøöĒĢ£ ņä▒ļŖźņØä ļ│┤ņØĖļŗż. ļśÉĒĢ£ ņāØņä▒ļÉ£ Ļ│╝ņé░ĒÖöņłśņåīļŖö ļ░▒ĻĖłņŚÉ ņØśĒĢ┤ ļ╣Āļź┤Ļ▓ī ļČäĒĢ┤ļ░śņØæ(2H2 O2 ŌåÆ H2 O + O2)ņØ┤ ņØ╝ņ¢┤ļé£ļŗż. ļö░ļØ╝ņä£ Pt/TiO2ņŚÉņä£ ļé«ņØĆ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØ ĒÜ©ņ£©ņØ┤ Ļ┤Ćņ░░ļÉ£ļŗż. rGO/TiO2ņØś ļ░śņØæņä▒ņØĆ ĻĘĆĻĖłņåŹņØ┤ ļŗ┤ņ¦ĆļÉ£ ņ┤ēļ¦żļ│┤ļŗż ļø░ņ¢┤ļé£ ĒÖ£ņä▒ņØä ļ│┤ņśĆņ£╝ļ®░, Ļ│╝ņé░ĒÖöņłśņåīņØś ņāØņä▒ ņåŹļÅäļŖö Au/TiO2ņÖĆ Ag/TiO2 ļ│┤ļŗż ļé«ņĢśņ¦Ćļ¦ī ņāØņä▒ļÉ£ Ļ│╝ņé░ĒÖöņłśņåīņØś ļČäĒĢ┤ ņåŹļÅä ļśÉĒĢ£ ņØ┤ ļæś ņ┤ēļ¦żļ│┤ļŗż ļé«ņĢä ņĀäņ▓┤ņĀüņØĖ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØļ¤ēņØĆ ņ”ØĻ░ĆĒĢ£ Ļ▓āņØä kinetic analysis ļź╝ ĒåĄĒĢ┤ ĒÖĢņØĖĒĢśņśĆļŗż. 2ņ░©ņøÉ ĻĄ¼ņĪ░ņØś ĻĘĖļלĒĢĆņØ┤ TiO2 Ēæ£ļ®┤ņØä ņØ╝ļČĆ Ļ░ÉņŗĖĻ│Ā ņ׳ņ£╝ļ®┤ ņāØņä▒ļÉ£ Ļ│╝ņé░ĒÖöņłśņåīņÖĆņØś ņ░®ļ¼╝ ĒśĢņä▒ņØ┤ ņĀĆĒĢ┤ļÉśņ¢┤ ļČäĒĢ┤ ņåŹļÅäļŖö ņżäņ¢┤ļōżĻ▓ī ļÉ£ļŗż. Ļ│╝ņé░ĒÖöņłśņåīņØś ļČäĒĢ┤ļŖö TiO2 Ēæ£ļ®┤ņŚÉņä£ ņØ╝ņ¢┤ļéśĻĖ░ ļĢīļ¼ĖņŚÉ ņØ┤ļź╝ ņĀ£ņ¢┤ĒĢśĻĖ░ ņ£äĒĢ┤ ņØĖņé░ņŚ╝(phosphate, PO43-)ņØä ļÅäņ×ģĒĢśņśĆļŗż. ļÅäņ×ģļÉ£ ņØĖņé░ņŚ╝ņØĆ TiO2 Ēæ£ļ®┤Ļ│╝ complexationņØä ņØ┤ļŻ©ņ¢┤ ņāØņä▒ļÉ£ Ļ│╝ņé░ĒÖöņłśņåīņØś ĒØĪņ░®ņØä ļ¦ēĻ│Ā ļö░ļØ╝ņä£ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØļ¤ēņØś ĻĖēĻ▓®ĒĢ£ ņ”ØĻ░Ćļź╝ ņĢ╝ĻĖ░ĒĢśņśĆļŗż(Fig. 3b). ņØ┤ļ¤¼ĒĢ£ ņĪ░Ļ▒┤ņŚÉņä£ļÅä rGO/TiO2ļŖö ņŚ¼ņĀäĒ׳ ĻĘĆĻĖłņåŹ ņ┤ēļ¦żņÖĆ ļ╣äņŖĘĒĢ£ ĒÖ£ņä▒ņØä ļ│┤ņśĆņ£╝ļ®░, ņĀäņ▓┤ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØļ¤ēņØĆ Ļ│╝ņé░ĒÖöņłśņåīņØś ļČäĒĢ┤ ņåŹļÅäņÖĆļŖö Ļ┤ĆĻ│äņŚåņØ┤ ņāØņä▒ ņåŹļÅäņŚÉ ņØśĒĢ┤ Ļ▓░ņĀĢļÉśļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ĻČüĻĘ╣ņĀüņ£╝ļĪ£ ļ¼╝ņØä ņé░ĒÖöņŗ£ņ╝£ Ļ│╝ņé░ĒÖöņłśņåīļź╝ ļ░£ņāØņŗ£ĒéżļŖö ņŗ£ņŖżĒģ£ņØä ĻĄ¼ĒśäĒĢśĻĖ░ ņ£äĒĢ┤ ļ¼╝ņé░ĒÖö ļ░śņØæņŚÉ ļø░ņ¢┤ļé£ ņ┤ēļ¦żņĀü ņä▒ņ¦łņØä Ļ░¢ļŖö cobalt phosphate complex ļź╝ ļÅäņ×ģĒĢśņśĆĻ│Ā, ĒÖ£ņä▒ņØ┤ ļé«ĻĖ░ļŖö ĒĢśņ¦Ćļ¦ī ļ¼╝ņØä ņĀäņ×É ņŻ╝Ļ░£ļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ ļ░śņØæņØä ņ£ĀļÅäĒĢĀ ņłś ņ׳ļŖö Ļ░ĆļŖźņä▒ņØä ĒÖĢņØĖĒĢśņśĆļŗż(Fig. 3c). Ēāäņåī ņåīņ×¼ņØś ļŗżļźĖ ņśłļĪ£ļŖö ņ¦łņåīņÖĆ ĒÖ®ņØ┤ ļÅÖņŗ£ņŚÉ ļÅäĒĢæ ļÉ£ graphene quantum dotĻ│╝ TiO2ņØś ņĪ░ĒĢ®(SN-GQD/TiO2)ņ£╝ļĪ£ ņŗżĒŚś ņĪ░Ļ▒┤ņØĆ ļŗżņØīĻ│╝ Ļ░Öļŗż.[9] ņĢäņØ┤ņåīĒöäļĪ£ĒīÉņś¼(isopropyl alcohol)ņØä ņĀäņ×É ņŻ╝Ļ░£ļĪ£ ņ▓©Ļ░ĆĒĢśņŚ¼ ņé░ņåīĻ░Ć ĒżĒÖöļÉ£ Ļ┤æņ┤ēļ¦ż ļČäņé░ ņÜ®ņĢĪņŚÉ simulated sunlight ņØä ņĪ░ņé¼ĒĢśņśĆļŗż. ņ¦łņåī ļśÉļŖö ņ¦łņåīņÖĆ ĒÖ®ņØ┤ ļÅÖņŗ£ņŚÉ ļÅäĒĢæņØ┤ ļÉ£ GQDĻ░Ć TiO2ņÖĆ ļ│ĄĒĢ®ņ▓┤ļź╝ ņØ┤ļŻ░ ļĢī Ļ│╝ņé░ĒÖöņłśņåī ņāØņä▒ ĒÜ©ņ£©ņØĆ ņ”ØĻ░ĆĒĢśļ®░, ņĄ£Ļ│ĀņØś ĒÜ©ņ£©ņØĆ ļÅÖņŗ£ ļÅäĒĢæ ļÉ£ ņāśĒöīņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłļŗż. ļŗżņ¢æĒĢ£ ņŗżĒŚśņØä ĒåĄĒĢ┤ SN-GQD/TiO2ņØś ļåÆņØĆ ĒÜ©ņ£©ņØś ņøÉņØĖņØä 1) ĒØĪĻ┤æļÅä ņ”ØĻ░Ć, 2) ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØś lifetimeņØ┤ ņ”ØĻ░Ć, 3) ņāØņä▒ļÉ£ Ļ│╝ņé░ĒÖöņłśņåīņØś ļČäĒĢ┤ ņåŹļÅä Ļ░Éņåī, 4) ņé░ņåīļĪ£ņØś ņĀäņ×É ņĀäļŗ¼ ņåŹļÅä Ē¢źņāü, 5) 2ņĀäņ×É ņĀäļŗ¼ ļ░śņØæ ņÜ░ņäĖ ļō▒ņ£╝ļĪ£ļČĆĒä░ ņ£ĀņČöĒĢśņśĆļŗż. ņ¦łņåīņÖĆ ĒÖ®ņØś ļÅäĒĢæņ£╝ļĪ£ ĒÖ®ņØś positive charge densityņŚÉ ņØśĒĢ┤ ņé░ņåīņØś ĒØĪņ░®ņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā TiO2ņØś Ļ┤æņŚ¼ĻĖ░(photo-excitation)ņŚÉ ņØśĒĢ┤ ņāØņä▒ļÉ£ ņĀäņ×ÉĻ░Ć ņé░ņåīļĪ£ ņØ┤ļÅÖĒĢśņŚ¼ hydroperoxo (-OOH) intermediatesĻ░Ć ĒśĢņä▒ļÉ£ļŗż. ņØ┤ļĢī negative charge densityļź╝ Ļ░¢ļŖö ņ¦łņåīņŚÉņä£ protonņØ┤ ĒØĪņ░®ļÉśņ¢┤ ņĄ£ņóģņĀüņ£╝ļĪ£ hydroperoxo ņżæĻ░äņ▓┤ņÖĆ protonĻ│╝ ĒĢ£ Ļ░£ņØś ņĀäņ×ÉĻ░Ć ļ¦īļéś Ļ│╝ņé░ĒÖöņłśņåīĻ░Ć ņāØņä▒ļÉ£ļŗż. Free energy diagramņŚÉņä£ ņĀäņ▓┤ ļ░śņØæ Ļ▓ĮļĪ£ņŚÉ ļīĆĒĢ£ ņŚÉļäłņ¦ĆņØś ļ│ĆĒÖöļŖö ņØīņØś Ļ░ÆņØä Ļ░¢ļŖöļŹ░ ņØ┤ļĪ£ļČĆĒä░ SN-GQD/TiO2 ņŗ£ņŖżĒģ£ņŚÉņä£ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØņØĆ ņŚ┤ņŚŁĒĢÖņĀüņ£╝ļĪ£ ņÜ░ĒśĖņĀüņØĖ Ļ▓āņØä ņĢī ņłś ņ׳ļŗż.
Fig.┬Ā3.
(a) ņ×ÉņÖĖņäĀ ļ╣øņØś ņĪ░ņé¼ ĒĢśņŚÉ TiO2, Au/TiO2, Ag/TiO2, Pt/TiO2, rGO/TiO2ņØś Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØļ¤ē ļ╣äĻĄÉ. (b) ņØĖņé░ņŚ╝ņØä ļÅäņ×ģĒĢśņŚ¼ surface passivation Ēøä Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØļ¤ē ļ╣äĻĄÉ. (c) ņĀäņ×É ņŻ╝Ļ░£ļź╝ ļ¼╝ļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ cobalt phosphate complexĒĢ®ĻĖłņØ┤ ļŗ┤ņ¦ĆļÉ£ rGO/TiO2ņŚÉņä£ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØ ļ╣äĻĄÉ. Reproduced with permission. Copyright 2014, Royal Society of Chemistry.[8]

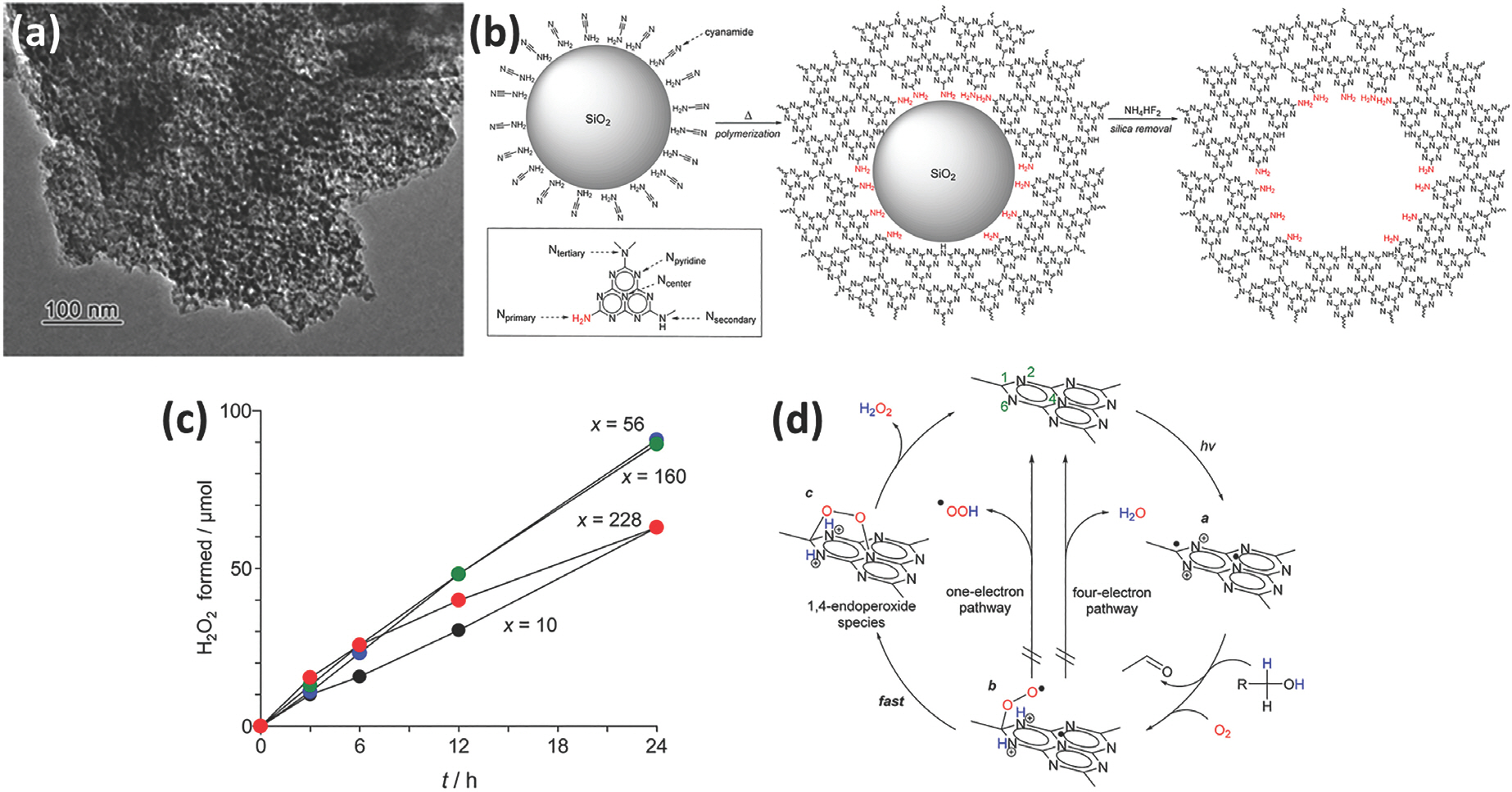
2.2. Ļ░Ćņŗ£Ļ┤æ Ļ░ÉņØæ Ļ┤æņ┤ēļ¦żņØĖ graphitic carbon nitride (g-C3 N4)
g-C3 N4ļŖö ĒāäņåīņÖĆ ņ¦łņåīļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŖö tris-s-triazineņØś ļ░śļ│ĄļÉ£ ļ░░ņŚ┤ļĪ£ ĒÅ┤ļ”¼ļ©ĖņØś ĻĄ¼ņĪ░ņÖĆ ņ£Āņé¼ĒĢśļ®░, ļ░░ņŚ┤ņØĆ 2ņ░©ņøÉ ĒÅēļ®┤ ĻĄ¼ņĪ░Ļ░Ć ņĖĄņāüņØä ņØ┤ļŻ©Ļ│Ā ņ׳ļŗż. ļ░┤ļō£Ļ░ŁņØĆ 2.7 eV(ņĢĮ 460 nm)ļĪ£ Ļ░Ćņŗ£Ļ┤æņØä ĒØĪņłśĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņĀäļÅäļīĆņÖĆ Ļ░ĆņĀäņ×ÉļīĆ ĒżĒģÉņģ£ņØĆ Ļ░üĻ░ü ŌłÆ1.3 V NHE ņÖĆ 1.4 VNHEļź╝ Ļ░¢ļŖöļŗż.[10] Ļ░Æ ņŗĖĻ▓ī ĒĢ®ņä▒ņØ┤ Ļ░ĆļŖźĒĢśĻ│Ā ņŚÉļäłņ¦Ć ļĀłļ▓©ņØ┤ ņé░ņåīļź╝ ĒÖśņøÉņŗ£ĒéżĻĖ░ņŚÉ ņČ®ļČäĒĢ£ ņןņĀÉņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ļé«ņØĆ Ēæ£ļ®┤ņĀü, ņāüļīĆņĀüņ£╝ļĪ£ ļČłņČ®ļČäĒĢ£ Ļ░Ćņŗ£Ļ┤æ ņśüņŚŁņØś ļ╣ø ĒØĪņłś, ļ╣ĀļźĖ ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØś ņ×¼Ļ▓░ĒĢ®ņØĆ Ļ░£ņäĀļÉśņ¢┤ņĢ╝ ĒĢĀ ņÜöņåīļĪ£ Ļ░äņŻ╝ļÉ£ļŗż. ļö░ļØ╝ņä£ ĒśĢņāü ņĀ£ņ¢┤, ļÅäĒĢæ, Ēæ£ļ®┤ņŚÉ ņ×æņÜ®ĻĖ░ ļÅäņ×ģ, ĻĖłņåŹļéśļģĖņ×ģņ×É ļŗ┤ņ¦Ć, Ļ▓░ņĀÉ(defect site) ļÅäņ×ģ, ļŗżļźĖ ņåīņ×¼ņÖĆ ļ│ĄĒĢ®ĒÖö ļō▒ ņŚ¼ļ¤¼ ņĀäļץļōżņØ┤ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØ ĒÜ©ņ£©ņØä ņ”ØĻ░Ćņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ ņŚ░ĻĄ¼ļÉśņ¢┤ ņÖöļŗż. ņ¦ĆĻĖłļČĆĒä░ ĻĄ¼ņĪ░ļź╝ ņĀ£ņ¢┤ĒĢ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ ņé┤ĒÄ┤ļ│┤ĻĖ░ļĪ£ ĒĢ£ļŗż.[11] mesoporous g-C3 N4ļŖö ņŗżļØ╝ņ╣┤ ļéśļģĖņ×ģņ×É (silica, SiO2 nanoparticle)ņØä templateļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ ņĀ£ņ×æĒĢśņśĆĻ│Ā, ņŗżļ”¼ņ╣┤ templateņŚÉ ļö░ļØ╝ Ēæ£ļ®┤ņĀüņØä 56, 160, 228 m2/gņ£╝ļĪ£ ņĪ░ņĀł Ļ░ĆļŖźĒĢśņśĆļŗż. ņ░ĖĻ│ĀļĪ£ template ņŚåņØ┤ ĒĢ®ņä▒ĒĢ£ ņāśĒöīņØś ļ╣äĒæ£ļ®┤ņĀüņØĆ 10 m2/gņØ┤ļŗż. ņŗżĒŚśņØĆ ņŚÉĒāäņś¼ņØä ņĀäņ×É ņŻ╝Ļ░£ļĪ£ ņ▓©Ļ░ĆĒĢśņŚ¼ ņé░ņåīĻ░Ć ĒżĒÖöļÉ£ Ļ┤æņ┤ēļ¦ż ļČäņé░ ņÜ®ņĢĪņŚÉ Ļ░Ćņŗ£Ļ┤æņäĀņØä ņĪ░ņé¼ĒĢśņŚ¼ ņ¦äĒ¢ēĒĢśņśĆļŗż. Fig. 4aļŖö transmission electron microscope (TEM) ņØ┤ļ»Ėņ¦ĆļĪ£ mesoporeĻ░Ć ņל ĒśĢņä▒ļÉśņ¢┤ ņ׳ļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ņŗżļ”¼ņ╣┤ templateņØä ņĀ£Ļ▒░ĒĢ£ ļČĆļČäņŚÉļŖö defect siteĻ░Ć ļÅäņ×ģņØ┤ ļÉśļŖöļŹ░ X-ray photoelectron spectroscopy (XPS)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢ£ Ļ▓░Ļ│╝ ļ¦ÄņØĆ ņłśņØś primary and secondary amine moietiesĻ░Ć ņāØņä▒ļÉ©ņØä ņĢī ņłś ņ׳ņ£╝ļ®░(Fig. 4b), ņĀäĻĖ░ĒÖöĒĢÖņĀüņØĖ ļ░®ļ▓Ģņ£╝ļĪ£ ļČäņäØĒĢ£ Ļ▓░Ļ│╝ primary amine moieties Ļ░Ć ļ¦ÄņĢäņ¦łņłśļĪØ 4ņĀäņ×É ņĀäļŗ¼ ļ░śņØæņØ┤ ņ┤ēņ¦äļÉśņ¢┤ ļ╣äĒæ£ļ®┤ņĀüņØ┤ Ēü¼Ļ▓ī ņ”ØĻ░ĆĒĢ©ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā Ļ│╝ņé░ĒÖöņłśņåī ņāØņä▒ ĒÜ©ņ£©ņØĆ bulk g-C3 N4ņÖĆ ņ£Āņé¼ĒĢśĻ▓ī ļÉ£ļŗż(Fig. 4c). ņ”ē Ēæ£ļ®┤ņĀüĻ│╝ defect siteņÖĆņØś ņāüĻ┤ĆĻ┤ĆĻ│äņŚÉ ļö░ļØ╝ ļ░śņØæņä▒ņØś ņŚ¼ļČĆļŖö Ļ▓░ņĀĢļÉśņŚłņ£╝ļ®░, ĻĘĀĒśĢņØ┤ ņל ļ¦×ļŖö ļ╣äĒæ£ļ®┤ņĀü 56, 160 m2/g ņāśĒöīņØ┤ Ļ░Ćņן ņóŗņØĆ ĒÖ£ņä▒ņØä ļ│┤ņśĆļŗż. ļ░śņØæ ļ®öņ╗żļŗłņ”śņØä ņé┤ĒÄ┤ļ│┤ļ®┤ bulk g-C3 N4ņŚÉņä£ļŖö Ļ┤æ ņĪ░ņé¼ ĒĢśņŚÉ melem unitņØś 1,4 ņ£äņ╣śņŚÉ ņĀäņ×ÉļōżņØ┤ localizationĒĢśĻ│Ā ņé░ņåīļź╝ ĒÖśņøÉņŗ£ņ╝£ 1,4-endoperoxide speciesļź╝ ļ¦īļōżĻ│Ā Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ Ļ│╝ņé░ĒÖöņłśņåīļź╝ ņāØņä▒ĒĢ£ļŗż. ĒĢśņ¦Ćļ¦ī primary amine moietiesļŖö 4ņĀäņ×É ņĀäļŗ¼ ļ░śņØæņØä ņ┤ēņ¦äĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ Ļ│╝ņé░ĒÖöņłśņåīļź╝ ņāØņä▒ĒĢśĻĖ░ ļ│┤ļŗżļŖö ļ¼╝ņØä ņāØņä▒ĒĢśļŖö Ļ▓Įņ¤ü ļ░śņØæņØä ņ┤ēņ¦äĒĢśņŚ¼ ļ░śņØæņä▒ņØĆ ļ¢©ņ¢┤ņ¦ĆĻ▓ī ļÉ£ļŗż.
Fig.┬Ā4.
(a) mesoporous g-C3 N4ņØś TEM ņØ┤ļ»Ėņ¦Ć. (b) ņŗżļ”¼ņ╣┤ templateņØ┤ ņĀ£Ļ▒░ļÉ©ņŚÉ ļö░ļØ╝ ļÅäņ×ģļÉśļŖö defect site ļ¬©ņŗØļÅä. (c) ļ╣äĒæ£ļ®┤ņĀüņØ┤ ļŗżļźĖ mesoporous g-C3 N4ņØś Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØļ¤ē ļ╣äĻĄÉ. (d) Ļ│╝ņé░ĒÖöņłśņåī ņāØņä▒ ļ®öņ╗żļŗłņ”ś ļ¬©ņŗØļÅä. Reproduced with permission. Copyright 2015, American Chemical Society.[11]
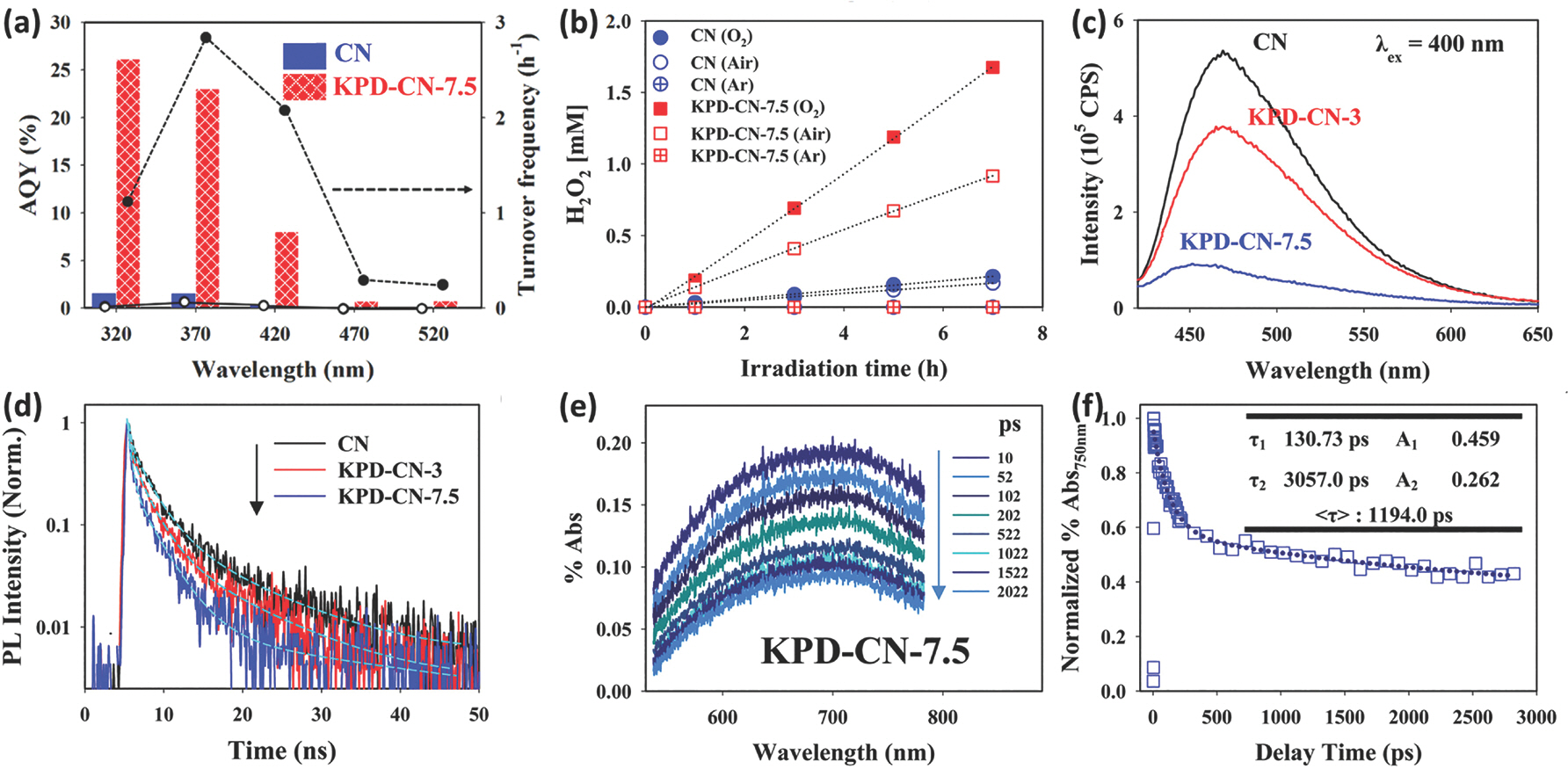
ĻĄ¼ņĪ░Ļ░Ć ņĀ£ņ¢┤ļÉ£ g-C3 N4ņŚÉ ĻĖłņåŹļéśļģĖņ×ģņ×ÉĻ░Ć ļŗ┤ņ¦ĆļÉ£ silver-decorated ultrathin g-C3 N4 nanosheets(Ag@ U-g-C3 N4-NS)ņØä ņØ┤ņÜ®ĒĢ£ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ ņé┤ĒÄ┤ļ│┤ĻĖ░ļĪ£ ĒĢ£ļŗż.[12] ņŗżĒŚśņØĆ ļ¼╝ņØä ņĀäņ×É ņŻ╝Ļ░£ļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ ņé░ņåīĻ░Ć ĒżĒÖöļÉ£ Ļ┤æņ┤ēļ¦ż ļČäņé░ ņÜ®ņĢĪņŚÉ simulated sunlightņØä ņĪ░ņé¼ĒĢśņŚ¼ ņ¦äĒ¢ēĒĢśņśĆļŗż. Ļ▓░ļĪĀņĀüņ£╝ļĪ£ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØ ņåŹļÅäļŖö bulk g-C3 N4(< 0.03 ├Ś 10ŌłÆ6 M/min), U-g-C3 N4-NS(0.414 ├Ś 10ŌłÆ6 M/min), Ag@U-g-C3 N4-NS((1.975 ├Ś 10ŌłÆ6 M/min) ņł£ņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░, g-C3 N4ņŚÉ ļ╣äĒĢ┤ U-g-C3 N4-NS ļ░śņØæņä▒ņØ┤ ņóŗņØĆ ņØ┤ņ£ĀļŖö ļäōņØĆ ļ╣äĒæ£ļ®┤ņĀüņØä ļĢīļ¼ĖņØ┤ļŗż. ņŚ¼ĻĖ░ņŚÉ ņØĆ ļéśļģĖņ×ģņ×ÉņØś ļÅäņ×ģņØĆ ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØś ņ×¼Ļ▓░ĒĢ®ņØä ĒÜ©ņ£©ņĀüņ£╝ļĪ£ Ļ░Éņåīņŗ£ĒéżļŖö ļÅÖņŗ£ņŚÉ ņé░ņåī ĒÖśņøÉ ļ░śņØæņØś ĒÖ£ņä▒ņĀÉ(active site)ņ£╝ļĪ£ ņŚŁĒĢĀņØä ĒĢśņŚ¼ ļ░śņØæņä▒ņØ┤ ĻĖēĻ▓®Ē׳ ņ”ØĻ░ĆĒĢśĻ▓ī ļÉ£ļŗż. ļÅäĒĢæņØĆ g-C3 N4ņØś Ļ┤æĒÖ£ņä▒ņØä ņ”ØĻ░Ćņŗ£Ēé¼ ņłś ņ׳ļŖö ļ░®ļ▓Ģ ņżæ ĒĢśļéśļĪ£ ņ╣╝ļź© ņØ┤ņś©(potassium ion, K+) ļÅäĒĢæĻ│╝ Ēæ£ļ®┤ņŚÉ Ēāäņé░ņŚ╝ĻĖ░ļź╝ ļÅäņ×ģĒĢśņŚ¼ Ļ│╝ņé░ĒÖöņłśņåī ņāØņä▒ņØä Ē¢źņāüņŗ£Ēé© Ļ▓░Ļ│╝ļź╝ ņåīĻ░£ĒĢśĻ│Āņ×É ĒĢ£ļŗż.[13] ļ®£ļØ╝ļ»╝(melamine)Ļ│╝ potassium phosphate dibasic precursorļź╝ ņä×ņ¢┤ ņŚ┤ņ▓śļ”¼ļź╝ ĒĢśļ®┤ ņ╣╝ļź© ņØ┤ņś©ņØĆ ņ¦łņåī ņøÉņ×ÉņØś non-bonding electron ņŚÉ ņØśĒĢ┤ tris-s-triazine 3Ļ░£ņØś unitņŚÉ coordinationņ£╝ļĪ£ Ļ│ĀņĀĢĒÖö ļÉśĻ│Ā Ēāäņé░ņŚ╝ņØĆ Ēæ£ļ®┤ņŚÉ ļÅäņ×ģļÉśĻ▓ī ļÉ£ļŗż(KPD-CN-7.5). ņŗżĒŚśņØĆ ņŚÉĒāäņś¼ņØä ņĀäņ×É ņŻ╝Ļ░£ļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ ņé░ņåīĻ░Ć ĒżĒÖöļÉ£ Ļ┤æņ┤ēļ¦ż ļČäņé░ ņÜ®ņĢĪņŚÉ ņ×ÉņÖĖņäĀ ļśÉļŖö Ļ░Ćņŗ£Ļ┤æņäĀņØä ņĪ░ņé¼ĒĢśņŚ¼ ņ¦äĒ¢ēĒĢśņśĆļŗż. Fig. 5aļŖö ļŗ©Ēīīņן ļ╣øņØä ņĪ░ņé¼ĒĢśņŚ¼ ĒĢ®ņä▒ļÉ£ ņāśĒöīĻ│╝ g-C3 N4ņØś Ļ│╝ņé░ĒÖöņłśņåī ņāØņä▒ņŚÉ ļīĆĒĢ£ apparent quantum yield(AQE)ļź╝ ļ╣äĻĄÉĒĢ£ ĻĘĖļלĒöäļĪ£ ņ×ÉņÖĖņäĀ ļ░Å Ļ░Ćņŗ£Ļ┤æņäĀ ņśüņŚŁņŚÉņä£ g-C3 N4ņŚÉ ļ╣äĒĢ┤ AQEĻ░Ć ņøöļō▒Ē׳ ļåÆņØĆ Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ņé░ņåīņŚÉ ļīĆĒĢ£ ļ»╝Ļ░ÉļÅäļź╝ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ ņĢäļź┤Ļ│ż(Ar), Ļ│ĄĻĖ░(air), ņé░ņåīĻ░Ć ĒżĒÖöļÉ£ ņĪ░Ļ▒┤ņŚÉņä£ ĒÖ£ņä▒ņØä ļ╣äĻĄÉĒĢ£ Ļ▓░Ļ│╝ ņĢäļź┤Ļ│żņŚÉņä£ļŖö ļæÉ ņāśĒöī ļ¬©ļæÉ Ļ│╝ņé░ĒÖöņłśņåīĻ░Ć ņĀäĒśĆ ļ░£ņāØļÉśņ¦Ć ņĢŖļŖö ļ░śļ®┤, ņé░ņåīĻ░Ć ņ׳ļŖö ņĪ░Ļ▒┤ņŚÉņä£ļ¦ī Ļ│╝ņé░ĒÖöņłśņåīĻ░Ć Ļ▓ĆņČ£ļÉ£ļŗż(Fig. 5b). ĒØźļ»ĖļĪ£ņÜ┤ ņĀÉņØĆ g-C3 N4ņØś Ļ▓ĮņÜ░ Ļ│ĄĻĖ░ņŚÉ ļ╣äĒĢ┤ ņé░ņåī ņĪ░Ļ▒┤ņŚÉņä£ Ļ│╝ņé░ĒÖöņłśņåīņØś ļ░£ņāØļ¤ēņØ┤ Ēü░ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ¦Ćļ¦ī KPD-CN-7.5ļŖö Ļ│ĄĻĖ░ņŚÉ ļ╣äĒĢ┤ ņé░ņåī ņĪ░Ļ▒┤ņŚÉņä£ ĒÖ£ņä▒ņØ┤ ĻĖēĻ▓®Ē׳ ņ”ØĻ░ĆĒĢśļŖöļŹ░ ņØ┤ļŖö ņé░ņåīļĪ£ņØś ņĀäņ×É ņĀäļŗ¼ņŚÉ ĒŖ╣ĒÖöļÉ£ ņåīņ×¼ļØ╝ļŖö Ļ▓āņØä ņĢöņŗ£ĒĢ£ļŗż. ņĀäņ×É ņĀäļŗ¼ņØś ļ®öņ╗żļŗłņ”śņØä ĻĘ£ļ¬ģĒĢśĻ│Āņ×É ļ©╝ņĀĆ static photoluminescence(PL)ļź╝ ņĖĪņĀĢĒĢśņśĆļŖöļŹ░, Fig. 5cņŚÉņä£ ļ│┤ļŖö ļ░öņÖĆ Ļ░ÖņØ┤ ļÅäĒĢæņØ┤ ļÉĀņłśļĪØ PL intensityļŖö ņĀÉņ░© Ļ░ÉņåīĒĢśļ®░, ņØ┤ļŖö ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØś ĒÜ©Ļ│╝ņĀüņØĖ ļČäļ”¼ļź╝ ņØśļ»ĖĒĢ£ļŗż. ņŚ¼ĻĖ░ņŚÉ ņŗ£Ļ░äņØ┤ļØ╝ļŖö ĒĢŁļ¬®ņØä ļÅäņ×ģĒĢ£ ļŹ░ņØ┤Ēä░Ļ░Ć ļ░öļĪ£ time-resolved PLņØ┤ļ®░ Fig. 5dņÖĆ Ļ░ÖņØ┤ ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØś radiative recombinationņØś lifetimeņØĆ ļÅäĒĢæņŚÉ ņØśĒĢ┤ ņśżĒ׳ļĀż ļŹö ņżäņ¢┤ļō£ļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ņØ┤ļŖö ņśłņāüĻ│╝ ļ░śļīĆ Ļ▓░Ļ│╝ļĪ£ ņØ┤ļź╝ ņóĆ ļŹö ņ×ÉņäĖĒ׳ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ transient absorption spectroscopy(TAS) ļČäņäØņØ┤ ņłśĒ¢ēļÉśņŚłļŗż. TASļŖö ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØ┤ trapņØ┤ ļÉśļ®┤ņä£ absorbanceņØś ņāØņä▒ ļ░Å ņŗ£Ļ░äņŚÉ ļö░ļźĖ Ļ░Éņåīļź╝ ĒåĄĒĢ┤ ļ░śņØæņåŹļÅäļź╝ ņ£ĀņČöĒĢśļŖö ļ░®ļ▓Ģņ£╝ļĪ£ KPD-CN-7.5ņŚÉņä£ Ļ┤Ćņ░░ļÉ£ 1,194 psļŖö g-C3 N4ņŚÉņä£ ņĖĪņĀĢļÉ£ 353.1 ps ļ│┤ļŗż Ēü¼ļ®░ ņØ┤ļŖö trapped ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØś lifetimeņØś ņ”ØĻ░Ćļź╝ ņØśļ»ĖĒĢ£ļŗż. ļśÉĒĢ£ Ēæ£ļ®┤ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ņØĖņé░ņŚ╝ņØĆ Ļ│╝ņé░ĒÖöņłśņåī ļČäĒĢ┤ļź╝ ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ņĀĆĒĢ┤ĒĢśņŚ¼ ļ░śņØæņåŹļÅäļŖö Ēü¼Ļ▓ī ņ”ØĻ░Ćļź╝ Ļ░ĆņĀĖņÖöļŗż.
Fig.┬Ā5.
(a) ļŗ©Ēīīņן ļ│ä g-C3 N4ņÖĆ KPD-CN-7.5ņØś Ļ│╝ņé░ĒÖöņłśņåī ņāØņé░ļ¤ē ļ╣äĻĄÉ. (b) ņé░ņåī, Ļ│ĄĻĖ░, ņĢäļź┤Ļ│ż ĒżĒÖö ņĪ░Ļ▒┤ņŚÉņä£ Ļ│╝ņé░ĒÖöņłśņåī ņāØņé░ļ¤ē ļ╣äĻĄÉ. Ļ░ü ņāśĒöīņŚÉ ļīĆĒĢ£ (c) static photoluminescenceņÖĆ (d) time-resolved photoluminescence Ļ▓░Ļ│╝. KPD-CN-7.5ņŚÉ ļīĆĒĢ£ (e) transient absorption spectrum ļ░Å (f) fitting ĻĘĖļלĒöä. Reproduced with permission. Copyright 2017, American Chemical Society.[13]
g-C 3 N 4 ņØś ĻĄ¼ņĪ░ļź╝ ņĀ£ņ¢┤ĒĢśļŖö ĻĖ░ņłĀ ņżæ ĒĢśļéśļŖö pyromellitic diimide (PDI)ļź╝ g-C3 N4ņŚÉ incorporation(g-C3 N4/PDI)ņŗ£ĒéżļŖö ļ░®ļ▓ĢņØ┤ļŗż.[14] ņŗżĒŚśņØĆ ļ¼╝ņØä ņĀäņ×É ņŻ╝Ļ░£ļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ ņé░ņåīĻ░Ć ĒżĒÖöļÉ£ Ļ┤æņ┤ēļ¦ż ļČäņé░ ņÜ®ņĢĪņŚÉ simulated sunlight ļśÉļŖö Ļ░Ćņŗ£Ļ┤æņäĀņØä ņĪ░ņé¼ĒĢśņŚ¼ ņ¦äĒ¢ēĒĢśņśĆļŗż. Density functional theory (DFT) Ļ│äņé░ņØä ĒåĄĒĢ┤ ņ¢╗ņØĆ Fig. 6aļź╝ ļ│┤ļ®┤ PDIĻ░Ć g-C3 N4ņØś basic building blockņØĖ tris-s-triazineĻ│╝ incorporationņØä ņØ┤ļŻ©ļ®┤ HOMOņÖĆ LUMO ņŚÉļäłņ¦Ć ļĀłļ▓©ņØ┤ positive ļ░®Ē¢źņ£╝ļĪ£ ņØ┤ļÅÖĒĢśĻ│Ā ņŚÉļäłņ¦Ć Ļ░ŁņØĆ ņżäņ¢┤ļōżĻ▓ī ļÉ£ļŗż. ņŗżĒŚśņĀüņ£╝ļĪ£ ņĖĪņĀĢļÉ£ UV-visible diffuse reflectance spectroscopy(UVDRS) Ļ▓░Ļ│╝ļÅä DFT Ļ│äņé░Ļ│╝ ņØ╝ņ╣śĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņØĖļŗż(Fig. 6b). Fig. 6cļŖö simulated sunlight ļ░Å Ļ░Ćņŗ£Ļ┤æņäĀņØś ņĪ░ņé¼ ņŗ£Ļ░äņŚÉ ļö░ļźĖ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØļ¤ēņØä ļéśĒāĆļéĖ ĻĘĖļלĒöäļĪ£ ļ¼╝ņØ┤ ņĀäņ×É ņŻ╝Ļ░£ļĪ£ ņé¼ņÜ®ļÉśņŚłņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņāüļŗ╣ļ¤ēņØś Ļ│╝ņé░ĒÖöņłśņåīĻ░Ć ļ░£ņāØĒĢśļŖö Ļ▓āņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ļŗż. ņ×ÉņÖĖņäĀņØ┤ ĒżĒĢ©ļÉ£ ļ╣øņØä ņĪ░ņé¼ĒĢĀ Ļ▓ĮņÜ░ ņ┤łĻĖ░ņŚÉļŖö ņāØņä▒ļ¤ēņØ┤ Ēü¼Ļ▓ī ņ”ØĻ░ĆĒĢśņ¦Ćļ¦ī ņāØņä▒ļÉ£ Ļ│╝ņé░ĒÖöņłśņåīņØś ļČäĒĢ┤ ļśÉĒĢ£ ņ┤ēņ¦äļÉśĻĖ░ ļĢīļ¼ĖņŚÉ ĒŖ╣ņĀĢ ņł£Ļ░äņØ┤ ļÉśļ®┤ Ļ│╝ņé░ĒÖöņłśņåī ņ¢æņØĆ saturationļÉśĻ▓ī ļÉ£ļŗż. ņĀ£ņŗ£ļÉ£ ļ®öņ╗żļŗłņ”śņØä ņé┤ĒÄ┤ļ│┤ļ®┤ ļ©╝ņĀĆ ļæÉ Ļ░£ņØś photonņØä ĒØĪņłśĒĢśņŚ¼ ļæÉ ņīŹņØś ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØä ļ¦īļō£ļŖöļŹ░, ņØ┤ļĢī ņĀäņ×ÉļŖö melemņØś C1Ļ│╝ N4 ņ£äņ╣śņŚÉ ņĀĢĻ│ĄņØĆ N2ņÖĆ N6 ņ£äņ╣śņŚÉ Ļ░üĻ░ü localization ļÉ£ļŗż. ņĀĢĻ│ĄņØĆ ļ¼╝ņØä ņé░ĒÖöĒĢśĻ│Ā, ņĀäņ×ÉļŖö ņé░ņåīļź╝ ĒÖśņøÉņŗ£ņ╝£ superoxo radicalņØä ļ¦īļōżĻ│Ā 1Ļ░£ņØś ņĀäņ×Éļź╝ ļŹö ļ░øņĢäļōżņŚ¼ 1,4-endoperoxideļź╝ ĒśĢņä▒ĒĢśņŚ¼ protonationĻ│╝ ĒĢ©Ļ╗ś Ļ│╝ņé░ĒÖöņłśņåīļź╝ ņāØņä▒ĒĢ£ļŗż(Fig. 6d). ņóĆ ļŹö ĒÖĢņןĒĢśņŚ¼ rGO/TiO2ņÖĆ Ļ░ÖņØ┤ g-C3 N4/PDIņŚÉ rGOļź╝ ļÅäņ×ģĒĢśļ®┤ Fig. 6e ņŚÉņä£ ļ│┤ļŖö ļ░öņÖĆ Ļ░ÖņØ┤ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØļ¤ēņØĆ Ēü¼Ļ▓ī ņ”ØĻ░ĆĒĢ£ļŗż.[15] ņĀäĻĖ░ņĀäļÅäļÅäĻ░Ć ļåÆņØĆ rGOņØĆ ņé░ņåīļĪ£ņØś 2ņĀäņ×É ņĀäļŗ¼ņØś ļø░ņ¢┤ļé£ ļ¼╝ņä▒ņØä Ļ░¢ĻĖ░ ļĢīļ¼ĖņŚÉ g-C3 N4/PDIņŚÉņä£ ņāØņä▒ļÉ£ ņĀäņ×Éļź╝ ļČäļ”¼ĒĢśņŚ¼ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØņŚÉ ņØ┤ņÜ®ĒĢĀ ņłś ņ׳ļŗż(Fig. 6f). PDIņÖĆ ņ£Āņé¼ĒĢśĻ▓ī anthraquinone(AQ)ņØ┤ ļÅäņ×ģļÉ£ g-C3 N4ņŚÉļÅä ĒÜ©ņ£©ņØś ņ”ØĻ░ĆĻ░Ć Ļ┤Ćņ░░ļÉśļŖöļŹ░ ņØ┤ļŖö anthraquinoneĻ░Ć ņĀäņ×Éļź╝ ļ░øņĢä ļōżņŚ¼ ļæÉ ļŗ©Ļ│äņØś ļ░śņØæņØä ņ┤ēņ¦äĒĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż(hydrogenation: AQ + 2H+ + 2eŌłÆ ŌåÆ AQH2; dehydrogenation: AQH2 + O2 ŌåÆ AQ + H2 O2).[16]
Fig.┬Ā6.
(a) PDIĻ░Ć ļÅäņ×ģļÉ£ g-C3 N4ņØś ĻĄ¼ņĪ░ ļ¬©ņŗØļÅä. (b) ļÅäņ×ģļÉ£ PDI ņ¢æņŚÉ ļö░ļźĖ ļ░┤ļō£ ĻĄ¼ņĪ░ņØś ļ│ĆĒÖö. (c) PDI/C3 N4ņØś simulated sunlight(ņśżļĀīņ¦Ćņāē) ļ░Å Ļ░Ćņŗ£Ļ┤æ ņĪ░ņé¼ ĒĢśņŚÉ Ļ│╝ņé░ĒÖöņłśņåī ņāØņé░ļ¤ē ļ╣äĻĄÉ. Reproduced with permission. Copyright 2014, Wiley.[14] (d) PDI/C3 N4ņØś Ļ│╝ņé░ĒÖöņłśņåī ņāØņé░ ļ®öņ╗żļŗłņ”ś ļ¬©ņŗØļÅä. (e) PDI/C3 N4ņŚÉ rGO ļÅäņ×ģ ĒÜ©Ļ│╝ ļ╣äĻĄÉ. (f) g-C3 N4/PDI/rGOņŚÉņä£ ņØ╝ņ¢┤ļéśļŖö ļ®öņ╗żļŗłņ”ś ļ¬©ņŗØļÅä. Reproduced with permission. Copyright 2016, American Chemical Society.[15]

2.3. Ļ┤æņĀäĻĘ╣(photoelectrochemial cell)ņØä ĒÖ£ņÜ®ĒĢ£ Ļ│╝ņé░ĒÖöņłśņåī ņāØņé░
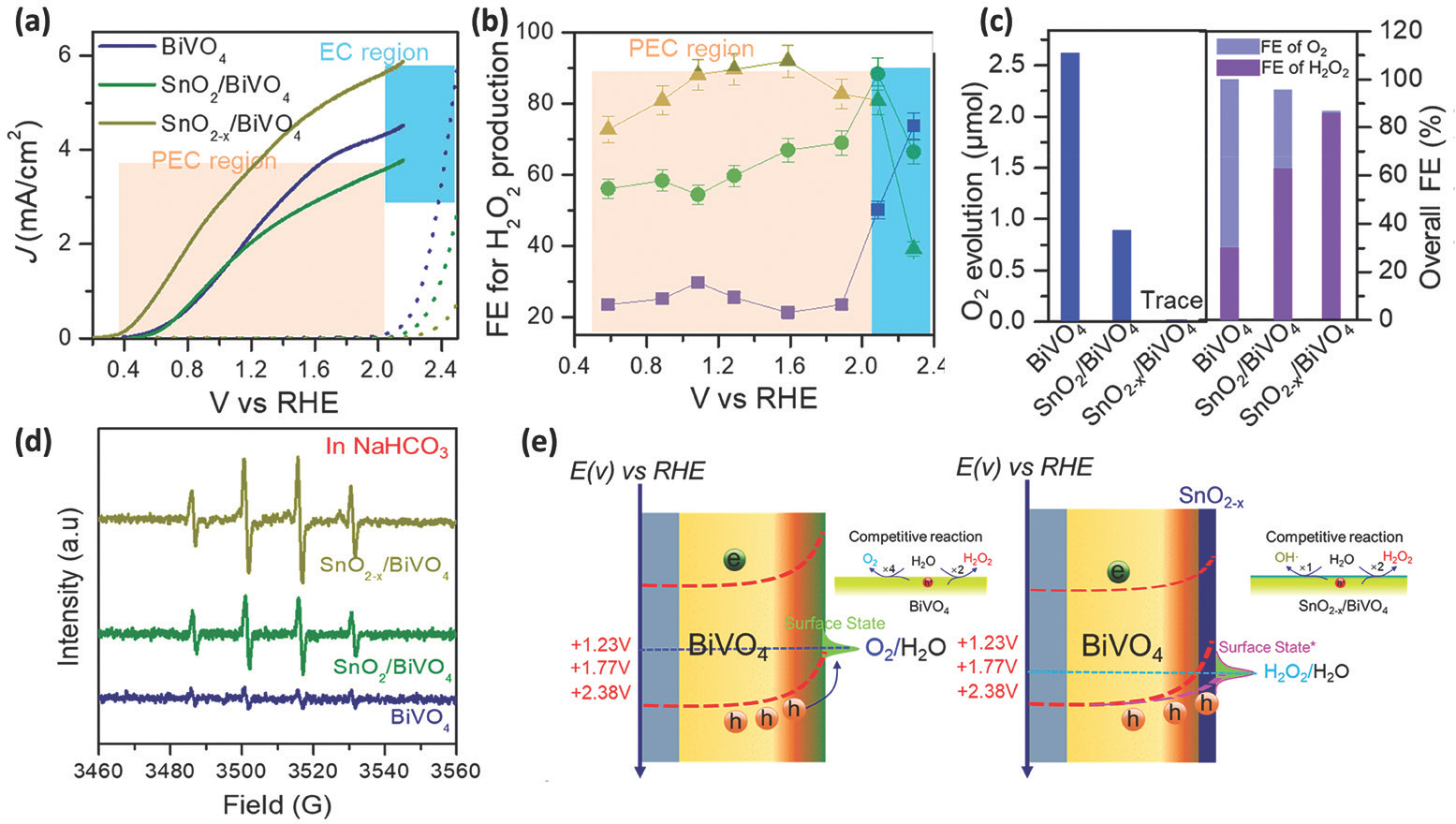
Ļ┤æņ┤ēļ¦żļŖö ĒĢśļéśņØś ņ×ģņ×ÉņŚÉņä£ ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØ┤ ņāØņä▒ļÉśņ¢┤ redox ļ░śņØæņØ┤ ņØ╝ņ¢┤ļéśļŖöļŹ░ ļ░śĒĢ┤ Ļ┤æņĀäĻĘ╣ņØĆ Ļ┤Ćņŗ¼ņØ┤ ņ׳ļŖö ļ░śņØæņØä working electrodeļĪ£ ļ¦īļōżĻ│Ā ņŚ¼ĻĖ░ņä£ Ļ┤æņŚ¼ĻĖ░ņŚÉ ņØśĒĢ┤ ņāØņä▒ļÉ£ ņĀäņ×É ļśÉļŖö ņĀĢĻ│ĄņØä counter electrodeļĪ£ ļ│┤ļé┤ ņé░ĒÖöņÖĆ ĒÖśņøÉ ļ░śņØæņØä ļČäļ”¼ĒĢĀ ņłś ņ׳ļŗż. Ļ┤æņ┤ēļ¦ż ņŗ£ņŖżĒģ£ņŚÉņä£ļŖö ĒÖśņøÉ ļ░śņØæ Ļ▓ĮļĪ£ņŚÉ ņØśĒĢ┤ Ļ│╝ņé░ĒÖöņłśņåīĻ░Ć ņāØņä▒ ļÉśņŚłņ¦Ćļ¦ī, Ļ┤æņĀäĻĘ╣ ņŗ£ņŖżĒģ£ņŚÉņä£ļŖö ļ¼╝ņØ┤ ņé░ĒÖöļÉśņ¢┤ ņłśņé░ĻĖ░ ļØ╝ļööņ╣╝ņØ┤ ļ¦īļōżņ¢┤ņ¦ĆĻ│Ā ņØ┤ļŖö ļŗżņŗ£ Ļ│╝ņé░ĒÖöņłśņåīļĪ£ ņĀäĒÖśļÉśļŖö ņé░ĒÖö ļ░śņØæ Ļ▓ĮļĪ£ļź╝ ļö░ļź┤Ļ▓ī ļÉ£ļŗż. ņØ┤ļĢī ļ¼╝ņØ┤ ņé░ĒÖöļÉśņ¢┤ ņé░ņåīĻ░Ć ļ░£ņāØĒĢśļŖö ļ░śņØæĒĢśļŖö Ļ▓Įņ¤ü ļ░śņØæņØ┤ ņØ╝ņ¢┤ļéśļŖöļŹ░ ņØ┤ļź╝ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ļ¦ēĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņłśņé░ĻĖ░ ļØ╝ļööņ╣╝ņØä ņäĀĒāØņĀüņ£╝ļĪ£ ļ¦īļō£ļŖö Ļ┤æņĀäĻĘ╣ņØä ņĀ£ņ×æĒĢśļŖö Ļ▓āņØ┤ ļ¦żņÜ░ ņżæņÜöĒĢśļŗż. SnO2ŌĆō x overlayer coated BiVO4 photoanodeļŖö ņØ┤ņŚÉ ļīĆĒĢ£ ļīĆĒæ£ņĀüņØĖ ņśłļĪ£ ņóĆ ļŹö ņ×ÉņäĖĒ׳ ņé┤ĒÄ┤ļ│┤Ļ│Āņ×É ĒĢ£ļŗż.[17] ņŗżĒŚśņØĆ Nafion membraneņ£╝ļĪ£ ļČäļ”¼ļÉ£ H-type cell, ņé╝ņĀäĻĘ╣ ņŗ£ņŖżĒģ£(counter electrode: Pt, reference electrode: Ag/AgCl), 1 M NaHCO3 electrolyte, simulated sunlight, ņØĖĻ░Ć ņĀäņĢĢ 1.23 V RHEņŚÉņä£ ņ¦äĒ¢ēĒĢśņśĆļŗż. Fig. 7aņÖĆ Ļ░ÖņØ┤ BiVO4ņŚÉ ļ╣äĒĢ┤ SnO2ŌĆōxļź╝ ņĮöĒīģĒ¢łņØä ļĢī ļ¼╝ņé░ĒÖö ņĀäļźśļŖö ņ”ØĻ░ĆĒ¢łņ£╝ļ®░, Ļ│╝ņé░ĒÖöņłśņåī ņāØņä▒ņŚÉ ļīĆĒĢ£ faradaic efficiencyļŖö Ļ┤æņĀäĻĘ╣ņØ┤ ĒÜ©Ļ│╝ļź╝ ļ│┤ņØ┤ļŖö ĒżĒģÉņģ£ ņśüņŚŁņŚÉņä£ 80 % ņØ┤ņāü ņĄ£ļīĆ 88 %ņŚÉ ļÅäļŗ¼ĒĢśņśĆļŗż(Fig. 7b). ņé░ņåīļĪ£ņØś Ļ▓Įņ¤ü ļ░śņØæņØä ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ ļ░£ņāØļÉ£ ņé░ņåīļ¤ēņØä ņĖĪņĀĢ ļ░Å ņé░ņåīņÖĆ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØņŚÉ ļīĆĒĢ£ faradaic efficiency ļź╝ ļ╣äĻĄÉĒĢ£ Ļ▓░Ļ│╝ BiVO4ņŚÉņä£ļŖö ļ¦ÄņØĆ ņłśņØś ņĀĢĻ│ĄņØ┤ ņé░ņåī ļ░£ņāØņŚÉ ņ░ĖņŚ¼Ē¢łņ¦Ćļ¦ī SnO2ŌĆōxļź╝ ņĮöĒīģĒ¢łņØä ļĢī 1ņĀäņ×É ļśÉļŖö 2ņĀäņ×É ņĀäļŗ¼ ļ░śņØæņØ┤ ņäĀĒāØņĀüņ£╝ļĪ£ ņØ╝ņ¢┤ļé©ņØä ņĢī ņłś ņ׳ļŗż(Fig. 7c). ļ¼╝ņØ┤ ņé░ĒÖöļÉśņ¢┤ ņāØņä▒ļÉśļŖö ņłśņé░ĻĖ░ ļØ╝ļööņ╣╝ņØĆ electron paramagnetic resonance (EPR) spectroscopy ļ░Å DMPI indicatorļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ĻĘ£ļ¬ģĒĢśņśĆļŗż. BiVO4ņŚÉņä£ļŖö DMPO-OH┬Ę peakņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖļŖöļŹ░ ļ░śĒĢ┤ SnO2ŌĆō xļź╝ ņĮöĒīģĒĢ£ ņāśĒöīņŚÉņä£ļŖö ņłśņé░ĻĖ░ ļØ╝ļööņ╣╝ņØś ņāØņä▒ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż(Fig. 7d). SnO2ņŚÉ oxygen vacancyņØś ļÅäņ×ģņØĆ Ļ░ĆņĀäņ×ÉļīĆņØś ņŚÉļäłņ¦Ć ļĀłļ▓©ņØä positive shiftņŗ£ĒéżĻ│Ā the hole quasi-Fermi levelņØä ļ│ĆĒÖöņŗ£ņ╝£ ļ¼╝ ņé░ĒÖöņŚÉ ņØśĒĢ£ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØ ņåŹļÅäļź╝ ņ”ØĻ░Ćņŗ£Ēé©ļŗż. SnO2ŌĆōx ņØś ņŚŁĒĢĀņØĆ Fig. 7eņŚÉ ļÅäņŗØĒÖö ĒĢśņśĆļŗż. ņĄ£ĻĘ╝ņŚÉ Ļ┤æņĀäĻĘ╣ ņŗ£ņŖżĒģ£ņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ│ĀļåŹļÅäņØś ņł£ņłśĒĢ£ Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØĒĢśļŖö ļ░®ļ▓ĢņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż.[18] Ļ┤æņĀäĻĘ╣ ļ░śņØæĻĖ░ļŖö proton exchange membrane(PEM)Ļ│╝ anion exchange membrane(AEM)ņØä stackingĒĢśņŚ¼ ņé░ņä▒ ņĪ░Ļ▒┤ņØĖ anode ņ▒öļ▓äņŚÉņä£ ļ¼╝ņØ┤ ņé░ĒÖöļÉśņ¢┤ ļéśņś© protonņØä ĻĘĖļ”¼Ļ│Ā ņŚ╝ĻĖ░ņä▒ ņĪ░Ļ▒┤ņØĖ cathode ņ▒öļ▓äņŚÉņä£ ņé░ņåīĻ░Ć ĒÖśņøÉļÉśņ¢┤ ņāØņä▒ļÉ£ HO2ŌłÆļź╝ Ļ░üĻ░ü solid polymer electrolyteĻ░Ć ņ▒äņøīņ¦ä ņżæĻ░ä ņ▒öļ▓äļĪ£ ņĀäļŗ¼ĒĢśņŚ¼ Ļ│╝ņé░ĒÖöņłśņåīļź╝ ņāØņé░ĒĢśļŖö ņøÉļ”¼ņØ┤ļŗż. Ļ┤æņĀäĻĘ╣ņØĆ n-type semiconductorņØĖ TiO2 nanorodņ£äņŚÉ RuO xļź╝ ļŗ┤ņ¦Ć(RuO x/TNR)ĒĢśņŚ¼ ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, counter electrodeļŖö anthraquinoneņØ┤ Ļ░£ņ¦łļÉ£ graphite(AQ/G)ļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. AQ/GļŖö HO2ŌłÆ ņāØņä▒ņŚÉ ņĢĮ 100 %ņØś ņäĀĒāØļÅäļź╝ ļ│┤ņśĆņ£╝ļ®░, ļ¼╝ņé░ĒÖö ņĀäļźśļÅä RuO xĻ░Ć ļÅäņ×ģļÉ£ ņāśĒöīņŚÉņä£ Ēü¼Ļ▓ī ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. 2ņĀäĻĘ╣ ņŗ£ņŖżĒģ£ņŚÉņä£ ņČöĻ░ĆņĀüņØĖ ņØĖĻ░Ć ņĀäņĢĢ ņŚåņØ┤ simulated sunlight ņĪ░Ļ▒┤ņŚÉņä£ ņāØņä▒ļ¤ēņØĆ ņĖĪņĀĢĒĢśļ®┤ ņŗ£Ļ░ä ļŗ╣ 80 mMņØś Ļ│ĀļåŹļÅäņØś Ļ│╝ņé░ĒÖöņłśņåīĻ░Ć ņāØņä▒ļÉśļ®░, 100 ņŗ£Ļ░äĻ╣īņ¦Ć
ņĢłņĀĢņä▒ļÅä ļø░ņ¢┤ļé£ Ļ▓āņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż.
Fig.┬Ā7.
Ļ░ü ņāśĒöīņŚÉ ļīĆĒĢ£ (a) linear sweep voltammetry(LSV) curves ļ░Å (b) Ļ│╝ņé░ĒÖöņłśņåīņŚÉ ļīĆĒĢ£ faradaic efficiency ļ╣äĻĄÉ. (c) ņé░ņåī ļ░£ņāØ ļ░Å ņé░ņåī/Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØ faradaic efficiency ļ╣äĻĄÉ. (d) DMPO-OH ņŗ£ĻĘĖļäÉņØä ļéśĒāĆļé┤ļŖö EPR spectra. (e) SnO2-xņØś ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé┤ļŖö ļ¬©ņŗØļÅä. Reproduced with permission. Copyright 2020, American Chemical Society.[17]
3. Ļ▓░ļĪĀ
Ļ│╝ņé░ĒÖöņłśņåīļŖö Ļ░ĆņĀĢ ļ░Å ņé░ņŚģņŚÉņä£ Ļ░Ćņן ļ¦ÄņØ┤ ņé¼ņÜ®ļÉśļŖö ĒÖöĒĢ®ļ¼╝ ņżæ ĒĢśļéśļĪ£ ņłśņÜöļŖö ņĀÉņ░© ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż. Ļ┤æņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ│╝ņé░ĒÖöņłśņåī ņāØņé░ņØĆ ļ»Ėļלņ¦ĆĒ¢źņĀüņØ┤ļ®░ Ļ╣©ļüŚĒĢ£ ĻĖ░ņłĀ ņżæ ĒĢśļéśļĪ£ ņśżņ¦ü ļ¼╝, ņé░ņåī, ļ╣ø ļ¦īņØä ĒĢäņÜöļĪ£ ĒĢ£ļŗż. ļ│Ė ļ”¼ļĘ░ ļģ╝ļ¼ĖņŚÉņä£ļŖö ņ×ÉņÖĖņäĀ Ļ░ÉņØæ Ļ┤æņ┤ēļ¦żņØĖ TiO2ņÖĆ Ļ░Ćņŗ£Ļ┤æ Ļ░ÉņØæ Ļ┤æņ┤ēļ¦żņØĖ C3 N4ņŚÉ ņ┤łņĀÉņØä ļæÉĻ│Ā Ļ│╝ņé░ĒÖöņłśņåī ļ░£ņāØ ĒÜ©ņ£©ņØä ļåÆņØ┤ĻĖ░ ņ£äĒĢ£ Ļ░£ņ¦ł ļ░®ļ▓ĢņŚÉ ļīĆĒĢ┤ ņé┤ĒÄ┤ļ│┤ņĢśĻ│Ā, ļŹö ļéśņĢäĻ░Ć Ļ│ĀļåŹļÅä Ļ│╝ņé░ĒÖöņłśņåīļź╝ Ļ┤æņĀäĻĘ╣ ņŗ£ņŖżĒģ£ņØä ĒÖ£ņÜ®ĒĢśņŚ¼ ĻĄ¼ĒśäĒĢśļŖö ņĀäļץņØä ņĢīņĢäļ│┤ņĢśļŗż. anthraquinone Ļ│ĄņĀĢņØä ļīĆņ▓┤ĒĢśĻĖ░ņŚÉļŖö ļ¼┤ļ”¼Ļ░Ć ņ׳ņ¦Ćļ¦ī, photonņØä ĒÖöĒĢÖ ņŚÉļäłņ¦Ć ĒśĢĒā£ņØĖ Ļ│╝ņé░ĒÖöņłśņåīļĪ£ ņĀĆņןĒĢ£ļŗżļŖö Ļ░£ļģÉ(ļśÉĒĢ£ Ļ│╝ņé░ĒÖöņłśņåī ņŚ░ļŻīņĀäņ¦ĆņØś ņŚ░ļŻīļĪ£ ņé¼ņÜ® Ļ░ĆļŖź)Ļ│╝ ņāØņé░ļÉ£ Ļ│╝ņé░ĒÖöņłśņåīļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņśżņŚ╝ļ¼╝ņ¦łņØä ņ▓śļ”¼ĒĢĀ ņłś ņ׳ļŖö ņŗ£ņŖżĒģ£ņØä Ļ░£ļ░£ĒĢśļŖö Ļ▓āņØĆ Ļ┤æņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ│╝ņé░ĒÖöņłśņåī ņāØņé░ ĻĖ░ņłĀņØ┤ ņČöĻĄ¼ĒĢ┤ņĢ╝ ļÉĀ ļ░®Ē¢źņØ┤ļØ╝ ĒīÉļŗ©ļÉ£ļŗż. ņśłļź╝ ļōżņ¢┤ ļÅäņŗ£Ļ░Ć ņל ņĀĢļ╣äļÉ£ ĻĄŁĻ░ĆņŚÉņä£ļŖö ļīĆĻĘ£ļ¬©ņØś ņāüĒĢśņłś ņ▓śļ”¼ ņŗ£ņäżņØä ņØĖĻĄ¼Ļ░Ć ļ░Ćņ¦æļÉ£ ņ¦ĆņŚŁņŚÉ ĻĄ¼ņČĢĒĢĀ ņłś ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī Ļ│Āļ”ĮļÉśĻ│Ā ļéÖĒøäļÉ£ ņ¦ĆņŚŁņŚÉņä£ļŖö ņØ┤ļ¤¼ĒĢ£ ņŗ£ņäżņØ┤ ļōżņ¢┤ņś¼ ņłś ņŚåĻĖ░ ļĢīļ¼ĖņŚÉ ņåīĒśĢ ļŗ©ņ£äņØś ņ▓śļ”¼ ņŗ£ņäżņØ┤ Ļ▓ĮņĀ£ņĀüņ£╝ļĪ£ ļŹö ņĀüĒĢ®ĒĢśļŗż. Ēā£ņ¢æĻ┤æņØĆ ņ¢┤ļööņŚÉņä£ļōĀņ¦Ć ņØ┤ņÜ® Ļ░ĆļŖźĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņāØņä▒ļÉ£ Ļ│╝ņé░ĒÖöņłśņåīļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļ¼╝ ņåŹņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ļ░ĢĒģīļ”¼ņĢä ļ░Å ņśżņŚ╝ļ¼╝ņ¦łņØä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņĀ£Ļ▒░ĒĢśļŖö ļÅģļ”ĮļÉ£ ĒśĢĒā£ņØś ļ░śņØæĻĖ░ļź╝ ĻĄ¼ņČĢĒĢĀ ņłś ņ׳ļŗżļ®┤, ĒĢ£ ĒĢ┤ņŚÉ ļ¼╝ ļĢīļ¼ĖņŚÉ ņŻĮĻ│Ā Ļ│ĀĒåĄļ░øļŖö ņłśļ░▒ļ¦ī ļ¬ģņØś ņé¼ļ×īļōżņŚÉĻ▓ī Ļ╣©ļüŚĒĢ£ ņŗØņłś Ļ│ĄĻĖēņØä ĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆĒĢ£ļŗż.









