전환반응 기반 전이금속산화물 리튬이온전지 음극 활물질 개발 동향과 전망
Conversion reaction-based transition metal oxides as anode materials for lithium ion batteries: recent progress and future prospects
Article information
Trans Abstract
The rapid increase in demand for high-performance lithium ion batteries (LIBs) has prompted the development of high capacity anode materials that can replace/complement the commercial graphite. Transition metal oxides (TMOs) have attracted great attention as high capacity anode materials because they can store multiple lithium ions (electrons) per unit formula via conversion reaction, resulting in high specific capacity (700-1,200 mAh g−1) and volumetric capacity (4,000-5,500 mAh cm−3). In addition, TMOs are cheap, earth-abundant, non-toxic and environmentally friendly. However, there have been no reports of practical LIBs using conversion-based TMO anodes, because of several major problems such as large voltage hysteresis, low initial Coulombic efficiency (large initial capacity loss), low electrical conductivity, and large volume changes (100~200%). This review summarizes the recent progress, challenges and opportunities for TMO anode materials. The conversion reaction mechanism, problems and solutions of TMO anode materials are discussed. Considering iron oxide as a promising candidate, future research directions and prospects for the practical use of TMO for LIB are presented.
1. 서론
파리기후 협약 준수와 탄소중립달성에 대한 국제사회의 요구가 증가함에 따라 전통적인 화석연료중심에서 신재생에너지중심의 산업구조로 패러다임 전환이 빠르게 이루어지고 있다. 신재생에너지원은 전력 생산의 간헐성 및 변동성, 시공간 제약 등의 태생적 한계를 가지고 있으며, 이와 같은 문제를 해결하기 위해 전력 생산 및 공급 효율을 증가시킬 수 있는 에너지저장장치시스템(ESS, energy storage system) 사용이 필수적이다. 또한 내연기관차 생산을 2035년 전후로 중단하고 전기자동차(electric vehicle)를 포함한 친환경 자동차로 대체하려는 움직임이 가속화되고 있다. 상술한 에너지전환 목표 달성에 있어 리튬이온전지가 에너지저장장치로서 핵심적인 역할을 수행할 것이라 여겨지고 있으며, 이에 리튬이온전지 시장이 기존 휴대기기용 소형전지 시장에서 ESS와 전기자동차용 중·대형전지 시장으로 확대·재편되고 있는 추세이다.
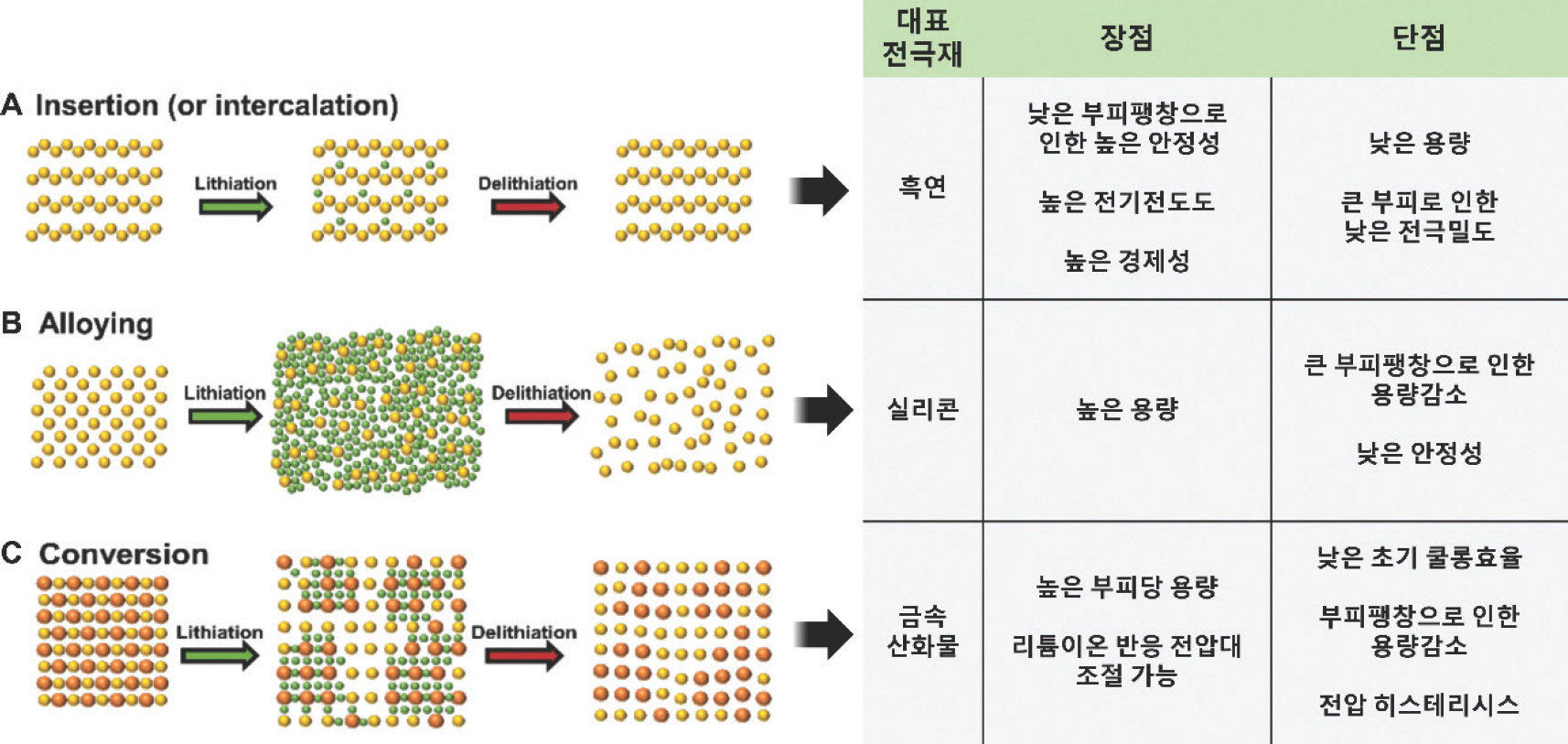
리튬이온전지는 양극 활물질(cathode materials), 음극 활물질(anode materials), 분리막, 전해질 등으로 구성된다. 이 중 음극 활물질은 에너지밀도, 출력밀도, 수명특성과 같은 전지 성능에 직접적인 영향을 미치며, 원재료비의 10-15%를 차지하는 전지의 핵심소재이다. 이상적인 음극 활물질은 낮은 작동전위, 높은 질량당/부피당 용량, 우수한 출력특성, 장기 안정성(수명), 높은 쿨롱효율(Coulombic efficiency)을 모두 가질 뿐만 아니라, 원료와 활물질 양산 공정 모두 환경친화적이며 높은 경제성을 갖는 물질이라고 할 수 있다. (Fig. 1)[1] 하지만 현실적으로 이러한 특성 모두를 만족하는 음극 활물질은 부재하며, 이차전지의 용도와 목적에 맞는 활물질을 선택하여 완전지(full cell) 및 배터리팩을 제작하게 된다.
음극 활물질은 리튬이온의 저장 메커니즘에 따라 삽입(insertion 또는 intercalation) 음극, 합금화(alloying) 음극, 전환반응(conversion) 음극으로 나눌 수 있다 (Fig. 1, 2).[2] 현재 상용화된 리튬이온전지에서 가장 폭넓게 사용되고 있는 음극 활물질은 흑연(graphite)이며, 이는 흑연의 낮은 가격, 높은 전기전도도, 우수한 안정성과 수명특성과 같은 장점 때문이다. 하지만 흑연은 Fig. 2A의 intercalation 메커니즘을 통해 흑연 단위체(C6) 1몰당 최대 1몰의 리튬이온만을 저장할 수 있어 372 mAh g−1의 낮은 이론용량을 갖는다는 한계가 있다. (intercalation은 층상구조에서 일어나는 삽입(insertion)을 특정하는 용어로 사용되며, 삽입(insertion) 메커니즘의 일종이라 볼 수 있다.) 최근에는 고에너지밀도 하이엔드(high end) 전지에 대한 수요가 증가함에 따라 흑연을 대체·보완할 수 있는 고용량 음극 활물질에 대한 관심이 높아지고 있다.
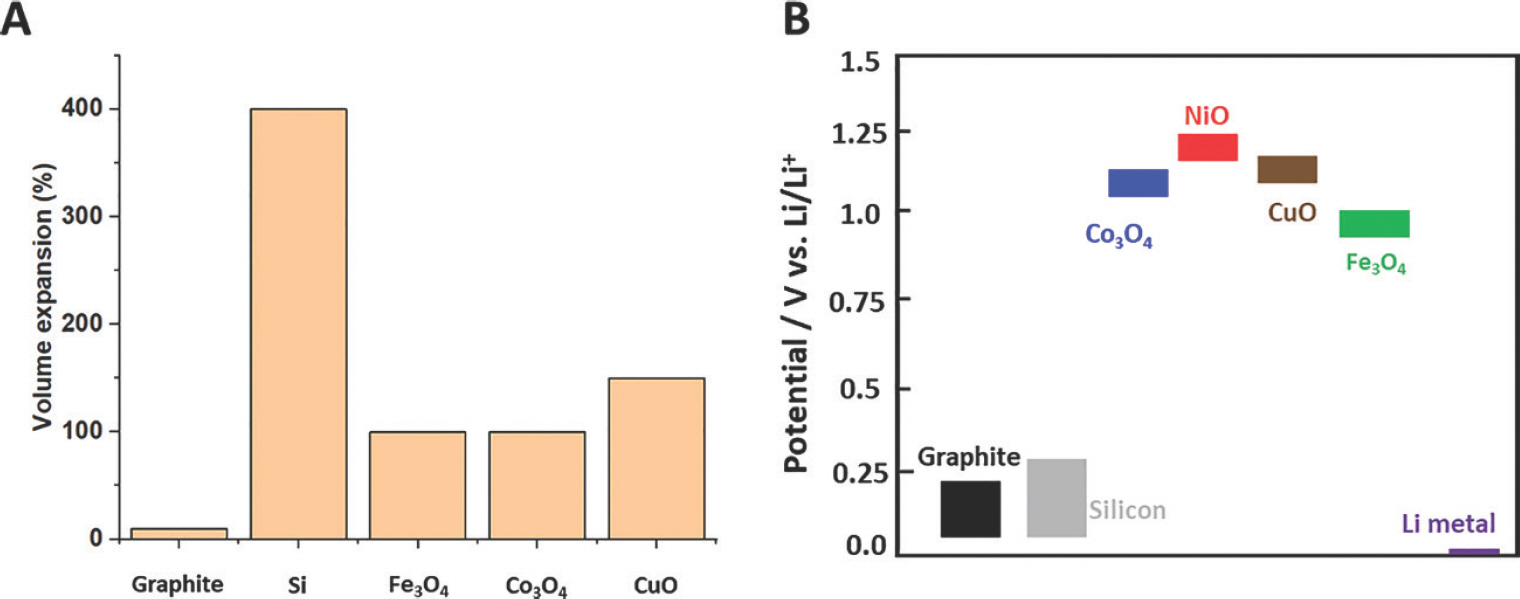
고용량 음극 활물질은 합금화(alloying)(Fig. 2B) 또는 전환반응(conversion)(Fig. 2C) 메커니즘을 통해 활물질 1몰당 여러 몰의 리튬이온을 저장한다. 합금화 음극 활물질의 예시로 실리콘(Si), 게르마늄(Ge), 주석(Sn)과 같은 14족 원소를 들 수 있으며, 리튬이온과 직접적인 합금화반응을 일으켜 활물질 1몰당 최대 4.4몰의 리튬이온을 저장할 수 있다 (Li4.4 M). 특히 실리콘의 경우 리튬금속을 제외한 음극 활물질 중 가장 높은 이론용량(4,200 mAh g−1)을 가지고 있어 차세대 고용량 음극재로 많은 주목을 받고 있다. 하지만 실리콘은 리튬이온이 저장될 때, 최대 400%에 달하는 입자의 부피변화를 동반하여 1) 활물질의 분쇄(material pulverization), 2) 전기적 단락 발생(loss of electrical contact), 3) 연속적인 SEI(solid electrolyte interphase)의 형성(continuous SEI layer growth) 및 쿨롱 효율감소(low Coulombic efficiency)와 같은 문제를 야기하고 그 결과 수명특성이 현저히 떨어진다 (Fig. 3).[3] 따라서, 실리콘을 음극 활물질로 단독 사용하는 것은 거의 불가능하다고 여겨진다. 현재 산업계에서는 고용량 음극 활물질의 상용화를 위해서 흑연에 5-10%의 실리콘 또는 실리콘산화물을 도입하는 방식이 주로 사용되고 있다. 흑연에 (나노)실리콘을 물리적으로 혼합하거나 흑연-실리콘 복합체를 제조하여 흑연과 실리콘 각각의 장점을 결합하고 단점을 보완하는 전략으로, 상용화 가능성이 매우 높다고 전망된다.
한편, 다른 고용량 음극 활물질로 전환반응 기반의 전이금속산화물(TMOs)을 들 수 있다.[4] 리튬이온 전지에서의 전환반응 메커니즘은 2000년 Tarascon 그룹에 의해 최초로 보고되었으며[5], 식(1)의 과정을 통해 리튬이온을 저장한다.
여기서 M은 전이금속 양이온 (Mn, Fe, Co, Ni, Cu, Zn 등), X는 O, S, N, F와 같은 음이온이며 n은 음이온의 산화수이다. 일반적으로 700-1,200 mAh g−1의 질량당용량과 4,000-5,500 mAh cm−3의 부피당용량을 가지고 있으며, 이는 전환반응 음극이 흑연대비 월등한 질량/부피당용량을, 그리고 실리콘과 유사한 부피당용량을 가짐을 의미한다 (Fig. 1). 일반적인 전이금속산화물의 경우 실리콘보다 질량당용량은 떨어지지만 높은 밀도(bulk density)를 가지기 때문에 부피당에너지밀도가 중요한 응용분야에서 유용할 수 있으리라 여겨진다. 또한 전이금속산화물은 무독성(non-toxic)이며 실리콘대비 원료의 접근성이 뛰어나고 가격 경쟁력이 우수하다. 예를 들어, 산화철은 지구에서 가장 풍부한 원소인 철을 양이온으로 포함하고 있으며, 광물뿐만 아니라 기존 제철/제련 공정의 주요 제품 또는 부산물로 생산되어 실리콘보다 저렴하고 접근성이 뛰어나다. 또한 전환반응음극은 다양한 전이금속 양이온(M)과 음이온(X)의 조합을 통해 리튬이온 반응 전압대를 조절하는 것이 가능하여 음극 뿐 아니라 양극에도 활용될 수 있다. 하지만 실리콘 음극이 상용화에 근접해 있는 반면, 전환반응 금속산화물 음극의 상용화 기술개발은 아직까지 지지부진한 상황이다. 금속산화물은 실리콘에 비해 작은 부피변화율(100-200%)를 가지고 있지만, 이는 흑연의 부피변화율이 10%인 것을 고려하였을 때 여전히 매우 큰 기계적 스트레스에 해당한다. 따라서, 금속산화물은 실리콘과 동일하게 전극 분쇄, 단락 발생, SEI 불안정성의 문제를 필연적으로 동반한다. 이에 더해 열악한 전기전도성 문제와 전환반응 자체의 열역학/동역학적 제한으로 야기되는 전압 히스테리시스(voltage hysteresis, 충·방전 프로필의 전압차이) 및 낮은 초기쿨롱효율(초기용량손실) 문제를 추가로 가지고 있어 기술개발 난이도가 높다. 하지만 이와같은 문제를 해결하고 상용 수준의 성능지표를 달성한다면, 리튬이온전지의 수요가 폭발적으로 증가하고 용도별 요구스펙이 다변화되는 미래 이차전지 시장에서 음극 활물질의 한 축을 담당할 수 있으리라 기대된다.
본 논문에서는 금속산화물을 중심으로하여 전환반응의 메커니즘을 살펴보고(2장) 전환반응이 가지는 문제점(3장)과 그에 대한 해결책(4장)에 대해 논할 것이다. 리튬이온전지 음극재 전반에 대한 동향은 참고문헌[6–8]을, 전환반응 전극재 관련 선행 총설논문으로는 참고문헌 [9-11]을 권한다. 나아가 전이금속산화물 중 가장 경제적이며 접근성이 높은 산화철을 중심으로 전환반응 음극재 상용화를 위한 주안점을 제시하고 상용화 가능성에 대해 제언하고자 한다(5장).
2. 전환반응의 메커니즘
2장에서는 전환반응이 일어나는 동안 나타나는 활물질의 일반적인 구조변화 및 입자의 거동을 먼저 소개할 것이다. 이후 산화철을 중심으로하여 전환반응 충·방전 전체 사이클을 전압대별로 나누어 각 과정에서 발생하는 구조변화와 리튬이온저장 메커니즘에 대해 상세히 논할 것이다. 나아가 전이금속산화물 음극에서 빈번하게 관찰되는 추가용량 발현 현상의 원인에 대해서도 언급하고자 한다.
2.1 리튬이온 저장 시 전환반응 물질의 구조변화 및 입자의 거동
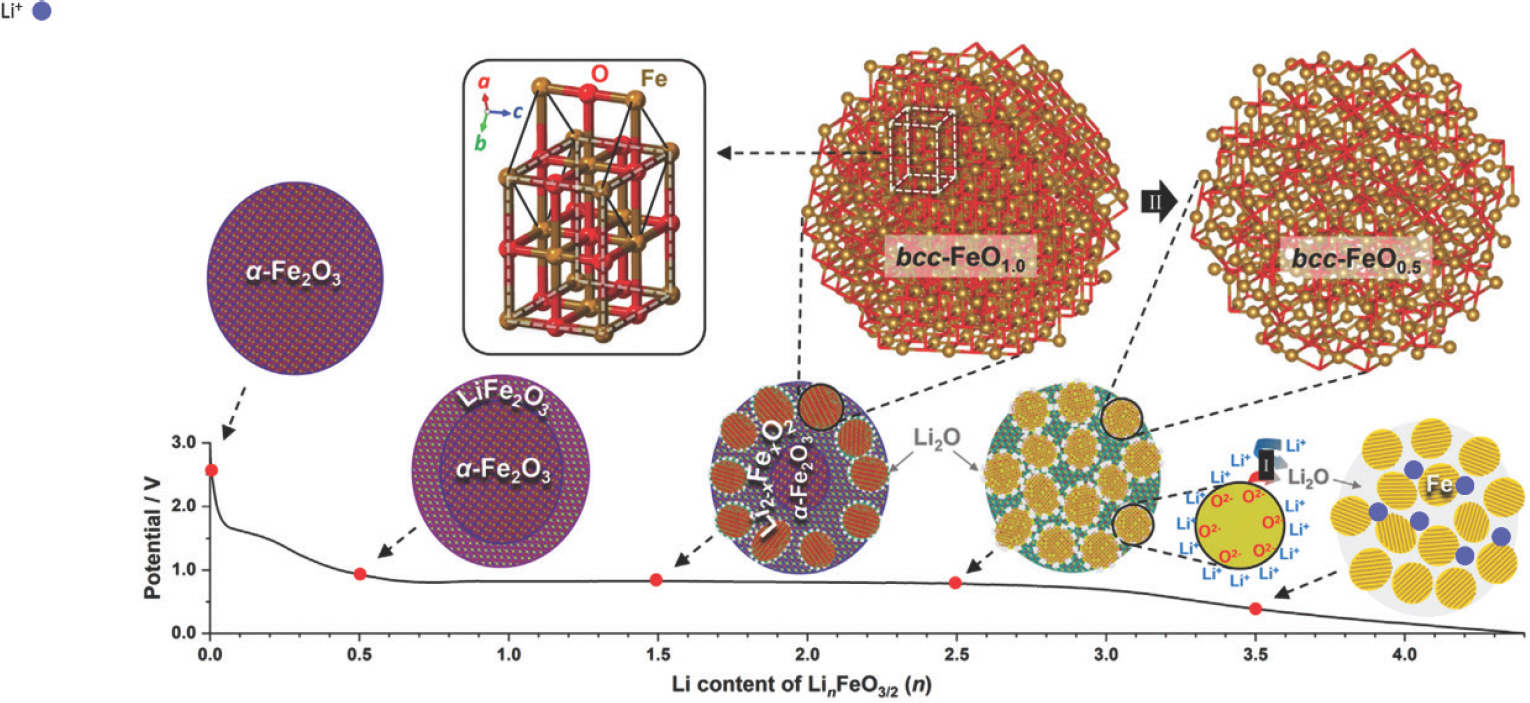
대표적인 전이금속산화물 음극 활물질인 산화철을 중심으로 전환반응 과정 중 활물질의 구조변화 및 입자의 거동을 설명하고자 한다. 산화철(α-Fe2 O3)의 전환반응은 식 (2) 와 같이 진행된다.
첫 번째 방전과정(반쪽전지 기준, lithiation)에서 Fe2 O3의 화학결합이 끊어지며 Fe금속과 Li2 O 구조체로 전환되고 Li2 O의 형태로 리튬이 저장된다. 그 과정에서 초기 Fe2 O3의 결정구조가 붕괴되어 비가역적으로 비정질화(amorphous)된다. 방전과정에서는 Li2 O가 다시 환원분해되고 Fe금속이 산화되어 Fe2 O3로 전환된다. 이 때 비정질화된 금속산화물은 다시 결정상(crystalline)으로 전환되지 않고 비정질 상태를 유지하며 반복적으로 충·방전 과정을 거친다고 알려져 있다 (Fig. 2C). 방전 과정이 모두 일어난 이후 활물질은 최종적으로 Li2 O 매트리스에 Fe 금속이 분산되어 있는 구조를 가진다 (Fig. 4). [12](주의: 리튬을 포함한 전이금속산화물 LiCoO2 등은 intercalation 메커니즘을 통해 높은 전압대(> 3.8 V)에서 리튬을 가역적으로 저장한다. 이 과정에서 고유의 결정구조를 유지하며 LiCoO2에 포함된 리튬농도가 달라진다. 따라서 양극에서 사용되는 리튬전이금속산화물과 전환반응기반 전이금속산화물 음극은 작동전압대 및 리튬저장메커니즘에서 본질적으로 다르다.)
산화철의 방전(lithiation) 시 입자의 변화 및 표면전하로 인한 추가용량 발생 개략도. (저작권의 문제로 유사 figure로 갈음한다.) Licensed under CC-BY from Ref. 15)
리튬이온의 저장은 리튬이온과 전자의 이동으로 인한 활물질의 산화, 환원 반응을 통해 일어난다. Fe2 O3의 전환반응 시 리튬이온은 Fe 금속과 Li2 O 매트리스의 접촉면을 통해 이동하고, 전자는 Fe 금속 또는 전도성탄소를 통해 이동한다. Li2 O는 부도체(insulator)로 전체 전기전도도를 낮추는 원인이 된다. 리튬이온과 전자의 이동뿐만 아니라, 전이금속 양이온의 확산도 함께 일어난다. 전이금속 양이온은 불균일하게 분포된 Li2 O 매트리스 간 기공을 통해 확산되고, 전이금속 양이온의 확산성에 따라 전환반응 이후 물질의 구조가 달라진다. 이는 나아가 전환반응의 가역성에도 영향을 미친다. 2011년 Graetz 그룹은 플루오린화 철과 플루오린화 구리를 이용하여 전이금속의 확산성에 따른 전환반응 이후 금속나노입자의 뭉침 정도와 분산성을 평가하였고, 확산성이 작은 철 이온은 전환반응이 일어나기 전 플루오린화 철의 위치를 유지하며 금속 나노입자로의 환원이 일어나고 금속 나노입자가 잘 분산되어 분포함을 확인하였다.[13] 하지만, 상대적으로 확산성이 높은 구리이온은 환원 이후 구리이온의 확산으로 인해 금속 나노입자가 더 크게 뭉치고, 덜 분산되는 것을 확인했다. 또한 크게 뭉쳐진 입자가 전환반응 시 더 많은 부피팽창을 일으켜 가역성을 떨어뜨린다는 사실을 입증하였다.
첫 번째 방전(lithiation)에서 전환반응이 일어나 금속산화물이 일부 환원이 진행된 금속산화물, 리튬산화물 및 금속나노입자(MO x, Li2 O, M)를 포함한 다수의 고체상(solid phases)으로 전환된다. 초기 금속산화물의 조성, 나노구조(0차원-3차원), 입자크기 및 형상은 전환반응 이후 생성되는 비정질 (MO x, Li2 O, M) 매트릭스의 구조와 전환반응 음극의 성능(용량, 수명, 쿨롱효율)에 직접적인 영향을 미친다. 따라서, 비정질화된 다양한 고체상(MO x, Li2 O, M)이 어떻게 분산되어 있으며 어떤 나노구조를 가지고 혼합되어 있는지 분석하는 것이 전환반응 메커니즘을 이해하는데 필수적이다. 하지만, 복잡한 비정질 고체상의 혼합물을 분석하는 일은 매우 어렵다. 그 결과 금속산화물 전환반응 메커니즘에 대한 구체적인 이해는 아직까지 부족하며, 몇몇 금속산화물 (Fe3 O4, Co3 O4, RuO2)에 대한 연구에 국한되어 있다.
2.2 전압대별 금속산화물의 충ㆍ방전 거동
2021년 Moodera 그룹에서는 철 나노입자의 자성을 이용하여 산화철에서의 전반적인 전환반응에 대한 메커니즘을 제시한 바 있다.[14] 산화철의 첫 방전(lithiation) 사이클에서 철의 환원(Fe3+ → Fe0)에 따른 자성 변화를 통해 산화철의 구조변화 및 물성변화를 관찰하였다. 또한 전환반응이 끝난 이후 원인 모를 자성의 변화를 확인하고 이를 역추적하여 철의 표면에서 커패시터-타입 리튬이온의 축전(capacitive charge storage)이 발생하면서 리튬이 추가 저장된다는 사실을 입증하였다. 자성을 이용한 메커니즘 분석은 환원 이후 강자성(ferromagnetic) 혹은 초상자성(superparamagnetic)을 가지는 많은 전이 금속산화물(CoO, NiO etc.)에 동일하게 적용할 수 있으며, 산화철과 유사한 자성 변화가 관찰되었다. Moodera 그룹에 의해 보고된 산화철의 첫 방전(lithiation) 사이클에서의 거동은 전압에 따라 총 5가지의 단계로 나눌 수 있다.
1) Stage 1. → Stage 2. (OCV – 1.2 V)
리튬이온이 지속적으로 삽입되며 intercalation 과정이 일어나 Li x Fe3 O4 형태로 리튬이 저장되는 단계이다. 초기 산화철이 가지는 구조(inverse spinel)에서 서서히 rock-salt like phase 로 구조변화가 일어나고 리튬이온이 삽입, 탈리될 수 있는 구간이다. 전압이 낮아지며 자성 또한 줄어드는 경향을 보이고 이에 대한 원인은 철 이온(Fe3+)의 환원(Fe3+ → Fe2+)과 더불어 inverse spinel구조에 리튬이온이 저장됨에 따라 철 이온의 위치가 달라져 철 이온이 가지고 있던 전자의 스핀이 서로 상쇄되기 때문이다.
2) Stage 2. → Stage 3. (1.2 V – 0.78 V)
추가적인 리튬이온의 삽입으로 rock salt like phase 에서 rock salt phase로의 구조변화가 일어나고, Li x Fe3 O4에서 Li2 O와 FeO로의 조성이 변화하는 단계이다. 이후 일어날 전환반응의 시작 단계이고 초기 산화철의 inverse spinel 구조는 비가역적으로 rock salt phase로 변하게 된다.
3) Stage 3. → Stage 4. (0.78 V – 0.45 V)
FeO에서 Fe로의 전환반응이 일어나며 리튬을 저장하는 단계이다.
전환반응으로 Fe 나노입자와 Li2 O가 합성되고 rock salt phase를 유지한다. 추가적인 리튬이 저장됨에 따라 자성이 증가하는 이유는 철 입자의 환원(Fe3+ → Fe0)에도 불구하고 Fe0가 강력한 자성을 가지기 때문이며, 산화철이 발현하는 총 용량의 대부분은 전환반응을 통해 생성된다.
4) Stage 4. → Stage 5. (0.45 V – 0.01 V)
이론적으로 전환반응을 끝으로 산화철의 리튬저장은 종료되어야 하지만 실제 산화철에서는 리튬이온이 추가적으로 저장되는 것이 관찰된다. Moodera 연구진은 이러한 추가용량의 원인으로 철 나노입자의 표면전하로 인한 커패시터-타입의 리튬이온 축전을 제시하였다. 추가적인 전자의 유입으로 철 나노입자는 더 많은 양의 표면전하를 띠고 이로 인해 이론적으로 계산된 용량보다 약 440 mAh g−1 더 많은 양의 용량이 저장된다. 이에 대한 설명은 (2장 3절) 추가용량발현에서 더 자세히 다룰 예정이다.
첫 사이클에서의 방전 과정은 위의 4가지 단계를 거치며 일어난다. 초기 inverse spinel 구조가 rock salt phase로 전환되었으므로, 더 이상 1)과정은 일어날 수 없다. 따라서, 이후 충·방전은 1)을 제외한 2), 3), 4) 가 반복적으로 일어나게 된다. 대부분의 전환반응 물질에서의 전환반응은 (2장 1절), (2장 2절)에서 제시한 과정과 유사하게 진행된다. 하지만 전환반응 이후 추가적인 용량발현은 물질마다 다른 메커니즘을 보인다.
2.3 추가용량발현의 원인
전이 금속산화물에서의 추가용량발현 원인에 대해 활발한 연구가 이루어져 왔다. 대표적인 원인은 크게 1) 표면전하로 인한 추가용량 2) 산화, 환원 반응으로 인한 추가용량, 3) 고분자 겔 타입의 필름(polymer gel like film)의 가역적 생성과 분해로 구분할 수 있다. 메커니즘 1), 2)를 통한 추가용량은 가역적이므로 전환반응의 장점이라 할 수 있으나, 메커니즘 3)을 통한 추가용량은 리튬손실을 일으킬 수 있으므로 억제하는 것이 바람직하다.
2021년 Moodera 그룹에서 앞서 밝힌 바와 같이 산화철의 리튬이온 저장 과정에서 전환반응이 끝난 후 추가적인 리튬이온의 저장과 함께 입자의 자성이 바뀌는 사실을 관찰했다.[14] Moodera 그룹은 Stage 4. → Stage 5. 단계에서 추가적인 리튬이온의 저장에 대한 원인으로 전환반응 이후 철 나노입자 추가적인 표면전하 때문에 발생한다고 주장하였다. 전환반응 이후 공급되는 전자로 인해 철 나노입자는 더 많은 표면전하를 띠게 됨과 동시에 철 나노입자의 자성은 줄어들게 된다. 이는 공급되는 전자가 기존 철 나노입자에 존재하는 전자와는 반대되는 스핀방향으로 공급되어 자성이 줄어들기 때문이다. 증가한 철 나노입자의 표면전하는 Li2 O에 추가적으로 공급되는 리튬이온을 커패시터적으로 저장하여 추가용량을 발현한다.
한편 2000년 Poizot 그룹에 의해 금속산화물의 추가용량발현이 산화, 환원 반응으로 인해 발생한다는 가설이 제기되었고 이후 많은 연구들이 진행되었다.[16, 17] 2013년 Hu 그룹에 의해 루세늄 산화물에 대한 추가적인 용량발현이 산화, 환원 반응으로 일어난다는 사실이 밝혀졌다.[18] Hu 그룹은 ex-situ solid NMR과 X-ray absorption spectroscopy 분석을 통해 루세늄 산화물의 전반적인 리튬이온 저장 거동을 분석하였다. 루세늄 산화물은 앞서 2021년 Moodera 그룹에 의해 밝혀진 산화철의 전환반응 메커니즘과 유사하게 초반 리튬이온의 저장(0 Li → 1.3 Li)은 루세늄 산화물로 리튬이온이 삽입되며 Li x RuO2를 형성하며 이루어진다. 이후 Li x RuO2가 전환반응을 일으키며 루세늄 나노입자와 Li2 O, LiOH 를 형성하고 활물질 당 (1.3 Li → 4.2 Li)의 리튬이온을 저장한다는 사실을 관찰했다. 전환반응이 마무리된 이후 (4.2 Li → 5.6 Li) 구간에서 ex-situ solid NMR을 통해 LiOH 피크는 감소하고 Li2 O, LiH 피크가 증가하는 것을 관찰하였다. 이는 전환반응 결과 합성된 LiOH 가 가역적으로 Li2O와 LiH로 바뀌는 산화, 환원 반응이 일어나고 있다는 것을 의미한다. 그 결과 식 (4) 와 같이 추가적인 산화, 환원 반응으로 인해 루세늄 산화물에서 추가용량이 발현된다고 주장하였다.
추가용량이 발현되는 또 다른 원인으로 고분자 겔 타입의 필름(polymer gel like film)의 가역적 생성과 분해가 제시되었다. 첫 사이클에서서 리튬이온의 삽입이 일어날 때, 낮은 전압대에서 유기 전해질의 분해가 일어나 전극 표면에 SEI 층이 형성되고, 사이클을 반복할수록 두께가 조금씩 두꺼워지는 특성을 보였다. 이러한 SEI 층은 Li2 O, Li2 CO3, LiF, 고분자 물질과 같은 다양한 유/무기물 복합체로 구성되고 추가적인 용량 발현은 충·방전 과정이 반복되며 SEI 층 혹은 전해질의 특정물질이 일부 환원되며 고분자 겔 타입의 필름이 형성되기 때문으로 여겨진다.[19–21] 2013년 Zhou 그룹은 탄소를 코팅한 산화철을 직접 합성하여 반쪽전지 테스트를 진행하였고, 전환반응이 끝난 이후 기존 SEI 층 위로 추가적인 고분자 겔 타입의 필름이 쌓이며 추가적인 용량이 발현된다는 사실을 관찰했다.[22] 전환반응 이후 만들어진 철 나노입자의 촉매적인 활성으로 전해질, SEI 층을 이루는 Li2 CO3, CO3가 가역적으로 환원(C4+ → C0)되며 추가용량이 발생한2- 와 같은 물질이 분해되고 탄소다고 주장하였고, 산화철뿐만 아닌 다른 여러 전이 금속 산화물에서도 유사한 이유로 추가용량이 발생한다고 주장하였다. 다수의 논문에서 전해질 혹은 SEI의 분해로 인해 합성된 고분자 겔 타입의 필름으로 리튬이온의 추가저장이 가능하다고 보고하였다. 하지만 이와 같은 리튬이온저장 방식의 가역성에는 의문이 남으며, 오히려 고분자 겔 타입 필름 형성과정에서 리튬이온과 전해질을 지속적으로 소모하여 장기 수명특성을 악화시킬 가능성이 높다. 특히, 리튬이온의 공급이 양극에 의해 제한되는 일반전인 완전지 시스템에서는 더 급격한 용량저하와 수명특성감소로 이어질 것이다.
3. 전이금속산화물 음극 활물질의 문제점
흑연과 같은 intercalation 기반의 반응과 비교해, 전환반응 기반 전이금속산화물은 저렴한 비용과 높은 용량을 가지고 있어 잠재적인 고용량 음극활물질으로 주목 받았다.[23] 하지만 전환반응 기반 전이금속산화물은 전압 히스테리시스(방전 프로파일과 충전 프로파일 사이에 전압 차이)가 존재하기 때문에 충·방전 과정에 과전압이 높아 에너지 효율이 크게 감소한다. 또한, 충전 및 방전 중에 매우 큰 부피 변화가 발생하여 수명 특성이 급격하게 감소할 뿐만 아니라 낮은 초기 쿨롱 효율 (심한 초기용량손실), Li2 O의 열악한 전도성으로 인한 낮은 속도특성도 개선되어야 한다.[24]
3.1 용량 감소 (음극의 부피 변화)
전이금속산화물의 리튬 저장 메커니즘은 전환반응을 기반으로 한다. 앞서 메커니즘에서 설명한 바와 같이, 리튬이 삽입(lithiation)될 때 Li2 O 매트릭스에 분산된 금속 나노입자로 환원되고, 탈리(delithiation)되는 동안 초기 산화 상태로 가역적으로 복원된다. M x O y와 Li+의 정반응(식 1)은 열역학적으로 가능하며 M y + 부터 M0의 형성은 금속원자 당 다량의 전자이동을 포함하여 높은 이론적 용량을 가질 수 있다. 그러나, Li2 O 매트릭스로부터 탈리되는 역반응은 가역성이 낮기 때문에 반복되는 충·방전 과정에서 Li2 O가 지속적으로 축적된다.[5, 1, 1, 23, 26] 또한, 리튬의 삽입/탈리과정에서 100 ~ 300 %의 급격한 부피 변화가 발생한다. 사이클이 증가할수록 반복되는 부피 변화로 인해 활물질의 분쇄 및 전기적인 단락이 야기된다. 또한, 금속 나노입자의 뭉침현상이 일어나며 구조 변형를 가속화 시킬 수 있다.27) 이러한 극심한 형태의 변화는 실리콘음극에서와 마찬가지로 급격한 용량 감소와 제한된 수명 특성을 초래한다(Fig. 3 과 Fig. 6A).
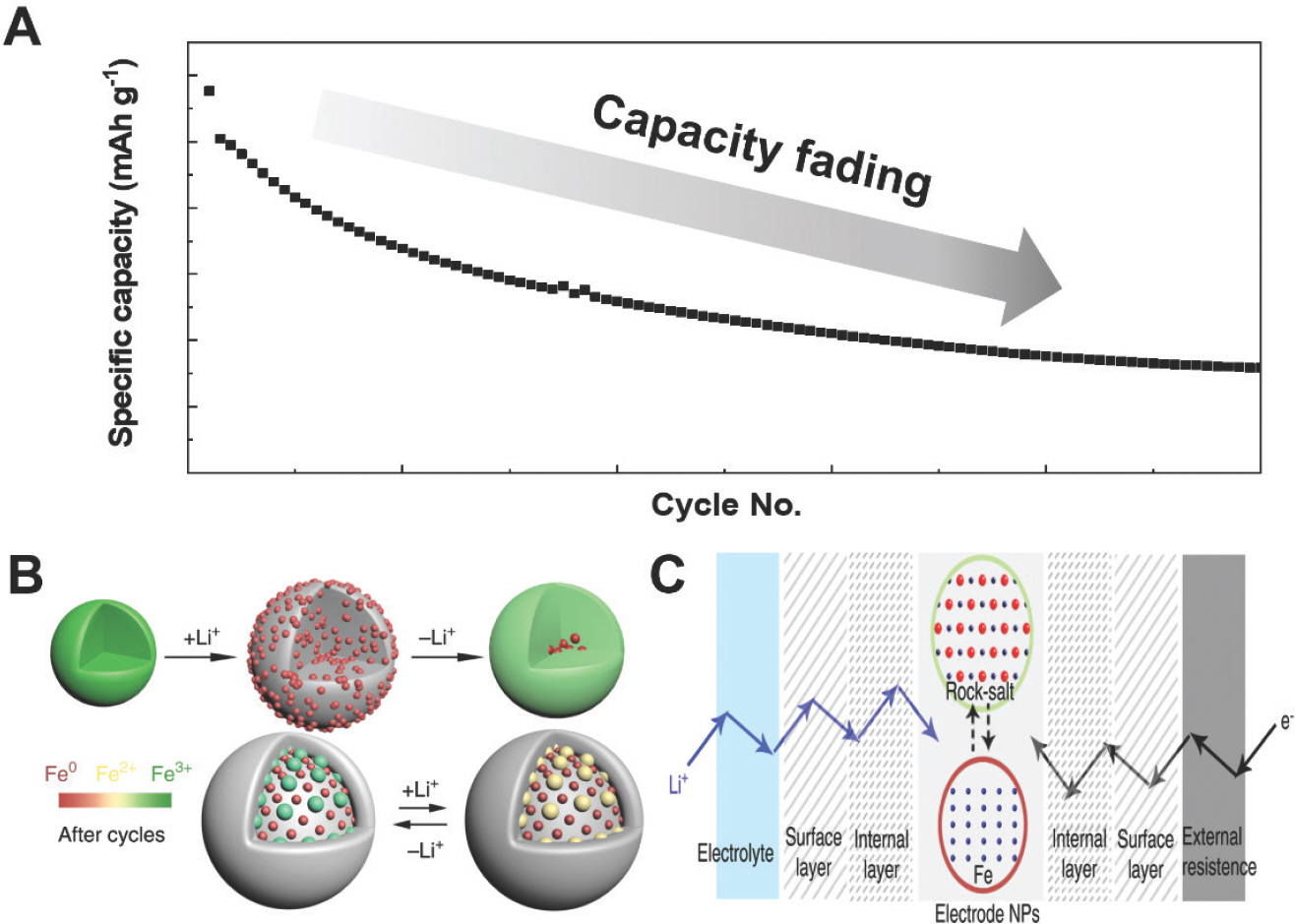
(A) 부피 변화에서 기인된 전환 반응 기반 음극에서 나타나는 용량 감소. (B) 사이클 진행에 따른 Fe3 O4의 상변화를 나타낸 개략도. (C) Li+ 이온과 전자의 효과적인 확산경로를 나타낸 개략도. (B - C) Licensed under CC-BY from Ref. 25)
2019년 Su's 그룹은 Fe3 O4의 용량 감소의 이유를 synchrotron-based X-ray와 in situ TEM을 통해 분석하였다.25) 충·방전 과정이 진행됨에 따라 불완전한 전환 반응과 전해질 분해로 인해 Li2 O가 축적되어 활성 입자 표면에 지속적으로 성장한다(Fig. 6B). 두꺼운 표면층은 확산 길이를 증가시켜 전자 전달을 저항을 증가시킨다(Fig. 6C). 따라서 표면 패시베이션 층의 지속적인 성장으로 인해 용량과 속도특성이 크게 감소한다고 주장하였다.
이와는 반대로, 충·방전 과정이 지속적으로 진행됨에 따라 표면층의 변화는 용량 증가의 이상현상을 야기한다는 발표 사례도 있다. H. Sun et al.은 고전류에서의 충·방전 사이클 간 메조다공성의 Co3 O4의 형태적 변화를 분석했다.28) 처음 90 사이클동안 용량은 약 830 mAh g−1 부터 약 205 mAh g−1까지 급격하게 감소하였다. 입자를 분석한 결과 전환 반응 기반 음극에서 흔히 나타나는 문제점인 표면층의 성장, 입자의 균열, 기공의 막힘 현상이 관찰되었다. 하지만 이후 사이클이 진행되는 동안 용량이 약 900 mAh g−1까지 증가하면서 안정화되었다. 850 사이클 이후에는 표면층이 감소하였고 기공의 크기도 확장되었다. 이 연구결과는 고전류에서의 lithiation induced reactivation 방법을 통해 금속산화물 음극의 수명특성을 향상시킬 수 있음을 보였다. 하지만 2장 3절에서 서술한 바와 같이 실제 완전지에서 이와같은 방식이 효율적으로 작동될 수 있을지는 의문이다.
3.2 낮은 초기쿨롱효율(initial Coulombic efficiency; ICE)
전이금속산화물 음극 활물질의 상업화 가능성에 대한 큰 기대감(저렴한 비용, 고용량)에도 불구하고 실행 가능한 대안이 되기까지는 많은 문제점이 존재한다. 그 중 전환반응 금속산화물의 낮은 초기쿨롱효율(ICE)가 가장 큰 문제로 대두되고 있다(Fig. 7A). 현재 상업용 리튬이 온전지에서 사용되는 intercalation 기반 음극인 흑연은 거의 90%의 높은 ICE를 가지는 반면, 전이금속산화물은 75% 이하의 낮은 ICE를 가진다. 낮은 ICE는 1) 금속의 불완전한 재산화(reoxidation) (i.e., 비가역적인 Li2 O의 환원분해), 2) 전해질 분해에 의한 SEI 층의 형성에 의해 야기된다.

(A) 첫 번째 충·방전 사이클이 진행될 때 나타나는 전환반응 기반 전이금속산화물 음극의 일반적인 전압 프로파일. (B) Li2 O 매트릭스에 가둬져 있는 Ru 입자. Reproduced from ref. 29) with permission of American Chemical Society. (C) 충·방전 사이클이 진행될 때 나타나는 전환반응 기반 전이금속산화물 음극의 일반적인 전압 프로파일. (D) Fe2 O3 음극의 voltage hysteresis를 나타내 주는 dQ/dV vs voltage 그래프. Reproduced from ref. 30) with permission of American Chemical Society.
전환반응은 Li2 O형태로 Li+ 이온을 저장한다. 따라서 리튬이온저장 효율이 Li2 O의 반응성에 큰 영향을 받는다. 하지만 Li2 O는 반응성이 굉장히 낮을 뿐만 아니라 Li+로 전환되는 것이 열역학적으로 불안정(unfavorable)하기 때문에 스스로 분해되기 어렵다. (3장 1절 용량 감소)에서 설명하였듯 전환반응 기반 음극은 리튬이 삽입될 때 극심한 부피 변화가 나타난다. 이 과정에서 최종 환원 입자 중 하나인 금속 나노입자가 비정질의 Li2 O에 둘러싸인 채 고립되어 전기적 단락이 발생한다. 하나의 예로, RuO2가 전환반응을 거친 후(RuO2 + 4 e− + 4 Li+ ↔ Ru + 2 Li2 O) 나타나는 문제점을 Fig. 7B에 나타내었다.29) Li2 O 매트릭스에 고립된 금속나노입자는 전기적 단락으로 인해서 전기화학적 반응(산화 반응)이 제한된다. 그러므로 첫번째 충ㆍ방전 사이클이 진행된 이후 금속 입자의 산화 상태는 충ㆍ방전 사이클이 진행되기 전 원래 상태보다 리튬과 반응할 수 있는 금속산화물의 비율이 낮아지게 된다.25, 31) 이러한 결과로 전환반응의 비가역적인 반응이 나타나고 낮은 ICE를 초래한다.
전환반응에서 Li+ 이온의 삽입에 따라 생성되는 표면층의 두께는 수십에서 수백 옹스트롬(Å)에 달한다. 전해질을 구성하고 있는 리튬염과 용매는 낮은 전압에서 불안정하여 환원 분해가 이루어진다. 전극의 표면에서 발생하는 전해질의 분해는 SEI 층의 형성으로 이어진다.32) 이 표면층은 Li+ 이온이 포함된 무기물(Li2 CO3, LiF, Li2 O)과 유기물로 구성되어 있으며, 이는 전해질의 환원분해에 의해 기인된 것이다. 생성된 SEI층은 전극의 표면을 보호해주는 역할을 해주어 추가적인 전해질의 분해를 막고 음극 활물질이 안정적으로 작동할 수 있게 해준다.33) 한번 생성된 SEI는 반복되는 사이클에서 열적, 기계적 및 화학적으로 안정하게 유지되는 것이 바람직하다. 하지만 전환반응의 경우 다량의 Li+ 이온이 첫 번째 lithiation과정에서 SEI 층의 형성을 위해 소모될 수밖에 없어 낮은 ICE를 갖게 된다. 또한 이후 사이클에서 부피 변화로 인해 SEI가 붕괴되는 일이 빈번하게 발생하여 쿨롱효율이 낮아지는 문제가 지속적으로 발생 한다.
3.3 전압 히스테리시스
전환반응의 주요 단점 중 하나이며 가장 많이 언급되는 문제점은 방전 프로파일과 충전 프로파일 사이에 전압 차이가 존재하는 전압 히스테리시스이다(Fig. 7C). 전압 히스테리시스는 열역학 및 동역학적 문제로 인해 주로 발생되며 앞서 설명한 용량 감소(3장 1절) 및 낮은 ICE(3장 2절)를 일으키는 문제점의 복합적인 이유로 발생되기도 한다. 전압 히스테리시스는 전환반응의 충· 방전 에너지 효율을 낮추는 원인이 된다.9, 10)
전이금속산화물(MO n)은 전환반응을 거치면서 한 개의 고체상(solid phase)에서 다양한 구조를 가진 여러개의 고체상(MO x, Li2 O, M)으로 전환된다 (리튬이온의 저장) (식 1). 생성된 복잡한 고체상(MO x, Li2 O, M) 혼합물이 역반응을 통해 다시 처음의 양론비 (stoichiometric ratio)를 가지는 비정질 MO n으로 전환되어야 한다 (리튬이온 방출). 이는 리튬 이온의 저장과 방출과정이 서로 다른 반응 경로를 가진다는 것을 시사한다. 다시 말해 정반응과 역반응의 반응경로가 현저히 다르며, 각 반응에 관련되는 열역학적 인자(e.g., 활성화에너지)가 다름을 말한다.
또한 전환반응은 강한 MO n 화학 결합의 파괴와 관련이 있고, 이러한 과정이 진행되기 위해서는 Li+ 이온의 확산뿐만 아니라 산소 및 금속이온의 확산도 고려되어야 한다. 하지만 전환반응이 진행되면서 두꺼운 SEI층이 축적되고, 이에 따라 높은 저항에 의해 이온 전도도가 낮아지게 된다. 확산저항, 이온전달저항, 복잡한 다성분계 계면에서의 저항과 같은 동역학적 한계(kinetic limitations)로 인한 분극현상이 심하게 발생할 수밖에 없다. 전압 히스테리시스는 이와 같은 2가지 원인(열역학적, 동역학적)에 의해 주로 나타난다. 전압 히스테리시스를 줄일 수 있는 대표적인 방안 중 하나는 나노구조화이다. 2015년 Braun 그룹은 일반적으로 약 1 V34, 35)의 전압 히스테리시스를 가지는 Fe2 O3를 나노구조화하여 전압 히스테리시스를 약 0.62 V 까지 낮추는데 성공하였다(Fig. 7D).30) 이러한 연구결과는 나노구조화 전략은 일반적으로 1 V 이상의 전압 히스테리시스를 가지는 전환반응 물질의 전압 히스테리시스의 값을 약 40 % 이상 줄일 수 있는 전략임을 시사한다. 36)
4. 전이금속산화물 음극 활물질 문제 해결 전략
3장에서 언급하였듯 전환반응기반 메커니즘은 다양한 문제점이 존재한다. 고용량을 갖는 전환반응 음극재를 상용화하기 위해서는 앞서 언급한 치명적인 단점을 해결해야 한다. 현재까지 이러한 문제를 극복하기 위해 수많은 연구가 진행되어왔다. 특히 전환반응의 역반응인 Li2 O 분해반응을 촉진하고, 극심한 부피 변화에서 기인된 전극의 분쇄를 완화하여 전극 재료의 구조적 안정성을 향상시키기 위한 많은 전략이 제안되어왔다. 이러한 전략에는 1) 나노구조화(nanostructured engineering), 2) 전이금속산화물과 탄소 복합체 형성(hybrid nanostructures based on metal oxide and carbon), 3) 촉매입자의 도입(introduction of catalytic elements)이 있다. 이러한 전략은 동역학적 특성 개선 및 전환반응의 가역성을 향상시키고 부반응을 억제하여 전기화학적 성능을 향상시키는데 도움을 준다.
4.1 나노구조화(nanostructured engineering)
전이금속산화물 음극의 나노구조화는 높은 에너지밀도, 출력 그리고 장수명의 향상된 고성능 리튬이온배터리의 개발을 위한 유망한 방법이다.39-41) 일반적으로 나노구조는 이온 및 전자이동의 거리를 줄이고 전극/전해질 접촉면적을 넓혀 나노구조 재료 기반 전극의 전기화학적 성능을 크게 향상시킨다(Fig. 8A). 또한 저차원 형태 및 중공(hollow) 공간과 같은 일부 구조적 특징은 충·방전 사이클 동안의 거대한 부피 변화를 완화할 수 있어 사이클 성능을 향상시킬 수 있다. 나노구조화의 장점을 극대화하기 위해서는 형태, 조성, 다공성 및 표면 특성을 최적화해야 한다. 따라서 다공성 입자37, 42), 0D 나노 입자43), 1D 나노 와이어 및 나노 튜브34, 44), 2D 나노 시트45) 및 3D 중공 구조46, 47)와 같은 다양한 기하학적 모양과 형태를 가진 전이금속산화물 음극이 광범위하게 연구되어왔다.
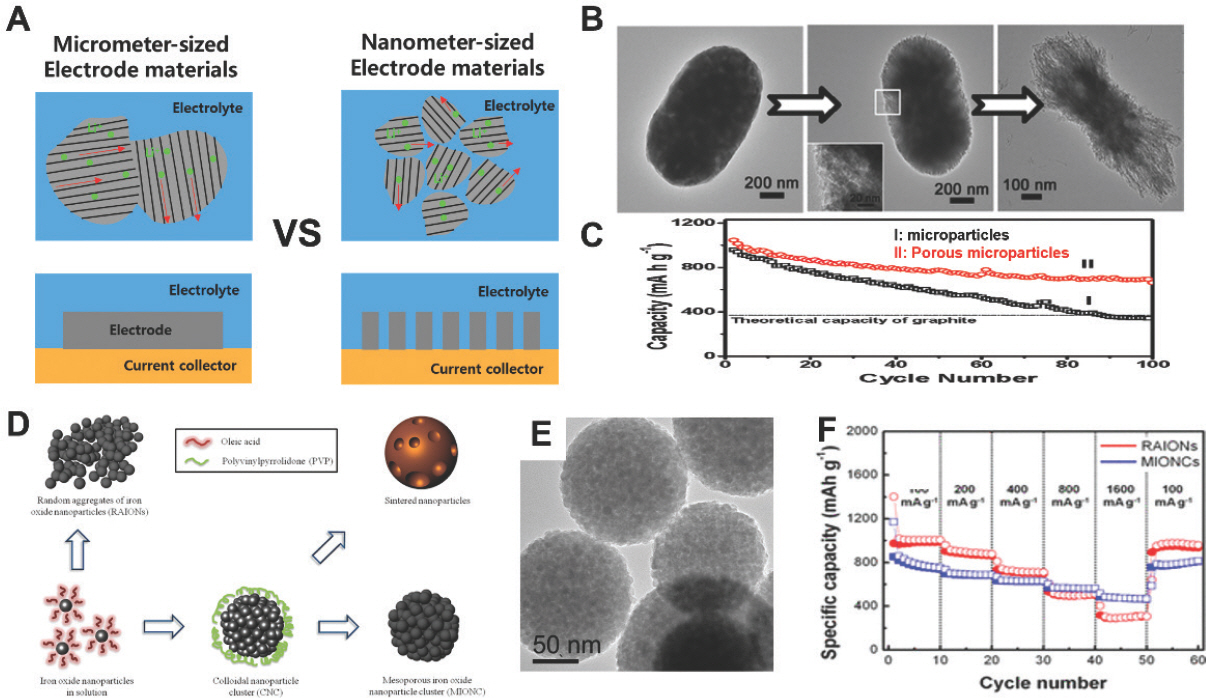
(A) 마이크로 입자와 나노 입자에서의 Li+ 이온의 이동거리 및 전극과 전해질의 접촉면적 차이점. (B) 에칭하는 시간에 따른 α-Fe2 O3 입자의 변화 과정. (C) 일반적인 α-Fe2 O3 입자와 다공성의 α-Fe2 O3 입자의 사이클 성능 차이. (B-C) Reproduced from ref. 37) with permission of American Chemical Society. (D) MIONCs와 RAIONs 합성의 개략도 (E) MIONCs의 TEM 이미지. (F) 다양한 전류밀도에서 MIONCs와 RAIONs의 전기화학 성능 차이. (D-F) Reproduced from ref. 38) with permission of American Chemical Society.
다공성(porosity)은 전환반응 음극의 전기화학적 성능을 향상시키는데 핵심적인 역할을 한다.48-56) 2010년 Xiong 그룹은 top-down 방법을 이용하여 α-Fe2 O3 입자를 합성하였다.37) Oxalic acid를 에칭재(etching agent)로 사용하여 전체적인 구조는 유지하면서 phosphate 이온을 시스템에 도입하여 에칭 방향을 제어하였다. 에칭 후 α-Fe2 O3 입자는 다공성 구조를 가졌으며 형태는 에칭 시간에 따라 크게 달라졌다(Fig. 8B). 이 다공성 입자와 일반적인 α-Fe2 O3 입자의 초기용량은 유사하지만, 100회 충·방전 사이클 이후에는 각각 662 mAh g−1과 341 mAh g−1로 다공성 α-Fe2 O3 입자에서 수명 성능이 크게 향상되는 효과를 보였다(Fig. 8C). 이 연구결과는 충ㆍ방전 사이클이 반복되는 동안 발생한 부피 팽창을 다공성 구조가 효과적으로 완화한다는 것을 의미한다. Top-down 방식을 이용하여 나노구조를 만든 Xiong 그룹과는 달리 Hyeon 그룹은 bottom-up 자기조립 방식을 이용하여 메조다공성산화철 2차입자를 합성하였다(Fig. 8D).38) Hyeon 그룹은 활성물질의 기하학적 구조를 변형하여 사이클 성능을 향상시킬 수 있음을 보여주었다. 균일한 산화철 나노입자는 열분해를 통해 올레산철-리간드(iron oleate-ligand) 복합체로 전환되었다. Oil-in-water 에멀젼 시스템을 이용하여 10 nm 크기의 산화철 1차입자를 200 nm 크기의 구형 2차 입자로 자가조립하였다(Fig. 8E). 불활성기체에서 열처리를 진행한 후 얻어진 결과물 MIONCs (Mesoporous iron oxide nanoparticle clusters)는 3.5 nm의 메조기공을 나타냈다. 이 입자는 867 mAh g−1의 질량당용량으로 100 사이클까지 유지하였고 이후 사이클에서는 쿨롱 효율이 급격히 증가하여 99.7 %까지 도달했다. 또한 MIONCs는 고전류밀도(1,600 mA g−1)에서 RAIONs (random aggregates of iron oxide nanoparticles)보다 더 높은 가역용량(473 mAh g−1)을 보여주었다(Fig. 8F). 위 2 가지 예시를 통해 전극의 재료에서 입자의 다공성은 전극의 수명유지향상에 크게 기여함을 확인할 수 있다.
다공성구조 뿐만 아니라 저차원의 나노구조(1D, 2D)34, 44, 45) 또한 Li+ 이온이 삽입될 때 부피 팽창을 효과적으로 완충할 수 있다. 이러한 저차원의 나노구조는 형태를 파괴하지 않고 특정 방향으로 팽창 및 수축할 수 있다는 특징이 있다. 반면, Li+ 이온의 이동은 감소된 확산 길이와 넓은 전해질/전극 접촉 면적으로 인해 향상된다.57-59) 특히 2D 나노물질은 측면 치수가 수백 나노미터에서 수 마이크로미터에 이르고 두께가 5 nm 미만인 물질48)로서 유한한 측면 크기를 제공하여 활물질을 통한 Li+ 이온 및 전자의 확산을 촉진하고 충·방전 과정에서 큰 부피 변화를 완충할 수 있다.60, 61) Liu 그룹은 옥시수산화철(iron(lll)-oxyhydroxide)를 전구체로 사용하여 간단한 열처리를 통해 2D 시트가 서브 유닛으로 구성된 꽃 모양의 α-Fe2 O3 입자를 합성하였다.62) 너비가 2 ~ 3 ㎛이고 두께가 20 nm인 수십개의 나노시트로 구성된 입자의 크기는 7 ~ 10 ㎛이고 115 m2 g−1의 Brunauer-Emmett-Teller(BET) 표면적을 가지고 있다. 꽃 모양의 α-Fe2 O3 입자로 제작된 전극은 100 mA g−1의 전류 밀도에서 높은 초기 용량(~1,700 mAh g−1)을 가졌고 10 cycle 후에는 989 mAh g−1의 용량을 가졌다. 또한 전하전달 저항은 일반적인 α-Fe2 O3 전극의 저항(250 Ω)보다 약 3배 낮은 값(80 Ω)을 가졌다. 상용 나노 입자와 비교하여 2D 시트 입자는 견고한 계층 구조와 높은 비표면적으로 인해 전환반응으로 인한 부피 팽창을 효과적으로 완충할 수 있다.
중공구조는 껍질과 내부 빈공간이 존재하는 마이크로 및 나노 구조 재료를 의미하며 나노 반응기, 약물 전달, 가스 센서 및 에너지 저장/변환등 다양한 응용 분야에 적용될 수 있어 많은 연구가 이루어져 왔다.64-68) 중공 구조는 전기화학적 성능 향상에 큰 도움을 주는데 그 원인은 다음과 같이 정리할 수 있다: 1) 중공 구조로 인해 상대적으로 높은 표면적을 가지는 전이금속산화물 입자에 리튬을 저장할 수 있는 다양한 위치가 존재하고 Li+ 이온 플럭스에 대한 전극-전해질 접촉면적을 증가시켜 활성 물질의 용량을 증가시키는 데에 유리하다. 2) 투과성의 얇은 껍질은 Li+ 이온과 전자가 확산하는 경로를 감소시켜 개선된 속도특성을 야기한다. 3) 속이 빈 내부는 구조적 변형 및 반복되는 충·방전에 의한 큰 부피 변화를 완화하기 위한 추가 여유 공간을 제공하여 수명특성을 향상시킬 수 있다. 이와 같은 장점들로 인해 오랜 기간 중공 구조를 갖는 전이금속산화물 음극을 제작하기 위해 다양한 전략이 사용되어왔다. 2013년에 Wang 그룹은 용매열합성을 사용해 나노플레이트 블록으로 구성된 계층적 중공 Fe3 O4 구체를 합성하였다.69) 이러한 계층적 중공 구조를 갖는 입자는 전자의 확산 거리가 현저히 감소하고 리튬저장능력이 우수할 뿐만 아니라 우수한 안정성과 높은 패킹 밀도를 가지고 있다. 그 결과 200 mA g−1의 전류밀도에서 100 사이클 이후에도 580 mAh g−1의 높은 용량을 가진다. 앞선 방법들은 수열합성 및 용매열합성을 통해 전구체를 얻은 물질을 다시 열처리하여 나노 구조를 갖는 전이금속산화물을 합성하였다. 하지만 이러한 방법을 사용하지 않고 미리 만들어진 고체입자를 주형 또는 전구체로 사용하여 중공 구조를 갖는 물질을 합성하는 방법63, 70-74)은 이전에 제시한 방법보다 간단하다는 장점이 있다. Zhang et al. 은 prussian blue(PB) 마이크로큐브를 전구체로 활용하여 간단한 열처리 과정을 통해 중공 구조를 갖는 Fe2 O3를 합성하였다.70) PB 마이크로큐브의 열처리 온도 조건을 조작하여 산화 분해와 Fe2 O3 껍질의 결정 성장을 제어함으로써 다양한 구조를 갖는 중공의 Fe2 O3를 얻었다(Fig. 9A-D). 열처리 온도가 550 ℃로 증가함에 따라 결정이 등방성으로 성장한 결과를 보였다(Fig. 9B). 또한 650 ℃로 온도를 높이면 나노플레이트로 구성된 계층적 껍질이 형성됨을 확인할 수 있다(Fig. 9C). 위 재료들을 리튬이온전지의 음극재로 사용하여 전기화학성능을 살펴본 결과 3가지 재료 모두 일반적인 Fe2 O3에 비해 개선된 결과를 보였고, 특히 650 ℃에서 열처리를 진행한 Fe2 O3가 가장 뛰어난 성능을 보였다(Fig. 9D). 앞선 사례들은 입자의 구조를 엔지니어링하여 전극을 합성하면 전이금속산화물의 전기화학적 성능을 향상시킬 수 있다는 사실을 증명하였다.
4.2 전이금속산화물과 탄소 복합체 형성
일반적으로 금속산화물은 반도체 또는 부도체이며, 전환반응에서 생성되는 Li2 O는 부도체이다. 그 결과 음극 활물질 및 전환반응 생성물 모두의 전자전도도가 현저히 떨어져 분극이 증가하고 전체적인 출력특성이 현저히 떨어진다. 이와같은 문제를 해결하기위해 전기전도도를 갖는 탄소와 금속산화물을 복합화하여 나노복합체를 합성하는 전략이 널리 활용되어 왔다. 복합체의 탄소 성분은 전도성이 낮은 전이금속산화물에서의 전자전도도를 향상시켜 고용량 및 속도특성을 향상시키는 데에 효과적이다. 또한 탄소재료는 탄성을 가지고 있는 완충층의 역할을 할 수 있어 전극 재료의 안정성을 향상시킬 수 있다. 다양한 전이금속산화물의 나노구조와 탄소재료를 결합함으로써 다양한 나노복합체를 합성할 수 있으며, 이는 차기 LIB용 전극재료로 검토되고 있다.35, 38, 78-84)
활물질의 표면에 탄소를 코팅하는 것은 전기화학적 성능을 향상시키기 위해 가장 널리 사용되는 효과적인 방법 중 하나이다.59, 85) Zhang et al.은 Fe2 O3를 glucose와 함께 수열합성을 진행한 후, 저온탄화를 진행하여 부분 환원에 의해 탄소가 코팅된 Fe3 O4(Fe3 O4-C)를 합성하였다.78) Fe3 O4-C는 높은 가역용량(C/5 전류에서 ~745 mAh g−1, C/2 전류에서 ~600 mAh g−1), 높은 ICE(~80 %), 수명특성 및 속도특성을 보여주었다. Fe3 O4-C는 일반적인 α-Fe2 O3입자와 비교하여 개선된 전기화학적 성능을 보여주었다. 이러한 예는 균일하게 코팅된 탄소층이 기계적특성을 향상시켜 내부 활성 물질을 보호하고, 복합체의 전기 전도도를 개선하는데 도움을 주어 LIB의 특성을 효과적으로 증진시킬 수 있음을 보여주었다.
위에서 언급한 탄소 코팅 전략은 일반적으로 미리 합성된 물질의 표면에 탄소 전구체 층을 증착하는 추가 단계를 필요로 하며, 이는 상대적으로 복잡한 합성 절차를 가지고 있다. 따라서, 전이금속산화물-탄소 복합체를 제조하기 위한 one-pot 합성 전략을 개발하는 것이 강조되고 있다.79, 86) 2011년, PAA (poly[acrylic-acid])를 활용하여 탄소 매트릭스에 균일하게 구형의 Fe3 O4가 함유되어있는 재료를 합성하였다.79) 합성이 진행되는 동안, PAA는 구조형성을 도와주고 이후 500 ℃ 탄화과정을 거치며 구형의 Fe3 O4 주위에 ~6 nm의 균일한 두께를 갖는 탄소층으로 전환된다. 탄소층이 지지된 Fe3 O4는 60 사이클 후에도 712 mAh g−1의 높은 가역용량을 보였다. 최근, Zhao 그룹에서는 추가의 탄소 유도체 물질을 사용하지않고 ferrocene을 사용해서 탄소매트릭스에 산화철나노입자가 도입되어있는 물질을 합성하였다.75) Ferrocene은 Fe원자를 중심으로 2개의 cyclopentadienyl(C2 H5)로 이루어진 복합체로 산화분위기에서는 Fe 이온과 cyclopentadiene(C2 H6)로 분리될 수 있다. 이 연구팀은 colloidal SiO2입자와 ferrocene 을 H2O2와 함께 용매열합성을 진행하였다. 용매열합성이 진행되는 동안 ferrocene은 H2 O2에 의해 산화되어 1차적으로 Fe 이온과 C2 H6로 가수분해 되었다. 또한 추가적인 산화과정을 통해서 Fe 이온은 SiO2 입자위에서 Fe3 O4로 가교되어 코팅되었고 C2 H6은 이 코팅층을 덮는 탄소층으로 중합되었다. 이 입자는 추가적인 600 ℃ 열처리 과정과 SiO2 에칭과정을 거쳐서 Fe3 O4가 도입된 중공구조를 갖는 나노스피어 탄소(hollow gradient-structured Fe3 O4@C nanospheres; HG-Fe3 O4@C)를 합성하였다(Fig. 10A). 420 nm의 HG-Fe3 O4@C 입자는 4~8 nm의 작고 균일한 크기를 가지고 있는 산화철 나노결정으로 이루어져있고 ~20 nm의 탄소층 두께를 가지고 있다. 이 물질을 LIB의 음극으로 평가했을 때, 200 mA g−1에서 ~99.8 %의 CE를 가지면서 1,200 mAh g−1의 우수한 고용량의 특성을 보였다. 특히 22 %의 적은 부피 변화로 인해서 10, 20 A g−1의 고전류에서 각각 ~757, ~500 mAh g−1의 안정적인 용량으로 10,000 사이클의 우수한 수명특성을 보였다(Fig. 10B).
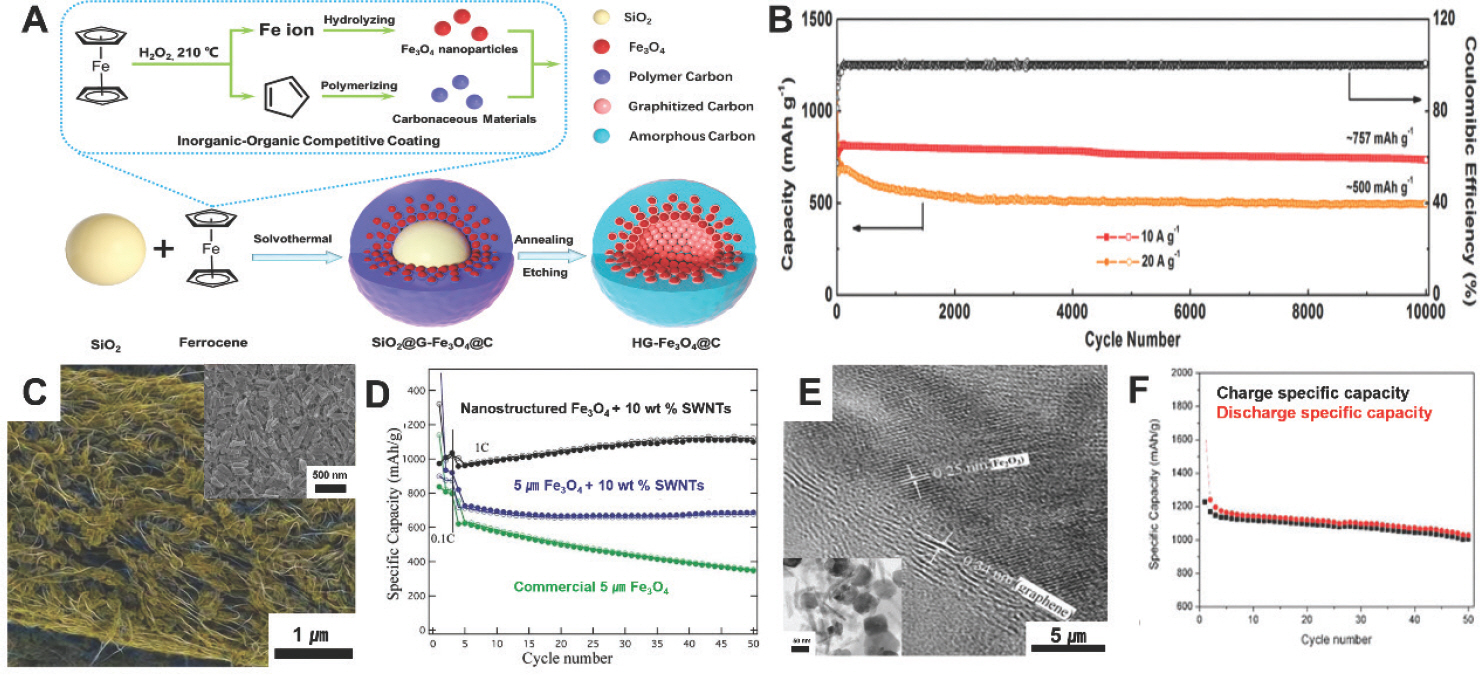
(A) HG-Fe3O4@C 합성 전략에 대한 개략도. (B) HG-Fe3 O4@의 고전류 밀도(10 및 20 A g−1)에서 고용량을 갖는 수명 성능. (A) Licensed under CC-BY from Ref. 75) (C) Fe3 O4/SWNTs 표면 및 옆 단면의 SEM 이미지. (D) 1 C 전류밀도에서 사이클수에 따른 각 산화철 탄소 복합체 및 산화철 입자의 용량 차이. (C-D) Reproduced from ref. 76) with permission of John Wiley and Sons. (E) rGO/Fe2 O3의 SEM 및 TEM 이미지. (F) 100 mA g−1의 전류밀도로 측정한 rGO/Fe2 O3의 사이클 성능. (E-F) Reproduced from ref. 77) with permission of American Chemical Society.
위에서 언급한 합성법 이외에도 전도성 탄소 매트릭스에 전이금속산화물을 삽입하는 것도 전기화학적 특성을 향상시키는데 효과적이다. 그 중 저차원의 형상을 갖는 복합체는 구조적변형을 완화하고 큰 부피 변화를 수용할 수 있다. 탄소나노튜브(CNT)는 1D의 형상을 갖는 탄소로서 높은 전도성과 유연성을 가지고 있어 전이금속산화물과 복합체를 합성할 수 있는 후보군 중 하나이다. Dillon's 그룹은 상호 연결된 단일벽을 가진 탄소나노튜브(single-walled carbon nanotube; SWNT) 매트릭스에 Fe3 O4 나노입자를 균일하게 삽입하는 간단한 2단계 방법을 발표하였다. FeOOH 나노라드(nanorod)를 전구체로 사용하고 진공 여과(vacuum-filtration)를 하여 SWNT와 조립한다. 이후 불활성기체에서 450 ℃ 열처리 과정을 진행하면 Fe3 O4가 나노입자가 삽입된 상호 연결된 SWNT(Fe3 O4/SWNTs)를 얻을 수 있다(Fig. 10C).87) SWNTs와 나노구조화가 이루어져있는 Fe3 O4 복합체의 전기화학적 성능을 보여주기 위해서 연구팀은 3가지 샘플을 준비 후 비교하였다(Fig. 10D). Fe3 O4/SWNTs는 1 C의 전류밀도에서 ~1,000 mAh g−1의 높은 질량당용량과 우수한 수명특성을 보여주었다. Fe3 O4가 5 ㎛로 커졌을 때 또한 SWNT의 효과로 인해 50 사이클 동안 ~600 mAh g−1의 안정적인 용량을 보였으며, 이는 일반적인 5 ㎛의 Fe3 O4보다 우수한 전기화학적 성능을 나타내었다. 이러한 예는 전이금속산화물과 CNT의 혼성화가 전환반응 음극 재료의 리튬 저장 특성을 효과적으로 향상시킬 수 있음을 분명히 보여 주었다.
그래핀은 높은 전기 및 열 전도성, 큰 비표면적, 경량, 높은 기계적 강도 및 유연성과 같은 물리적/화학적 특성으로 인해 현재 각광받고 있는 탄소 재료 중 하나이다.88) 그래핀의 이러한 특성을 극대화하여 다양한 응용에 적용하기 위해, 그래핀기반 하이브리드 나노구조를 설계하고 합성하는 연구가 활발히 이루어졌다.48, 89–91) 그래핀은 전자 수송을 촉진하고 금속산화물을 고정하기 위한 넓은 표면적을 제공하여 전기화학적 성능을 향상시킬 수 있다. 하나의 예로, Zhu et al.은 환원그래핀옥사이드/Fe2 O3 복합체(rGO/Fe2 O3)를 합성하였다.77) rGO/Fe2 O3를 만들기 위해 FeCl3를 GO 서스펜션에서 urea 존재하에 90 ℃에서 가수분해하여 Fe(OH)3를 만들었다. 이후 Fe(OH)3를 GO 플레이트 표면에 코팅시킨 뒤 hydrazine을 사용하여 Fe(OH)3는 Fe2 O3로, GO는 rGO로 환원시켜 최종복합체를 합성하였다(Fig. 10E). 합성을 통해 얻어진 복합체 음극(rGO/Fe2 O3)은 1,227 mAh g−1의 충전용량을 보였으며 우수한 사이클 성능 및 속도특성을 가졌다(Fig. 10F). rGO/Fe2 O3의 총용량은 순수 rGO와 나노입자 Fe2 O3 용량의 합보다 높으며, 이는 전기화학적 성능 향상에 대한 rGO와 Fe2 O3의 긍정적인 시너지가 발생했음을 의미한다. 이와 비슷하게, Yang 그룹은 샌드위치 구조를 가지고 있는 그래핀 기반 Co3 O4(G/Co3 O4/G)와 NiO(G/NiO/G)를 합성하였다.84) 일반 그래핀 기반 Co3 O4 및 NiO와 비교하여 G/Co3 O4/ G와 G/NiO/G는 1 C 전류밀도에서 각각 310 mAh g−1 및 718 mAh g−1로 개선된 용량을 보였다. 샌드위치 구조를 가지고 있지 않은 그래핀 전이금속산화물 복합체의 경우 입자와 그래핀 사이의 약한 접촉으로 인해 사이클 진행 시 그래핀 표면에서 전이금속산화물이 쉽게 벗겨져 급속한 용량 감소가 발생하는 단점을 보완할 수 있다. 실제로 이 합성법을 사용한 SnO2의 경우 ICE가 거의 100 % 가까이 보이는 우수한 성능을 보인 사례도 있다.92) 위 연구사례들은 전이금속산화물 탄소 복합체를 LIB의 음극으로 사용하면 응집 및 부피 변화에 대한 이중 보호 기능을 제공하고 전자와 리튬 이온 모두에 대해 유리한 이동성을 제공할 수 있음을 시사한다.
4.3 촉매입자의 도입(Introduction of catalytic elements)
앞서 언급하였듯이, 전환반응에서의 역반응(Li2 O → Li+)은 비자발적이기때문에 가역성이 떨어져 음극에서의 용량 및 쿨롱효율의 감소를 유발한다. 따라서, 전환반응기반 음극의 전기화학성능을 극대화시키기 위해서는 Li2 O의 가역성을 증진시키는 것이 필수적이다. 식 1에서와 같이 전환반응의 역반응은 비활성의 Li2 O와 금속나노입자의 반응과 연관이 있으므로, 전환반응의 가역성은 금속나노입자의 촉매 특성에 영향을 받는다. 따라서, 촉매로 작용할 수 있는 불균일 금속원소를 도입(introduction of the heterogeneous metal elements as catalysts)하는 것은 전환반응의 가역성을 높여주는 방법이 될 수 있다. 예를 들어, Kang et al. 은 금속 Ni 를 Co3O4 전극에 첨가하여 전극의 쿨롱효율을 증진시켰다.95) Ni 금속나노입자는 1) Li2 O의 분해를 위한 촉매, 2) Co 산화를 촉진하기 위한 Co와 Li2 O 사이의 전자 전도성 네트워크 형성, 3) Co3 O4의 부피 변화를 최소화시키는 완충 작용의 역할을 한다고 발표했다. 이러한 연구사례는 비가역적 용량 손실을 최소화하기 위해서 Co, Ni 및 Ge와 같은 다양한 금속원자를 화합물에 첨가하는 것이 Li2 O의 분해를 위한 촉매의 역할뿐만아니라 금속 나노입자의 재산화를 촉진시킬 수 있고, 체적 변형을 완화하여 수명성능을 향상 시킬 수 있음을 시사한다.
이와 같은 연구에 영감을 받아 전환반응음극에 금속나노입자를 도입하는 연구가 활발히 진행되어왔다.94-101) Cho 그룹은 GeO2 나노입자를 C2 H2/Ar 혼합가스 분위기에서 열처리하여 Ge가 도입된 GeO2-탄소 복합체(GeO2/Ge/C)를 합성하였다. GeO2/Ge/C는 1 C(2,100 mA g−1)전류에서 높은 쿨롱효율을 가지면서 1,860 mAh g−1의 용량을 가졌으며, 고전류(10 C)조건에서도 ~1,700 mAh g−1의 고용량의 특성을 보였다. GeO2 또는 GeO2-C전극의 용량과 비교하였을 때, 각각 40 % 또는 20 % 더 높은 용량을 보였다. 이러한 우수한 전기화학적 성능은 Ge 금속나노입자의 촉매효과에 의해서 Li2 O의 가역적 분해 반응이 촉진되어 나타난 결과로 여겨진다(Fig. 11A).93) 이와 비슷하게, Lee 그룹은 탄소 및 Ge 금속나노입자가 도입된 메조다공성을 갖는 GeO2 (m-Ge/GeO2/C)를 합성하였다.94) 연구팀은 Ar 분위기 열처리과정을 통해 메조다공성을 갖는 GeO2(m-GeO2)를 얻고 추가적인 열환원과정(thermal reduction, 4 % H2/Ar 분위기)을 통해서 최종적인 m-Ge/GeO2/C 를 합성하였다. m-Ge/GeO2/C는 향상된 쿨롱 효율, 높은 가역 용량(1,631 mAh g−1), 높은 면적 용량(areal capacity, 1.65 mAh cm−2) 및 안정적인 수명성능을 보여줬다. 이러한 우수한 성능은 다공성 구조와 Ge의 촉매 기능의 시너지 효과에 의해서 기인되었다. 앞서 언급하였듯이, 다공성 구조는 기계적 변형을 완충할 수 있는 역할과 넓은 비표면적을 유도해 높은 전극-전해질 접촉 면적을 제공하며 Ge 금속나노입자는 Li2 O 분해를 위한 전기적 촉매 역할 뿐만아니라 Ge금속과 Li2 O 사이의 전기 전도성 네트워크를 제공하여 재산화반응(Ge + 4.4 Li = Li4.4 Ge)을 유도해 전체 용량과 쿨롱효율을 증가시켰다. 더해서, 이 연구팀은 Ge의 Li2 O의 가역성을 촉진시키는 촉매역할을 증명하기 위해서 추가적인 분석을 진행하였다. 특히 결정질의 전이금속산화물은 전환반응 후 비정질의 상을 포함하는 구조로 변환되기 때문에, XRD(X-ray diffraction)로는 분석하는데 제한이 있다. 이러한 관점에서 XANES(X-ray absorption near-edge structure)과 EXAFS(X-ray absorption fine structures) 스펙트라 분석을 진행하여 Ge의 촉매적 특성을 증명하였다. m-GeO2는 Li+가 삽입(방전)됨에 따라서 Ge-O 피크 및 Ge-Ge 피크의 변화가 미미하며 탈리(충전)된 후 원래 상태로 복원되지 않음을 EXAFS를 통해 확인할 수 있다(Fig. 11B). 이는 Li+가 m-GeO2 전극에 삽입됨에 따라 전극 표면에 Li2 O가 형성되고, 이로 인해 리튬이 삽입된 m-GeO2로부터 Li+의 추출이 제한되어 금속 Ge가 GeO2로 재산화과정이 어렵다는 것을 나타낸다. 반면 m-Ge/GeO2/C 전극에서는 Ge-O피크가 충·방전과정 중 명확하게 변화되는 것을 확인할 수 있으며, 이는 Ge 금속입자의 촉매작용으로 인해서 Ge 의 재산화과정이 촉진됨을 시사한다(Fig. 11C). 이러한 연구사례들은 나노 크기의 입자, 다공성 구조, 탄소 코팅 및 금속나노입자의 도입이 전환 반응의 동역학을 활성화하고 개선하는데 도움을 줄 수 있다는 것을 보여 준다.
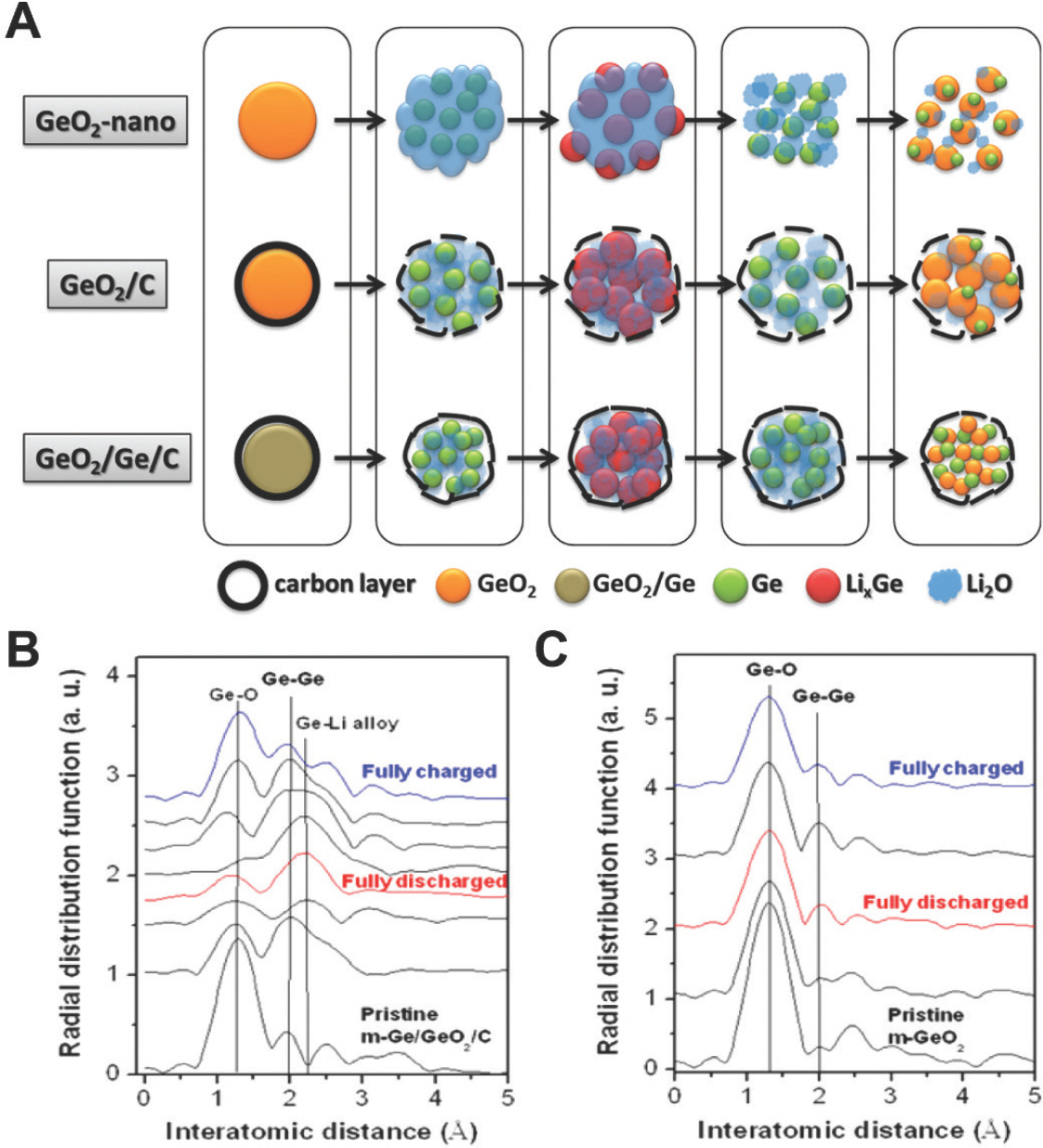
(A) GeO2기반 물질(GeO2, GeO2/C, GeO2/Ge/C)의 전환반응 메커니즘을 나타낸 개략도. Reproduced from ref. 93) with permission of American Chemical Society. (B) m-GeO2/C와 (C) m-Ge/GeO2/C의 EXAFS 스펙트럼의 퓨리에변환(Fourier transform). (B-C) Reproduced from ref. 94) with permission of American Chemical Society.
하지만 아직까지 정확히 어떤 촉매반응 메커니즘을 통해 전환반응 음극의 성능향상이 일어나는지 명확히 밝혀진 바가 없다. 저차원구조, 다공구조, 탄소 및 전도성 이종원소의 존재, Li2 O의 분산도 향상, Li2 O와 Ge, GeO x간의 접촉계면 확대 등의 영향이 복합적으로 혼재되어 있어 전기화학 성능향상의 원인을 촉매효과라고 단정하기에는 어려움이 따르며, 후속연구가 필요하다. 최근에는 리튬-황전지102)의 polysulfide(Li x S) 및 리튬-공기전지103)의 Li2 O2의 분해를 촉진하고 전극반응의 가역성을 높이기 위해 다양한 촉매가 전극 또는 전해질에 도입되고 있다. 타 전지시스템에서 성공적으로 적용된 촉매 연구사례는, 촉매도입전략이 전환반응 음극의 가역성 문제를 해결할 수 있는 유효한 방법이 될 수 있음을 시사한다.
4.4 선리튬화 공정(pre-lithiation process)
LIB 완전지 조립 및 성능 개선을 위해 전환반응에서의 ICE 문제를 우선적으로 해결해야한다. 선리튬화 공정은 앞서 설명한 해결책들과 달리 주로 완전지 제조에서의 성능을 향상시킬 수 있는 방법 중 하나이다. ICE 감소의 가장 큰 영향을 끼치는 원인은 첫 번째 사이클 진행 시 전해질의 분해에서 기인된 SEI층 형성과 비가역적인 Li2 O의 생성 때문이다. 이러한 음극의 비가역성은 완전지에서의 음극과 양극에서의 용량불균형으로 이어지며, 이는 완전지의 수명 성능저하 원인이 된다. 실제로 선리튬화 공정을 진행한 음극을 사용하여 완전지를 제작하였을 때, 완전지의 성능이 개선된 다양한 연구사례가 존재한다.104-112)
Liu et al.은 고용량을 갖는 음극의 ICE문제를 해결할 수 있는 간략한 방안을 제안했다.104) 이 연구팀은 음극 활물질을 전해질에 노출시킨 뒤 Li 메탈과 직접적인 접촉을 시켜 자발적인 반응(self-discharging mechanism)을 유도하였다. 실제로, 20분의 접촉을 거친 뒤 Si전극의 용량은 ~2,000 mAh g−1의 용량을 보였다. 이러한 반응은 전극의 형상에는 영향을 끼치지 않고 전지의 성능만을 효과적으로 증진시킬 수 있었다. 합금화반응을 기반으로 하는 Si전극 뿐만아니라, 전환반응을 기반으로 하는 산화철의 경우에도 비슷한 연구사례가 존재한다.105) Morales 그룹은 그래핀-Fe2 O3 복합체를 Li 메탈과의 선처리를 진행한 후 LiFePO4 양극과 완전지를 조립하여 성능을 평가하였다. 선리튬화를 진행한 완전지는 고용량(~140 mAh g−1)과 장수명특성을 보였지만, 선리튬화를 진행하지 않은 완전지는 이와 다른 용량(~40 mAh g−1) 및 수명특성을 보였다.
Li 메탈과의 직접적인 접촉을 하여 선리튬화를 진행하는 공정과 달리, Li 메탈을 상대전극으로하여 전기화학적 반응을 통해 음극의 선리튬화를 진행하는 공정도 존재한다. 이 공정은 음극 또는 양극에 관계없이 실험실규모 및 산업에서 가장 많이 사용되는 간단한 공정 중 하나이다. Hassoun et al. 은 LiFePO4(양극물질)을 Li 메탈과의 전기화학반응을 통해 4 V까지 충전(delithiation)을 진행하여 Li0 FePO4, Fe2 O3 음극은 0.3 V까지 방전(lithiation)시켜 2 Fe0 + 3 Li2 O의 형태로 변환시켰다. 이러한 선리튬화 과정을 진행한 후, 각각의 양극과 음극으로 완전지를 제작한 뒤 성능평가를 진행하여 전기화학성능이 증진됨을 확인하였다. Fe2 O3 뿐만아니라 MnO x 음극에서도 같은 선처리 공정을 통해서 전기화학성능을 개선시킨 사례가 있다. 이 연구팀은 우수한 수명특성(200 사이클 동안 82 %의 용량 유지)을 갖는 전환반응기반 완전지를 제작하여 보고하였다.
위에서 언급한 사례들과 같이, 선리튬화 공정은 완전지의 성능을 증진시킬 수 있는 유망한 방법 중 하나이다. 앞서 소개한 전환반응의 전기화학 성능을 개선시키는 공정(나노구조화, 탄소복합체, 나노촉매 도입)과 선리튬화 공정의 시너지를 통해 LIB의 성능을 극대화시킬 수 있으리라 기대된다. 하지만 선리튬화와 관련된 공정이 추가되어 전체적인 비용을 상승시키며, 아직까지 대량의 금속산화물 선리튬화를 진행할 수 있는 효율적인 방법이 부재하다는 한계를 가지고 있다.
5. 전환반응 음극 상용화 주안점
현재까지 전환반응 기반 음극의 상용화 사례는 보고된 바가 없다. 이는 전환반응 메커니즘의 특성상 본질적으로 심각한 분극현상(전압 히스테리시스)과 초기용량손실(initial capacity loss)을 가지면서, 부피 변화(100-300%)에 따른 구조 안정성 문제를 동시에 수반하기 때문이라 여겨진다. 상술한 문제들은 선리튬화과 같은 음극 활물질의 선처리(pre-treatment), 나노구조화, 전도성 탄소/금속과의 복합화, 나노촉매의 도입 등을 통해 부분적으로 해결이 가능하다. 5장에서는 전환반응 문제들이 해결된다는 가정하에, 실제 전환반응 음극이 상용화되어 시장에 진입하는데 필요한 요인들에 대해 간략하게 소개하도록 하겠다. 먼저 실리콘 음극을 기준으로하여 고용량 음극재가 가져야 할 특성과 개발 주안점을 소개하고(5장 1절), 상용화 가능성이 있는 금속산화물 음극으로 산화철(α-Fe2 O3, hematite)을 제시하여 논하도록 하겠다(5장 2절).
5.1. 실리콘 음극 개발 동향으로부터의 시사점
아직까지 전환반응의 상용화 연구가 거의 이루어지지 않았으므로, 상용화 단계에 접어든 실리콘 음극의 성능지표를 기준으로 하여 향후 전환반응음극의 상용화를 위한 주안점을 유추해볼 수 있다. 실제 완전지 제작 시 양극-음극의 용량균형이 달성되어야 하며, 이는 음극 활물질의 용량이 증가하는 만큼 양극 활물질 사용량을 증가시켜야 함을 의미한다. Fig. 12는 양극의 용량을 140 mAh g−1, 200 mAh g−1, 300 mAh g−1 으로 고정하고, 고용량 음극의 용량을 증가시켰을 때의 전체 완전지의 활물질 질량당용량 (total specific capacity) 변화를 나타낸 그래프이다.118) Fig. 12를 통해 음극 활물질의 용량 증가가 항상 완전지의 용량 증가로 이어지지 않는다는 것을 쉽게 알 수 있다. 특히, 음극 활물질의 용량을 1,000 mAh g−1 이상으로 증가시켰을 경우 전체 완전지의 용량은 더 이상 크게 증가하지 않고 거의 일정하게 유지된다. 이는 음극 활물질의 용량이 증가한 만큼 더 많은 양의 양극 활물질을 사용하여 완전지 전체의 질량이 급격히 증가하기 때문에 나타나는 현상이다. 전극제조에서는 양극 활물질 사용이 늘어남에 따라 다른 구성요소들(전해질, 도전재, 바인더)의 사용량이 함께 증가하므로, 실제 완전지의 용량은 Fig. 12 값보다 작아질 것이다. 따라서, 상용화를 위한 고용량 음극재의 현실적인 질량당용량은 약 500-1,000 mAh g−1 수준이면 충분할 것으로 판단된다. 뿐만 아니라 고용량 음극재는 필연적으로 큰 부피 변화를 수반하므로, 전극 내부에 부피 변화를 완충할 수 있는 빈 공간이 필요하다. 하지만 셀 내부의 빈 공간은 전체 부피당에너지밀도를 감소시키는 원인이 되므로 최소화하는 것이 바람직하다. 2021년 Cho 연구진은 기상화학증착방식(chemical vapor deposition)으로 5%실리콘-탄소-흑연 복합체 음극을 개발하고 상용 수준에 근접한 전극밀도와 활물질 로딩레벨을 사용하여 파우치셀/모듈/팩 및 103.2 kWh급 ESS 프로토타입까지 제작하였다.119) ESS는 110 Ah급 완전지로 이루어져있으며 2,895 사이클 이후에도 91% 용량이 유지되는 우수한 성능을 나타내어, 실리콘 음극 성능향상의 새로운 지평을 열었다.
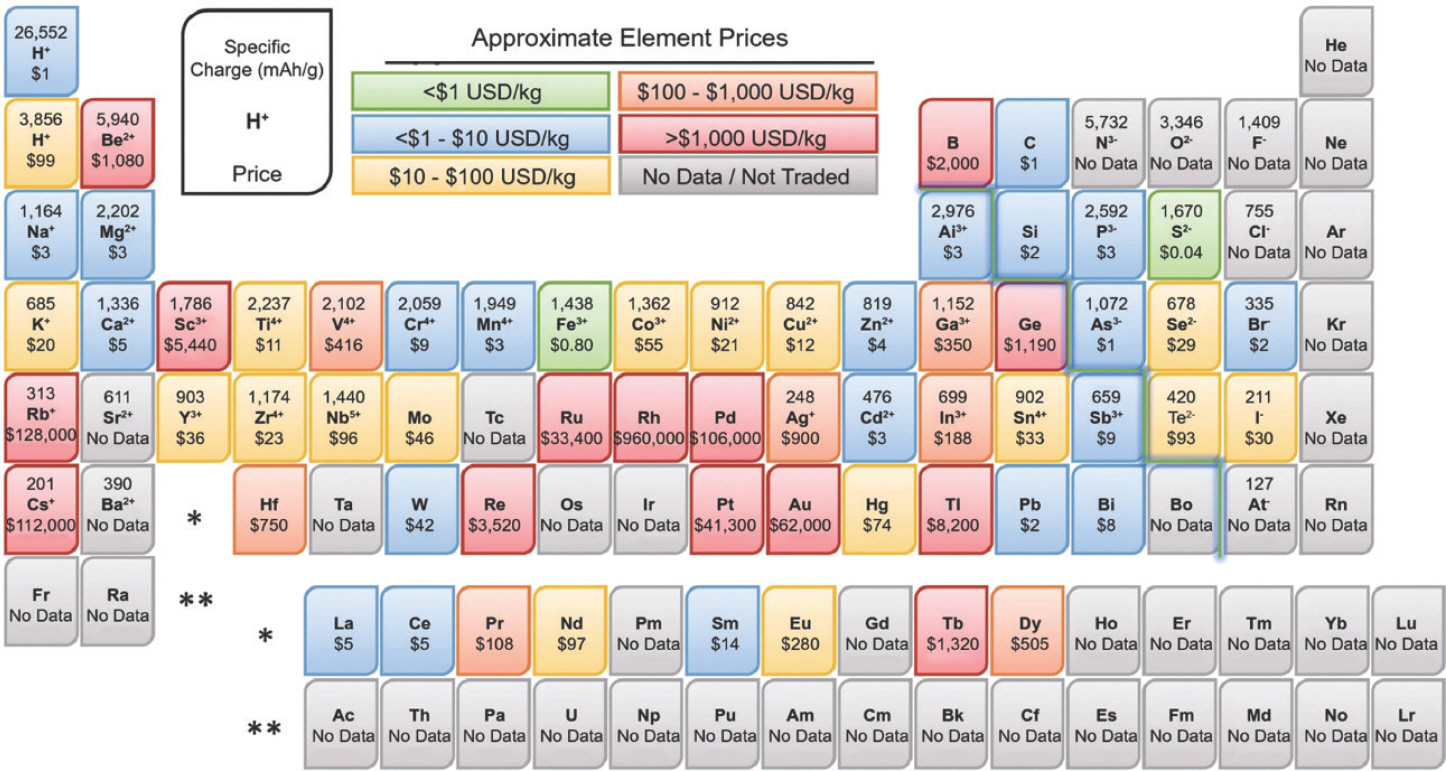
실제 상용화된 실리콘 음극의 경우 흑연 활물질에 실리콘산화물이나 실리콘을 5-10%정도 혼합/복합화하여 질량당용량을 500-600 mAh g−1 내외로 맞추어 사용하고 있다. 미국 에너지부 (Department of Energy)의 Vehicle Technologies Office (VTO)에서는 고용량 실리콘음극재와 차세대 고전압양극재를 이용하여 2028년까지 에너지밀도 달성목표로 300-400 Wh kg−1 및 800-1,200 Wh L−1를 제시하였다.121) 이를 위해 실리콘 음극재는 1,000 mAh g−1 이상의 용량과 10년 혹은 1,000 사이클 이상의 수명특성을 가져야 함을 제시하고 있다. 기존 흑연/LCO 배터리의 에너지밀도가 각각 150 Wh kg−1 와 250 Wh L−1 인 것을 고려하였을 때 매우 도전적인 성능지표라 할 수 있다. 또한 2028년까지 전기자동차 리튬이온전지 비용을 $100/kWh 이하로 낮추는 것을 목표로 하고 있다. 배터리 비용이 $100/kWh 이하로 내려가면 km 당 운행비용이 내연기관 자동차와 비슷해져 운송수단의 패러다임이 전기자동차로 급격히 이동하리라 전망하고 있다. 하지만 2022년 러시아-우크라이나 전쟁으로 인한 국제정세 불안정, 글로벌 경제성장 둔화, 원자재 가격 폭등 및 배터리수요 폭증에 따른 공급망 이슈로 인해 해당 목표가 달성될 시점이 늦춰지리라 예상된다. 이러한 문제를 해결하기 위한 하나의 대안으로 풍부한 원료와 높은 경제성을 갖는 금속산화물 음극재를 고려해볼 수 있다.
5.2 전환반응 금속산화물 후보군: 산화철
현재 전환반응 음극의 성능평가는 리튬금속을 상대전극으로 한 반쪽전지 테스트가 대부분이다. 반쪽전지의 경우 리튬금속 상대전극에서 리튬이온이 거의 무한대에 가깝게 지속적으로 공급되어 금속산화물의 부반응이나 SEI축적에도 셀 성능이 유지될 수 있으며, 오히려 경우에 따라 음극의 용량이 감소했다가 다시 증가하는 현상까지 나타난다. 실제 완전지에서는 오직 양극에서 제한된 양의 리튬이온만이 공급되며, SEI 형성에 따른 리튬이온의 손실은 곧 전체 완전지 용량의 감소로 직결된다. 즉, 반쪽전지에서 무시할 수 있는 현상들이 완전지에서는 분극 증가 및 성능저하로 이어질 수 있다. 또한 반쪽전지 테스트를 통해서는 실제 완전지에서의 평균작동전압과 전압-용량 프로필 정보를 얻을 수 없어 실용적인 성능지표(e.g., 에너지밀도)의 도출이 힘들다. 완전지의 에너지는 전극용량에 평균작동전압을 곱한 값 (E=qV)이므로, 완전지의 높은 에너지밀도 달성을 위해서는 양극과 음극의 평균 전위차 (V)를 높게 유지해야한다. 따라서, 전환반응을 포함한 고용량 음극의 상용화를 위해서는 동일한 양극을 사용하여 완전지 수준에서 성능을 비교하는 것이 필수적이나 관련 연구는 상대적으로 미비한 편이다.
다양한 전환반응 음극재 후보군 중에 다음과 같은 이유로 산화철(Fe2 O3 또는 Fe3 O4)이 가장 높은 상용화 가능성이 있다고 판단된다. 첫째, 산화철은 접근성이 높으며 원료가 풍부하여 경제적이다. Fe은 다른 전이금속 (Ni, Co, Mn, Cu, Zn 등)과 비교하여 가격이 저렴할 뿐만 아니라 리튬이온전지의 다른 구성요소(양극 활물질(Ni, Co, Mn), 집전체(Cu) 등)에 사용되지 않아 수급 안정성이 뛰어나다. 또한 기존에 사용되는 실리콘 가격의 30-40% 수준의 낮은 원료가격대를 형성하고 있어 가격경쟁력을 가질 수 있다 (Fig 13).120) 다만 실제 전극화에 필요한 제조공정비용 및 완전지 수준에서 kWh 당 가격비교검증이 필요하다. 둘째, 산화철은 높은 이론용량과 밀도를 가지고 있어 부피당용량 측면에서 흑연과 실리콘대비 비교우위를 가지고 있다. 예를 들어, Fe2 O3는 높은 질량당용량(~1,000 mAh g−1)과 높은 밀도(5.24 g cm−3)를 가지고 있다. 셋째, 산화철은 실리콘 음극보다 훨씬 작은 부피 변화율을 가지며, 이는 금속산화물 중에서도 가장 낮은 값에 속한다(Fig. 14A). 따라서 실리콘이나 다른 금속산화물 대비 부피팽창의 문제로부터 상대적으로 자유롭고 안정성이 높으리라 기대된다. 넷째, 산화철은 금속산화물 중에서 상대적으로 낮은 작동 전압(~0.7 V)을 가지고 있다(Fig. 14B). 음극 활물질의 리튬이온저장 전위가 낮을수록 전체 완전지의 평균작동전압이 높아지며 전체 에너지밀도를 향상시킬 수 있다. 하지만 여전히 흑연 (~0.15 V)이나 실리콘 (~0.30 V) 대비 높은 작동전압을 가져 에너지밀도 측면에서는 다소 불리하다. Zn와 같이 산화철과 복합체를 형성할 수 있으며 낮은 전압대(~ 0.10 V)에서 합금반응을 일으키는 이종금속을 도입하는 것이 하나의 해결책이 될 수 있다.
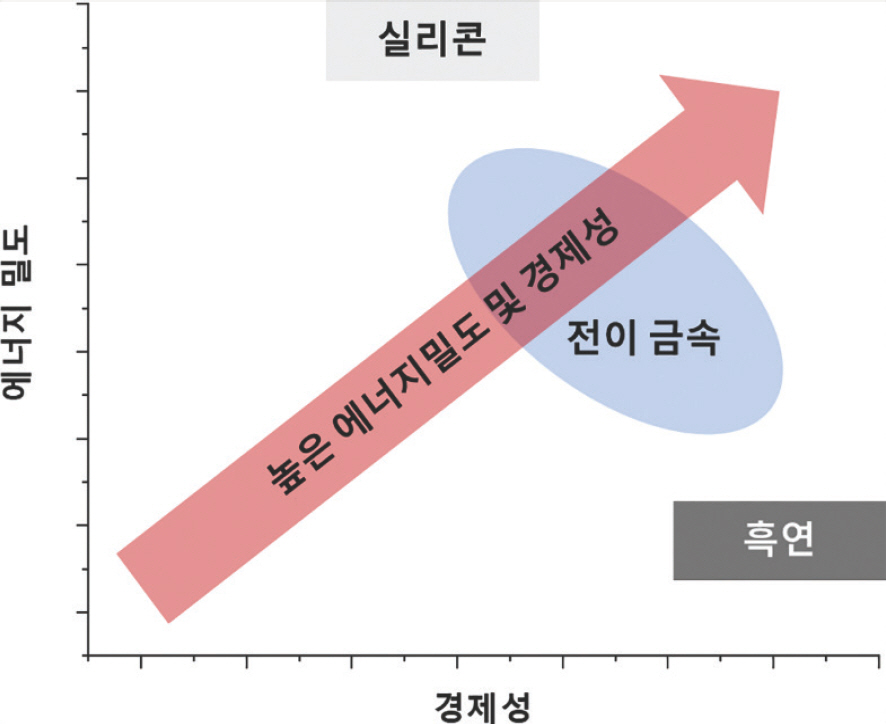
결과적으로 실제 산화철 음극의 상용화를 위해서는 전지 성능측면(예: 에너지밀도)에서는 흑연보다 우수하고 실리콘에 필적하며, 경제성 측면에서는 기존 실리콘 기반 고용량 음극재 대비 가격경쟁력을 갖춰야만 할 것이다 (Fig. 15).
6. 결론
본 총설논문에서는 전환반응기반 음극의 충ㆍ방전 시 나타나는 구조변화 및 입자의 거동, 리튬이온저장메커니즘과 전환반응 기반 음극의 당면과제 및 해결책에 대해 다루고, 나아가 상업화 가능성에 대해 논의하였다.
전환반응 금속산화물 음극 활물질은 전환반응 (식 1) 메커니즘을 통해 리튬이온을 저장하여 흑연(372 mAh g−1)대비 월등한 용량(700–1,200 mAh g−1)을 가지고 있다. 또한 금속산화물은 높은 고유밀도로 인해 실리콘에 필적하는 높은 부피당용량(4,000-5,500 mAh cm−3)을 가질 수 있다. 또한 금속산화물은 무독성이며 원료의 접근성과 경제성이 뛰어나다. 예를 들어 산화철의 경우 실리콘가격의 30-40% 수준으로 가격이 저렴하고 기존 제철/제련공정의 생산물/부산물로 접근성이 매우 뛰어나다.
이와 같은 장점에도 불구하고 금속산화물 음극 활물질 상용화에는 많은 난제가 남아있다. 실리콘대비 부피변화율은 작지만 (실리콘 300~400%), 금속산화물 역시 100%이상의 부피변화율을 동반하며 이는 실리콘과 마찬가지로 전극분쇄, 전기적 단락 발생, SEI불안정성, 낮은 초기쿨롱효율(초기용량손실) 문제가 발생함을 의미한다. 이에 더해 전환반응 자체의 열역학/동역학적 제한으로 야기되는 전압 히스테리시스 문제를 추가로 가지고 있어 기술개발 난이도가 높다. 또한 리튬이온을 저장하는 평균전압대가 흑연이나 실리콘보다 높아 완전지 수준에서 에너지밀도의 손실이 크다는 한계가 있다.
금속산화물 음극 활물질이 당면한 문제를 해결하기 위해서는 부피변화에 따른 변형 완화, 전기전도도 향상, Li2 O 분산도 및 전환반응 가역성 향상, Li2 O와 M, MO x 간의 접촉계면 확대를 통한 분극감소 전략이 필요하다. 이를 위해 나노구조화, 탄소-금속산화물 복합체 형성, 나노촉매의 도입, 선리튬화 등의 전략이 제시되었으며, 실제 괄목할만한 전기화학성능의 향상이 보고되었다. 하지만 대부분의 연구가 반쪽전지 수준의 성능평가에 그치고 있으며, 실제 상용화 가능성 평가를 위해서는 완전지 수준에서의 경제성 및 에너지밀도 비교평가가 필요하다고 여겨진다.
리튬이온전지 수요가 폭발적으로 증가함에 따라 고에너지밀도와 장수명을 갖는 리튬이온전지의 개발과 더불어 글로벌 소재 공급망 구축, 원재료 수급 안정성 확보가 중요한 이슈로 부각되고 있다. 또한 업체별 경쟁이 심화됨에 따라 배터리가격 인하에 대한 요구가 높아지고 있다. 따라서, 금속산화물 음극 활물질이 당면한 문제를 해결하고 상용 수준의 성능지표와 경제성을 만족한다면, 가격경쟁이 심화되고 용도별 요구스펙이 다변화되는 미래 이차전지 시장에서 음극 활물질의 한 축을 담당할 수 있으리라 기대된다.
Acknowledgement
이 연구는 2022년 고려아연(주)의 지원을 받아 수행되었다.
References
Biography

◉◉권민재
◉ 2022년 아주대학교 화학공학과 학사
◉ 2022년~현재 아주대학교 에너지시스템학과 석사과정

◉◉박종윤
◉ 2021년 아주대학교 화학공학과 학사
◉ 2021년~현재 아주대학교 에너지시스템학과 석박사 통합과정

◉◉황종국
◉ 2016년 POSTECH 화학공학과 박사
◉ 2018년 Max Planck Institute 박사 후 연구원
◉ 2020년 Utrecht University 박사 후 연구원
◉ 2020년~현재 아주대학교 화학공학과 조교수