다양한 광전자 응용을 위한 산화니켈 합성법
Synthesis of NiO for various optoelectronic applications
Article information
Trans Abstract
Oxide semiconductors have developed rapidly in a short period of time in various industrial fields due to their ability to be easily manufactured at low temperatures and recoverability of electrical properties. Among these oxide semiconductors, nickel oxide (NiO) is one of the most studied transition metal oxides. NiO is a p-type semiconductor with a wide band gap at room temperature, and has advantages of low toxicity, low cost, and excellent stability. Due to these advantages, NiO is widely used in various industrial fields such as gas sensors. In this paper, various synthesis methods of NiO will be briefly reviewed. Such synthesis methods include organic solvent methods, chemical vapor deposition methods, sol-gel methods, and chemical solution deposition methods. Materials required for each synthesis method, experimental methods, post-processing, and experimental results are briefly described.
1. 서론
산화물 반도체는 센서 등의 다양한 전자 장치에 많이 사용되어 왔다. 산화물 반도체는 상온에서 기계적 변형 또는 열화로 인한 전기적 특성의 복원력과 저온에서 쉽게 만들 수 있다는 특성을 가져 짧은 시간 동안 빠르게 발전해왔다. 이러한 특성으로 산화물 반도체는 최근 각광받고 있는 폴더블 스마트폰 등의 플렉서블 디스플레이에 적용될 수 있어 지속적으로 연구되어오고 있다.[1,2,3]
지금까지 대부분의 전자 장치에는 n형 반도체가 주로 사용되고 있다.[4] p형 산화물 반도체는 대부분의 산화물의 valence band가 국소화된 O 2p 궤도로 구성되어 있어 다루기가 더욱 어렵다. 이러한 결과로 정공 이동도는 전자 이동도보다 상대적으로 낮은 경향이 있으며, 이는 여러 장치에서 정공 수송 문제로 인한 성능에 영향을 준다.[5] 그러나 이러한 문제에도 불구하고 산화물 반도체는 집적 회로용 투명 CMOS, 센서 그리고 디스플레이용 정공 수송층 등의 다양한 분야에서 매우 큰 중요도를 가진다. 이러한 분야들에서 일반적으로 가장 널리 사용되고 있는 산화물 반도체로는 ZnO, SnO2, Cu2 O, NiO X 등이 있다.
산화 니켈 (NiO)은 가장 많이 연구된 전이금속 산화물 중 하나이며, 실온에서 3.6~4.0 eV의 넓은 밴드갭을 가지는 반강자성 p-type 반도체이다.[6] NiO는 독성이 낮고 저렴하며, 광학적 투명도와 안정성과 같은 우수한 특성들을 가져 많은 광학 및 전기 응용 분야에서 사용되고 있다.[7,8,9] 더 나아가 NiO는 디스플레이의 전하수송층,[10] 가스 센서의 active layer,[11] 자성 박막[12] 그리고 배터리 재료[13] 등으로 사용될 수 있어 광범위하게 연구가 진행되고 있다.
여러 가지 분야에서 사용될 수 있는 NiO 분말 및 용액은 다양한 방법으로 제조될 수 있다. 그 방법들에는 유기용매법,[14] 화학기상증착법,[15,16,17] 졸-겔법,[10,18,19] 화학용액증착법[20,21] 등 다양한 기술들이 있다. 이러한 방법들은 필요한 재료 및 도구들이 모두 다르며 각자 고유의 장점 및 단점들을 가지고 있다. 예를 들어 졸-겔법은 저온에서 사용이 가능하고 순도가 상대적으로 좋다는 장점이 있으나, 상대적으로 처리 시간이 길다는 단점이 있다.
본 논문에서는 NiO을 합성하는 다양한 방법들에 대해 소개하고 이러한 방법들을 통해 만들어진 NiO의 역할과 성능을 간략히 분석하여 NiO 합성법을 올바르게 이해하고자 한다.
2. 다양한 NiO 합성법
2.1. Organic Solvent Method
종종 다른 화학적 방식의 NiO 합성법에 경우 NiO 분말이 쉽게 응집되어 불완전한 조밀화 및 결함으로 이어진다는 단점이 있다. 이를 해결하기 위해 Guo-Jun Li 그룹은 분산성이 뛰어난 NiO 나노 분말을 합성하는 새로운 방법으로 ‘organic solvent method’를 제시했다.[14]
Organic solvent method는 다음과 같다. 질산 니켈(Ni(NO3)2·6H2 O) 및 옥살산(H2 C2 O4·2H2 O)을 각각 0.2와 1.0 M의 농도로 에탄올 용매에 용해시킨다. 이 후 질산 니켈 용액을 교반하며 옥산살 용액을 조금씩 넣어준다. 시간이 지나면 연한 파란색의 침전물이 형성되는데, 침전물을 여과한 후 에탄올로 여과액이 무색이 될 때까지 세척한 후, 최종적으로는 아세톤으로 세척하여 준다. 마지막으로 세척된 침전물을 공기 중에서 높은 온도로 1시간 동안 가열하여 NiO 분말을 얻어준다.
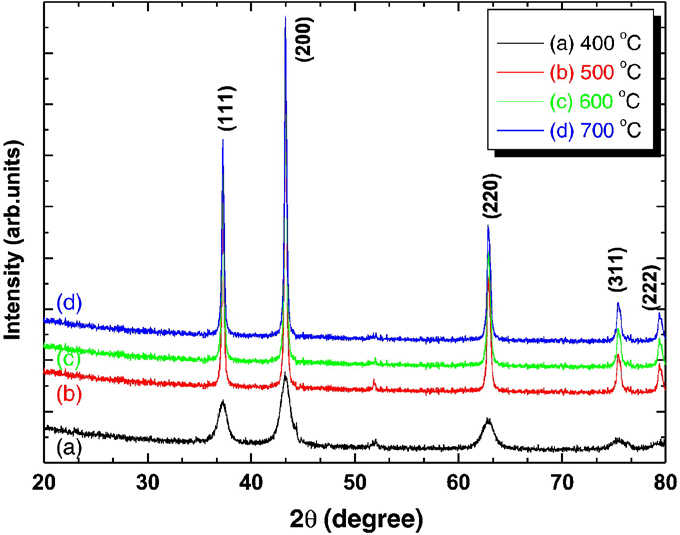
Fig. 1은 해당 방법으로 제작된 NiO 분말들의 1시간 동안 가열한 온도에 따른 XRD peak이며, 네 경우 모두 정상적인 NiO peak가 확인되었다. 또한 가한 온도가 높을수록 peak가 얇아지는 것을 확인할 수 있는데, 이는 합성된 NiO 입자 크기가 온도가 증가함에 따라 증가함을 뜻한다. 이러한 organic solvent method는 일반적으로 수용액에서 진행되는 NiO 합성과 다르게 유기 용매에서 합성이 이루어진다. 합성에 수용액을 사용할 경우 제조되는 전구체가 결정수 사이의 수소 결합을 통해 긴 체인을 형성하고 소성 과정에서 입자들이 쉽게 응집된다는 단점이 있다. 그러나 유기용매에서 합성을 진행할 경우 전구체 표면에 흡수된 에탄올이 수소 결합을 막아 응집을 억제한다. 이러한 효과로 NiO 나노 분말의 분산성을 향상시킬 수 있다. 이 효과에 관련된 메커니즘의 경우 Fig. 2에 나와 있다.
2.2. Chemical Vapor Deposition (CVD)
J. C. Berne‵ de 그룹은 perfume atomizer을 이용한 화학적 분무 열분해 (chemical spray pyrolysis) 기법으로 NiO 박막을 제작하였다.[15]
해당 기법은 다음과 같다. 글라스 기판을 깨끗하게 세척한 후 완전히 건조시킨다. 이후 기판은 NiO 박막을 형성하는데 가장 효율적인 350℃의 온도로 유지시켜준다.[22] 실험에 사용된 전구체는 총 4종류로 염화니켈 6수화물(NiCl2·6H2 O), 질산니켈 6수화물(Ni(NO3)2·6H2 O), 수산화니켈 6수화물(Ni(OH)2·6H2 O), 황산니켈 4수화물(NiSO4·4H2 O)이 전구체로 사용되었다. 이러한 용질들은 모두 재증류수(bi-distilled water)에 용해되었다. 이후 제작된 용액들은 perfume atomizer를 통해 각각의 기판이 존재하는 공기 중에 분무되었다. 분무가 완료된 기판들은 증착 후 어닐링의 영향을 확인하기 위해 425℃의 온도에서 3시간 동안 가열되었다.
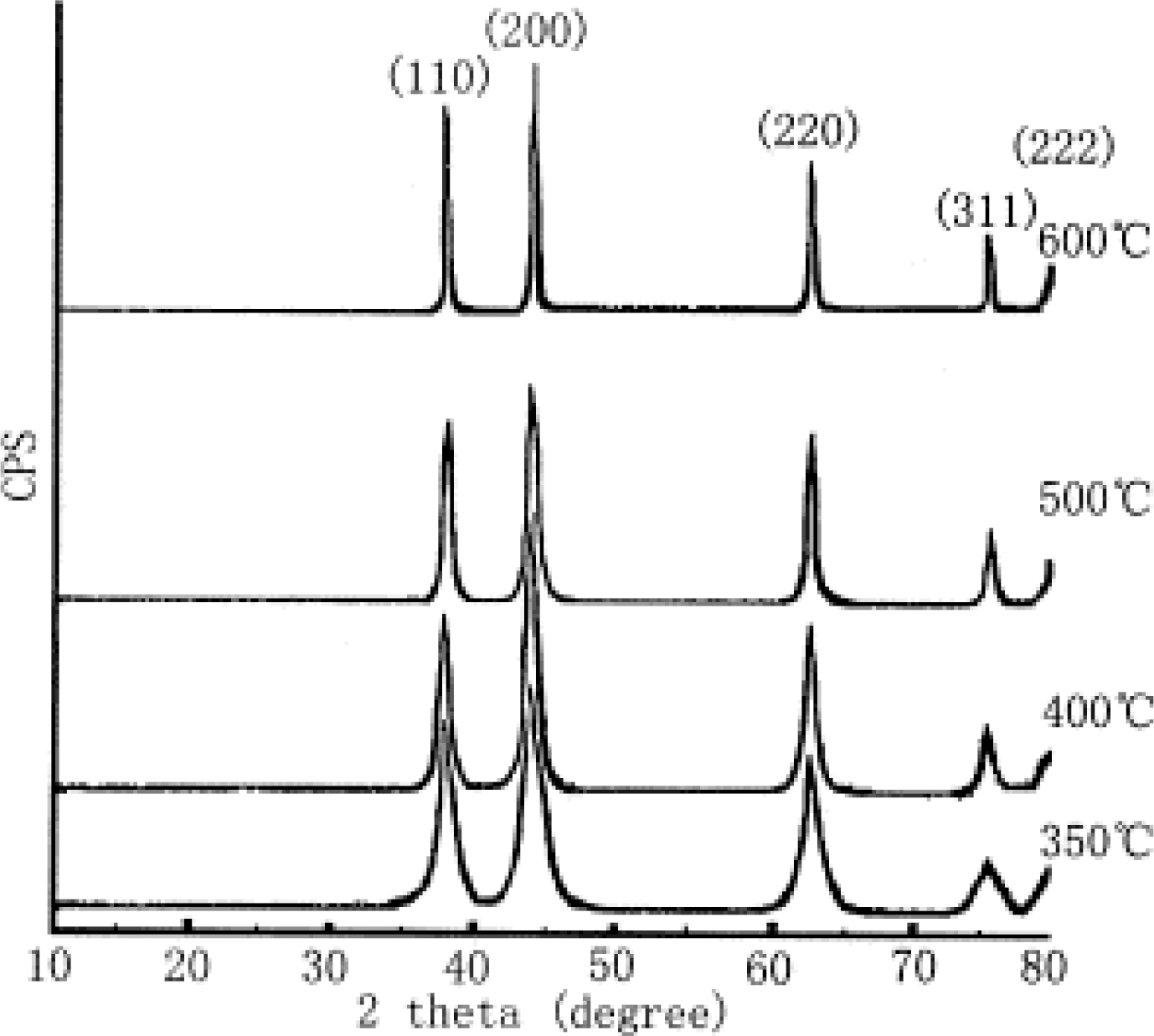
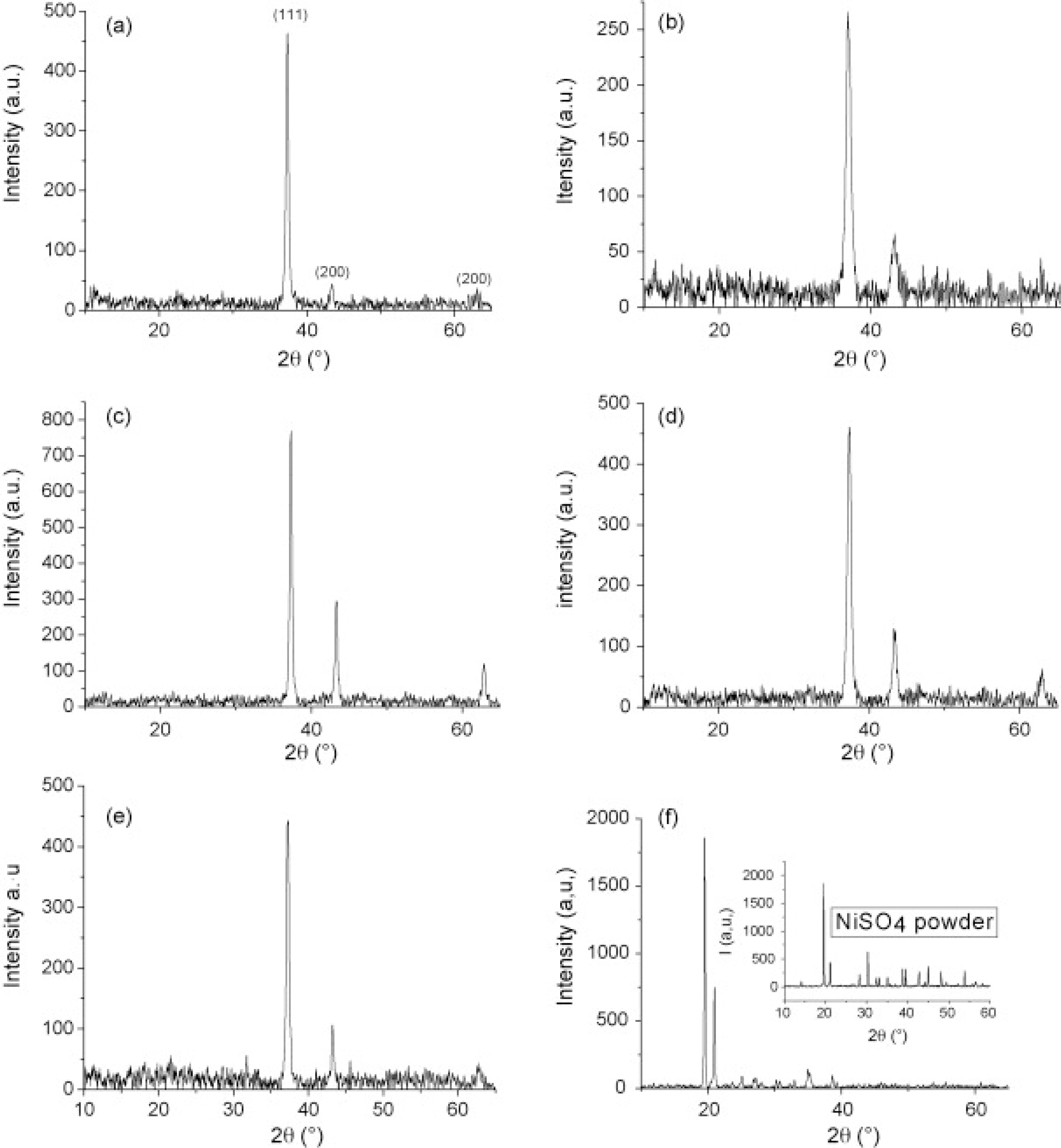
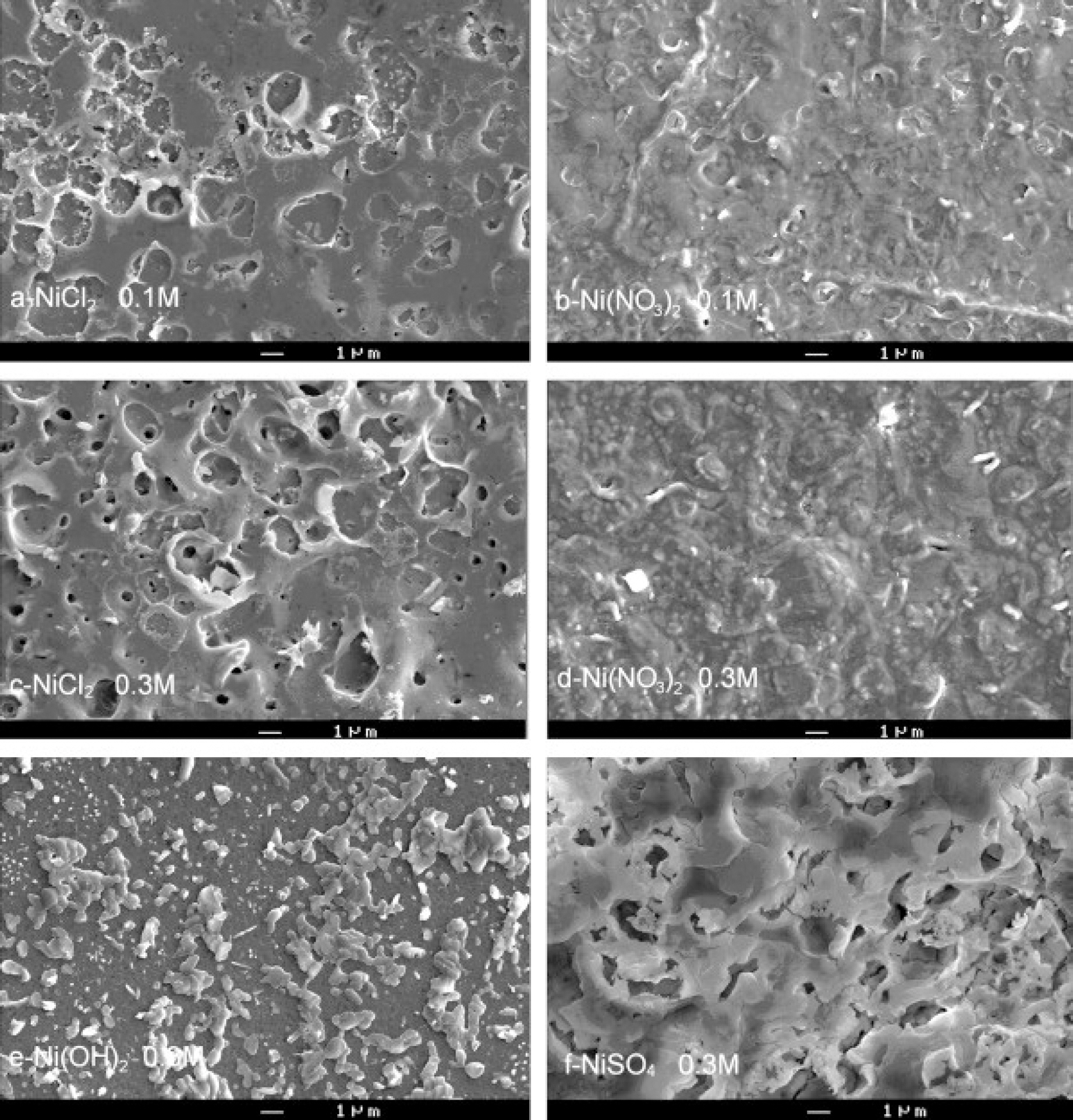
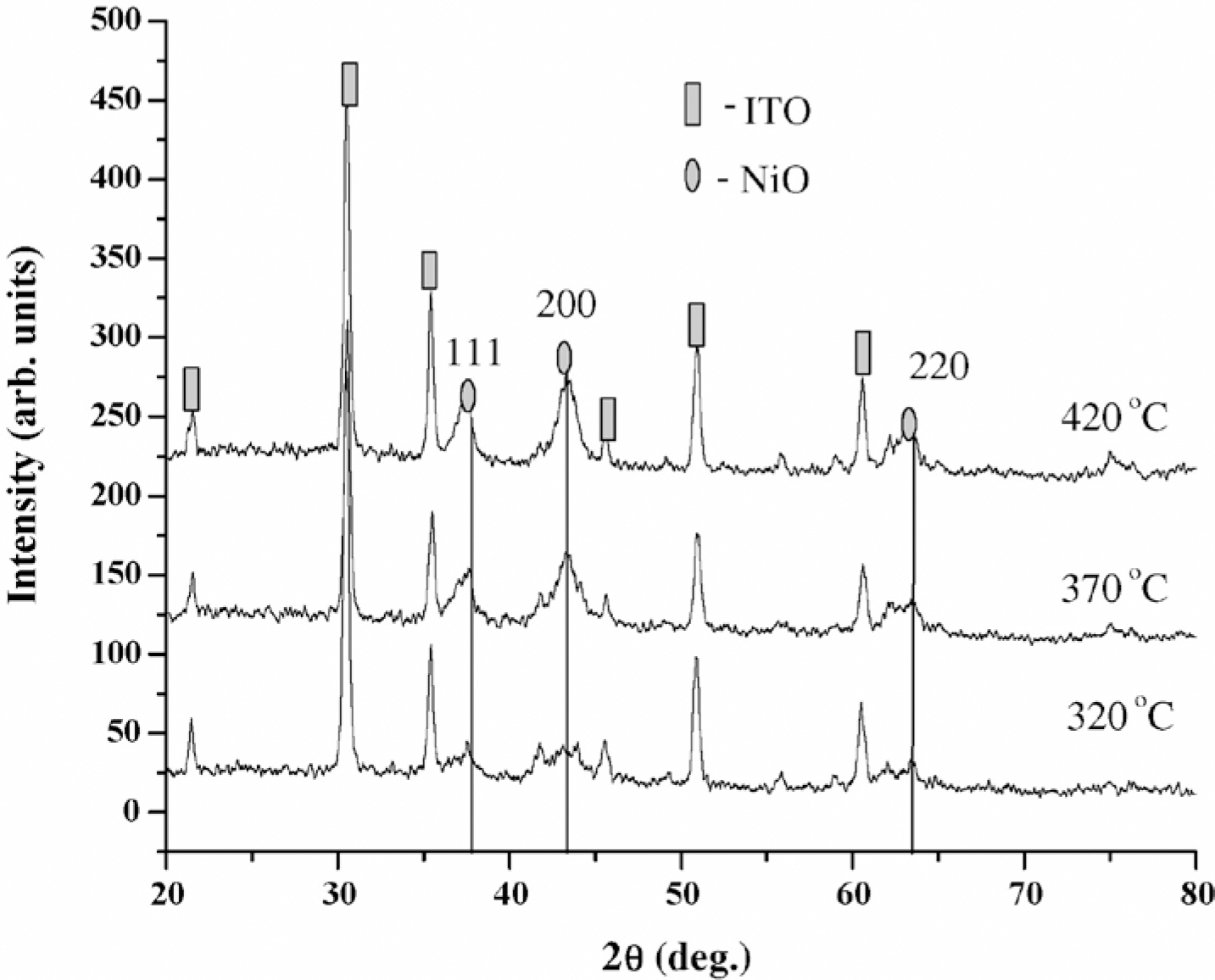
Fig. 3은 각각의 전구체 용액에 따른 XRD peak이다. Fig. 3(a)-(e)에서 확인되는 모든 peak는 입방체 NiO 상(JCPDS 04-0835)에 속한다. 그러나 Fig. 3(f)에서 볼 수 있는 peak는 NiSO4에 해당한다. 또한 Fig. 4는 각각의 전구체 용액에 따른 증착된 박막의 SEM 사진이다. NiCl2 또는 Ni(NO3)2에서 얻은 박막은 NiO 박막과 매우 유사한 측면을 가진다(Fig. 4(a)-(d)). 그러나 Ni(OH)2(Fig. 4(e))의 경우 박막이 균일하지 않고 무작위의 모양의 덩어리가 매끄러운 층에 분포되어 있다. 또한 Fig. 4(f)의 NiSO4에서 생성된 박막은 보다 조밀한 형태를 가진다. 이는 Table. 1의 EPMA 정성 연구와 잘 일치한다. 해당 표에서 확인할 수 있듯 NiCl2와 Ni(NO3)2에서 형성된 박막이 NiO의 조성과 유사하며, 나머지 두 개의 전구체는 NiO 박막이 형성되었다고 보기가 어렵다. 결론적으로 화학적 분무 열분해 기법으로 NiO 박막을 형성할 수 있는 전구체는 NiCl2·6H2 O와 Ni(NO3)2·6H2 O이며, 단순히 전구체 용액을 공기 중에 분사하고 열처리를 하는 것만으로 쉽게 NiO 박막을 형성할 수 있음을 보여준다. 또한 본 연구에서는 NiO 박막의 투과율 특성을 측정하였다. Fig. 5에서 확인할 수 있듯이 NiO 박막은 파장이 500 nm에서 1500 nm로 증가할 때 투과율이 약 40%에서 약 65%로 천천히 증가한다. 그러나 진공 조건에서 열처리할 경우 박막의 투과율이 강하게 감소한 것을 확인할 수 있다.
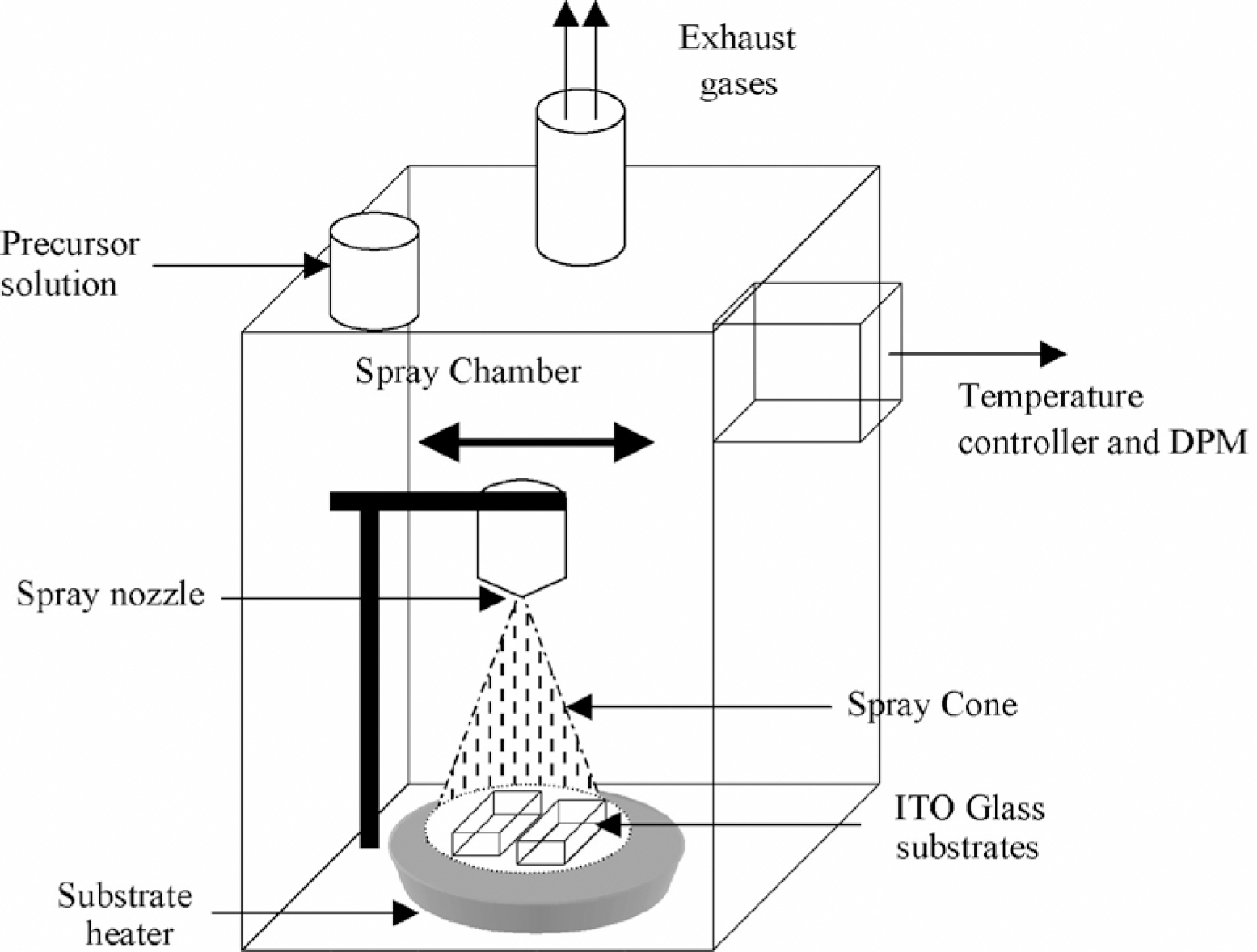
비슷하게 Oh-Shim Joo 교수 그룹은 화학적 분무 열분해 기법으로 NiO 박막을 제작하였는데,[16] 니켈 아세트산(Ni(C2 H3 O2)2·4H2 O)을 사용하였다. 니켈 아세트산은 0.1 M ~ 0.22 M의 수용액 상태로 준비되었고 나머지 실험 과정은 J. C. Berne‵ de 그룹과 같다. Fig. 6은 분무 시스템의 모식도이다.
Fig. 7은 열처리 과정에서 온도에 따른 니켈 아세트산의 분해 패턴을 보여주는 TGA 그래프이다. 특정 온도마다 관찰되는 중량 손실은 니켈 아세트산의 열분해에 대한 단계를 나타낸다. 95~150℃의 온도에서 발생한 첫 번째 체중 감소는 탈수에 해당한다. 약 33.42%의 중량이 감소하였다. 반응식은 다음과 같다.
250~345℃의 온도에서 약 38.55%의 중량이 감소하는 두 번째 단계는 니켈 아세트산의 분해로 인해 발생한다. 반응식은 다음과 같다.
이러한 분해 패턴의 결과로 약 350℃의 온도에서 NiO 박막이 형성되는 것을 확인할 수 있다. 이러한 관찰을 고려하여 박막 합성을 위한 기판의 온도는 330~420℃의 범위에서 채택되었다. 이렇게 형성된 NiO 박막은 Fig. 8의 XRD 결과에서 정상적인 NiO peak로 확인되었다.
Shi-Woo Rhee 그룹은 금속 유기 화학 기상 증착(MOCVD) 방법을 활용해 니켈 아세트산(Ni(C5 H5)2)을 NiO 박막으로 합성하였다.[17] MOCVD는 낮은 공정 온도에서 낮은 결함 밀도로 조밀하고 접착력 있는 박막을 형성할 수 있다는 장점이 있어 NiO 박막을 제조하기에 유망한 방법이다. 합성에는 상온의 고체인 Ni(C5 H5)2를 원료로 사용하였고, 전구체의 승화 장치 온도는 60℃로 일정하게 유지하였다. 이 온도에서 전구체의 증기압은 0.15 torr이다. 반응 전 조기 분해를 방지하기 위해 Ni(C5 H5)2를 Ar에서 승화시킨 다음 반응기 직전에 산소와 혼합하였다. NiO 박막의 증착은 200~500℃의 온도 범위로 100 torr에서 수행되었다. 승화 장치를 통한 Ar 캐리어의 유속은 30 sccm이고 O2의 유속은 1~500 sccm 범위에서 진행되었다.
Fig. 9는 NiO 박막의 XRD 패턴을 보여주며 37.3°, 43.3°, 44.5°, 51.8°의 피크는 각각 NiO와 Ni막의 (111), (200) 평면에 해당한다. Fig. 9(a)는 1 sccm의 O2 유량으로 증착된 NiO 박막이 결정질 Ni을 포함하고 있음을 보여준다. 또한 증착 온도가 증가함에 따라 결정질 Ni의 peak가 NiO의 peak보다 더 많이 증가하였다. 이는 리간드의 산화 속도가 빠르고 산소가 소모되어 고온에서 Ni 성분의 산화 속도가 느리다는 것을 의미한다. Fig. 9(b),(c)는 O2 유량이 증가함에 따라 결정질 Ni이 사라졌음을 보여준다. 전체적으로 낮은 증착 온도 영역(<275°C)에서 증착된 NiO 박막은 표면 에너지가 가장 낮은 (200)면으로 우선 배향되었다. 이 경우 증착 속도는 표면 화학 반응에 의해 결정된다. 높은 증착 온도 영역(>275°C)에서 증착된 NiO 박막은 (111)면으로 우선 배향되며, 이는 (111)면이 가장 낮은 변형 에너지를 가진다는 것을 뜻한다. 이 경우 증착 속도는 기판 표면으로 반응물의 이동 반응에 의해 결정된다.
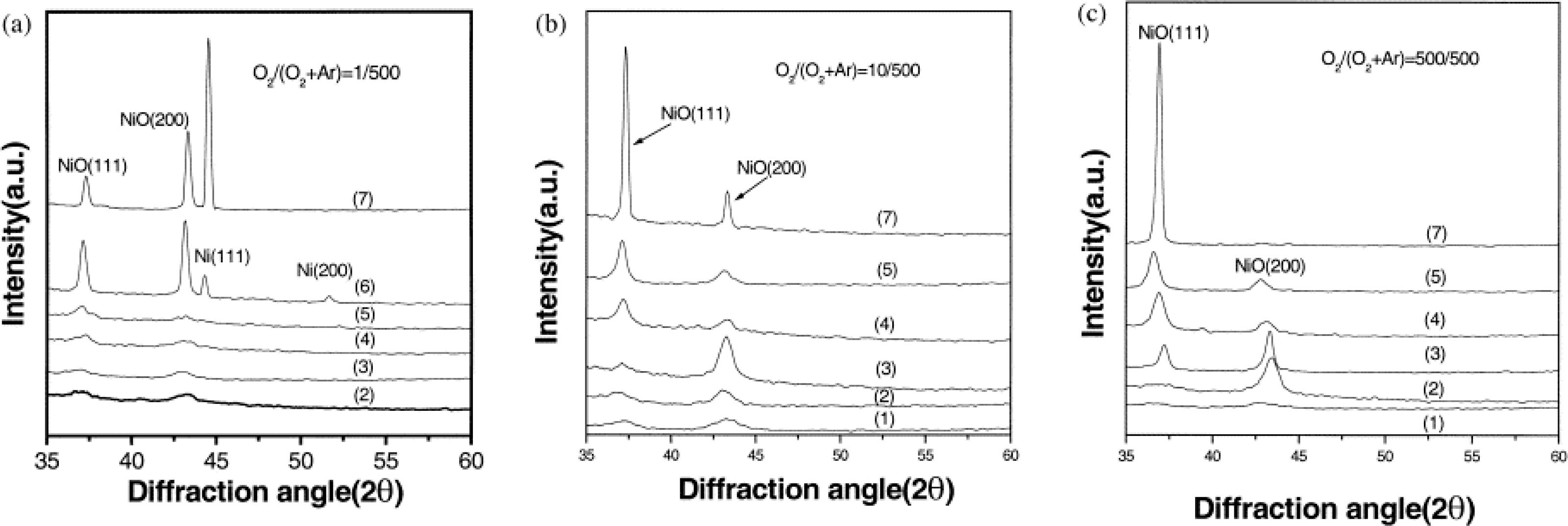
증착 온도에 따른 NiO 박막의 XRD 패턴: (a) O2/(Ar + O2) = 1/500 sccm; (b) O2/(Ar + O2) = 10/500 sccm; (c) O2/(Ar + O2) = 500/500 sccm; (1) T = 200℃ (2) T = 225℃ (3) T = 250℃ (4) T = 275℃ (5) T = 300℃ (6) T = 400℃ (7) T = 500℃ Adapted from Kang et al. Thin Solid Films 2001;391:57-61, with the permission of Elsevier Science.[17]
2.3. Sol-Gel 법
Douglas J. Taylor 그룹은 sol-gel 방법을 활용하여 TiO2-NiO 윤활 필름을 제작하였다.[18] Ni의 산화물들은 낮은 마찰 계수를 가진다. 이로 인해 기계 엔진 등에서 마찰과 마모를 막아주는 윤활제로 활용되기도 한다. 연구에서는 니켈 아세트산 4수화물(Ni(C2 H3 O2)2·4H2 O)과 질산을 활용하여 NiO을 합성하였다. 먼저 니켈 아세트산을 에탄올에 혼합하였다. 그 다음 충분한 양의 진한 질산을 혼합하여 니켈 전구체를 완전히 용해시켰다. 니켈 아세트산의 완전한 용해에는 최소 12시간 이상의 시간이 필요하다. 이후 필요에 따라 다른 금속들을 첨가하여 원하는 최종 산화물 조성을 얻었다.
Fig. 10은 TiO2-NiO 윤활 필름의 XRD peak를 나타낸다. TiO2와 NiO은 50:50의 중량비를 가지며 여러 peak들 중에서 NT는 NiTiO3를, R은 TiO2를 나타내며 B는 NiO를 나타낸다. 이러한 결과에 따라 니켈 아세트산을 질산을 활용하여 잘 용해시키는 것으로 NiO를 합성할 수 있음을 확인할 수 있다.
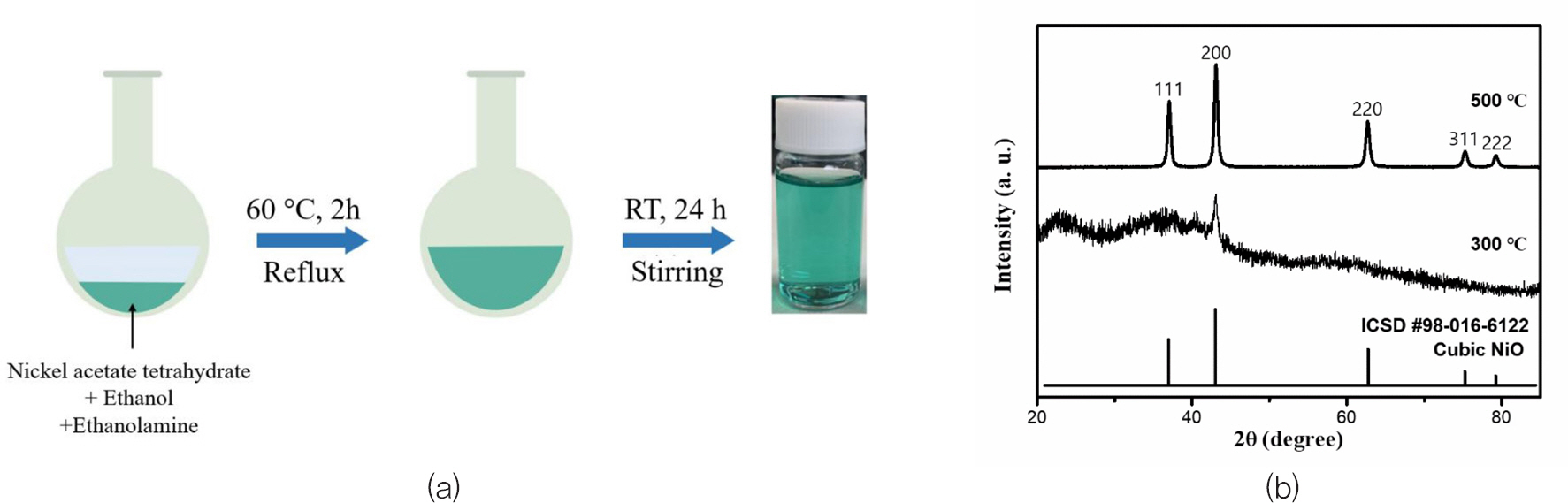
J. Kim 또한 sol-gel 방법을 활용하여 NiO 를 합성하였다.[10] 이 경우 니켈 아세트산 4수화물(Ni(C2 H3 O2)2·4H2 O)과 에탄올아민(NH2 CH2 CH2 OH)을 활용하였다. 에탄올에 니켈 아세트산과 에탄올아민을같은 몰수만큼 넣어준다. 만들어진 용액을 60℃의 온도에서 2시간 동안 잘 교반한 후 상온에서 24시간 동안 추가로 교반한다. 마지막으로 교반이 완료된 용액을 0.45 μm 크기의 polytetrafluoroethylene(PTFE) 필터로 여과하여 NiO 용액을 완성하였다.
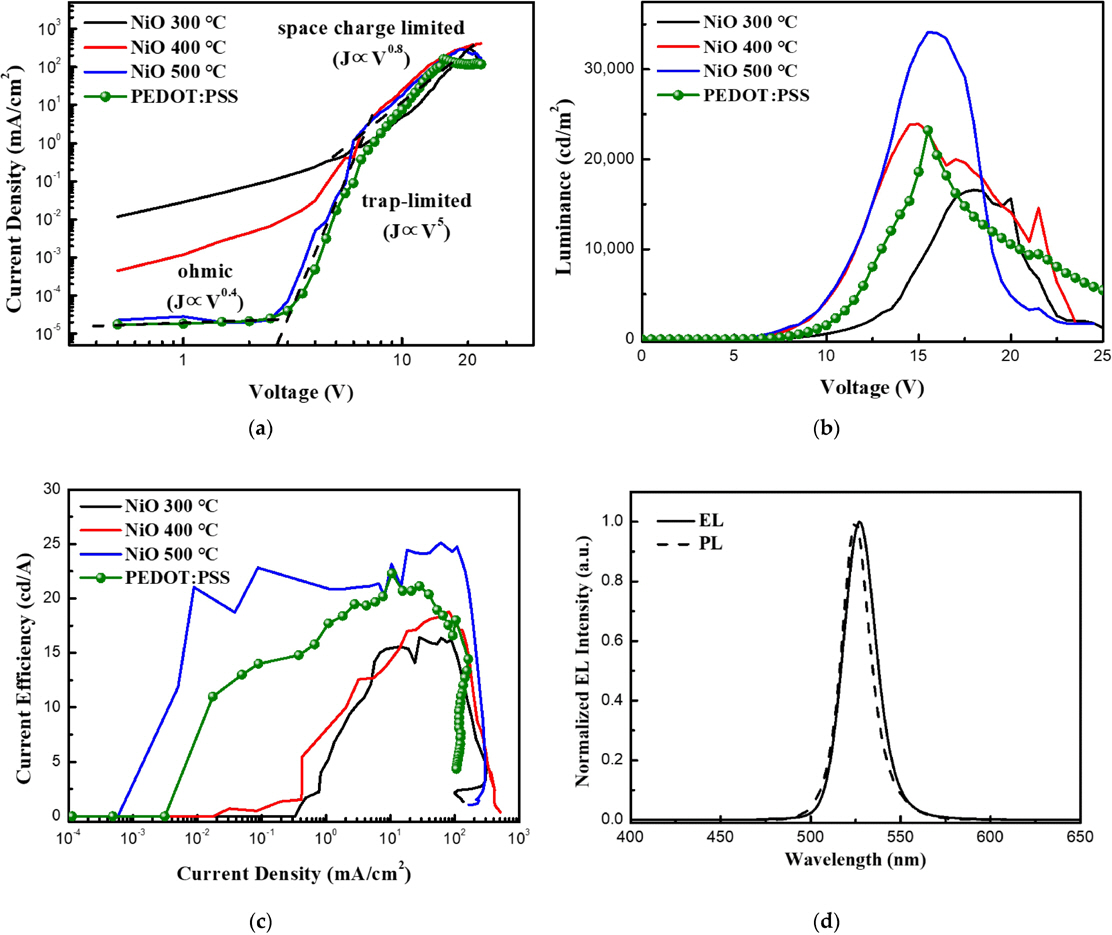
Fig. 11(a)는 sol-gel 방법을 활용한 NiO 합성법의 간단한 모식도이다. 이러한 합성법으로 청록색의 투명한 NiO 용액을 제작할 수 있다. Fig. 11(b)는 1시간 동안 진행된 열처리 온도에 따른 NiO 용액의 XRD peak 이다. 그래프에서 확인할 수 있듯이 합성된 NiO 용액은 500℃ 이상의 온도에서 열처리를 가하였을 때 정상적인 결정질의 NiO peak를 확인할 수 있다. 그 이하의 온도에서는 결정질 NiO peak의 일부가 관찰되나 전체적으로는 아직 비정질의 형태를 가지는 것을 확인할 수 있다. 본 논문에서는 sol-gel 방법으로 만들어진 NiO를 QLEDs(Quantum dot Light-Emitting Diodes)의 정공주입층으로 활용하였다. Fig. 12는 다른 온도에서 열처리된 NiO 박막의 QLEDs 소자 특성을 보여준다. 열처리 온도가 증가함에 따라 전기적 특성과 휘도가 모두 개선됨을 확인할 수 있다. Fig. 12(a)에서는 높은 온도에서의 열처리가 Ohmic 영역에서 발생하는 누설 전류를 크게 감소시킨다는 것을 확인할 수 있다. Fig. 12(b),(c)에서는 500℃에서 열처리된 NiO 박막을 가진 QLEDs 가 15.5 V에서 최고 휘도 34,125 cd/㎡를 가지고 25.1 cd/A의 최고 효율을 가지는 것을 확인할 수 있다. Fig. 12(d)는 QD 용액의 PL 피크와 소자의 EL 피크의 모양과 피크 위치에 큰 차이가 없다는 것을 보여준다.
V. B. Patil 그룹 역시 sol-gel 방법을 활용하여 NiO 를 합성하였다.[19] 이 그룹 또한 니켈 아세트산 4수화물(Ni(C2 H3 O2)2·4H2 O)을 활용하였다. 니켈 아세트산 3.332 mg을 메탄올 40 mL에 첨가하고 60℃에서 1시간 동안 격렬하게 교반하여 연녹색 분말을 형성한다. 완성된 분말을 공기 중에서 1시간 동안 400~700℃의 범위의 온도로 소결하여 다양한 결정 크기를 가지는 NiO를 얻는다. 니켈 아세트산과 메탄올과의 반응은 다음 메커니즘을 따른다.
이후 1시간 동안의 소결 과정에서의 반응식은 다음과 같다.
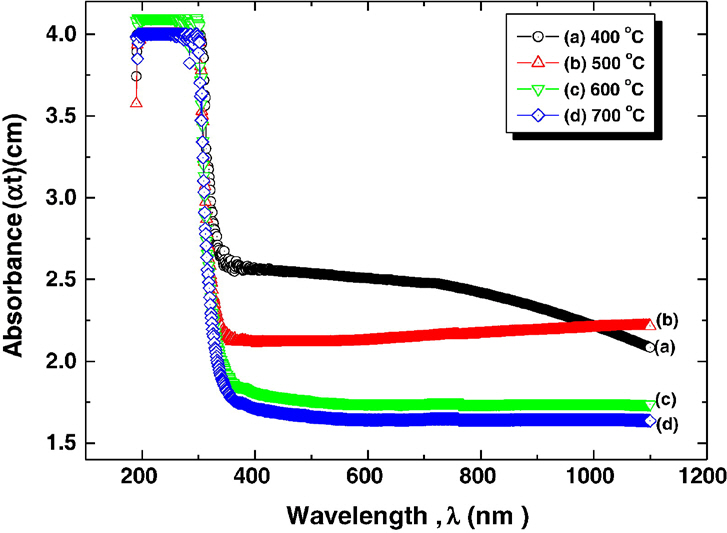
Fig. 13은 소결 온도에 따른 NiO 분말의 XRD 그래프이다. 그래프에서 확인할 수 있듯이 소결 온도가 높아질수록 XRD peak가 날카로워지는데 이는 소결 온도가 증가함에 따라 NiO의 결정성이 상승한다는 뜻이다. Fig. 14는 소결 온도에 따른 NiO 박막의 FESEM 사진이다. 사진에서 NiO은 나노결정질 입자로 구성되어있음을 알 수 있다. 또한 소결 온도가 증가함에 따라 NiO의 형태가 조밀하고 매끄러우며 균일해짐을 알 수 있다. 본 연구에서는 또한 400~700℃ 범위에서 열처리된 NiO 박막에 대한 200~1000 nm 범위의 광흡수 실험을 진행하였다. Fig. 15는 각기 다른 온도에서 열처리된 NiO 박막의 광흡수 스펙트럼을 보여주고 있으며, 적외선과 가시광선 영역에서 광자 에너지에 대한 흡수 계수는 매우 낮은 반면 자외선에 가까운 영역에서는 흡수 계수가 급격히 증가하는 것을 알 수 있다. 어닐링 온도가 증가함에 따라 박막의 흡수 계수가 증가하는 것을 확인할 수 있는데, 이것은 열처리 온도가 증가함에 따라 홀의 상태 밀도가 증가하기 때문이라고 유추된다.
2.4. Chemical solution deposition
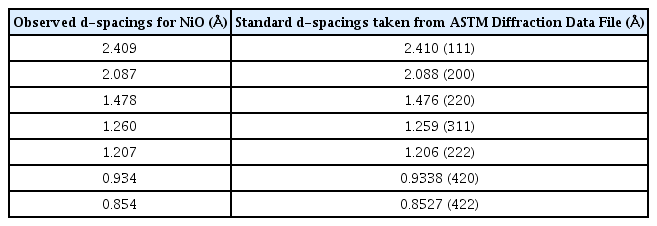
P. Pramanik과 S. Bhattacharya는 최초로 화학용액증착법을 활용하여 NiO 박막을 형성하였다.[20] 40 mL의 황산니켈 용액(1 M), 30 mL의 과황산칼륨 용액 (0.25 M), 그리고 10 mL의 암모니아(14 M)를 잘 섞어준 후 증류수를 넣어 용액이 100 mL가 되도록 한다. 더 교반한 후 유리 기판이 세로로 고정된 비커에 조심히 용액을 부어준다. 이 때 용액의 색은 점차적으로 검은색으로 변한다. 약 1시간 후에 유리 기판을 용액에서 꺼내 증류수로 세척하고 진공 조건에서 건조시킨다. 이렇게 완성된 NiO 박막의 두께는 275 nm 이다. Table. 2에서 직접 합성한 NiO 박막의 d-간격과 ASTM 회절 데이터 파일에서 가져온 표준 d-간격이 잘 일치함을 확인할 수 있다.
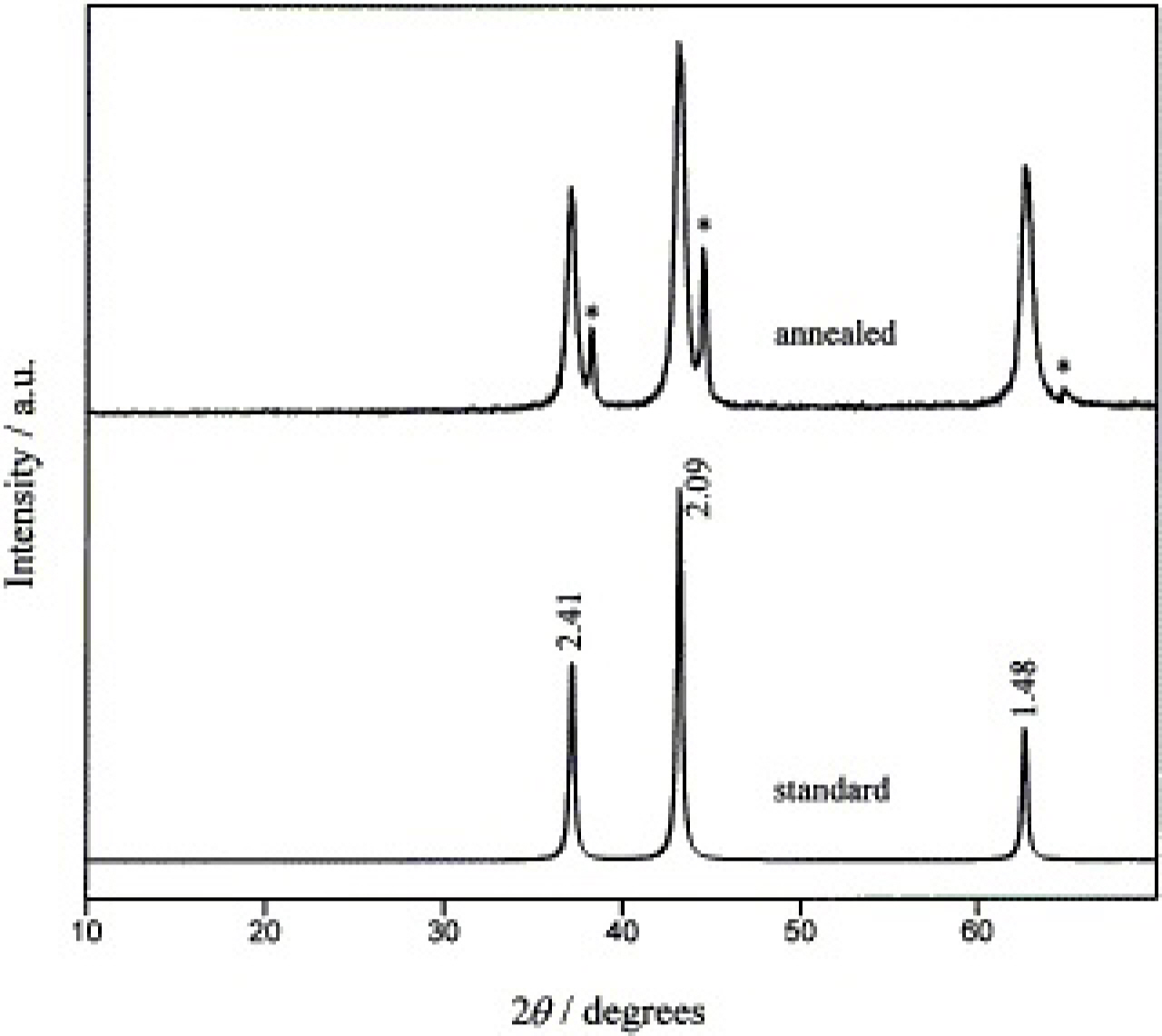
B. Pejova 그룹 또한 화학용액증착법을 활용하여 NiO 박막을 형성하였다.[21] 50 mL의 질산니켈 용액(1 M)과 25 mL의 urea 용액(1 M)을 혼합하고 탈이온수를 총 부피가 100 mL가 될 때까지 넣어준다. 이 때 용액의 pH는 6이었다. 세척된 기판을 용액이 담긴 비커에 수직으로 조심히 넣어준다. 이후 100℃에서 약 2시간 동안 가열해준다. 이 때 비커 바닥에는 3Ni(OH)2·2H2 O 침전물이 형성된다. 기판 양면에는 동일한 물질이 균일하게 증착되어있다. 증착된 박막을 탈이온수로 세척하고 약 48시간 동안 350~450℃의 온도에서 열처리해준다. Fig. 16에는 표준 자료와 함께 350℃에서 열처리된 NiO 박막의 XRD 데이터를 보여준다. 이러한 결과를 통해 기판에 정상적으로 NiO 박막이 형성된 것을 확인할 수 있다.
3. 결론
다양한 분야에서 넓은 가능성을 가진 산화물 반도체의 지속적인 연구와 개발은 필수적인 과제이다. 본 연구에서는 이러한 산화물 반도체 중 가장 널리 쓰이는 NiO의 여러 가지 합성법에 대하여 소개하고, 각각의 합성법이 가지는 특징과 성공적인 합성 결과에 대해 설명하였다. 특히 유기용매법, 화학기상증착법, 졸-겔법 그리고 화학용액증착법 등 총 네 가지의 합성법을 소개하였다. 유기용매법에 경우 NiO의 합성 시 유기 용매를 주재료로 사용하여 기존의 수용액으로 합성한 NiO의 단점인 쉽게 응집되는 특성을 제어하였다. NiO의 최종 형태는 분말이다. 화학기상증착법에 경우 다양한 Ni 전구체들을 공기 중에 분사하는 것만으로 쉽게 NiO를 합성할 수 있었다. 이 경우 NiO의 최종 형태는 박막이다. 졸-겔법에 경우 특별한 장치 없이 비교적 저렴하게 NiO를 합성할 수 있었다. 이 때 NiO의 최종 형태는 용액이지만 후에 열처리 과정을 통해 분말의 형태로도 NiO를 얻을 수 있다. 마지막으로 화학용액증착법에 경우 또한 특별한 장치 없이 NiO 박막을 합성할 수 있었다. 박막을 형성하기 위한 다양한 장비들을 생각해보면 이는 매우 특별하다.
각각의 합성법들은 고유의 특징들을 가지며 장단점들이 존재한다. 그에 따라 실험을 진행하기 전 개인의 연구실 혹은 실험실에서 보유하고 있는 장비, 가지고 있는 재료 및 각자의 사정들을 충분히 고려하여 본인에게 잘 맞는 합성법을 선택하는 것이 중요할 것이다. 앞서 소개한 네 가지의 합성법 외에도 NiO 합성법은 더 다양하게 존재하며 앞으로도 지속적으로 연구 및 개발될 것으로 판단된다. 나아가서 이러한 합성법들은 NiO 뿐만 아니라 다른 산화물 반도체에도 적용될 수 있기 때문에 더욱 더 발전하게 될 산화물 반도체 시장에서 다양한 방면으로 활용될 수 있을 것으로 기대된다.
References
Biography

◉◉김지완
◉ 1998년 연세대학교 세라믹공학과 학사
◉ 2000년 연세대학교 세라믹공학과 석사
◉ 2008년 University of Wisconsin-Madison 의공학과 박사
◉ 2009~2016년 KETI 디스플레이 연구센터 선임연구원
◉ 2016년~현재 경기대학교 신소재공학과 조교수, 부교수

◉◉김정호
◉ 2022년 경기대학교 신소재공학과 학사
◉ 2022년~현재 경기대학교 신소재공학과 석사과정