친환경 비납계 페로브스카이트 기반 발광 다이오드의 연구 동향
Recent Progress of Eco-friendly Lead-free Halide Perovskite Light-Emitting Diodes
Article information
Trans Abstract
Metal halide perovskites (MHPs) are promising candidate materials for next-generation optoelectronic device applications such as light-emitting diodes (LEDs), solar cells, and photodetectors. However, the toxicity and poor stability issues of lead-based MHPs (LHPs) are still challenging to fulfill a restriction of hazardous substances directive (RoHS) and industrial standards for the commercialization of LHP devices. Therefore, eco-friendly and lead-free halide perovskites (EHPs), which are superior to LHPs, should be developed. In this review, we will review the promising strategies to substitute a lead cation with non-toxic metal cations such as tin (Sn), bismuth (Bi), antimony (Sb), and copper (Cu), and discuss the synthetic methods, crystal structures, luminescent properties, and their LED applications.
1. 서론
일반적으로 알려진 금속 할로겐화 페로브스카이트 (metal halide perovskites, MHPs)는 ABX3 결정구조를 가지는 화합물로써 A자리에 유기 또는 무기 1가 양이온, B자리에 금속 2가 양이온, X자리에 할로겐 1가 음이온으로 구성된다.[1,2] 특히, B자리에 납 양이온 (lead cation, Pb2+)이 사용된 경우 납 할로겐화 페로브스카이트 (lead halide perovskites, LHP)라고 부르며, 긴 전하 확산 거리 (carrier diffusion length), 높은 전하 이동도 (charge carrier mobility), 높은 결함 허용 특성 (defect tolerance) 및 우수한 광물리적 특성 (photophysical property)을 가지고 있어 발광 다이오드 (light-emitting diodes, LEDs), 태양 전지 (solar cells), 광 검출기 (photodetectors) 등의 다양한 광전 소자 (optoelectronic device) 분야에 응용 가능한 차세대 광전 소재로 많은 주목을 받고 있다.[3–6] 특히, 용액 공정 용이성, 높은 색순도 (color purity), 발광 파장 조절의 용이성, 높은 발광 효율, 합성 용이성, 저비용의 장점들로 인해 차세대 LED를 위한 발광 소재로 많은 연구자들과 관련 산업 분야에서 주목하고 있다.[7,8]
하지만, LHP 소재에 포함된 Pb는 물에 잘 용해되기 때문에 실생활 사용 중 또는 사용 후 폐기되는 과정에서 사람과 자연에 노출되면서 큰 환경적 문제를 야기할 수 있으며, 강한 독성으로 인해 체내에 축적되어 현기증, 구토, 불면증을 비롯한 혼수, 경련 등의 심각한 증상이 발생할 위험이 있다. 유럽 연합에서 지정한 유해 물질에 대한 Restriction of Hazardous Substances (RoHS) 규정에서는 이러한 Pb의 유해성으로 인해 전자 장치가 포함하는 Pb의 최대 용량을 1000 ppm으로 제한하고 있다.[9] 이에 따라 페로브스카이트 소재 기반 소자들의 상용화를 위한 친환경 비납계 할로겐화 페로브스카이트 (eco-friendly, lead-free halide perovskites, EHP)의 개발은 산업적으로 큰 주목을 받고 있다. 따라서, 고효율 및 고안정성 EHP 소재 개발은 학문적인 중요성뿐만 아니라 차세대 조명 및 디스플레이 산업을 포함한 광전 소자 응용 분야에서 매우 의미 있는 연구이다.
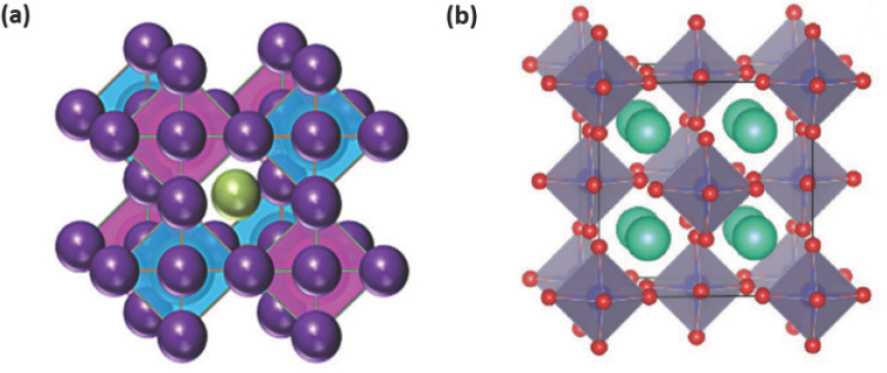
기존 LHP는 ABX3 구조에서 B자리에 위치한 Pb2+ 이온은 6개의 X자리 할로겐 음이온과 배위 결합을 하며 [PbX6]4- 팔면체를 형성하고, A자리 양이온을 가진 모서리 공유 팔면체 (corner-shared octahedra)가 연속적으로 배열된 대칭적인 페로브스카이트 구조를 가지게 되며, EHP 소재는 B자리 양이온의 구조적, 전자적 특성을 고려함으로써 기존 LHP의 Pb를 대체할 수 있다. Pb를 대체할 수 있는 원소를 선택할 때 반드시 고려해야 하는 것은 이온 반경 (ionic radius) 및 전하 중성 (charge neutrality)이다. 주석 (Sn)은 이러한 전제 조건을 충족하기 때문에 등가 원소 치환 방법 (homovalent substitution)으로 Pb를 대체하기에 적합하다.[10] 즉, Sn2+ 이온은 Pb2+ 이온과 동일한 원자가를 가지며, 비슷한 이온 반경 (Sn2+: 1.35 Å, Pb2+: 1.49 Å)을 가지므로 이온 반경 차이로 인한 격자 진동을 줄여 안정적으로 치환이 가능하다.[11]
또한, Pb는 이가 원소에 의해 치환 (heterovalent substitution)이 가능하며, 크게 2가지 방법으로 EHP 를 형성한다. 첫번째 유형은 2개의 Pb2+를 단일의 3가 또는 1가 양이온으로 치환하는 형태로써, Pb와 유사한 lone-pair 6s2를 가지면서 낮은 독성을 가지는 3가 양이온 원소로는 비스무트 (Bi)와 안티모니 (Sb)가 대표적이다. 이 경우 Bi와 Sb가 각각 B자리에 사용될 때 Bi3+와 Sb3+ 이온으로 형성되는데 과잉 전하로 인한 균형을 맞추기 위해 B자리의 2/3만 차지하는 결정 구조를 가져 A3 B2 X9 구조가 형성됨을 확인할 수 있다.[12] 그리고 Pb 를 단일의 1가 양이온으로 치환하여 형성되는 A3B2X5 또는 AB2 X3 구조가 있고, 구리 (Cu)가 대표적이다.[13] 두번째 유형은 Pb2+ 이온 2개를 하나의 B+ 이온과 하나의 B3+ 이온으로 대체하는 형태로써, B자리의 양이온이 2가지로 구성 (2B2+ → B+ + B3+)되어 있는 이중 페로브스카이트 (double perovskite)가 형성되는 것이 대표적이다. 생성된 페로브스카이트는 A2 B(I)B(III)X6 형태의 결정 구조를 가지며, B자리에 대체된 두 양이온들의 평균 이온 반경을 고려하여 선택할 수 있다.[14]
따라서 본 리뷰 논문에서는 LHP의 Pb2+를 효과적으로 대체한 EHP 소재 개발의 2가지 방법으로, (1) Pb2+와 같은 원자가를 가지는 2가 양이온으로 대체하는 등가 원소에 의한 Pb 대체 방법 및 (2) 1가 및 3가 이온 그리고 이중 양이온으로 대체하는 이가 원소에 의한 Pb 대체 방법으로 분류하여 합성 방법, 구조적 특성 그리고 광전기적 특성과 이를 기반으로 하는 EHP 기반 LED (EPeLED)에 대한 최신 연구 동향을 살펴보고자 한다.
2. 등가 원소에 의한 Pb 대체 방법 (homovalent substitution)
2.1. 주석 (Sn) 기반 페로브스카이트
Sn은 주기율표에서 Pb와 같은 14족에 속하면서 동일한 원자가 전자를 가져 ABX3 결정 구조에서 전기적으로 중성을 유지할 수 있고, 특히 Sn2+의 경우 Pb2+와 이온 반경이 비슷하고 (Sn2+: 1.35 Å, Pb2+: 1.49 Å),[11] 6배위수를 가져 안정적인 ABX3 구조를 형성할 수 있기 때문에 Pb를 대체하기 위한 금속 원소로 많이 연구되고 있다.[15]
LHP의 Pb를 Sn으로 대체하기 위해 극복해야 하는 한계점들로는 (1) 용액 공정 중 Sn 전구체들의 빠른 결정화에 따른 불균일한 박막 표면 형성으로 인한 큰 결정립계 (grain boundary) 및 핀홀 생성, 높은 트랩 밀도 (trap density) 생성과 이로 인해 발생하는 소자의 누설 전류 (leakage current) 문제,[16] (2) Pb에 비해 약한 비활성 전자쌍 효과 (inert pair effect)로 인한 Sn2+이 Sn4+로 쉽게 산화되는 문제,[17] 그리고 (3) Sn2+의 산화로 생기는 Sn 공공 (vacancy)에 의한 P형 자가도핑으로 금속성을 나타내는 문제점들이 있다.[18] 따라서, 이와 같은 근본적인 문제점들을 극복하기 위한 Sn 기반의 EHP 소재 개발 동향 및 LED 응용에 대해 살펴보고자 한다.
2.1.1. 3D ASnX3 페로브스카이트
MHP 기반 LED (PeLED)는 가시광선 파장 영역 (visible 파장 범위: 380 – 700 nm)부터 근적외선 파장 영역 (near-infrared (NIR) 파장 범위: 700 – 1100 nm)의 넓은 발광 파장 범위를 나타낼 수 있으며, 종래의 유기 발광체와 무기 양자점 (quantum dots) 발광체 기반의 LED에 준하는 20% 이상의 우수한 외부 양자 효율 (external quantum efficiency, EQE)을 보여 차세대 발광체로써 가능성을 입증하였다.[7,19–21] 특히, Sn 기반 EHP는 LHP보다 더 작은 밴드갭 (~1.0 eV)을 가지고, 더 높은 전하 이동도 (~102 – 103 ㎠ V−1 s−1)를 가져 IR 또는 NIR 발광체로 응용이 가능하다.[22,23] 상용화된 적외선 영역 LED는 III-Ⅴ족 무기물 반도체를 결정질 기판 위에 에피택셜 성장시키기 때문에 광전자 장치로의 통합이 어렵다는 문제와 높은 비용의 고진공 및 고온 공정이 필요하다는 한계가 있어, 공정 및 재료 비용이 낮고 저온 공정이 용이한 적외선 영역 PeLED에 대한 관심이 높아지고 있다.[24,25] 특히, NIR LED는 야간 투시 장치 (night-vision), 얼굴 인식 (face recognition), 생물학적 이미징 (bio-imaging), 화학 센서 (chemical sensor), 광통신 (optical communications) 및 의료 분야 (medical treatments)와 같은 일상 생활과 밀접한 분야에서 응용이 가능하기 때문에 EHP 기반의 NIR LED 개발 연구가 필수인 분야이다.[26,27] NIR 페로브스카이트 발광체는 CsPbI3와 MAPbI3 (MA = methylammonium, CH3 NH3), FAPbI3 (FA = formamidinium, CN2 H5)와 같은 독성을 가지는 Pb 기반 소재가 주로 사용되었으나, 위와 같이 실생활에 밀접한 소자 응용을 위해 MASnI3, CsSnI3, FASnI3 등이 함께 연구되고 있다.[28–32]
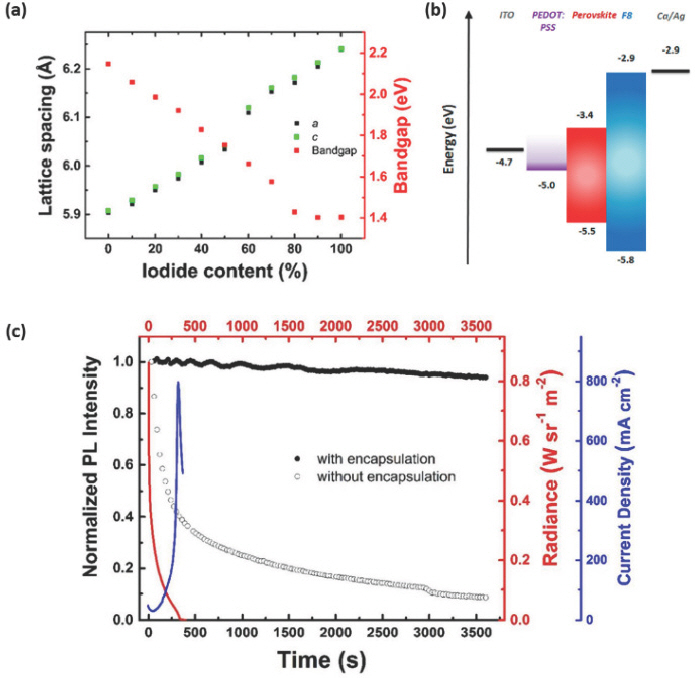
Sn 기반 EHP는 태양 전지에 먼저 개발되어 응용이 되었으나,[33,34] 2016년에 처음으로 Sn 기반 3D EHP를 NIR PeLED에 응용한 결과가 보고되었다.[35] MASn(Br1-x I x)3 박막은 스핀 코팅을 통해 형성이 가능하며, MASn(Br1-x I x)3는 Br-I 조성 범위 전체에서 사방정계 (orthorhombic) 구조를 가지고 있다. 할로겐 원소에 따라 격자 상수 (lattice parameter)가 MASnBr3 (a = 5.90353 Å, c = 5.90743 Å)와 MASnI3 (a = 6.23932 Å, c = 6.24087 Å)에서 달라짐을 X선 회절 (x-ray diffraction, XRD)분석을 통해 확인하였고, iodide 의 비율 (0% – 100%)에 따라 MASn(Br1-xIx)3의 밴드갭은 1.40 – 2.15 eV 범위에서 조절이 가능하다 (Fig. 1a). 이러한 특성을 나타내는 MASn(Br1-x I x)3를 발광층에 응용하여 ITO/poly(3,4-ethylenedioxythiophene):poly(styrenesulfonate) (PEDOT:PSS)/MASn(Br1-x I x)3/poly(9,9-dioctylfluorene) (F8)/Ca/Ag의 구조를 가지는 EPeLED를 제작했을 때, 전계 발광 (electroluminescence, EL) 파장은 667 nm에서 945 nm까지 조절할 수 있고, 이에 따른 NIR 영역의 발광 파장을 가지는 MASnI3 기반 EPeLED (945 nm)는 2.2 V 의 낮은 턴온 전압 (turn-on voltage)을 보였다. 그리고 최대 EQE는 iodide의 비율이 증가하며 장파장 영역의 EL 파장을 나타낼수록 0.72%까지 증가하는 경향을 가진다 (Table. 1). 정공수송층으로 사용된 F8은 –2.9 eV의 lowest unoccupied molecular orbital (LUMO)와 −5.8 eV의 highest occupied molecular orbital (HOMO) 에너지 준위를 가져 전자수송층 및 정공차단층 역할을 하여 MASnI3 발광층 내의 정공이 빠져나가는 것을 방지하여 MASnI3 발광층 내에서 엑시톤의 방사성 재결합 (radiative recombination)을 향상시켜 소자 효율을 높였다 (Fig. 1b). MASnI3 EPeLED의 수명을 6 V의 고정된 인가 전압에서 측정한 결과, 인가된 전압에 의한 급격한 열화로 인해 이온 이동 (ion migration)이 나타나 초기 2분 동안 방사 휘도 (radiance)가 급격히 감소하였고, 6분 경과 후에는 완전히 열화되어 방사 휘도가 측정되지 않았다 (Fig. 1c). 소자의 열화 원인을 분석하기 위해 대기 노출에 따른 MASnI3 박막의 시간 경과에 따른 광발광 (photoluminescence, PL) 세기 변화를 측정한 결과, 대기에 노출된 MASnI3 박막은 시간에 따른 PL 세기가 급격하게 감소한 반면, 봉지 공정을 통해 대기와 차단시킨 MASnI3 박막의 경우 1시간 동안 94% 이상의 PL 세기를 안정적으로 유지하였다. 따라서, MASnI3 기반 PeLED의 작동 수명은 대기에 의한 영향보다는 주로 장치 작동 중에 인가되는 전압에 의한 이온 이동 현상에 의해서 발생되었고, 이를 통해 이온 이동이 발생할 수 있는 결정의 결함과 결정립계를 줄이면 Sn 기반 EPeLED의 안정성은 크게 향상될 것이다.
Sn 기반 EHP에 부피가 큰 리간드를 추가하면 페로브스카이트 결정의 성장을 제한해 작은 크기의 결정립 (grain)을 형성할 수 있어 균일한 Sn 기반 EHP 박막을 형성할 수 있다. 또한, Pb와 Sn의 비율 Pb1-x Sn x (0 ≤ × ≤ 1)을 조절함으로써 기존의 Sn 기반 EHP의 Sn2+에서 Sn4+로의 산화로 인한 빠른 열화 문제를 극복하고 발광 파장 영역을 조절할 수 있다.[25] MAPb1-x Sn x I3에 부피가 큰 유기 암모늄 할라이드 리간드인 4-fluorobenzylammonium iodide (FPMAI)를 전구체 용액에 첨가하면 결정화 과정 중 리간드에 의해 결정 성장을 억제할 수 있다.[25] FPMAI를 첨가하지 않은 MAPb1-x Sn x I3의 결정립이 약 100 nm 크기를 가진 반면, FPMAI를 첨가함으로써 수십 nm 수준의 더욱 작은 크기의 결정립을 형성하게 된다. 동시에 결정 표면의 결함을 패시베이션하여 고효율의 균일한 박막을 형성할 수 있다.[3,36,37] FPMAI를 첨가한 MAPb0.6 Sn0.4 I3는 안정적으로 페로브스카이트 결정 구조를 가지는 것을 보였고, MAPb0.6 Sn0.4 I3의 표면 거칠기는 FPMAI 첨가를 통해 2.7 nm에서 1.7 nm로 감소되었다. 이를 통해 ITO/poly[N,N′-bis(4-butylphenyl)-N,N′-bis(phenyl)-benzidine] (Poly-TPD)/ FPMAI-MAPb1-x Sn x I3/ 1,3,5-tris(1-phenyl-1H-benzimidazol-2-yl) benzene (TPBi)/LiF/Al의 구조를 가지는 PeLED를 제작한 결과, 다양한 Pb와 Sn의 조성 비율 중 FPMAI-MAPb0.6 Sn0.4 I3 기반 PeLED에서 917 nm 발광 파장을 가지는 5%의 고효율 NIR PeLED를 구현한 반면, FPMAI-MASnI3 기반 EPeLED는 901 nm의 발광 파장을 보이며 0.9%의 EQE를 나타냈다. 또한, FPMAI-MAPb0.6 Sn0.4(I1-x Br x)3 (0 ≤ × ≤ 1)에서 iodide에 대한 bromide의 함량 (X)을 FPMAI-MAPb0.6 Sn0.4 I3 (X = 0)와 FPMAI-MAPb0.6 Sn0.4 I2 Br (X = 0.33)로 조절함에 따라 발광 파장이 928 nm에서 854 nm의 단파장 영역으로 이동하였다. FPMAI-MAPb0.6 Sn0.4 I3 기반 PeLED 에 점차적으로 2.5 V부터 4 V의 전압을 인가했을 때와 1 mA cm–2의 전류 밀도를 30분간 일정하게 인가한 결과, 두 조건에서 모두 EL 파장이 유지되어 상 분리가 일어나지 않아 안정적으로 소자가 작동함을 확인하였다.
CsSnX3는 높은 PL 양자 수율 (PL quantum yield, PLQY)과 전자이동도와 같은 우수한 광전기적 특성을 가진다.[38–40] CsSnI3는 MASnI3와 함께 IR PeLED 개발을 위해 널리 연구되는 발광 소재로써 4가지 polymorph를 가지고 있는데, 상온에서는 검은색과 노란색을 나타내는 2가지 polymorph로 존재할 수 있다.[18] 이 중 사방정계 구조를 가지는 black polymorph (B-γ)-CsSnI3는 –3.62 eV의 전도대와 –4.92 eV 의 가전자대를 가져 1.3 eV의 밴드갭을 가지므로 950 nm의 IR 영역의 PL 파장을 나타내며, 585 ㎠ V−1 s−1의 높은 정공이동도를 가지는 특징이 있다.[40] 3D B-γ-CsSnI3는 IR EPeLED에 응용이 가능하다.[38] 이 때 B-γ-CsSnI3 발광층을 형성하는 방법으로 스핀 코팅 공정 중 toluene을 이용한 비용매 (anti-solvent) 처리 공정을 사용하였다. Toluene 비용매 처리 공정을 사용하지 않은 B-γ-CsSnI3 박막은 저농도 전구체 용액을 사용할 경우 알갱이와 같은 형태를 가지고, 전구체 용액의 농도가 증가할수록 스펀지와 같은 형태를 가진다. 반면에, CsSnI3 전구체가 녹은 dimethyl sulfoxide (DMSO) 용액을 4000 rpm으로 스핀 코팅하는 도중 150 µL의 toluene을 기판에 떨어뜨리고 90 ℃에서 10분 동안 열처리를 하면 상대적으로 균일한 B-γ-CsSnI3 박막을 형성할 수 있게 된다. Toluene을 사용한 비용매 공정을 통해 제작된 B-γ-CsSnI3 박막은 핀홀이 관찰되지 않아 박막의 품질이 개선된 것을 알 수 있다. 이를 통해 제조한 IR EPeLED 구조에서 2-(4-tert-butylphenyl)-5-(4-biphenylyl)-1,3,4-oxadiazole (PBD)는 전자수송층 및 정공차단층으로 사용되는데, CsSnI3의 가전자대 (–4.92 eV)와 PBD의 HOMO 에너지 준위 (–6.20 eV) 사이에 생기는 큰 에너지 장벽 (energy barrier)은 정공을 CsSnI3 발광층 내에 효과적으로 가두고, PBD 전자수송층의 높은 전자이동도 (2 × 10−5 ㎠ V−1 s−1)는 음극으로부터 발광층으로의 전자 주입이 효과적으로 이루어지도록 하여 전하 균형을 향상시키는 역할을 한다. 또한, PBD 박막을 CsSnI3 위에 스핀 코팅 공정으로 형성함으로써 CsSnI3의 핀홀을 채우면서 균일한 박막 형성이 가능하였다. 이렇게 제작된 NIR EPeLED는 40.01 W Sr−1 m−2의 최대 복사 휘도와 3.80%의 최대 EQE의 성능을 보였다.
2.1.2. 2D A2 BX4 페로브스카이트
3D ABX3 구조의 안정성은 Goldschmidt의 tolerance factor
Lanzetta et al. 연구진은 처음으로 페로브스카이트 A 자리에 phenethylammonium (PEA)를 사용해 파장을 가시광선 영역에서 조절 가능한 2D (PEA)2 SnI x Br4-x 를 발광층으로 사용하여 Sn 기반 2D EPeLED를 개발하였다.[51] PEAI/PEABr과 SnI2/SnBr2를 화학량론적 비율로 DMF에 녹인 전구체 용액을 스핀 코팅하여 2D (PEA)2 SnI x Br4-x 박막을 형성하게 되는데, 결정화되는 과정에서 PEA 양이온이 steric hindrance를 유발하게 되어 2D 구조를 형성한다 (Fig. 2a). 2D (PEA)2 SnI4의 PL 파장은 627 nm로 측정되어 1.97 eV의 광학 밴드갭을 가지고, PEDOT:PSS 정공수송층 및 F8 전자수송층과 함께 LED를 제작하여 618 nm의 EL 파장과 0.15 cd m–2의 최대 휘도를 가지는 EPeLED를 만들 수 있다.
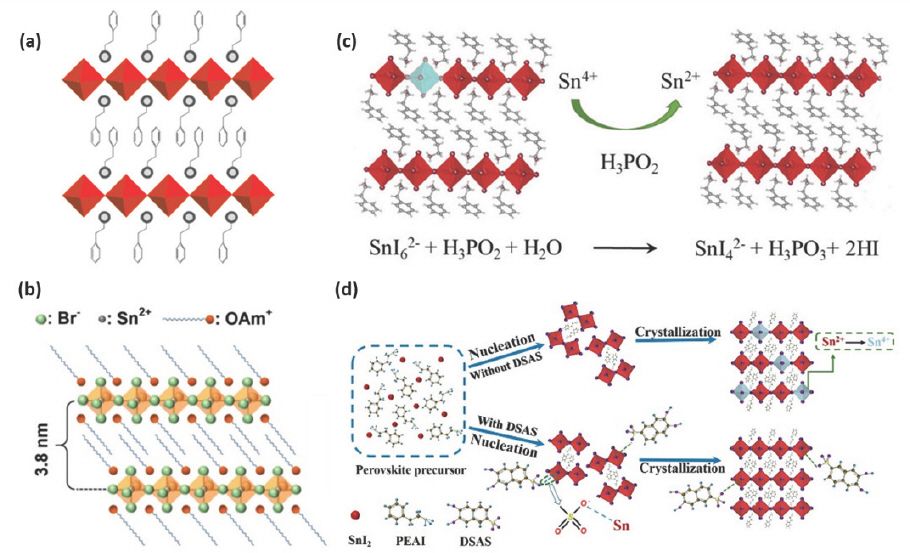
(a) 유기-무기 층이 교대로 적층된 (PEA)2 SnI x Br4-x 결정 구조 (회색 원: -NH3 그룹, 빨간 다면체: 모서리 공유 [SnX6]4- 팔면체 (X는 할로겐 물질)). Reproduced with permission. Copyright 2017, American Chemical Society.[51] (b) (OAm)2 SnBr4 결정 구조. Reproduced with permission. Copyright 2019, American Chemical Society.[52] (c) H3 PO2의 Sn4+ 환원 메커니즘 모식도. Reproduced with permission. Copyright 2020, WILEY-VCH.[62] (d) DSAS 유무에 따른 (PEA)2 SnI4의 핵생성과 결정화 과정 모식도. Reproduced with permission. Copyright 2020, American Chemical Society.[66]
2D (C18 H35 NH3)2 SnBr4 (C18 H35 NH3 cation (OAm+), (OAm)2 SnBr4)는 hot-injection 방법으로 합성이 가능하다.[52] 이를 합성하기 위해 SnBr2를 + = oleylamine tri-n-octylphosphine (TOP)에 넣어 160 ℃에서 30분간 교반하여 SnBr2-TOP 용액을 만든다. Oleic acid (OA), oleylamine (C18 H35 NH2, OAm), 1-octadecene (ODE) 혼합 용액을 100 ℃에서 2시간 동안 degassing 처리 후, N2 및 180 ℃ 분위기에서 예열된 SnBr2-TOP 용액을 주입한다. 10초 후에 냉각시켜 반응을 멈추고 5000 rpm으로 10분간 원심분리한 침전물을 hexane에 재분산한 뒤 10000 rpm으로 10분간 원심분리한다. 이 과정을 2번 반복하여 얻은 (OAm)2 SnBr4가 포함된 백색 침전물을 hexane에 분산시킨 용액을 hexane으로 200배 희석시켜 2D (OAm)2 SnBr4를 합성한다.
2D 층 사이의 유기 사슬은 A자리에 OAm+의 NH3+말단이 정전기적으로 [SnBr6]4- 팔면체의 Br−이온과 상호작용하고, 긴 탄소 사슬들은 [SnBr6]4- 팔면체에 의해 형성된 무기 층 사이에서 반데르 발스 상호작용을 통해 맞물려 있게 된다 (Fig. 2b). OAm+ 양이온이 절연층으로 작용하여 [SnBr6]4- 팔면체 단일 층과 양자 우물 구조를 형성하고 전자 밴드 형성을 효과적으로 방지함으로써 양자 구속 효과 (quantum confinement effect)를 유도한다. 합성된 (OAm)2 SnBr4 박막은 620 nm의 PL 파장과 68%의 PLQY를 나타냈다. (OAm)2 SnBr4 박막을 이용하여 ITO/ZnO/PEI/(OAm)2 SnBr4/TCTA/MoO3/Au 구조를 가지는 역구조 EPeLED는 625 nm의 EL 파장을 보이면서 2.2 V의 턴온 전압, 0.1%의 EQE, 350 cd m–2의 최대 휘도를 나타냈다.
Sn2+는 Sn4+로 쉽게 산화되어 Sn 공공을 형성하여 비방사성 재결합의 증가로 인한 발광 효율 저하를 야기하므로,[53,54] 고효율의 Sn 기반 EPeLED를 구현하기 위해서는 Sn2+의 산화를 억제하는 것이 중요하다. 이러한 Sn 산화 억제를 위한 Sn compensator로 SnF2가 널리 사용되었으나,[55–57] SnF2 잔여물은 상분리를 유발하여 박막 품질과 장치 성능을 낮추는 문제가 있다.[58–60] 또한, hydrazine (N2 H4) 증기와 같은 환원제를 이용하여 산소 농도를 낮추고 Sn의 산화를 줄이는 노력이 있었으나, 일부 Sn2+의 과환원으로 금속성 Sn이 생성되는 문제가 있었다.[61] 특히 같은 환원제가 사용되어도 Sn 기반 EHP의 종류에 따라 산화 경로 (oxidation pathway)가 달라져 다른 산화 방지 효율을 가질 수 있게 된다. 즉, 2D (PEA)2 SnI4에서 발생할 수 있는 Sn2+의 산화 문제는 Sn2+의 산화 경로를 확인하고 H3 PO2 (hypophosphorous acid, HPA)와 같은 적절한 환원제를 선택함으로써 박막 품질을 낮추지 않고 산화를 억제할 수 있다.[62] 산화 경로는 열 중량 분석법을 이용하여 확인 가능하며, (PEA)2 SnI4와 O2가 반응하여 SnI4가 형성되는 경로를 산화에 필요한 첫 번째 단계로 선택할 수 있는데, 이러한 산화 경로에서 중요한 요소는 SnI 결합의 해리이고, 해리를 억제하는 한 가지 방법은 중간 착물을 형성하는 것이다. HPA는 DMSO가 있을 때 Sn2+보다 쉽게 산화되고 Sn(H2 PO2)2를 형성하여 인접한 SnI 팔면체를 파괴하고 Sn-HPA 착물을 형성하여 SnI4 형성을 억제할 수 있게 된다 (Fig. 2c).
HPA 환원제 첨가로 인해 2D (PEA)2 SnI4의 PL lifetime이 0.4 ns에서 1.1 ns로 증가함으로써 Sn2+의 산화가 억제되고 트랩 밀도가 낮아진 것을 알 수 있다. 또한, HPA가 첨가된 2D (PEA)2 SnI4는 큰 결정 크기와 적은 결정립계를 가지는 균일한 박막을 형성하고, PLQY도 0.6%에서 1.35%로 증가했다. 이에 추가로, poly(2-hydroxyethyl methacrylate)[63]와 toluene 기반의 비용매 처리를 통한 균일한 결정 성장을 유도하여 HPA가 첨가된 (PEA)2 SnI4 박막의 특성을 더욱 향상시킬 수 있고, ITO/PEDOT:PSS/(PEA)2 SnI4/TPBi/LiF/Al 구조를 가지는 EPeLED에서 633 nm의 EL 파장과 70 cd m–2 최대 휘도 및 0.3%의 EQE를 달성하였다. Sn 기반의 2D EPeLED의 소자 효율 향상을 위한 다른 방법으로는 A자리 유기 양이온을 치환하는 것이다. 기존의 PEA 대신에 2-thiopheneethylamine(TEA) 양이온을 이용하고,[64] toluene 기반 비용매 처리를 한 (PEA)2 SnI4와 (TEA)2 SnI4 박막을 보면, (PEA)2 SnI4 박막의 경우 핀홀이 많지만 (TEA)2 SnI4 박막은 핀홀이 없고 균일하고 밀도가 높은 것을 알 수 있다. 또한, 630 nm의 PL 파장을 가지는 (PEA)2 SnI4 박막과 비교하여 (TEA)2 SnI4 박막의 PL 파장은 적색 파장 영역으로 이동했는데, 이는 PEAI 양이온이 TEAI 양이온으로 대체되면서 유전율이 낮은 TEAI가 dielectric confinement effect로 인해 밴드갭을 감소시킨 결과이다.[65] PLQY 의 경우 TEAI로 대체한 후 0.41%에서 1.52%로 증가하였다. 특히, (TEA)2 SnI4의 무기층 사이 거리 (15.5 Å)가 (PEA)2 SnI4 (16.2 Å)보다 감소하여 전하의 이동이 유리한 구조를 가지고 (TEA)2 SnI4의 최대 가전자대가 (PEA)2 SnI4보다 0.09 eV 높아 LED 구동에 장점을 가진다. 이에 따라 ITO/PEDOT:PSS/(PEA)2 SnI4 또는 (TEA)2 SnI4/TPBi/LiF/Al 구조를 가지는 2D EPeLED의 성능을 보면, (PEA)2 SnI4 기반 PeLED에서는 629 nm의 EL 파장을 보이면서 2.5 V의 턴온 전압과 58 cd m–2의 최대 휘도, 0.16%의 EQE를 나타냈고, (TEA)2 SnI4 기반 PeLED에서는 638 nm의 EL 파장을 보이면서 2.3 V의 더 낮은 턴온 전압, 322 cd m–2의 최대 휘도와 0.62%의 EQE를 나타내 더 향상된 성능을 보여주었다.
2,3-dihydroxynaphthalene-6-sulfonic acid sodium salt (DSAS)는 앞서 언급한 2D (PEA)2 SnI4 박막 개발의 문제점들을 극복할 수 있는 naphthol sulfonic salt 첨가제이다.[66] DSAS의 hydroxyl 그룹과 sulfonic 그룹은 각각 I−와 Sn2+와 상호작용하여 Sn 기반 페로브스카이트 핵생성을 지연시킬 수 있고 전자 주개 sulfonic 그룹이 정전기적 상호작용을 통해 SnI2 전구체와 상호작용하여 중간 착물을 형성하며 루이스 염기로 작용할 수 있다 (Fig. 2d).[67–69] DMF와 DMSO 혼합 용액에 DSAS를 PEAI와 SnI2 전구체에 첨가한 후 스핀 코팅 공정 중 chlorobenzene으로 비용매 처리를 함께 진행하여 균일한 (PEA)2 SnI4 박막을 형성할 수 있다. DSAS는 어닐링 후 표면에 유지되어 Sn2+ 결함을 패시베이션 할 수 있다.[70] 또한 naphthol 고리의 높은 전자 구름 밀도는 DSAS와 Sn2+의 상호작용을 증가시켜 패시베이션 효과를 보여준다.[71] DSAS의 환원성 수산기는 Sn2+ 산화를 방지하는 O2 scavenger 역할을 하고 결정립계에서 I− 이온의 이동을 억제할 수 있어 대기 안정성을 향상시킬 수 있다.[72] DSAS가 포함된 (PEA)2 SnI4 박막은 5일간 대기 중에 노출되어도 (PEA)2 SnI4 상이 유지되었다. ITO/PEDOT:PSS/(PEA)2 SnI4/TPBi/LiF/Al 의 구조를 가진 EPeLED는 632 nm의 EL 파장을 보이며 DSAS가 첨가되지 않은 EPeLED에서 26 cd m–2의 휘도와 0.124%의 EQE를 나타낸 반면, 3 mol% DSAS 가 첨가된 EPeLED는 향상된 132 cd m–2의 휘도와 0.72%의 EQE를 보였다.
Sn2+ 산화는 전구체 용액을 제조할 때 적절한 용매를 사용하여 제어할 수도 있다.[73,74] DMSO 용매는 페로브스카이트 전구체 용액 제조에 많이 쓰이지만 Sn2+가 산화되는 요인으로 작용하기도 한다. 그리고 끓는점이 높은 용매는 어닐링 공정에서 간단히 제거되지 않는 문제가 있다. 이러한 문제는 재결정화 및 재용해 과정을 포함하는 2단계 결정화 방법을 통해 결함을 감소시켜 높은 발광 효율을 가지는 2D (PEA)2 SnI4를 제조할 수 있다.[75] 2단계 결정화 합성법 중 첫 번째 단계는 γ-butyrolactone (GBL) 용매에 PEAI, SnI2와 Sn 분말을 혼합한 용액을 dichloromethane (DCM)에 주입하여 침전시킨 미세 결정 (microcrystal)을 분리하여 (PEA)2 SnI4 미세결정을 얻는다. 그리고 두 번째 단계에서 (PEA)2 SnI4 미세결정을 DMF 또는 DMSO:DMF 에 재용해하여 전구체 용액을 만들고, 이를 스핀 코팅하면 재결정화된 2D (PEA)2 SnI4 박막을 제조할 수 있다 (Fig. 3a). 기존의 PEAI와 SnI2를 DMSO:DMF 혼합 용매에 녹이는 용액 제조 방법보다 PLQY가 1.3%에서 1.9% (DMF 재용해)와 2.0% (DMSO:DMF 재용해)까지 향상된다. 특히, 박막 내의 Sn4+ 함량은 10.5%에서 1.8% (DMF 재용해), 2.2% (DMSO:DMF 재용해)로 크게 감소하여 전구체 용액 제조 과정과 사용한 용매 종류에 의해 Sn2+ 산화를 억제할 수 있음이 확인되었다. ITO/PEDOT:PSS/PEIE/(PEA)2 SnI4/TPBi/Liq/Al의 구조를 가지는 EPeLED에서도 기존 전구체 용액 합성법에서 627 nm의 EL 파장에서 35.1 cd m–2의 휘도와 0.13%의 EQE를 나타낸 반면, DMF 기반 2단계 결정화 합성법에서는 625 nm EL 파장에서 43.3 cd m–2의 휘도와 0.4%의 EQE를 보였다.
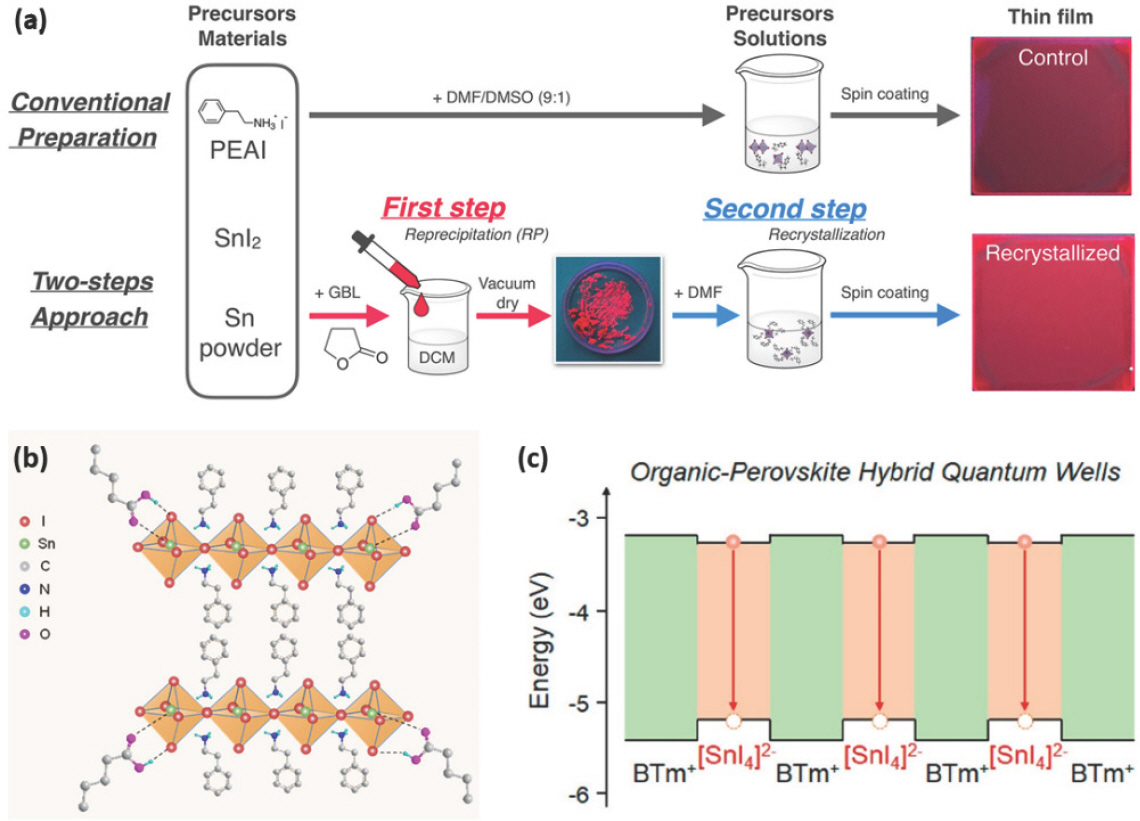
(a) (PEA)2 SnI4 박막을 형성하는 기존 결정화 방법 및 2단계 결정화 방법과 형성된 박막 이미지. Reproduced with permission. Copyright 2022, American Chemical Society.[75] (b) VA와 (PEA)2 SnI4 사이 O-H…I의 수소 결합과 C=O…Sn의 상호작용 모식도. Reproduced with permission. Copyright 2020, American Association for the Advancement of Science.[76] (c) BTm+ 유기층과 [SnI4]2- 무기층으로 이루어진 2D HQW 밴드 구조의 모식도. Reproduced with permission. Copyright 2021, American Chemical Society.[79]
또한, 용매에 valeric acid (VA)를 첨가하면 (PEA)2 SnI4의 결정화를 제어하여 균일한 박막 형성을 유도하고 Sn2+의 산화를 억제할 수 있다.[76] 중수소화된 DMSO에 VA를 포함한 용액에 PEAI와 SnI2 전구체들을 각각 넣으면 VA는 I− 이온 및 Sn2+ 이온과 각각 수소결합 및 배위결합을 형성한다 (Fig. 3b). 이에 따라 VA 와 Sn2+의 배위 결합 형성으로 인해 Sn2+의 산화가 억제되어 (PEA)2 SnI4 박막에 포함된 Sn4+ 함량이 26%에서 7%로 감소하게 되었고, VA와 전구체 사이의 상호 작용으로 인한 결정 성장 억제 효과로 인해 작은 결정 크기를 가지고 핀홀이 없는 균일한 (PEA)2 SnI4 박막을 형성할 수 있다. 이를 발광층에 이용하여 ITO/PEDOT:PSS/(PEA)2 SnI4/TPBi/LiF/Al의 구조로 제작된 EPeLED는 VA 첨가 이전에 640 nm의 EL 파장과 20 cd m–2의 휘도와 0.2%의 EQE를 나타낸 반면, VA를 첨가함으로써 632 nm의 EL 파장에서 170 cd m–2의 최대 휘도와 5%의 향상된 EQE가 나타났다.
2D 페로브스카이트는 하나의 무기층이 두 개의 절연성 유기 양이온 층에 둘러싸인 hybrid quantum well (HQW) 구조를 가진다. HQW 구조는 높은 PLQY 및 좁은 반치폭을 가지는 발광 파장의 우수한 광전기적 특성을 가져 LED 분야에서 유망하지만, PEA와 같은 절연성 유기 양이온에 의해 생기는 높은 에너지 장벽은 전하 주입에 효과적이지 못하고, 짧은 유기 양이온은 인가된 전압에 의한 이온 이동을 효과적으로 막기 어려운 문제를 가진다. 이런 문제들은 7-(thiophen-2-yl) benzothiadiazol-4-yl)-[2,2′-bithiophen]-5-yl) ethylammonium iodide (BTmI)와 같은 부피가 크고 (bulky) 단단한 (rigid) 반도체성 유기 양이온을 사용하면 HQW 구조 내의 에너지 장벽 높이를 낮춰 전하 이동을 향상시킬 수 있고, 이온 이동을 억제할 수 있다 (Fig. 3c).[77–79] (BTm)2 SnI4 용액은 먼저 BTmI, SnI2, SnCl2 전구체와 hydroquinonesulfonic acid potassium salt 첨가제를 DMF:DMSO에 용해시키고,[70] 2시간 교반 후 Sn wire를 넣고 1시간 더 교반하여 만든다. HQW 구조를 가지는 (BTm)2 SnI4 박막은 BTm+에서 [SnI4]2- 사이의 에너지 전달이 빠르게 일어나 [SnI4]2-에서 발생하는 627 nm의 발광 peak를 나타낸다.[79] 이를 이용하여 만든 ITO/m-PEDOT:PSS/(BTm)2 SnI4/TPBi/LiF/Al의 구조를 가지는 EPeLED는 627 nm 파장에서 3466 cd m−2의 최대 휘도와 3.33%의 EQE를 보였다.
3. 이가 원소에 의한 Pb 대체 방법 (heterovalent substitution)
3.1. 비스무트 (Bi) 기반 페로브스카이트
A3 B2 X9 구조를 가지는 EHP의 Pb를 이가 원소로 대체하기 위한 물질로는 Bi와 Sb가 대표적이다.[80–82] Bi는 Pb와 동일한 [Xe]4f145d106s26p0의 전자 배치를 가지기 때문에 유사한 물리적 성질을 나타내며, Bi3+의 6p 오비탈의 낮은 결합에너지는 전자적 밴드갭을 감소시키는 경향성을 가져 전자 주개 (electron donor)로 작용하므로 LHP의 전하 캐리어 농도를 증가시켜 전기적으로 우수한 성질을 보인다.[55] 또한, 낮은 독성과 높은 안정성을 가져 LHP의 Pb를 대체할 수 있는 친환경 금속이다.
A3 Bi2 I9 (A = Cs+, MA+)구조를 가지는 Bi 기반 EHP 는 Cs+ 또는 MA+ 양이온에 의해 둘러싸인 [Bi2I9]3- 이중 팔면체 클러스터(dioctahetral cluster)로 구성되어 있으며, Cs+ 또는 MA+ 양이온이 팔면체 사이의 공극을 채움으로써 균일한 박막을 형성한다.[83] MA3 Bi2 I9 전구체 용액은 MAI (7.425 M)와 BiCl3 (1.65 M)를 7:3 부피비로 혼합된 DMF:DMSO 혼합 용매에 용해시켜 합성할 수 있고, Cs3 Bi2 I9 전구체 용액은 CsI (2.475 M)와 BiI3 (1.65 M)를 동일한 용매 조건에서 합성할 수 있다. MA3 Bi2 I9와 Cs3 Bi2 I9 전구체 용액들을 1500 rpm에서 20초 동안 스핀 코팅한 후 110 ℃에서 30분간 열처리를 하면 Bi 기반 EHP 박막을 만들 수 있다. 암실 및 10% 미만의 습도 하에서 A3 Bi2 I9 (A = Cs+, MA+) 박막의 흡수 파장은 30일간 유지될 정도로 대기 중에서 높은 안정성을 가지고 있었고, 이는 MAPbI3 박막이 40% 습도 환경에서 30일 동안 500 nm 이하 파장 영역의 흡수 강도가 달라지는 것과 비교하여 EHP 박막이 우수한 대기 안정성을 확보할 수 있는 가능성이 있음을 보여준다.[84]
고진공-저진공 증착법 (high-low vacuum deposition)은 용액 공정에 의해 형성된 MA3 Bi2 I9 박막보다 고밀도의 핀홀이 없는 MA3 Bi2 I9 박막을 합성하기에 적합하다.[85] 고진공 (10−4 Pa)에서 BiI3를 증착한 후 저진공 오븐 (100 Pa)으로 옮겨 160 ℃에서 MAI와 10시간 동안의 기상-고상 반응 (gas-solid reaction)을 통해 BiI3의 균질 변환 (homogeneous transformation)을 유도하면 MA3 Bi2 I9 박막을 합성할 수 있다. MA3 Bi2 I9 박막을 대기중에서 열처리하면 결정성 향상과 잔여 MAI 를 제거하여 낮은 핀홀 밀도와 20.27 nm의 표면 거칠기 값을 가지는 고밀도의 MA3 Bi2 I9 박막을 얻을 수 있다.
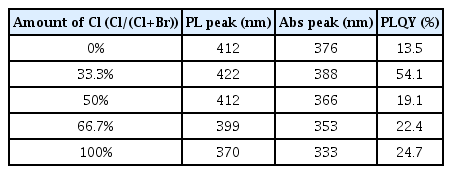
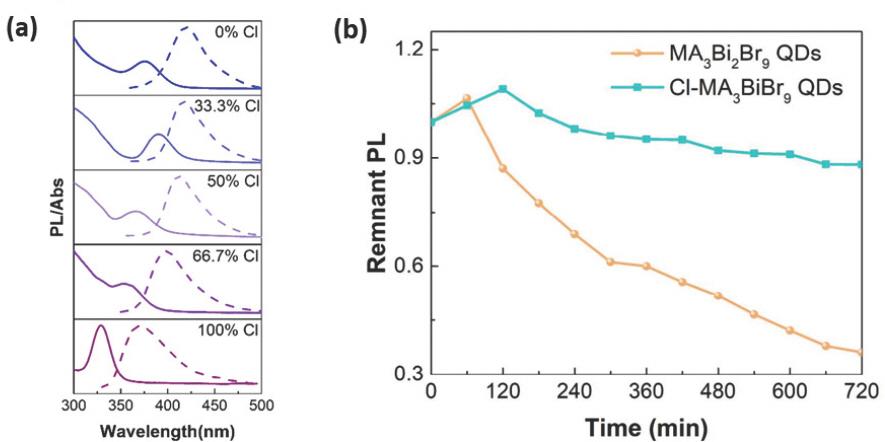
Co-LARP 합성법 (collaborate ligand assisted reprecipitation)을 통해 안정적인 MA3 Bi2(Cl, Br)9 nanocrystal (NC)을 합성할 수 있다.[86] 0.2 mmol 의 MABr과 MACl을 1 mL의 DMF에 용해시킨 용액과 0.134 mmol의 BiBr3과 BiCl3를 ethyl acetate에 용해시킨 용액을 혼합한 후 20 µL n-octylamine을 혼합시키면 MA3 Bi2(Cl, Br)9 전구체 용액을 합성할 수 있다. 그리고 0.5 mL MA3 Bi2(Cl, Br)9 용액을 0.625 mL OA 가 포함된 5 mL octane 용액에 주입 후 8000 rpm에서 10분 동안 원심 분리를 하면 큰 크기의 입자를 제거할 수 있다. 첨가된 Cl− 이온은 NC의 표면에서 리간드로 작용하여 표면 결함을 줄여주어 흡수하는 파장보다 더 긴 PL 파장을 방출하게 되는 Stokes shift를 감소시켜 줄 수 있다 (Table 2). 하지만, MA3 Bi2(Cl, Br)9 전구체 용액에서 Cl/(Cl+Br) 함량이 33.3% 이상이 되면 Cl과 MA3 Bi2 Br9의 합금 (alloy)을 이루며 PL 파장과 흡수 파장이 모두 단파장 영역으로 이동하게 되고, 표면 결함의 증가로 인한 Stokes shift 증가가 나타나게 된다 (Fig. 4a, Table. 2). 결과적으로 33.3% Cl/(Cl+Br)이 함유된 MA3 Bi2(Cl, Br)9 NC 용액은 422 nm의 PL 파장과 41 nm의 반치폭을 가지며 54.1%의 높은 PLQY를 나타냈고, 365 nm 자외선 램프 (UV lamp)에 12시간 동안 노출되었을 때 88% 수준으로 PL이 유지되어 MA3 Bi2 Br9 NC보다 높은 광 안정성(photostability)을 나타냈다 (Fig. 4b).
결정 성장 과정을 통해 형성되는 MHP 박막과 마찬가지로 단순 스핀 코팅 공정만으로는 균일한 Bi 기반 EHP 박막을 형성하는 것은 어려움이 있기 때문에 핀홀이 적고 균일한 표면을 가지는 박막 제작을 위한 새로운 공정과 조건이 개발되고 있다. 이러한 문제는 박막 공정 이후 가스 펌프 처리 (gas pump treatment)와 같은 후처리 공정을 통해 핀홀이 적은 균일한 Bi 기반 EHP 박막이 형성되도록 할 수 있다.[87] 스핀 코팅 직후 휘발성 가스에 노출시켜 PHABiI4 (PHA = C6 H5 NH3+) 박막을 만들면 대기 중에서 330일 이후에도 결정 구조가 안정적으로 유지되고, 우수한 습도 안정성과 180 ℃ 정도의 고온에 대한 안정성을 확보할 수 있다.
현재까지 Bi 기반 EHP의 PL 특성은 계속 보고되고 있으나 Bi 기반 EHP의 박막화의 어려움과 표면 결함의 문제점들에 의해 LED에 응용된 결과는 아직 보고되지 않았다. 하지만, 밴드갭 조절 능력과 우수한 광학적 성능, 열적 안정성을 기반으로 다양한 공정적 접근을 통해 균일한 A3 B2 X9 박막을 개발하면 우수한 EPeLED 개발이 가능할 것이다.[88]
3.2. 안티모니 (Sb) 기반 페로브스카이트
Sb는 낮은 독성과 높은 결함 내성을 가져 LHP의 Pb 를 대체하기 위한 물질로 알려져 있다. Sb 기반 EHP 는 A3Sb2X9 (A=Cs+, MA+, Rb+; X=Cl, Br, I)의 구조를 가지며 결정면을 공유 (face-sharing)하는 [Sb2 X9]3- 이중 팔면체로 구성된 0차원 이량체 형태 (0D dimer form, space group P63/mmc, No. 194))와 모서리를 공유하는 (corner sharing) [SbX6]3- 팔면체로 구성된 2차원 박막 형태(2D layered form, space group P3m1, No. 164)) 2가지 동질이상을 가진다.[89,90] 0차원 이량체 형태는 보통 저온의 용액 공정을 통해 합성되며, 2차원 박막 형태는 비교적 높은 온도의 증기 처리 공정을 통해 합성된다. 0D 또는 2D 구조는 온도, 조성 등의 결정화 조건에 따라 조절 가능하며, 합성된 구조 (0D 또는 2D)에 따라 Sb 기반 EHP 물질의 광학적 특성 및 전기적 특성이 결정된다.[91,92]
Toluene을 이용한 비용매 처리 공정을 이용하면 핀홀이 적고 균일한 MA3 Sb2 I9 박막을 만들 수 있다.[93] MA3 Sb2 I9 전구체 용액은 SbI3:MAI = 2:3의 몰 비율로 GBL: DMSO의 혼합 용매에 용해시켜 만들고, 2단계 스핀 코팅 (3000 rpm, 45초 후 5000 rpm, 20초)을 통해 MA3 Sb2 I9 박막을 형성한다. 이 때 toluene을 이용한 비용매 처리 공정은 2번째 스핀 코팅 단계 중에 이루어져 균일하고 작은 결정을 가지는 박막을 형성할 수 있다 (Fig. 5a). 형성된 MA3 Sb2 I9 박막은 410 nm 파장대의 파란색 PL peak를 나타냈다.
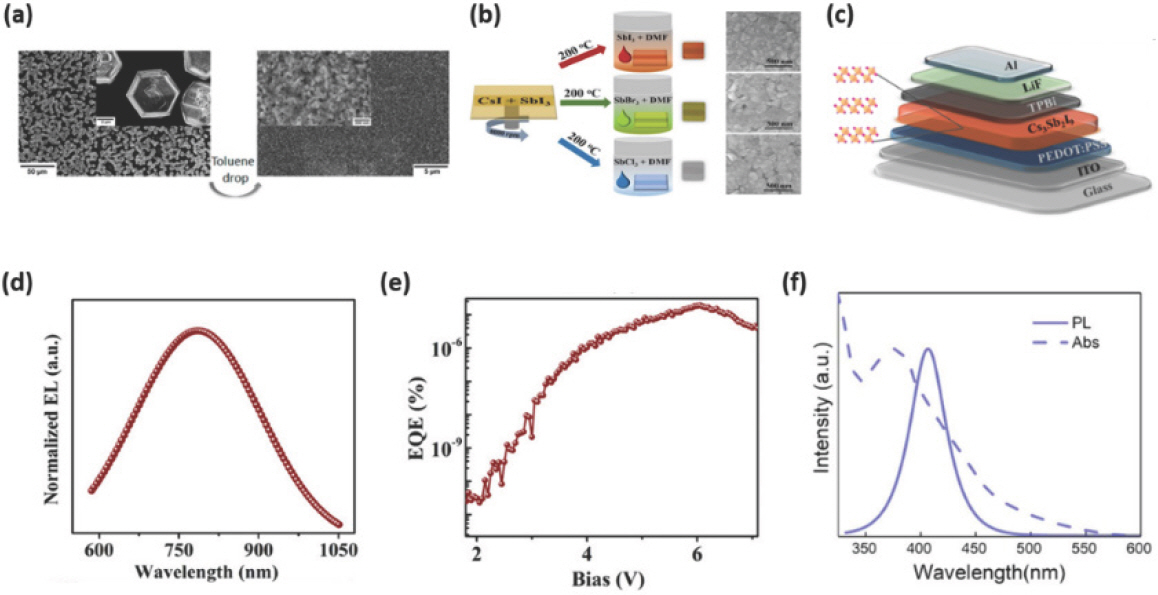
(a) Toluene 비용매 처리 유무에 따른 MA3 Sb2 I9 박막 표면의 SEM 이미지. Reproduced with permission. Copyright 2016, American Chemical Society.[93] (b) 2D Cs3 Sb2 X9 (X=Cl, Br, I) 박막 형성을 위한 증기 음이온 교환 방법(vapor-anion-exchange method)의 도식화된 이미지와 Cs3 Sb2 I9, Cs3 Sb2 Br9과 Cs3 Sb2 Cl9의 SEM 이미지. (c) Cs3 Sb2 I9 기반 EPeLED의 소자 구조. 2D Cs3 Sb2 I9 기반 EPeLED의 (d) EL 파장 및 (e) EQE-전압 특성. Reproduced with permission. Copyright 2019, American Chemical Society.[88] (f) 콜로이달 Cs3 Sb2 Br9 NC의 UV-vis 흡수 및 PL 파장. Reproduced with permission. Copyright 2017, American Chemical Society.[94]
0차원 이량체 형태의 Bi, Sb 기반의 EHP는 간접 천이형 밴드갭 (indirect bandgap), 양자 구속 효과에 의한 밴드갭, 저조한 캐리어 수송능력에 의해 광전자 분야로의 응용이 어렵다는 단점을 가지고 있다. 증기 음이온 교환법 (vapor-anion-exchange method, V-AEM)은 2D Cs3 Sb2 X9 (X=Cl, Br, I)의 위 문제점들을 보완할 수 있다.[88] Cs3 Sb2 I9 전구체 용액은 SbI3와 CsI를 DMSO에 용해시키고 70 ℃에서 6시간 동안 교반하여 만든다. 이후 PEDOT:PSS가 코팅된 기판 위에 Cs3 Sb2 I9 용액을 8000 rpm으로 40초 동안 스핀 코팅하여 박막을 형성하고, 유리병 (glass bottle) 내로 옮겨 200 ℃에서 열처리를 한다 (Fig. 5b). 이어서 할라이드 치환을 위한 증기 음이온 교환 반응을 위해 45 wt%의 SbX3(X=Cl, Br, I):DMF 용액을 유리병 내에 넣어주고 200 ℃에서 15분 동안 열처리를 진행하면 할로겐 원소에 따라 적색, 청색, 녹색 영역의 발광 파장을 가지는 2D Cs3 Sb2 I9, 2D Cs3 Sb2 Cl9, 2D Cs3 Sb2 Br9 박막이 형성된다. SbX3 (X = Cl, Br, I)가 가지는 서로 다른 증기압으로 인해 2D Cs3 Sb2 I9 박막은 2D Cs3 Sb2 Cl9, 2D Cs3 Sb2 Br9 박막에 비해 결정 크기 분포가 균일하고 핀홀이 적은 박막 표면을 가지게 되는데 (Fig. 5b), 온도와 조성을 정밀 제어하면 2D Cs3 Sb2 Cl9, 2D Cs3 Sb2 Br9 박막도 균일하게 만들 수 있을 것이다. 제조한 박막을 이용하여 제작한 ITO/PEDOT:PSS/Cs3 Sb2 I9/TPBi/LiF/Al (Fig. 5c) 구조를 가지는 EPeLED의 EL 파장은 상온에서의 PL 파장과 동일하게 750 nm 영역에서 측정되었으며 (Fig. 5d), 6 V에서 0.012 W sr−1 m−2의 복사휘도 (radiance)를 나타냈고 약 10−5%의 EQE를 나타냈다 (Fig. 5e).
Cs3 Sb2 X9 (X = Cl, Br, I) NC은 m-LARP (modified ligand-assisted reprecipitation) 공정을 통해 합성할 수 있다.[94] Cs3 Sb2 X9 NC의 음이온 치환 반응 (anion exchange reaction)을 통해 X자리의 할로겐 음이온을 치환하면 370 – 560 nm (370 nm [X = Cl], 410 nm [X = Br], 560 nm [X = I])의 범위로 PL 파장이 조절된 NC를 합성할 수 있다 (Fig. 5f). 합성된 Cs3 Sb2 X9 NC 중 Cs3 Sb2 Br9 NC은 평균 3.07 nm로 가장 작게 합성이 되어 530 meV의 큰 엑시톤 결합에너지를 가졌고 효과적인 방사성 재결합으로 46%의 가장 우수한 PLQY와 41 nm의 좁은 반치폭을 가진다.
또한, Cs3 Sb2 Br9 NC는 과포화 재결정화 방법 (supersaturated recrystallization method)으로도 합성된다.[95] 이 때 Cs3 Sb2 Br9 전구체 용액은 상온에서 0.2 mmol CsBr와 0.13 mmol SbBr3를 3 mL DMSO에 용해시킨 뒤, 30 µL OAm과 0.5 mL OA를 첨가하여 만든다. 이후 Cs3 Sb2 Br9 전구체 용액을 toluene에 주입한 후 50 ℃에서 교반하면 Cs3 Sb2 Br9 NC이 합성된다. 1000 rpm에서 10분 동안 원심 분리를 하면 큰 크기의 결정을 제거할 수 있고, 이후 4000 rpm과 1000 rpm에서 각각 15분간 원심 분리한 후 최종적으로 Cs3 Sb2 Br9 NC 분말을 얻어낼 수 있다. 이렇게 얻어진 Cs3 Sb2 Br9 NC 용액은 51.2%의 높은 PLQY를 나타냈다. 할로겐 원소 조절 (Cs3 Sb2 X9, × = Cl x Br y I1-x-y, 0 ≤ x, y ≤ 1)을 통해 385 – 640 nm의 PL 파장을 가지는 NC를 합성할 수 있다. 이 중 Cs3 Sb2 Br9 NC에서 가장 높은 PLQY와 좁은 반치폭 (55 nm)이 나타났으며, 365 nm UV에 노출된 CsPbBr3 NC의 PL 세기는 급격한 감소를 보인 반면, Cs3 Sb2 Br9 NC은 상대적으로 시간에 따른 PL 세기 감소가 적게 나타나 우수한 광 안정성을 보였다. ITO/ZnO/PEI/Cs3 Sb2 Br9 NC/TCTA/MoO3/Al 구조를 가지는 EPeLED는 408 nm의 EL 파장에서 0.206% EQE를 나타냈으며 (Fig. 6a,b), 7 V의 고정 전압이 인가되었을 때 6시간의 작동 시간 동안 90% 이상의 EL 파장 세기를 유지하는 안정성을 보여주었다 (Fig. 6c).
3.3. 구리 (Cu) 기반 페로브스카이트
철 (Fe), 구리 (Cu), 니켈 (Ni)과 같은 다양한 전이금속 (transition metal) 중 Cu는 독성이 없고 토양 내에도 풍부하기 때문에 저렴한 비용으로 Pb를 대체할 수 있는 물질이다. 특히, 직접 천이형 밴드갭 (direct bandgap) 등의 우수한 광전자 특성을 가지고 있기 때문에 Pb를 대체하여 LED에 응용하기 적합한 EHP로 알려져 있다.[96]
Cu 기반 EHP는 반응 온도 및 합성 조건에 따라 저차원 (low-dimension) 0D Cs3 Cu2 I5 NC와 1D CsCu2 I3 nanorod (NR)를 합성할 수 있다 (Fig. 7a,b).[97] Cs3 Cu2 I5에서 Cu+ 이온은 사면체 (tetrahedral) 자리와 삼각형 (trigonal) 자리에 위치하여 [Cu2 I5]3-를 형성하며, 각각의 [Cu2 I5]3-가 주변의 Cs+ 이온에 의해 분리되어 분자 수준에서의 0D NC 구조를 가지게 되고, 전형적인 Cs3 Cu2 I5 결정 구조는 사방정계 결정 시스템의 Pnma 공간군에 속한다.[98] 그리고 CsCu2 I3에서 [Cu2 I3]− 사면체는 모서리를 공유하여 c축을 따라 이중 사슬을 형성하여 1D NR 구조를 가지며 사방정계 결정 시스템의 Cmcm 공간군에 속한다.[98] 이러한 2가지 형태학적 구조는 들뜬 상태 (excited-state)에서 Jahn-Teller effect에 의해 구조적 격자 왜곡 (lattice distortion)이 발생해 전자적 0D (electronic zero-dimension) 구조를 형성한다.[99] Cu+ 할로겐화물의 경우 d10 오비탈을 가진 사면체 기하학을 선호하는데, 광여기 상태에서 Cu+는 Cu2+ d9 오비탈 중심을 형성하는 Jahn-Teller effect가 발생한다. 따라서 밴드갭 이상의 에너지가 흡수되면 Cu+ 3d10 오비탈의 전자 구성이 Cu2+ 3d9 오비탈의 전자 구성으로 변경되어 들뜬 상태 구조의 격자 왜곡을 유도한다. 이로 인해 첫번째 여기 (excitation) 파장과 PL 파장의 위치가 다르게 나타난다 (Fig. 7c).[100] 이러한 구조적인 왜곡으로 인해 self-trapped 엑시톤 (STE)이 발생한다.[101] STE는 PL에 기여하는 엑시톤의 한 종류로, 일반적으로 할로겐화물 결정 및 유기 분자 결정에서 나타난다.[102] Cu+ 기반 할로겐화물의 전자적 구조 특성으로 인해 Cs3 Cu2 X5의 엑시톤 결합 에너지 (62 meV)가 Pb 기반 CsPbX3의 엑시톤 결합 에너지 (18 meV)보다 크다.[103] 즉, STE를 형성해 높은 엑시톤 결합 에너지를 가져 높은 PLQY와 긴 PL 수명을 가진다.[100] 그리고 할로겐 음이온 (X = Cl, Br, I)을 조절함으로써 0D Cs3 Cu2 X5는 청색 파장 영역 (445 nm, Cs3 Cu2 I5)에서부터 녹색 파장 영역 (515 nm, Cs3 Cu2 Cl5)까지 발광 파장의 조절이 가능하며 (Fig. 7c),[100] 1D CsCu2 X3의 경우 527 nm (CsCu2 Cl3)에서부터 576 nm (CsCu2 I3)까지 발광 파장을 제어할 수 있다 (Fig. 7d–f).[104]
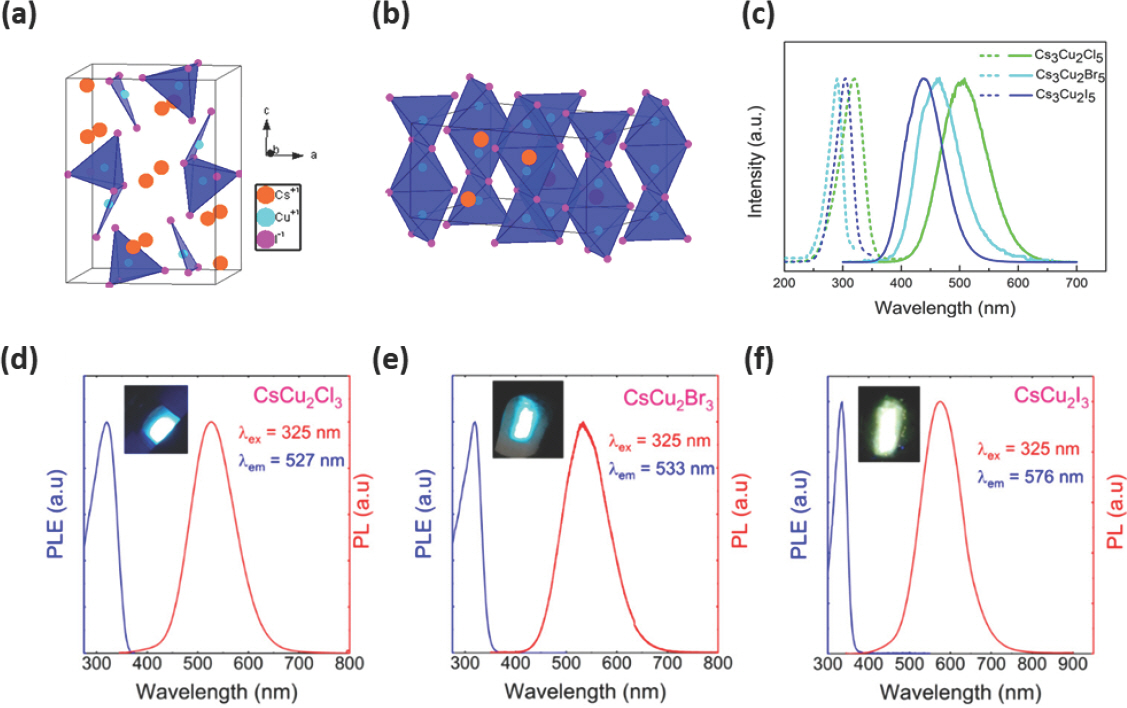
(a) 사방정계 결정 구조를 가지는 Cs3 Cu2 I5 NC. (b) 사방정계 결정 구조를 가지는 CsCu2 I3 NR. Reproduced with permission. Copyright 2019, American Chemical Society.[97] (c) Cs3 Cu2 X5 (X = Cl, Br, I)의 여기 (excitation) 및 PL 파장. Reproduced with permission. Copyright 2020, American Chemical Society.[100] (d–f) CsCu2 X3 (X = Cl, Br, I)의 PL 파장 및 발광 이미지 (inset). Reproduced with permission. Copyright 2019, American Chemical Society.[104]
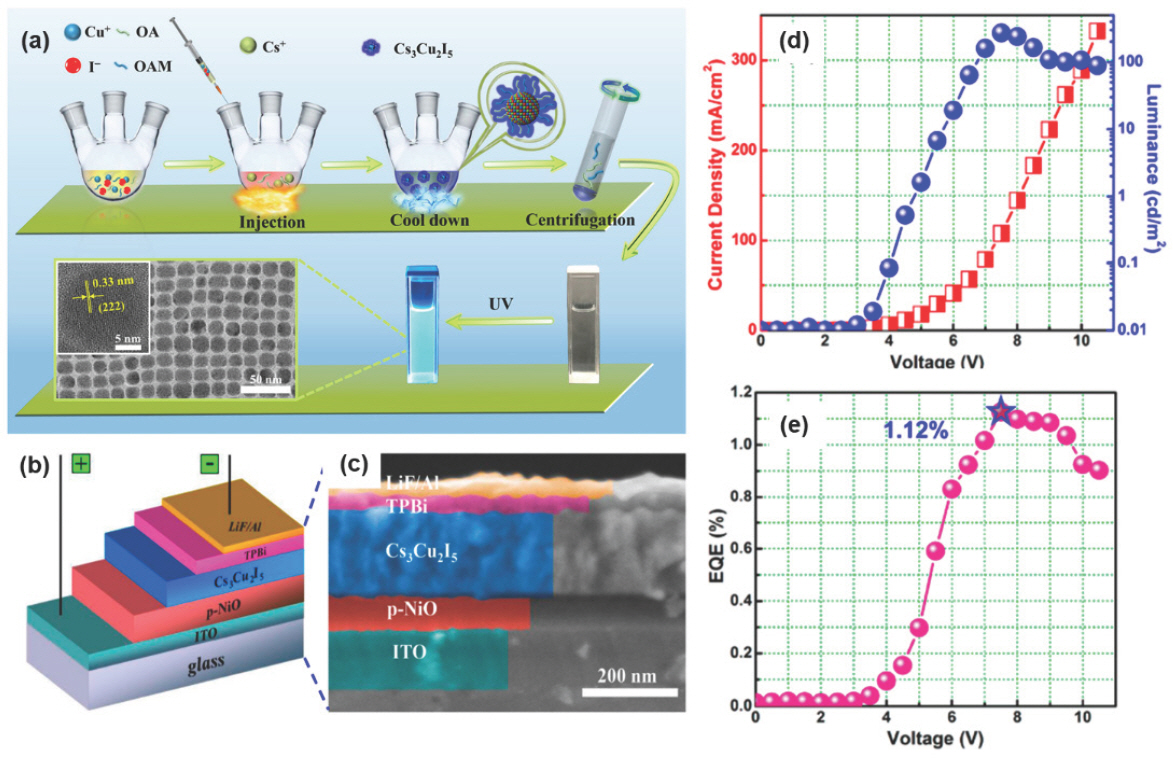
Hot-injection 합성법에서 반응 온도를 조절하여 0D Cs3 Cu2 X5와 1D CsCu2 X3의 합성이 가능하다.[105] 먼저, Cs-oleate 용액은 3구 플라스크에 0.305 g Cs2 CO3 (cesium carbonate), 15 mL ODE 및 0.95 mL OA를 넣고 120 ℃에서 30분간 건조시킨 후 질소 분위기에서 100 ℃로 유지하여 제조한다. 그리고 다른 3구 플라스크에는 76.2 mg CuI 및 10 mL ODE를 넣고 120 ℃에서 30분 동안 진공 건조 후 0.5 mL OAm 및 0.5 mL OA를 주입한다. 이후 CuI가 완전히 용해되면 온도를 70 ℃로 낮추고 Cs-oleate 용액 3 mL을 신속하게 주입하고 30초 후 냉각 bath에서 반응 혼합물을 냉각시키고, 냉각된 용액을 10분 동안 10000 rpm으로 원심분리 후 침전물을 toluene 또는 hexane에 재분산시킨다. 재분산시킨 용액을 다시 8분 동안 10000 rpm에서 원심분리하면 균일한 크기를 갖는 Cs3 Cu2 I5 NC를 얻을 수 있다. 이처럼 70 ℃의 낮은 반응 온도에서 합성된 최종 생성물은 Cs3 Cu2 I5로 합성되며, 110 ℃ 이상의 높은 반응 온도에서 최종 생성물로 CsCu2 I3를 합성할 수 있다. Cs3 Cu2 I5 NC는 441 nm의 청색 PL 파장과 67%의 PLQY를 나타낸 반면, 1D CsCu2 I3 NR은 553 nm 황색 PL 파장과 5%의 낮은 PLQY를 나타냈다.
Hot-injection 합성법 중 Cs-oleate를 주입하는 방법 대신 Cu-oleate를 주입하면 기존 고온주입법에서 주입하는 순간의 온도 하강으로 인한 용액 석출 문제를 해결할 수 있고, 445 nm 발광 파장을 가지는 Cs3 Cu2 I5 NC를 합성할 수 있다.[106] 먼저 3구 플라스크에 CuI 0.3 mmol과 ODE 2 mL의 혼합물을 질소 하에서 2시간 동안 100 ℃로 가열하여 모든 수분을 제거한 후, OA 0.2 mL 및 octylamine 0.4 mL를 리간드로 첨가한 Cu-oleate를 제조한다. 다른 플라스크에는 Cs2 CO3 0.22 mmol, OA 0.5 mL 및 ODE 5 mL를 혼합한 후, 동일하게 100 ℃로 가열하고 질소 분위기에서 2시간 동안 유지한다. 이후 온도를 160 ℃로 올려 Cu-oleate 1 mL를 신속하게 주입하고 10초 후 냉각 bath에서 반응 혼합물을 냉각시킨다. 냉각된 용액을 10000 rpm으로 10분간 원심분리하여 얻은 침전물을 hexane에 분산시키고 다시 원심분리하면 Cs3 Cu2 I5 NC를 합성할 수 있다 (Fig. 8a). 이렇게 합성한 NC를 발광층에 이용하여 제작한 ITO/NiO/Cs3 Cu2 I5 NC/TPBi/LiF/Al (Fig. 8b,c) 구조를 가지는 EPeLED는 Cs3 Cu2 I5/TPBi 불균일한 계면으로 인해 약 4.5 V의 비교적 높은 턴온 전압을 나타냈다 (Fig. 8d). 28개의 소자를 제작하여 측정한 평균 EQE는 약 1.1%이며 7.5 V에서 262.6 cd m−2의 휘도와 1.12%의 EQE를 나타냈다 (Fig. 8d,e).
CsCu2 I3 박막 제작 시 불균일하게 생성되는 표면은 비용매 처리를 통해 개선을 기대할 수 있다.[107] 먼저, CsCu2 I3 전구체 용액은 1:1 부피비로 혼합된 DMSO:DMF 혼합 용매에 CsI와 CuI를 1:2의 몰비로 혼합한 후 70 ℃에서 12시간 동안 교반하고 PTFE 필터로 여과하여 어두운 적색의 전구체 용액을 제조한다. EPeLED를 제조 공정 poly-TPD 박막 위에 바로 CsCu2 I3 용액을 코팅하면 표면 에너지 차이로 인해 CsCu2 I3 용액이 잘 도포되지 않기 때문에 poly-TPD 박막 표면을 3분 동안 아르곤 플라즈마 처리하여 wettability를 향상시켜야 한다. 그 후 CsCu2 I3 전구체 용액을 3000 rpm에서 55초 동안 스핀 코팅을 통해 CsCu2 I3 발광층을 형성할 수 있으며, 스핀 코팅 중 45초 경과 시점에 toluene 비용매 처리를 할 때 높은 PLQY를 나타내는 균일한 CsCu2 I3 박막을 형성할 수 있다 (Fig. 9a). ITO/PEDOT:PSS/poly-TPD/CsCu2 I3/TPBi/LiF/Al (Fig. 9b,c) 구조로 제작된 EPeLED는 550 nm의 EL 파장을 나타냈고 5.0 V의 비교적 높은 턴온 전압과 47.5 cd m−2의 휘도 및 0.17%의 EQE를 보였다.
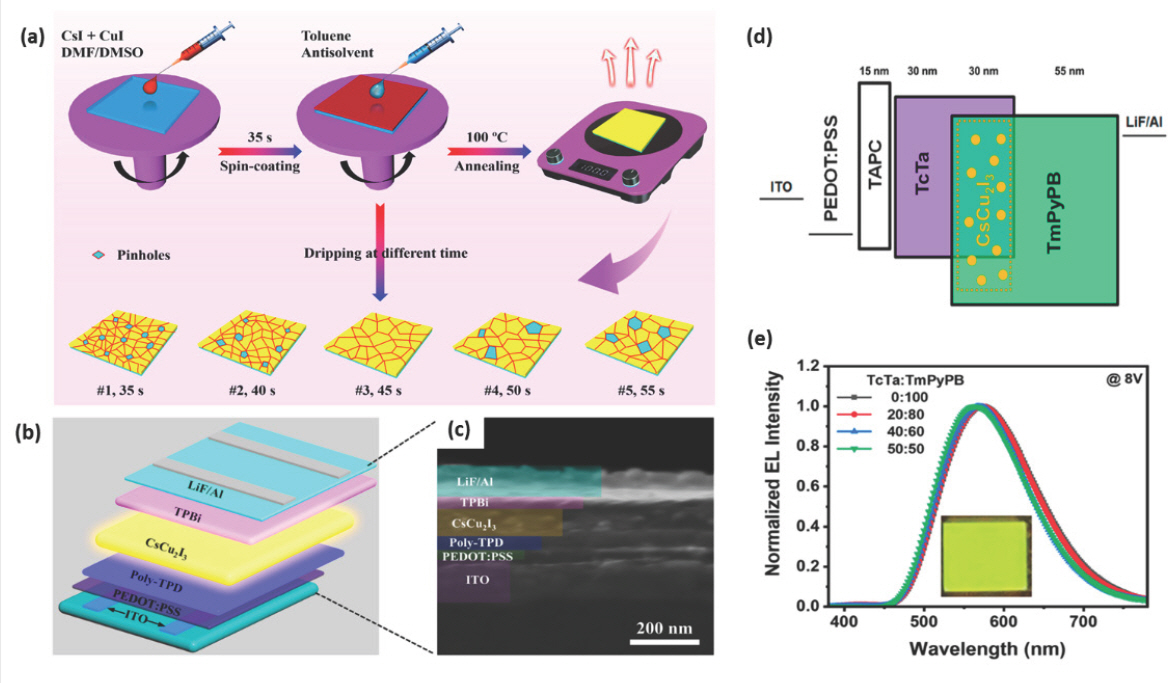
(a) Toluene 비용매의 처리 시간 조절에 따른 CsCu2 I3 박막 제조 방법. CsCu2 I3 기반 EPeLED의 (b) 소자 구조 및 (c) 단면 SEM 이미지. Reproduced with permission. Copyright 2020, American Chemical Society.[107] Co-host 시스템을 가지는 CsCu2 I3 기반 EPeLED의 (d) 에너지 준위 다이어그램 및 (e) co-host 비율에 따른 EL 파장. Reproduced with permission. Copyright 2021, American Chemical Society.[109]
Cu–EHP 기반 EPeLED 소자의 턴온 전압이 높고 효율이 낮은 이유는 저차원으로 합성되는 Cu 기반 EHP 만으로는 전하 균형이 우수한 발광층을 제조하기 어렵기 때문이다. 이는 유기물 LED에서 많이 사용하는 co-host 및 host-dopant 시스템으로 극복할 수 있다. Co-host 시스템은 전하 균형을 향상시키고 엑시톤 재결합 영역을 넓혀 발광 효율을 향상시키기에 적합하다.[108] Host-dopant 시스템을 EPeLED에 응용하기 위해 4,4′,4-tris(carbazol-9-yl)triphenylamine (TcTa) 정공수송층과 1,3,5-tri[(3-pyridyl)-phen-3-yl]benzene (TmPyPB) 전자수송층을 co-host로 사용하고, 0.5% 농도로 CsCu2 I3를 도핑 증착하여 host-dopant 시스템의 발광층을 제조할 수 있다 (Fig. 9d).[109] CsCu2 I3 dopant는 CsI와 CuI를 1:2 화학량론적인 비율로 유발에서 분쇄하고 냉간 프레스를 사용하여 펠렛화한 후 410 ℃에서 48시간 동안 어닐링하고 20시간 동안 천천히 냉각시켜 분말로 합성한다. 합성된 CsCu2 I3 분말과 host 재료들을 열증착 방법을 통해 Di-[4-(N,N-di-p-tolyl-amino)-phenyl]cyclohexane (TAPC)/TcTa/TcTa:TmPyPB:0.5% CsCu2 I3/ TmPyPB/LiF/Al (Fig. 9d) 구조를 가지는 EPeLED를 제조한다. 그 결과, co-host 비율이 TcTa:TmPyPB = 40%:60% 일 때 11 V에서 15879 cd m−2의 가장 높은 휘도를 보였고 TcTa:TmPyPB = 20%:80% 일 때 약 585 nm의 파장에서 7.4%의 가장 높은 EQE 값을 보였다 (Fig. 9e).
3.4. 이중 (double) 페로브스카이트
이중 페로브스카이트 (double perovskite)는 일반적으로 A2 BX6의 B자리에 2종류의 양이온이 위치함으로써 형성된다. 첫번째 유형은 2개의 B2+이온이 B+ 이온과 B3+ 이온으로 치환되면서 전기적 중성을 유지하며 [B(I)X6] 팔면체와 [B(Ⅲ)X6] 팔면체가 모서리를 공유하며 3차원적으로 배열된 A2 B(I)B(Ⅲ)X6 구조를 가지게 된다 (Fig. 10a).[90,110] 이 때 B(I) 자리에는 Ag+를 포함한 Na, In의 원소가 위치할 수 있으며, B(Ⅲ) 자리에는 Bi, In, Sb의 원소가 위치할 수 있으며, X자리에는 Cl, Br, I의 원소가 위치할 수 있다. 두번째 유형은 B자리에 공공 (vacancy)과 B4+ 이온이 치환되는 A2 B(Ⅳ)B(□)X6 구조로써 vacancy-ordered 페로브스카이트이다 (Fig. 10b).[111]
이중 페로브스카이트는 다른 2가 양이온 치환 대비 열, 수분, 산화 등에 대한 안정성이 높고, 캐리어 재결합 수명이 길며 구조적으로 안정적이지만 극성 용매에서 용해도가 낮아 원하는 조성을 갖는 균일한 박막을 형성하기 어려운 문제가 있어서 이를 극복하기 위한 효과적인 합성법 개발이 필요하다.[112] CsBr, AgBr 및 BiBr3 전구체는 DMSO에 대한 용해도가 낮아 일반적인 스핀 코팅을 통해서는 균일한 이중 페로브스카이트 박막을 형성하기 어렵다. 낮은 용해도는 전구체 용액을 75 ℃에서 합성해 향상시킬 수 있고, 박막 형성 공정에서는 예열한 기판을 사용하여 스핀 코팅 중 용매가 빠르게 증발하도록 하여 이중 페로브스카이트의 결정화 속도를 빠르게 조절해 균일한 표면을 가지는 Cs2 AgBiBr6 박막을 형성할 수 있다.[113]
Cs2 AgInCl6 이중 페로브스카이트는 AgCl6 팔면체에서 Jahn-Teller effect가 일어나 STE에 의한 백색 발광이 나타나고, 엑시톤의 dark transition에 의해 방사성 재결합율이 낮아져 PLQY가 감소하는 문제가 있다.[114] 이는 Ag와 다른 전자 배치를 가지면서 이중 페로브스카이트 구조를 유지시킬 수 있는 알칼리 금속을 B자리에 첨가하여 STE의 파동함수를 조절하고, 격자의 반전 대칭 (inversion symmetry)을 변형하여 dark transition 을 억제함으로써 극복할 수 있다. Cs2AgInCl6의 B자리에 Na을 첨가하거나 Ag를 치환하여도 이중 페로브스카이트의 구조가 안정적으로 유지된다. Na가 첨가되면서 Cs2 AgInCl6 격자의 반전 대칭을 깨고 Ag 자리의 전자 파동함수를 비대칭하게 변화하면 STE의 파동함수에서 parity 변화가 나타나 방사성 재결합이 향상된다. 특히, Na 도핑은 전도대 최소값이나 가전자대 최대값에 영향을 주지 않으며 AgCl6 팔면체를 부분적으로 격리하여 Cs2 AgInCl6 격자의 전자적 차원을 줄일 수 있다. 격자 내에 새로 형성된 NaCl6 팔면체는 STE의 공간 분포를 제한하여 전자와 정공의 궤도 중첩을 향상시키고 전이 쌍극자 모멘트를 증가시킨다. 이에 따라 Na 도핑에 의해 Cs2 AgInCl6의 PLQY가 향상된다. 추가적으로, Bi3+를 도핑을 하여 공공 결함 발생을 억제하면 0.04% Bi3+ 도핑된 Cs2 Ag0.6 Na0.4 InCl에서 PLQY가 86%까지 향상된다.
전구체의 낮은 용해도에 의해 균일한 박막 형성이 어려운 문제는 이중 페로브스카이트 NC의 형태로 합성함으로써 극복이 가능하다. 콜로이달 NC는 용액 공정으로 박막을 형성할 수 있고, 0D 구조를 가지고 있기 때문에 3D 또는 2D와 다른 광학 및 전기적 특성을 활용할 수 있다.[115] Cs2 AgInCl6 NC은 silver acetate (Ag(ac)), indium(III) acetate (In(ac)3), OAm, Cs-oleate 용액과 diphenyl ether (DPE)를 플라스크에 넣고 40 ℃에서 건조한 후 온도를 105 ℃로 증가시켜 benzoyl chloride를 degassing된 DPE와 혼합하여 플라스크에 주입한다. 그리고 만들어진 용액을 10분 동안 4500 rpm으로 원심분리하여 침전된 NC를 hexane에 재분산시키면 Cs2 AgInCl6 NC를 만들 수 있다. Cs2 AgInCl6 NC는 공기 중에서 최대 500 ℃까지 우수한 안정성을 보였으며, 560 nm의 PL 파장과 1.6%의 PLQY를 보였다. Cs2 AgInCl6에 Mn 이온을 도핑하여 Mn d 전자를 탈여기시키면 PLQY를 증가시킬 수 있다.[116] Mn을 콜로이달 NC에 도핑하는 과정은 기존 콜로이달 NC 합성법과 동일하게 합성되지만 Ag(ac)를 줄이고 manganese acetate (Mn(ac)2)를 초기 반응 용액에 첨가하여 Mn이 도핑된 Cs2 AgInCl6 NC를 만들 수 있다. 이로 인해 1.5% Mn 도핑하면 Cs2 AgInCl6의 결정 구조를 변화시키지 않고 Cs2 AgInCl6 엑시톤의 에너지 전이에 의해 620 nm의 PL 파장에서 PLQY를 16%까지 높일 수 있다.
Cs2 AgIn0.9 Bi0.1 Cl6 NC는 hot-injection 합성법을 통해 만들 수 있고 30%의 상대적으로 높은 PLQY 를 가져 백색 발광 EPeLED 응용에 적합하다.[117] Cs2 AgIn0.9 Bi0.1 Cl6 NC는 Cs-acetate, Ag-acetate, In-acetate 및 Bi-acetate를 10 mL ODE, 2.5 mL OA, 660 µL OAm에 용해시켜 40분 동안 110 ℃에서 가열하고, 이어서 180 ℃의 질소 분위기 하에서 chlorotrimethylsilane (TMSCl) 0.5 mL를 주입하고 30초 후 실온으로 냉각하여 원심분리한 침전물을 n-hexane에 재분산한 뒤 methyl acetate로 정제하면 Cs2 AgIn0.9 Bi0.1 Cl6 NC을 합성할 수 있다. 이를 이용하여 제조한 ITO/PVK/Cs2 AgIn0.9 Bi0.1 Cl6 NC/TPBi/LiF/Al (Fig. 11a) 구조를 가진 EPeLED는 (0.32, 0.32)의 CIE 색좌표를 가지는 백색 발광을 보였으며, 0.08%의 EQE 와 158 cd m−2의 휘도를 나타냈고 약 48분의 소자 수명을 보였다 (Fig. 11b).
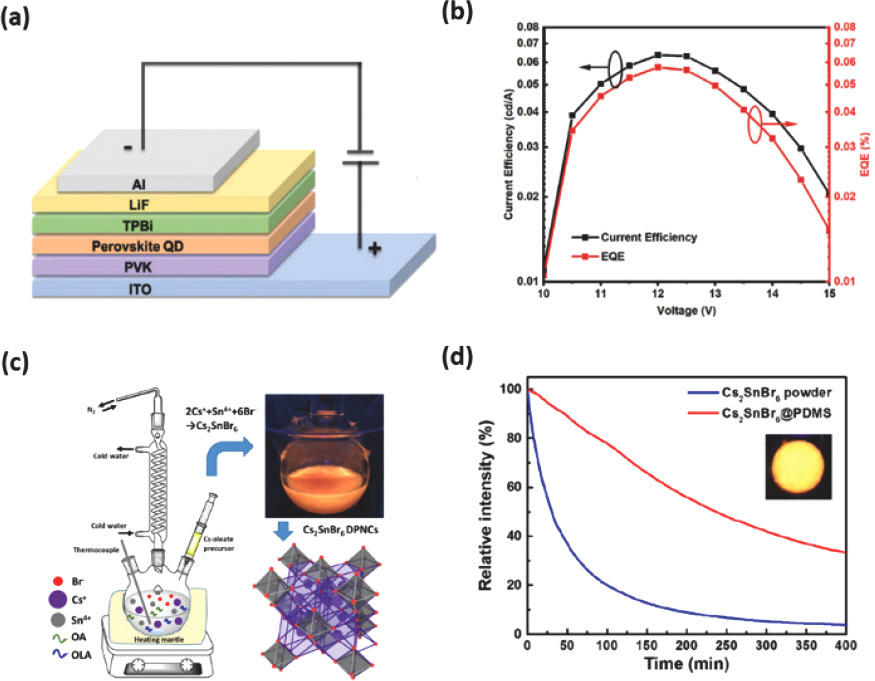
Cs2 AgIn0.9 Bi0.1 Cl6 NC 기반 EPeLED의 (a) 소자 구조 및 (b) 구동 전압에 따른 전류 효율 및 EQE. Reproduced with. Copyright 2021, Wiley-VCH.[117] (c) Cs2 SnBr6 이중 페로브스카이트 NC의 hot-injection 합성법 과정 및 결정 구조. (d) Cs2 SnBr6 분말 및 Cs2 SnBr6@PDMS 박막의 광학 안정성. Reproduced with permission. Copyright 2021, American Chemical Society.[119]
앞서 살펴봤듯이 Sn2+는 대기 조건에서 안정적인 Sn4+로 쉽게 산화되며 트랩으로 작용하는 결함을 생성하여 효율을 저하시킨다.[118] Sn2+을 Sn4+로 대체하면 B자리에서 공공이 교대로 위치하면서 BX6 팔면체가 분리된 vacancy-ordered 이중 페로브스카이트를 형성할 수 있다.[119] Hot-injection 합성법으로 제조한 Cs2 SnBr6 NC는 vacancy-ordered 이중 페로브스카이트 구조를 가진다. 이를 제조하기 위해 먼저 0.68 mmol SnBr4와 1 mL TOP를 교반한 후 OA, OAm 및 10 mL ODE를 SnBr4/TOP 용액과 혼합한다. 그 후, 반응 혼합물을 60 ℃로 가열하여 교반한 후 120 ℃에서 1시간 동안 degassing 후 180 ℃로 가열하여 Cs-oleate 용액을 주입하고 60초 후 상온으로 냉각하여 원심분리를 통해 hexane에 분산된 Cs2 SnBr6 NC를 합성한다 (Fig. 11c). Cs2 SnBr6 NC는 112 nm의 넓은 반치폭을 가지는 600 nm의 PL 파장과 31%의 향상된 PLQY를 나타냈다. Cs2 SnBr6 NC는 넓은 비표면적과 수분 반응성으로 인해 대기 안정성이 좋지 못하며, polydimethylsiloxane (PDMS)와 같은 고분자와 혼합하여 Cs2 SnBr6@PDMS 박막을 만들어 안정성을 향상시킬 수 있다. 시간에 따른 PL 파장의 세기 변화를 관찰해보면 Cs2 SnBr6 NC은 30분만에 절반으로 감소하지만, Cs2 SnBr6@PDMS 박막은 30분 동안 94% 이상의 PL 세기를 유지하며 230분까지 50% 이상 유지할 수 있다 (Fig. 11d).
결론
본 리뷰에서는 기존 독성을 가진 Pb가 포함된 페로브스카이트 소재 중심으로 연구되어왔던 PeLED를 친환경적인 EHP 재료로 대체하기 위한 Pb의 등가 원소 및 이가 원소 치환 방법으로 나누어 대체 가능한 금속 원소의 종류와 전략에 대해 살펴보았고, 이를 응용한 EPeLED 에 대한 연구 동향을 살펴보았다. 등가 원소로 사용된 Sn은 학계에서 다양한 연구들이 진행되어 왔지만, Sn2+에서 Sn4+로 쉽게 산화되는 성질과 Sn 기반 EHP의 박막 형성 과정 중 결정화 속도를 제어하여 균일하고 안정적인 박막을 합성하는 것이 중요하다. 다음으로, 이가 원소 치환 방법은 Pb2+를 1가 또는 3가의 단일 양이온으로 치환하거나 이중 양이온으로 대체할 수 있어 등가 원소 치환 방법보다 다양한 Bi, Sb, Cu 등을 비롯한 이중 양이온들이 연구되고 있으나, 특정한 결정 구조에 따른 낮은 발광 효율과 안정성 문제는 LHP 소재에 비해 매우 떨어지는 상황이다. 다양한 비납계 페로브스카이트 소재 기반 EPeLED 개발을 위해 결함 억제, 비용매 처리, 금속 이온 도핑, 합성 공정 개발 등과 같은 방법들을 통해 효율적인 EHP 발광 소재를 합성하고자 노력하고 있지만, 이와 함께 효율적인 소자 개발을 위해 제조된 EHP 발광층의 물리적/전기적 성질, 박막 표면 개질에 따른 인접층과의 계면 특성 제어, 효과적인 전하 주입을 위한 에너지 준위 제어 등 소자 효율을 향상시킬 수 있는 소자 기술들이 함께 연구된다면 향후 차세대 디스플레이 분야에서 핵심적으로 EPeLED가 자리잡을 수 있을 것으로 기대한다.
Acknowledgements
이 논문은 삼성전자 미래기술육성센터의 지원을 받아 수행된 연구임 (과제번호 SRFC-TC2103-03).
References
Biography

◉◉이세린
◉ 2018년–현재 숭실대학교 유기신소재· 파이버공학과 학사과정

◉◉정재근
◉ 2017년–현재 숭실대학교 유기신소재· 파이버공학과 학사과정

◉◉이병현
◉ 2017년–현재 숭실대학교 유기신소재· 파이버공학과 학사과정

◉◉김도영
◉ 2017년–현재 숭실대학교 유기신소재· 파이버공학과 학사과정

◉◉김현우
◉ 2017년–현재 숭실대학교 유기신소재· 파이버공학과 학사과정

◉◉박민호
◉ 2013년 포항공과대학교 신소재공학과 석사
◉ 2017년 포항공과대학교 신소재공학과 박사
◉ 2019년 서울대학교 재료공학부 박사후연구원
◉ 2021년 삼성디스플레이 책임연구원
◉ 2021년–현재 숭실대학교 유기신소재· 파이버공학과 조교수