차세대 리튬금속 음극의 기술적 이슈와 연구 전략
Perspectives on the development of advanced lithium metal anode
Article information
Trans Abstract
The demand for high-energy Li batteries is rapidly increasing due to the growing market for electric vehicles and portable electronic devices. Lithium (Li) metal has been considered as an ideal anode for high-energy Li batteries because of its high theoretical capacity (3860 mAh g-1) and low redox potential (−3.04 V vs. SHE). However, the utilization of Li metal anode is still limited by fundamental problems associated with unavoidable dendritic growth and huge volume changes during cycling. To improve the electrochemical performance of Li metal anode, various strategies have been explored including electrolyte design, interfacial engineering, and structural modifications. One of the most promising approaches is to store Li metal in porous host materials, which can effectively suppress the formation of Li dendrite and volume expansion. Herein, we focus on recent progress in the development of advanced Li metal anodes and suggest research directions and design rules.
1. 서론
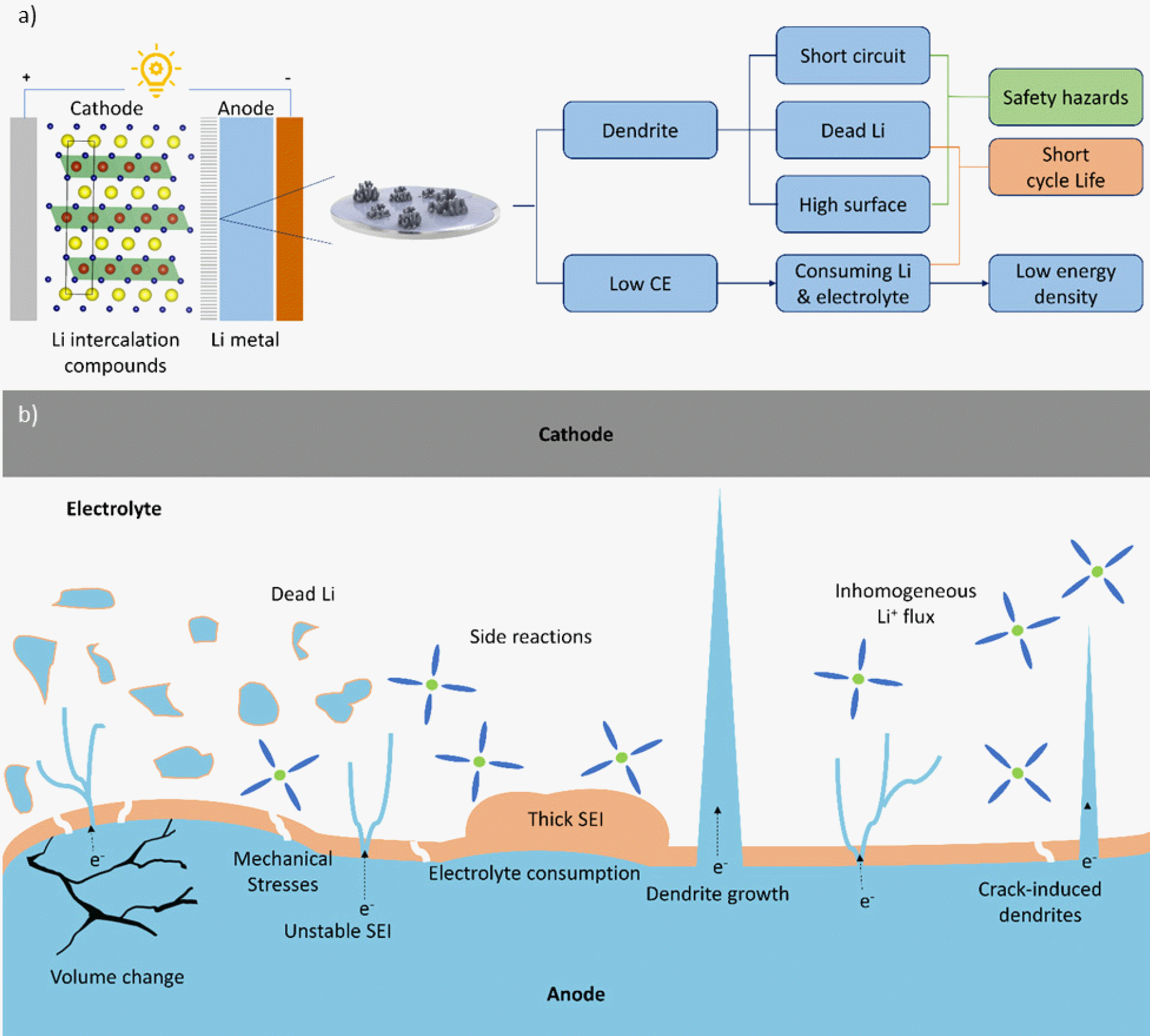
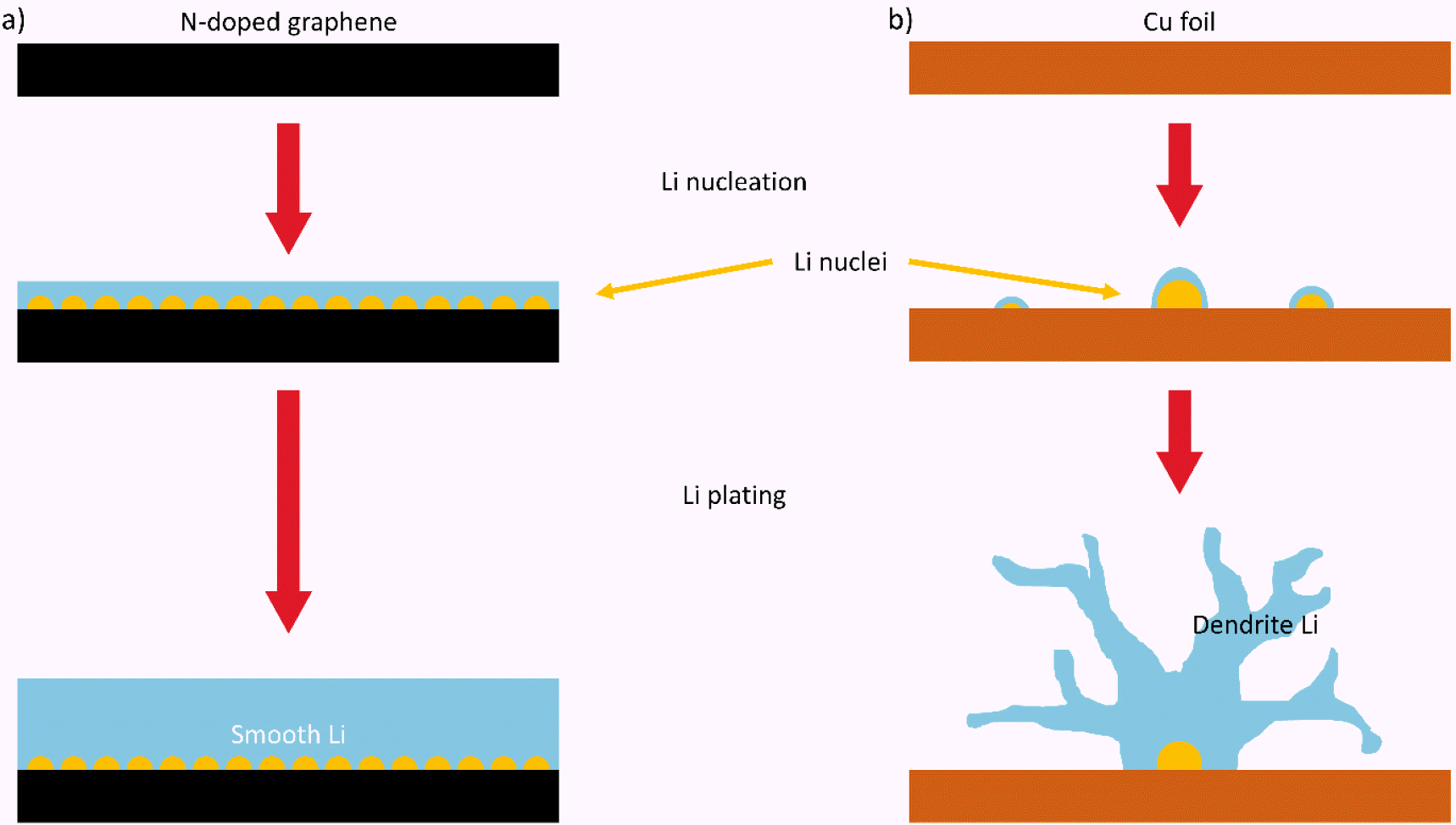
최근 전기자동차와 휴대용 전자기기의 급속한 발전으로 인해, 지속적인 에너지의 저장과 사용이 가능한 이차전지에 대한 수요가 증가하고 있다.[1] 상용 리튬이온전지는 흑연을 음극으로 사용하여 리튬이온의 가역적인 삽입/탈리 반응에 기반하여 에너지를 저장한다. 하지만 리튬이온전지는 흑연의 낮은 이론용량 때문에 에너지밀도의 한계를 마주하고 있으며, 다양한 수요 대응을 위해 추가적인 에너지밀도 향상이 반드시 필요한 실정이다. 이러한 기술적 한계를 극복하기 위해 높은 에너지밀도를 구현할 수 있는 다양한 차세대전지에 대한 관심이 높아지고 있다.[2] 특히, 리튬금속은 가장 높은 이론용량(3860 mAh g-1)과 가장 낮은 표준환원전위(−3.04 V vs. standard hydrogen electrode)로 인해 차세대전지의 유망한 음극으로 고려되고 있다.[3] 하지만 리튬금속은 높은 반응성 때문에 반복적인 충방전 시 지속적인 SEI의 형성과 분해를 유도하고 전해질의 고갈을 초래하며, 나아가 비가역적인 리튬수지상 형성과 심각한 극심한 부피변화를 유발하는 치명적인 약점을 가지고 있다. 이는 결국 쿨롱효율과 수명특성을 저하시키고, 반응에 참여하지 못하는 ‘dead’ 리튬을 형성하며, 결국 전지의 내부단락 및 안전성 문제로 이어진다(Fig. 1.a 참고). 따라서 리튬수지상의 성장을 억제하는 것은 리튬금속 음극의 상용화를 위한 반드시 극복해야 할 과제이다.[4,5]
실제로 리튬금속을 음극으로 사용한 일차전지는 이미 1970년대에 상용화되었으며, 계속해서 리튬금속 음극을 이차전지에 적용하려는 시도가 있었다. 1980년 대 Moli Energy는 MoS2 양극과 리튬금속 음극을 적용한 이차전지를 개발했지만, 충방전 시 리튬수지상 제어가 어려워 심각한 안전성 문제로 상용화에 실패했다.[6,7] 이후 리튬금속 음극을 대신하여 탄소계 음극을 기반으로 한 리튬이온전지가 성공적으로 상용화 되어 현재까지 널리 사용되고 있다.[8] 하지만 최근 높은 에너지밀도를 갖는 차세대전지에 대한 요구가 증가함에 따라 리튬금속 음극의 필요성이 다시 대두되고 있으며, 리튬금속 음극을 안전하게 사용하기 위한 다양한 연구가 활발하게 진행되고 있다. 리튬금속 음극은 차세대전지 구현을 위한 궁극적인 목표이지만, 이를 위해서 다양한 기술적 문제가 해결되야 한다. 특히 반복된 충방전으로 인한 리튬수지상 형성과 심각한 부피변화와 더불어 ‘dead’ 리튬 형성 등의 문제 해결을 위한 혁신적인 기술 개발이 필요하다. 이에 본 기고문에서는 차세대전지 개발에 있어서 리튬금속을 음극으로 사용하기 위한 실용적인 전략 중 리튬금속저장체의 개발 및 응용에 대해 주목하고자 하며, 다양한 선행연구 결과를 바탕으로, 리튬금속 음극을 상용화하기 위한 구체적인 전략을 제시하고자 한다. 다공성 리튬금속저장체는 전지의 무게당 용량을 일부 감소시키는 단점이 있지만, 전극 부피변화와 리튬수지상 성장을 효과적으로 억제하여 리튬금속의 근본적인 문제를 해결하기 위한 효과적인 방향성을 제시할 수 있다.
2. 본론
2.1 리튬금속 음극의 열화 요인
Fig. 1.b 에서 확인할 수 있듯이, 리튬금속 음극의 열화는 충방전 동안 발생하는 전극 부피변화와 불안정한 SEI 형성 및 리튬수지상의 성장과 밀접한 연관이 있다.[9] 특히 리튬금속 전극의 부피팽창은 SEI의 불안정성과 기계적 응력을 발생시키며, 반복되는 충방전으로 인해 형성된 두꺼운 SEI는 높은 계면저항을 유발한다. 전극 표면이 불균일한 경우, 국부적으로 리튬 전착이 집중되어 리튬수지상이 형성되고, 리튬수지상은 지속적으로 성장하여 리튬이 용출되는 과정에서 전극 표면에서 분리되어 전기적으로 비활성인 ‘dead’ 리튬을 형성하거나 양극과 접촉하여 내부단락을 일으킬 수 있다.[10]
2.1. 1. 심각한 부피변화
흑연 음극은 리튬이온의 삽입/탈리 반응에 의해 약 10% 정도의 부피변화가 발생하지만, 이에 비해 리튬금속 음극은 리튬이온이 전극 구조 내로 삽입되지 않고 표면에서 전착/용출 반응에 의해 저장/방출되면서 극심한 부피변화가 발생한다.[11] 실제로 리튬금속 음극은 충방전 과정에서 최대 수십 마이크로미터까지 두께가 변할 수 있으며(Fig. 1.b 참고), 이러한 심각한 부피변화는 전극 내부에서 과도한 기계적 응력을 유도하고, SEI 의 불안정성을 유발하며, 전극과 전해질 사이 계면저항을 증가시켜 결국 가역용량의 감소로 이어진다.[12,13]
2.1.2. 불안정한 SEI (Solid-electrolyte interphase) 형성
충전 시 음극은 전해질과의 화학적 부반응에 의한 부산물로 인해 부동태 피막인 SEI가 형성된다. SEI는 전해질의 종류에 따라 조성과 구조가 결정되며, 리튬이온 전도특성을 가지고 전해질과 전극의 접촉을 차단하여 추가적인 부반응을 억제하는 역할을 한다. 그러나 리튬금속 음극은 높은 반응성과 큰 부피변화로 인해 형태와 두께가 일정하지 않은 불안정한 SEI의 형성을 유도한다. Fig. 1.b 에 나타낸 바와 같이, 불안정한 SEI는 두꺼울수록 높은 계면저항을 유발하며, 얇을수록 전해질과의 부반응으로부터 전극을 보호할 수 없다.[14] 또한 반복적인 충방전에 의해 파괴된 SEI를 보상하기 위해 지속적인 부반응이 일어나면 리튬이온이 소모되어 비가역적인 리튬의 고갈이 발생하며, 이는 리튬금속전지의 가역용량과 쿨롱효율을 저하시킨다.[15]
2.1.3. 리튬수지상 성장
앞서 언급한 리튬수지상 형성은 일반적으로 리튬이온이 리튬금속 표면에 전착되는 과정에서 일어나는 일반적인 현상이다. 전해질 내에 있는 리튬이온은 전자를 얻고 리튬금속 음극 표면에서 환원되어 다양한 형상과 크기를 갖는 3차원 수지상 구조를 형성한다.[16,17] 충전 시 리튬이온은 ‘tip effect’에 의해 더 강한 전기장과 큰 활성표면을 갖는 리튬수지상 표면에 우선적으로 전착되고 이로 인해 지속적으로 불균일한 리튬금속 전착이 유도된다. 이 과정에서 리튬수지상 형성에 따른 표면적 증가로 인해 전해질과의 부반응이 가속화된다(Fig. 1.b 참고). 이와 더불어 리튬수지상의 성장은 리튬이온이 용출되는 과정에서 전기적으로 비활성인 ‘dead’ 리튬을 형성할 수 있으며, ‘dead’ 리튬은 전기화학 반응에 참여하지 못하므로 충방전이 반복됨에 따라 리튬금속 음극의 표면에 누적되어 계면저항을 증가시킨다. 또한, 리튬수지상의 성장은 분리막을 관통하고 양극 표면에 도달할 수 있으며, 이는 전지의 내부단락을 유발하고 나아가 화재 및 폭발 등의 안전 문제를 발생시킬 수 있다.
2.2 리튬금속전지 연구동향
리튬금속 음극의 상용화를 위한 연구는 리튬수지상 형성과 부피변화를 억제하는 것을 중점으로 하고 있다. 이를 위해 전해질을 제어하거나 전극과 전해질 간 계면을 제어하는 방법, 그리고 리튬금속저장체를 도입하는 방법 등 다양한 전략이 제시되고 있다. 이러한 연구들은 안정적이고 효과적인 리튬금속 음극의 개발을 위해 중요하며, 이를 통해 차세대 전지 기술의 발전에 큰 기여를 할 것으로 기대된다.
2.2.1. 기능성 전해질 및 첨가제 설계
전해질의 물성은 리튬수지상의 성장에 매우 밀접한 영향을 끼치기 때문에, 균일한 리튬의 전착을 유도할 수 있는 전해질 및 첨가제에 대한 연구가 활발하게 진행되고 있다. 최근 리튬 염의 농도가 높을 때 전기화학적 안정성이 증가하고 리튬수지상의 형성을 효과적으로 억제할 수 있다는 이론이 제시되면서, 다양한 고농도 전해질에 대한 연구가 보고되고 있다. 예를 들어, 7M lithium bis(trifluoromethanesulphonyl)imide (LiTFSI) 전해질은 리튬-황 전지의 주요한 문제점 중 하나인 리튬폴리설파이드의 용출을 감소시키면서, 반복적인 충방전 과정에서 리튬수지상의 성장을 효과적으로 억제할 수 있었다.[18]
한편, 전해질 첨가제는 매우 적은 양으로도 긍정적인 효과를 발휘할 수 있기 때문에, 전해질에 기능성 첨가제를 도입하는 것도 효율적인 방법으로 여겨진다. 최근 연구결과에 따르면, 카보네이트계 전해질에 세슘이온 혹은 루비듐이온을 첨가제로 사용하여 리튬수지상의 형성을 효과적으로 제어할 수 있었다.[19] 세슘이온은 리튬이온보다 높은 표준환원전위를 가지고 있지만 (Cs+: −3.026 V, Li+: −3.040 V) 리튬이온에 가까운 표준환원전위를 가지기 때문에, 네른스트식에 따라 세슘이온의 농도가 훨씬 낮은 경우 리튬이온보다 낮은 유효 환원전위를 가질 수 있다. 따라서 Fig. 2.a 에 나타낸 바와 같이, 불균일한 리튬 전착이 발생하면 전하가 집중된 팁 부근에 세슘이온이 환원되지 않고 흡착되어 팁 부근으로의 리튬이온 접근과 환원을 막아주어, 결과적으로 리튬수지상 형성을 억제할 수 있다.

a. Schematic illustration of the Li deposition process by introduction of cationic additives.[19] b. Schematic illustration of the Li3 PO4-modified Li metal anodes during SEI formation and cycling.[20] c. Schematic illustration of Li metal modified with a hollow carbon nanosphere layer during Li deposition, dissolution, and cycling.[21]
2.2.2. 안정한 SEI 및 보호막 설계
부동태 피막인 SEI의 안정성은 리튬금속의 표면에서 리튬이온의 전착/용출 거동 및 수명특성에 직접적인 영향을 미치기 때문에, SEI 물성제어는 리튬금속 음극을 적용하기 위한 중요한 인자이다. 리튬금속 음극의 안정적인 전기화학 거동을 유도하기 위해 표면에 형성되는 SEI는 가능한 균일하고 얇아야 하며, 높은 이온전도도와 탄성강도를 가져야 한다.
충방전 중에 리튬금속과 전해질 사이 화학반응에 의해 형성되는 SEI는 부산물의 종에 따라 화학적 및 기계적 물성의 차이가 발생한다. 그러나 전지 구동 중 화학반응을 제어하여 원하는 물성의 SEI를 도입하는 것은 어렵기 때문에 리튬금속 음극 표면을 사전에 개질하는 전략이 연구되었다. 예를 들어, SEI 구성물질 중 LiF는 카보네이트계 전해질에 대한 용해도가 낮고 높은 화학적 안정성으로 인해 우수한 물질로 평가되고 있다. LiF 가 풍부한 SEI는 리튬수지상의 성장을 억제할 수 있을 정도의 기계적 강도를 가지고 화학적으로 안정하여 전해질 사이에서 일어나는 부반응을 억제할 수 있다. 마찬가지로 Li3 PO4는 또한 우수한 화학적 안정성과 높은 young's modulus 때문에 리튬수지상 형성을 효과적으로 억제한다. 최근 습식 화학처리를 통한 얇고 균일한 Li3 PO4 기반의 SEI는 우수한 이온전도도와 화학적 안정성, 그리고 높은 young's modulus를 가진다. 이를 통해 리튬수지상 형성 억제 및 수명특성 개선 효과를 검증하였다(Fig. 2.b 참고).[20]
한편, 화학반응을 통한 SEI물성제어와 달리, 리튬금속 표면에 물리적인 보호막을 도입하는 전략은 민감한 반응조건을 제어할 필요가 없다. SEI는 보호막 상부에 형성되고 리튬이온은 보호막을 자유롭게 통과하여 보호막 아래에서 리튬금속으로 환원된다. Cui 그룹은 이상적인 계면을 구현하기 위해, 다공성 비정질탄소 보호막을 제안했다. 얇은 비정질탄소 보호막은 계면저항을 증가시키지 않으면서도, 우수한 기계적강도와 화학적 안정성을 바탕으로 리튬수지상의 성장을 효과적으로 억제할 수 있다. Fig. 2.c 에 나타낸 바와 같이, 충전 시 안정적인 SEI가 다공성 비정질탄소 보호막 위에 형성되며 리튬금속은 비정질탄소층 아래에 전착되는 것으로 나타났다.[21] 제안하는 보호막을 도입한 리튬금속 음극은 리튬수지상 형성 없이 150 사이클 동안 쿨롱효율과 수명특성이 개선되었다.
2.2.3. 3차원구조 리튬금속전극
리튬금속 음극의 부피변화를 최소화하기 위한 전략 중 3차원 다공성 구조를 갖는 리튬금속저장체를 사용하는 전략이 소개되었다. 리튬금속저장체는 충분한 내부기공을 가지고 있어 리튬금속을 안정적으로 수용할 수 있으며, 친리튬성 특징을 가지기 때문에 리튬수지상의 형성 없이 안정적인 리튬금속의 저장을 유도할 수 있다. Cui 그룹은 환원된 그래핀 옥사이드(rGO) 필름 내 리튬을 저장하여 리튬금속이 안정적으로 저장될 수 있는 복합리튬금속 음극을 제안하였으며, 이 복합음극은 충방전 동안 부피변화가 작고(∼20%) 우수한 기계적 강도를 가진다. 스파크 반응을 통해 제조된 rGO 필름은 리튬금속 저장을 위한 공간을 제공한다. rGO 필름의 독특한 친리튬성은 가장자리가 용융된 리튬금속과 접촉하는 것만으로도 리튬이 rGO 필름에 주입될 수 있게 유도한다(Fig. 3.b 참고).[22] 또한 복합리튬금속 음극은 카보네이트계 전해질에서 리튬수지상 형성 없이 높은 가역용량과 낮은 과전압을 바탕으로 우수한 출력특성을 구현하였다.

a. In a conventional 2D planar current collector, the Li+ flux is concentrated at the tips of small Li dendrites, which will finally lead to the formation of dendritic and mossy Li.[26] b. Schematic of the material design and the consequent synthetic procedures from a GO film (left) to a sparked rGO film (middle) to a layered Li–rGO composite film (right).[22] c. In a 3D porous current collector, Li is likely to nucleate and grow at the protuberances on the inner surface of the pores, thus Li+ will distribute evenly on the surface of the collector and few Li dendrites will be formed. [26]
리튬금속저장체의 우수한 리튬친화도는 용융된 리튬 주입을 위한 필수적인 조건이지만 대부분의 물질은 용융된 리튬에 대한 친화도가 높지 않다. 따라서 얇고 균일한 Si[23] 또는 ZnO[24]의 표면코팅을 통해 리튬금속저장체의 리튬친화도를 제공하는 전략은 이러한 문제를 해결하기 위한 새로운 방향성을 제시해 준다. Si 또는 ZnO와 용융된 Li 사이의 자발적인 반응은 리튬금속저장체 표면에 더 많은 친리튬성 부산물(Lix Si 및 Lix Zn/Li2 O)을 제공하며, 리튬친화도를 개선을 통해 충방전 동안 부피변화 감소 및 수명특성 향상 효과를 검증하였다.
2.3 3차원 리튬금속저장체 기반 전극 기술
3차원 다공성 리튬금속저장체의 도입은 무게당/부피당 에너지밀도의 손실이라는 단점이 있지만, 합리적으로 설계된 리튬금속저장체를 사용하면 충방전 과정에서 발생하는 리튬수지상 형성과 심각한 부피변화를 효과적으로 해결할 수 있다. 이를 통해 리튬금속 음극의 상용화를 위한 기반을 마련하고, 나아가 고에너지밀도 차세대전지 구현에 활용할 수 있을 것으로 기대된다.
2.3.1. 3차원 리튬금속저장체 기공구조 제어
큰 기공부피와 높은 비표면적을 갖는 3차원 리튬금속저장체 개발은 리튬금속전지의 성능을 향상시키기 위한 합리적인 전략이다.[25] 다공성 리튬금속저장체는 높은 비표면적을 통해 전극 표면에 대한 유효 전류밀도를 감소시키며, 리튬이온 확산을 위한 더 많은 경로를 제공하여 계면저항을 감소시킬 수 있다. 다공성 리튬금속저장체를 합성하기 위한 다양한 템플릿 공정 기반 기공구조 제어 기술이 보고되고 있으며, 이는 비용이 저렴하고 공정이 용이하여 큰 관심을 받고 있다.
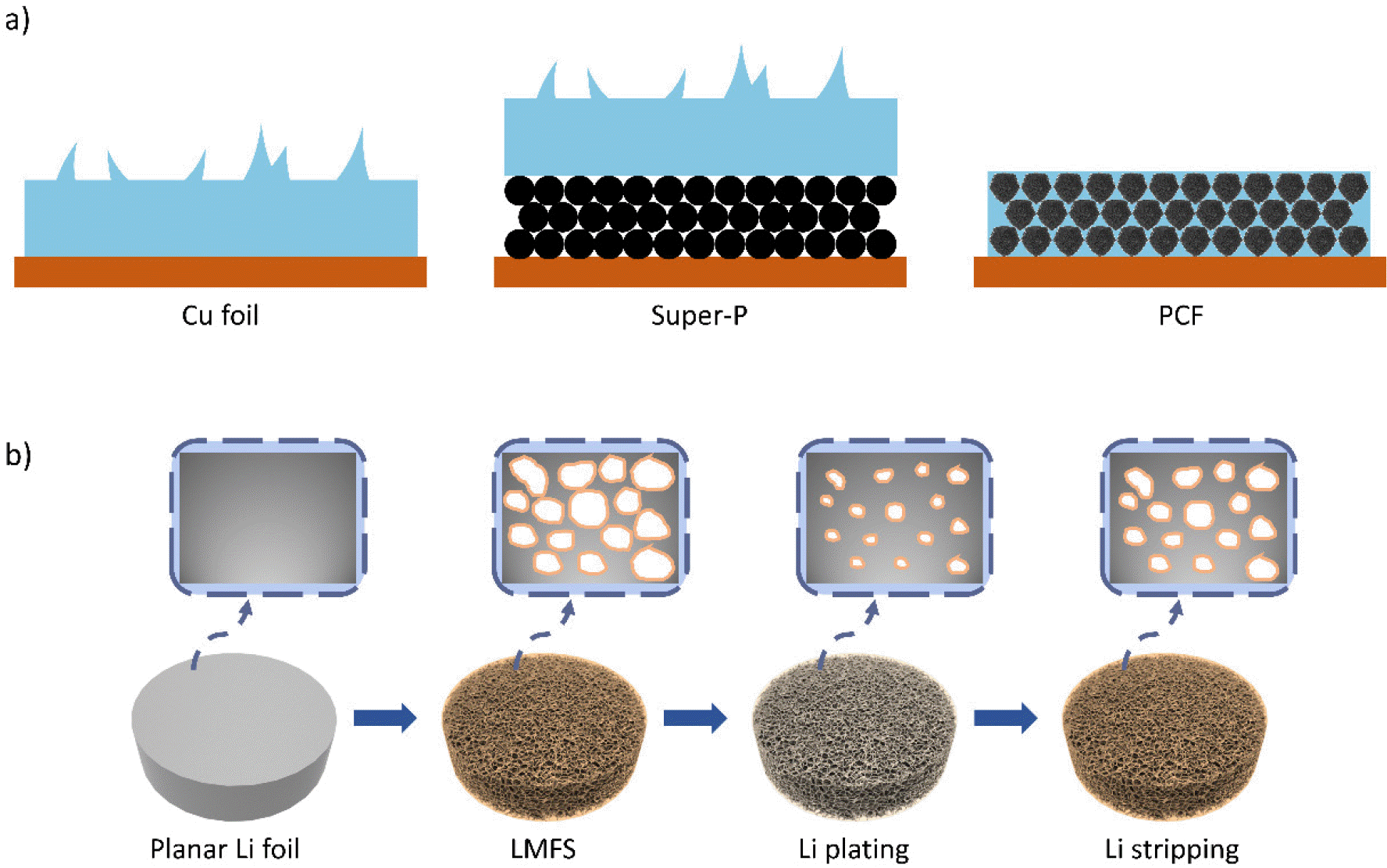
Yang 그룹은 구리-아연 합금 테이프의 아연금속을 HCl과 NH4 Cl 혼합 용액으로 제거하여 구리금속에 연속적인 미세 기공구조를 형성하는 간단한 합금분해 공정을 제안했다.[26] 기공이 형성된 다공성 리튬금속저장체는 큰 비표면적(11 m2 g-1)과 효과적으로 리튬을 저장할 수 있는 충분한 공간을 제공하며, 유효 전류밀도를 감소시키는데 큰 역할을 한다. 기존 구리 집전체는 사이클 수가 증가할수록 전극이 두꺼워지고 불균일한 전착이 발생하였지만, 다공성 리튬금속저장체는 안정적인 전극구조를 유지하여 전극의 두께 변화와 리튬수지상의 형성을 억제하였다(Fig. 3.c 참고).
3차원 탄소 소재는 리튬금속 음극 적용을 위한 리튬금속저장체 후보 중 하나로, 비용 효율성, 쉬운 합성 및 기능화, 제어 가능한 미세구조, 전기전도도 및 높은 비표면적 등의 이점이 있다. Kim 그룹은 ZIF-8을 기반으로 하는 다공성 탄소 구조체(PCF)를 리튬금속저장체로 활용하였다.[27] ZIF-8은 MOF의 한 종류이며 Zn 클러스터와 이미다졸 연결체로 구성된 유-무기 하이브리드 물질이다. ZIF-8은 간단한 탄화공정을 통해 기공의 크기와 분포를 제어할 수 있으며, 균일하게 분산된 Zn과 N은 리튬친화도 및 전기전도도를 향상시키는 데 도움이 된다. 결과적으로 리튬친화도를 확보하고 기공구조를 제어한 PCF 전극은 리튬수지상 형성 없이 균일한 리튬의 전착을 유도하고 리튬 금속화 반응에 대한 과전압을 감소시켰다(Fig. 4.a 참고).
3차원 구조체를 도입하지 않고 리튬금속 자체의 구조를 제어하는 전략은 리튬금속 음극 사용을 위한 유용한 전략이다. 리튬분말 전극은 비표면적을 크게 증가시켜 리튬수지상 형성을 억제할 수 있어 2차원 리튬박막의 대체물로 제안되었다.[28]
Zhu 그룹에 의해 개발된 다공성 리튬폼은 기공을 통해 내부 및 외부 전극표면에 균일한 전해질 분포를 유도하고, 더 큰 활성 비표면적을 통해 유효 전류밀도를 감소시켰다.[29] 이러한 다공성 리튬폼은 전극의 부피팽창을 수용하고, 효율적인 열 방출을 유도할 수 있다. 또한 DFT 계산을 통해 리튬금속 표면과 전해질이 접촉할 때 리튬이온 흡착을 위한 활성화에너지가 진공상태 대비 0.24 eV만큼 더 안정하다는 것을 검증하여, 균일한 전해질 분포가 리튬수지상 형성을 억제할 수 있음을 보여주었다. Yan 그룹은 4-dodecylbenzene sulfonic acid 에칭을 통해 리튬박막 내 기공을 형성하고, 동시에 기능성 표면층으로서 LDBS(Liodecyl benzene sulfonate)층을 도입한 다공성 리튬폼(LMFS)을 설계하였다(Fig. 4.b 참고).[30] 다공성 리튬폼은 충방전간 전극의 부피변화를 완화하고, 기공 내부에 리튬을 저장함으로써 리튬수지상 형성을 억제한다. 또한 LDBS층은 계면에서 리튬이온 확산을 위한 균일한 전기장을 유도하여 내부 기공 활용도를 높이고, 전해질과 Li 금속 사이의 부반응을 제한할 수 있다.
2.3.2. 3차원 전극구조 제어
리튬금속저장체 섬유를 기반으로한 3차원 섬유 네트워크는 독특하고 탁월한 기능성으로 인해 리튬금속저장체로 널리 사용되고 있다.[31] 3차원 섬유 네트워크는 기공이 풍부하여 리튬금속을 저장하고 부피변화를 억제할 수 있는 공간을 제공한다. 유연한 마이크로/나노 섬유 네트워크는 리튬 전착에 따라 팽창하여 리튬수지상 성장의 원동력으로 알려진 음극 내 압축 응력을 완화하도록 유도한다. 또한 3차원 섬유 네트워크는 집전체를 사용하지 않고도 에너지밀도를 증가시키기 위한 독립형 전극으로도 사용할 수 있다. 리튬금속저장체 섬유는 정전기 방사, 습식 화학 반응, 열 산화, 화학 기상 증착 등의 전략을 사용하여 합성할 수 있다. 그러나 일반적으로리튬금속저장체 섬유의 전기전도도와 기계적 안정성을향상시키기 위해서는 추가적인 절차가 필요하다.[32] 예를 들어, 전기 방사법에 의해 얻어진 고분자 섬유는 탄화를 통해 전기전도도가 향상시킬 수 있다.
탄소섬유는 나노 단위에서 마이크로 단위까지 다양한 직경을 가진 1차원 구조를 가지며, 높은 기계적 강도와 대량 생산이 가능하다는 비용적 강점이 있다. Guo 그룹은 흑연화 탄소섬유(GCF)을 기반으로 한 3차원 네트워크가 비표면적 및 기공구조 확보를 통해 유효 전류밀도를 감소시키고 충방전에 의한 부피변화의 효과적인완화 효과를 보고했다.[33] 또한 GCF 기반 네트워크는집전체의 역할을 수행하며, 리튬의 전착 반응을 통해 8 mAh cm-2의 높은 면용량을 제공하면서도 리튬수지상이 형성되지 않았다(Fig. 5.a 참고).
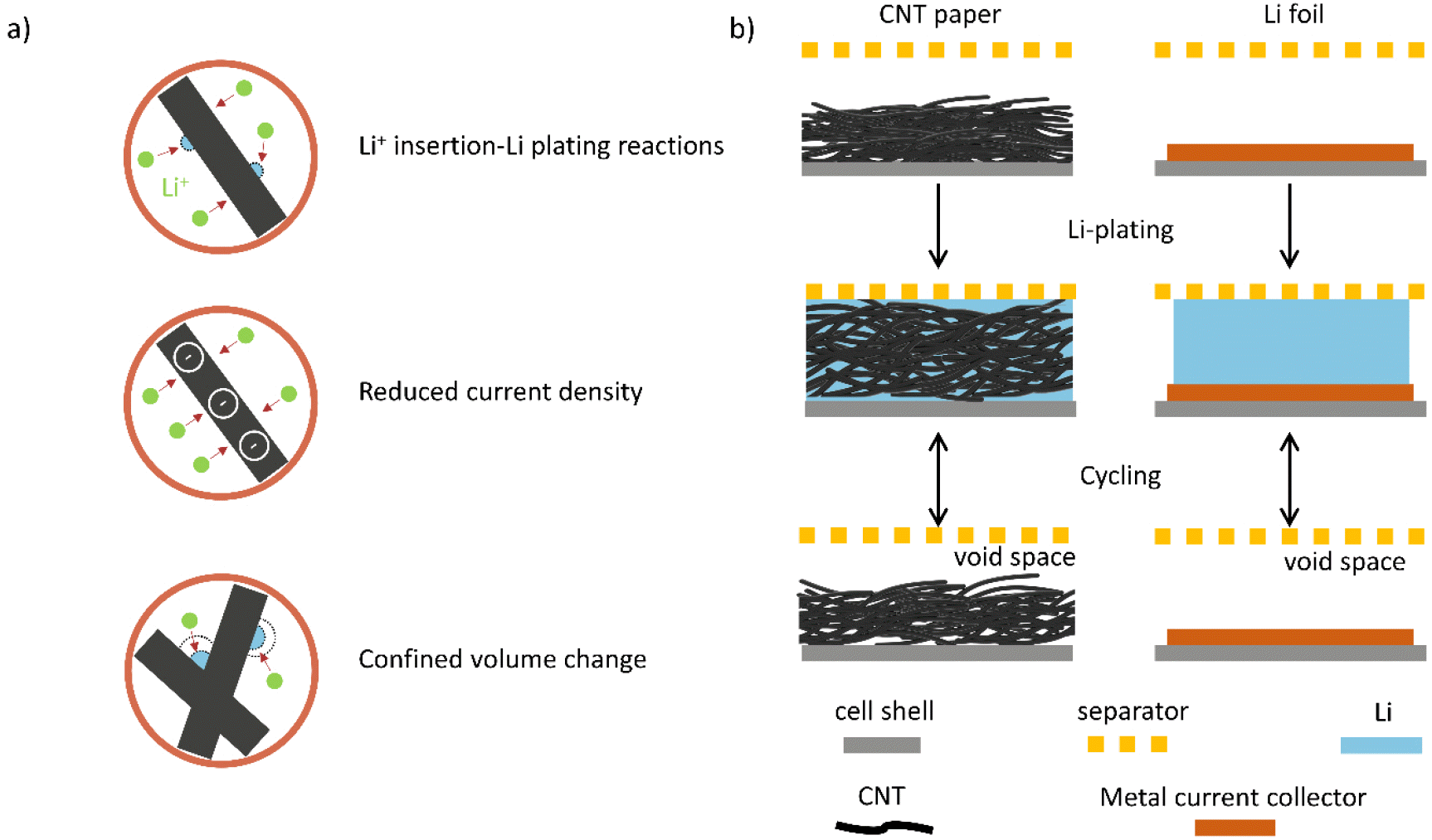
Ji 그룹은 높은 비표면적(118 m2 g-1)과 인장강도(σ = 27 MPa)를 갖는 독립형 탄소나노튜브(CNT) 섬유를 이용하여 비표면적과 기계적 특성을 더욱 개선했다.[34] Li/CNT 네트워크 전극의 리튬 전착 및 용출에 의한 두께변화는 27.6 μm이었으며, 이는 리튬금속 박막의 두께 변화인 48.5 μm보다 현저히 감소한 것으로 CNT 기반 복합전극의 부피팽창 억제 효과를 검증한 결과이다(Fig. 5.b 참고). 또한 CNT 기반 리튬금속저장체 섬유는 sp2-하이브리드 탄소로 만들어져 높은 전도성(σ = 1.1 × 105 S m-1)을 가지며, 리튬수지상 형성을 효과적으로 억제하고 높은 쿨롱효율을 유지할 수 있었다.
곡률이 높은 영역에서 전하밀도가 집중된다는 이론이제시되었고, 수직 배열 구조를 가지는 다공성 전극에 대한 연구가 보고되고 있다. 높은 곡률로 인해 다공성 채널 내부의 국소 전류밀도는 전극의 상부 표면보다 크기때문에 리튬금속이 다공성 채널 입구 내부에 전착되는경향이 있다. 게다가 계곡과 같은 배열 구조는 리튬이온플럭스와 전기장의 분포를 고르게 하여, 리튬의 균일한전착을 유도할 수 있다. 배열 구조를 갖는 리튬금속저장체 전극 제조법은 압연과 반복 적층 등의 다양한 방식을 사용한다. Yang 그룹은 리튬과 구리동박을 이용하여 Li-Cu-Li 배열의 전극을 만드는 새로운 제조전략을 개발했다(Fig. 6.a 참고). 동일한 크기의 리튬과 구리동박을 압연 처리 후 절단하여 Li-Cu-Li 배열의 전극을 제조했다. 이러한 독특한 구조는 배열의 두께와 간격에 따라 리튬금속의 전착/용출뿐만 아니라 리튬이온 플럭스와 전기장까지 제어할 수 있어 리튬수지상 형성을 억제하고 리튬금속전지 상용화를 위한 새로운 전망을 보여준다.[35]
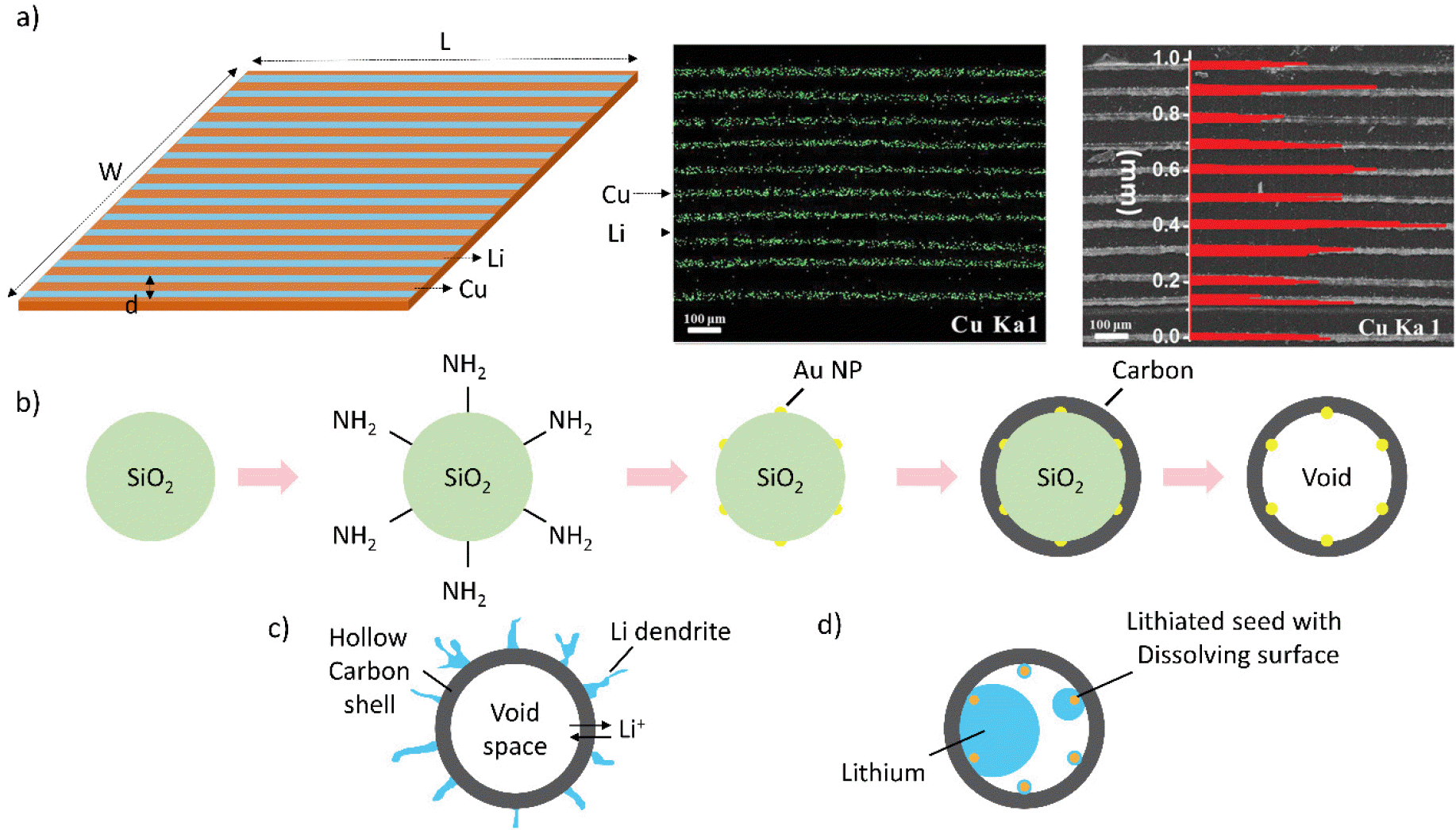
a. Schematic illustration of vertically oriented Li-Cu-Li arrays, with controllable length (L), width (w), and thickness (d). Elemental mapping image of the vertically oriented Li-Cu-Li arrays.[35] b. Synthesis procedure of hollow carbon shells loaded with Au NPs inside. Schematic of c. hollow carbon shells and d. hollow carbon shells loaded with Au NPs after Li deposition.[38]
2.4 리튬친화도 제어
3차원 리튬금속저장체의 도입에 대한 다양한 검토가 이루어졌지만, 여전히 다공성 구리 및 탄소와 같은 일부 소재는 리튬친화도가 낮다는 단점이 있다. 리튬친화도가 충분하지 않은 다공성 리튬금속저장체는 내부 기공보다 상부 표면에서 리튬금속의 우선적인 전착이 발생하고 리튬수지상이 지속적으로 성장하는 것이 확인되었다.[36] 결국 충방전 이후에 3차원 다공성 구조는 2차원 평면으로 변형되어 리튬수지상 성장을 억제하는 특성을 잃는다. 따라서 기공구조 내에서 리튬 전착을 유도하고, 계면에서 리튬이온의 분포를 조절하기 위해 리튬금속저장체의 리튬친화도를 개선하는 것이 중요하다.
2.4.1. 리튬친화도 제어: 표면개질
리튬 전착의 초기 단계는 리튬금속저장체 표면에서의 리튬 핵생성 과정이며, 리튬에 대한 높은 친화도를 가지는 표면은 리튬 핵생성 및 전착을 용이하게 한다는 것이 입증되었다.[37] 리튬금속과 소재 표면 간 결정구조 불일치는 표면에너지를 증가시키며, 이는 리튬금속의 핵생성 장벽에 영향을 미치는 핵심 요소이다. 소재의 표면개질을 통한 리튬친화도 개선 전략은 전착되는 리튬금속과의 구조 불일치를 완화하고 리튬 핵생성 장벽 및 과전압을 효과적으로 낮출 수 있다.
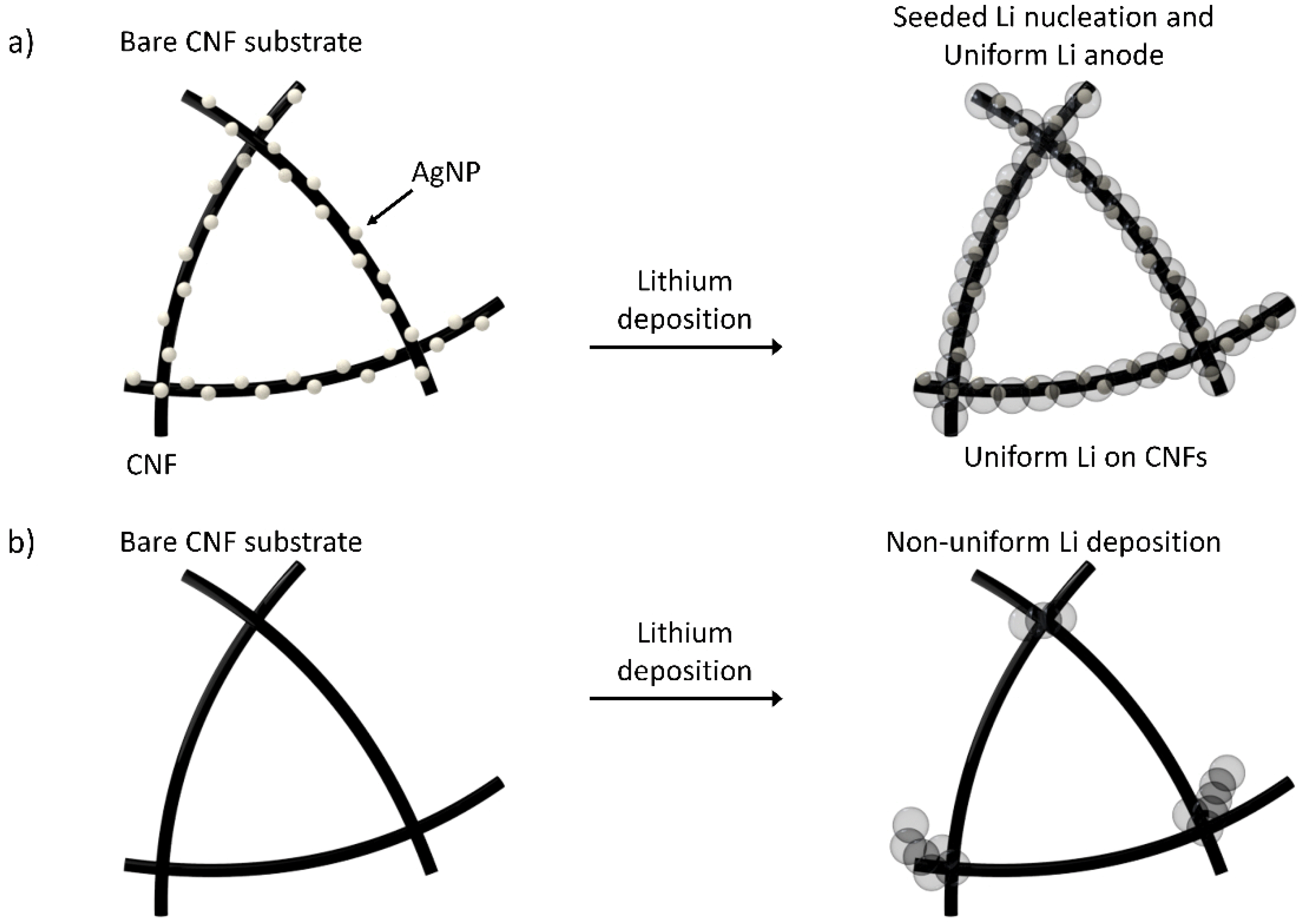
Cui 그룹은 다양한 금속 표면 위에서의 리튬 핵생성 과전압을 측정하였고, 일부 금속(Au, Ag, Sn, Si, Zn, Mg, Al, Pt)은 리튬과 반응하여 합금을 형성할 뿐만 아니라, 특정 온도에서 리튬에 대한 용해도를 가지기 때문에 리튬 전착 중에 과전압을 저감하는 것을 보고했다.[38] 리튬과 금속 표면 사이의 반응에 의해 먼저 리튬 상이 형성되며, 리튬 상은 이어지는 리튬 전착을 위한 핵생성 장벽을 감소시키는 완충층으로 작용한다. 반면, 리튬에 대한 용해도가 없는 다른 금속(Cu, Ni, Sn)의 경우 리튬 전착에 대한 과전압이 증가하는 것을 확인할 수 있었다. Fig. 6.b 에 나타난 바와 같이, Cui 그룹은 화학적 에칭을 통해 다공성 탄소나노캡슐을 합성하였으며, 캡슐 내에 Au 나노입자를 도입하였다. 다공성 탄소나노캡슐 내의 Au 입자는 리튬과 합금을 형성하여 다공성 탄소 구조 내로 리튬금속의 전착을 유도하며 리튬수지상 성장을 억제하는 것이 검증되었다. 이에 따라 다공성 탄소나노캡슐은 카보네이트계 전해질에서 300사이클 동안 98%의 쿨롱효율을 유지하면서 안정적인 수명특성을 확보하였다.[38] 이와 유사하게 Hu 그룹은 리튬 핵생성을 유도할 수 있는 Ag 나노입자를 탄소나노섬유 표면에 균일하게 분산시켰다(Fig. 7 참고).[39] Ag 나노입자는 리튬 핵생성 과전압을 효과적으로 감소시키고 리튬수지상 형성 없이 3차원 탄소 네트워크에서 균일한 리튬 전착을 유도하여 가역성을 향상시키고 수명특성을 개선하였다.
표면개질을 통한 리튬친화도 개선 전략은 장점이 많지만 여전히 고려해야 할 요소가 존재한다.
1) 지지 골격이 없는 단일 친리튬성 소재의 경우 리튬 전착/용출 과정에서 리튬금속저장체의 구조붕괴를 일으킬 수 있다
2) 다공성 구조의 친리튬성 소재는 리튬금속을 수용할 수 있는 공간을 제공하기 위해 작고 균일하게 분포해야 한다.
3) 비표면적이 큰 다공성 소재는 전해질과의 부반응을 증가시키므로 합리적인 구조설계가 필요하다.
2.4.1. 리튬친화도 제어: 이종원소 도입
이종원소 도핑을 통한 리튬친화도 개선 전략은 원자 수준에서 리튬 전착을 더 정확하게 조절할 수 있어 효과적이다. 친리튬성 표면에서의 리튬 전착 거동을 이해하는 것은 효과적인 리튬친화도 개선 전략을 설계하는 첫 단계이다. 리튬이온은 친리튬성 부위에 먼저 흡착되고 전기력, 이온 농도구배 및 정전기적 상호작용에 의해 화학적 결합을 형성한 후 리튬금속으로 환원된다. 핵생성 이론에 따르면, 친리튬성 표면은 리튬이온이 흡착 시 큰 결합에너지를 가지며, 이는 작은 표면에너지를 유도하고 리튬 핵생성 장벽을 감소시킬 수 있다.
Zhang 그룹은 그래핀 나노리본에 리튬친화도를 개선하기 위하여 다양한 이종원소를 도핑 했고, 이러한 이종원소가 도핑된 탄소와 리튬원자 사이의 결합에너지를 계산했으며,[40] 연구 결과를 바탕으로 전기음성도, 국소 쌍극자 측면에서 친리튬성 표면 설계를 위해 고려해야 할 조건을 제시하였다.
1) 루이스 산으로써 리튬이온은 높은 음의 전하를 갖는 루이스 염기에 강하게 끌리기 때문에 이종원소는 리튬이온과 상호작용하기 위해 루이스 염기로 작용해야 한다. O, N, 및 B 작용기는 리튬 핵생성 과전압를 줄일 수 있는 반면 F, Cl, Br, I 및 S 작용기는 리튬원자에 대한 충분한 상호작용을 제공할 수 없다.
2) 강한 국소 쌍극자를 갖는 이종원소가 도핑된 경우 흡착된 리튬이온 주위에 쌍극자를 유도하여 결합에너지를 증가시킬 수 있으며, O과 B 같은 두 종의 이종원소를 동시에 도핑할 경우 큰 국소 쌍극자를 형성하여 결합에너지를 극대화할 수 있다.
이러한 원리는 단층 그래핀뿐만 아니라 2차원 층상 그래핀과 흑연 표면에서도 적용될 수 있다. 예를 들어, Zhang 그룹은 핵생성과 성장을 유도하기 위한 pyridinic N과 pyrrolic N 같은 균일한 친리튬성 작용기를 갖는 그래핀 표면을 설계했다(Fig. 8 참고).[41] DFT 계산 결과 pyridinic N, pyrrolic N의 경우 그래핀(−3.64 eV) 및 Cu(−2.57 eV) 표면과 비교하여 각각 −4.46 eV, −4.26 eV의 비교적 큰 결합에너지를 보이며 이는 리튬과 도핑된 N 원자 사이의 강한 상호작용을 나타낸다. 실제 N 도핑된 그래핀 소재는 0.05 mA cm-2의 전류 밀도에서 Cu 표면 대비 핵생성 과전압을 감소시켰다. 하지만, 일반적으로 N 도핑은 흑연 표면에 pyridinic-N과 pyrrolic-N 외에도 리튬과의 상호작용이 더 약한 작용기를 형성할 수 있으며, 이로 인해 불균일한 리튬 핵생성 및 성장을 유도할 수 있다.
Gong 그룹은 리튬의 핵생성과 성장을 개선하기 위해 황이 도핑된 그래핀 기판을 설계했다.[42] 위 조건과 비교하였을 때, 황 도핑은 상대적으로 낮은 흡착 능력으로 인해 적절한 전략이 아닐 수 있지만, 황 원자는 인접 영역의 전하 상태를 크게 변화시켜 주변 넓은 영역의 리튬 흡착에너지를 증가시킬 수 있다. 황 도핑 표면은 초기 리튬 전착 동안 5개의 유효 핵생성 부위를 보유하며, 이 효과적인 부위는 그래핀 위 분산되어 존재하여 균일한 리튬 전착으로 이어진다. 황 도핑 표면의 확산 상수는 기존 표면과 거의 유사하며 이는 동일한 이온 전달 성능을 유지하거나 흡착 강도가 증가했음에도 응집되는 경향이 없음을 의미한다.
3. 결론
최근 높은 에너지밀도를 갖는 차세대전지에 대한 관심이 높아지면서, 리튬금속을 음극으로 활용하기 위한 연구가 활발히 이루어지고 있다. 리튬금속은 높은 이론용량과 낮은 표준환원전위를 가지고 있어서 매우 이상적인 음극이지만, 충방전시 발생하는 리튬수지상의 성장과 심각한 부피변화로 인해 상용화에 어려움을 겪고 있다. 한편, 리튬금속저장체는 넓은 비표면적과 큰 기공부피 뿐만아니라 우수한 기계적 강도와 전자전도도 등의 특징을 바탕으로 안정적으로 리튬금속을 저장하고 리튬수지상 형성과 부피팽창을 효과적으로 억제할 수 있기 때문에 고성능 리튬금속전지 구현을 가능하게 할 것으로 기대된다. 그러나 이러한 장점에도 불구하고 아직까지 안정적이고 호환성이 높은 리튬금속저장체의 설계 및 개발은 부족한 수준이다. 따라서 본 기고문은 보고된 다양한 전략들을 기반으로 리튬금속저장체 개발에 있어 고려해야 조건을 정리하고, 지향해야 할 방향성을 제시하고자 한다.
1) 리튬금속저장체는 우수한 전기전도도 및 이온전도도, 높은 비표면적과 적절한 기공부피를 가져야 한다. 우수한 전도성 표면은 빠른 전하전달을 가능하게 하여 리튬금속 음극의 출력특성을 크게 향상시킨다. 높은 비표면적은 효율적으로 유효 전류밀도를 낮춰 리튬수지상 성장을 억제하고 균일한 리튬 전착을 유도할 수 있으며, 기공부피는 리튬금속의 저장용량을 결정한다.
2) 리튬금속저장체는 부반응을 억제하기 위해 화학적/전기화학적 안정성이 우수해야 한다. 리튬금속저장체 표면은 부반응으로 인해 기계적 특성이 감소하거나, 불균일한 리튬 전착을 유발하는 불순물(HF, LiOH, Li2 O 등)이 형성될 수 있기 때문이다.
3) 리튬금속저장체는 반복적인 전착/용출 동안 부피변화 및 리튬수지상 성장을 억제시킬 수 있도록 기계적으로 견고해야 한다. 하지만 지나치게 단단한 리튬금속저장체는 전극 내 응력을 완화시키지 못하여 리튬수지상 성장이 더 가속화될 수 있다. 따라서 균일한 리튬 전착을 위해 응력 완화를 용이하게 할 수 있는 적절한 기계적 강도와 유연성이 필요하다.
4) 리튬금속저장체는 리튬수지상 형성 없이 안정적인 리튬 전착을 유도하기 위해서 균일한 표면특성을 가져야 한다. 불균일한 리튬의 전착이 일어나면 국부적으로 리튬이온의 농도가 높아지게 되고, 결국 리튬수지상의 성장으로 이어진다. 친리튬성 표면은 리튬 핵생성 과전압을 낮추고 균일한 리튬의 전착을 유도할 수 있다.
본 기고문은 보고된 연구결과를 기반으로 하여 위와 같은 리튬금속저장체 기반 3차원 리튬금속 전극 개발에 대한 가이드라인을 제시한다. 다공성 리튬금속저장체의 도입은 무게당/부피당 에너지밀도의 손실이라는 단점이 있지만, 합리적으로 설계된 리튬금속저장체는 리튬금속의 근본적인 문제를 해결할 수 있다. 향후 새로운 소재의 개발, 전극 특성화 기술, 셀 최적화 등에 대한 지속적인 연구와 노력이 필요하며, 이러한 연구는 단순히 리튬금속 음극에 대한 문제를 해결하는 것뿐만 아니라, 차세대전지 기술 발전에 기여를 할 것으로 기대된다.
References
Biography

◉◉서 주 형
◉ 2022년 경희대학교 정보전자신소재공학 학사
◉ 2023년 경희대학교 정보전자신소재공학 석사과정

◉◉김 동 기
◉ 2023년 경희대학교 정보전자신소재공학 학사
◉ 2023년 경희대학교 정보전자신소재공학 석사과정

◉◉박 민 식
◉ 2008년 University of Wollongong 재료공학 박사
◉ 2008년 삼성전자 종합기술원 전문연구원
◉ 2010년 한국전자기술연구원 책임연구원
◉ 2016년 경희대학교 정보전자신소재공학과 부교수