광전기화학적 하이브리드 수전해 연구 동향
Recent Advances and Trends in Photoelectrochemical Hybrid Water Electrolysis
Article information
Trans Abstract
The replacement of fossil fuels is urgently needed for carbon neutrality and sustainable development. Hydrogen is represented as a next-generation energy source, and among the various methods to obtain hydrogen, water electrolysis using catalysts has been studied steadily. Among them, photoelectrochemical water electrolysis using solar energy is a promising method, but it has problems such as high overvoltage, durability of photoelectrodes under aqueous electrolyte environment, and photocorrosion. Therefore, recently, there has been increasing interest in hybrid water electrolysis, which improves efficiency by reducing the high overvoltage of water electrolysis by adding sacrificial materials. In this article, we review various photoelectrochemical hybrid water electrolysis studies and their limitations.
1. 서론
다변화되는 기후 변화와 지구 온난화에 대응하기 위해서 전세계적으로 탄소중립에 기인한 청정에너지 생산 및 활용에 초점을 맞추고 있다. 파리기후협약 이후 이산화탄소 배출량 감축 목표 달성을 위한 탄소배출권, Renewable Energy 100 (RE100) 등의 협약이 마련되면서 현재 산업의 방향은 산업의 종류를 막론하고 온실가스 배출량 제한 또는 감축을 동반한 지속가능한 발전이 점차 중요해지고 있다.[1] 그동안 산업 전반에 걸쳐 활용되어오고 있는 화석 연료를 대체하고 탄소 중립 달성을 위해서 에너지원으로 활용할 수 있는 물질들에 대해 탐구하고 적합한 에너지원을 찾는 것이 시급하다. 여러 대체 에너지원 중 수소 (H2)가 차세대 에너지원으로 가장 근접했다고 평가되고 있다.
지구상에서 가장 풍부한 원소인 수소는 낮은 발열량과 함께 120 MJ Kg-1의 높은 중량 에너지 밀도를 가지고 있으며, 휘발유와 디젤유와 비교하여 중량 에너지 밀도에서 우위를 가지고 있다.[2] 이러한 수소의 생산 방식은 현재 비용적으로 저렴한 천연가스 또는 석탄 등의 화석 연료를 이용해 주로 생산되고 있다.[3] 이 방식은 청정한 수소 생산 방식이 아니며, 대부분의 수소는 가혹한 반응 조건 하에서 화석 연료가 개질되어 수소로 생산되고 있다.[4] 이러한 환경친화적이지 않은 기존의 수소 생산 방식에서 화석 연료를 배제한 친환경적인 수소 생산에 대한 연구가 진행되고 있다. 특히 광촉매 (PC), 전기촉매 (EC) 또는 광전기화학 (PEC) 공정을 사용한 물 분해 반응은 탄소 배출이 없고, 고순도의 수소로 생산이 가능하며 이 공정에 사용되는 에너지원으로 태양에너지, 수력, 풍력 등의 재생 에너지를 이용할 수 있다는 점에서 청정 수소 생산 방식으로 각광받고 있다. 더욱이 전기촉매를 이용한 수소 생성에는 고전압이 필요한 반면, 광전기화학적 기술은 광 생성 운반체 분리를 용이하게 할 수 있도록 중간 바이어스(bias)를 가하고, 광전극에서 태양에너지를 받아들여 전압을 발생시킴으로써 결국 감소된 에너지 소비를 통해 지속가능한 에너지원 생산 및 활용이 가능하다.[5] 광전기화학 수전해는 광에너지를 흡수할 수 있는 물질로 이루어진 광전극 (photo electrode)에 조사되는 빛이 전기 에너지로 전환됨으로써 수전해 반응이 이루어진다.[6] 광전극에서 광흡수를 통한 전자-정공 쌍이 생성되고. 외부 바이어스에 의해 전자-정공이 분리된다. 이후 정공은 광양극에서 산소 발생 반응을 일으키고 전자는 광음극으로 전달되어 수소 발생 반응에 참여한다. 광촉매 시스템과 다르게 광전기화학 시스템은 외부 전위가 인가됨에 따라 전자-정공 쌍의 분리가 원활하게 진행되며, 전자-정공 재결합 확률이 낮다는 장점을 가지고 있다. 이를 바탕으로 친환경적이며 지속가능한 그린 수소 생산을 위한 광전기화학적 수전해 연구가 활발히 진행되고 있다.
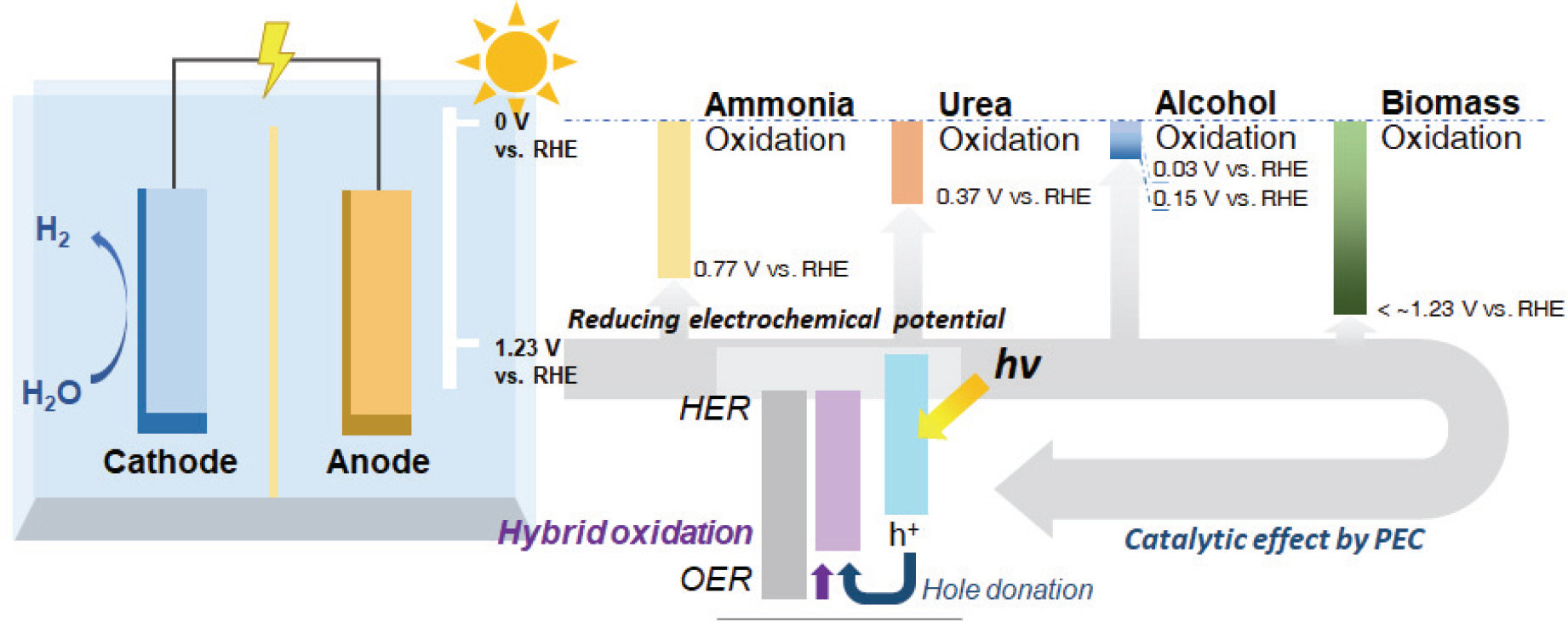
일반적인 물 전기분해는 음극에서 수소발생반응 (Hydrogen Evolution Reaction, HER)을 유도하고, 양극에서 산소발생반응 (Oxygen Evolution Reaction, OER)을 유도하여 이루어지게 되며, 수소를 생산하기 위해서는 이론적인 값보다 더 높은 과전압이 요구된다. (Fig. 1) 결국 높은 전위를 가하여 4-전자 전달 경로를 따르는 느린 동역학에 의해 산소발생반응을 유도하게 된다.[7] 최근에 이르러서 수전해 기술은 이러한 양극의 산소발생반응의 제한점을 추가적으로 개선하기 위해서 다양한 추가적인 희생물질을 전해질에 첨가하여 다른 촉매반응을 유도함으로써 산소발생반응을 대체하는 하이브리드 수전해 (Hybrid Water Electrolysis) 기술에 관심을 가지고 있다.[8] 본 리뷰에서는 광전기화학 공정에서의 다양한 희생제를 활용한 하이브리드 수전해 및 소재에 대한 연구기술 동향을 살펴보고자 한다.
2. 광전기화학적 (PEC) 하이브리드 수전해 연구동향
PEC 설계에서 광전극의 역할은 매우 중요하며 태양광 스펙트럼에서 넓은 흡광 범위를 가지도록 구성되어야 한다. 또한 전하 운반체의 수명이 길어야 하며 비용 효율적이어야 한다. 하이브리드 수전해에 활용되는 희생물질은 대표적으로 암모니아, 요소, 알코올, 바이오매스 등이 이용되고 있으며, 이러한 희생물질의 사용은 양극에서 이루어지는 산소발생반응보다 낮은 반응 전위를 나타내며 높은 과전압을 개선할 수 있게 해준다.[9-12] 높은 과전압을 갖는 수전해를 개선하기 위한 방법으로 최근 5년간 광전기화학적 하이브리드 수전해와 관련하여 게재되는 논문 수가 점차 증가하고 있는 것으로 볼 때, 이에 대한 연구적 관심도가 증가하고 있음을 알 수 있다 (Fig. 2).
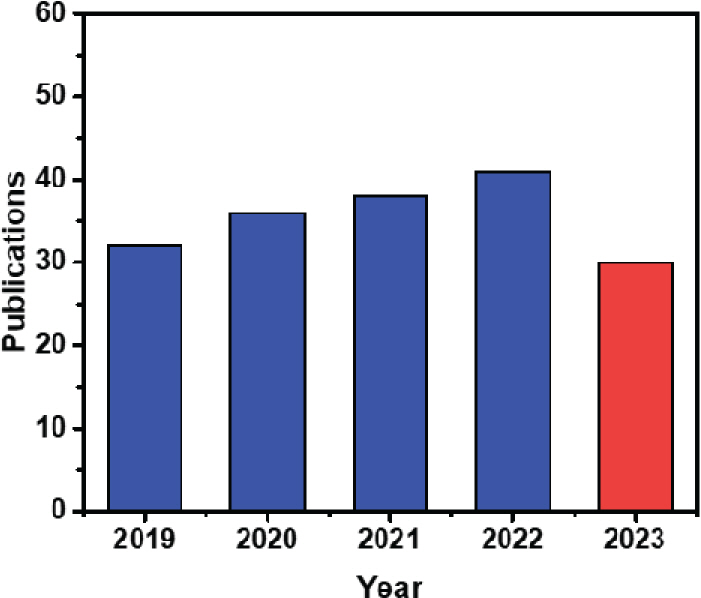
Number of published papers related to hybrid water electrolysis in the last 5 years (as of 11 August 2023). Source: World of Science, Clarivate
2.1 광전기화학적 암모니아 전해
수전해 반응에서 산소발생반응의 높은 과전압을 개선하기 위해서 암모니아 (NH3)를 희생물질로 한 암모니아 산화반응 (Ammonia oxidation reaction)으로 반응 전위를 낮추는 연구들이 이루어지고 있다. 암모니아 산화반응과 산소발생반응에 대한 반응식은 다음과 같다 (Eq 1, 2).
위 반응식에 따르면 암모니아 전해는 0.77 VRHE의 낮은 반응 전위를 바탕으로 일반적인 수전해와 비교하여 과전압을 감소시켜 낮은 개시전위를 달성할 수 있다. 일반적으로 TiO2, WO3, BiVO4, MoS2 등을 비롯한 몇 가지 소재의 광양극은 간접 라디칼 매개 전략에 기인한 간접적인 방식의 광전기화학적 암모니아 산화반응에 대해 보고되었다.[13-15] 이는 활성 염소 종, 수산화 라디칼, 황산 라디칼 등의 강한 산화제를 사용하지만, 이 경우 암모니아를 다양한 생성물로 산화시켜 암모니아 산화반응의 선택도가 낮아질 수 있는 문제가 있다.[13,16] 반면, 직접적인 광전기화학적 암모니아 산화 연구는 아직까지 활발하게 이루어지지 않고 있다.
Lei Wu 그룹에서는 적철석 (Hematite, Fe2O3)을 광양극으로 이용하여 광전기화학적 암모니아 전해 연구를 보고하였다 (Fig. 3).[17] 중성에 가까운 수준의 전해질의 pH(9-11)와 전위에 대하여 1.0-1.4 VRHE의 인가 조건에서 α-Fe2 O3 광양극에서 유도되는 암모니아 산화반응을 수행하여 광전류를 10∼55배 증가시키는 결과를 보였다. Fig. 3. c.에서, 470 nm 파장의 빛 조사 하에서 팁 전류 (Itip)의 증가를 통해 α-Fe2O3 전극 표면에서의 산소 발생을 확인했으며, 0.1 M NH3가 첨가된 전해질에서 물 산화반응 (WOR)의 개시 전위는 0.88 VRHE로 나타나 NH3가 존재하지 않을 때의 1.05 VRHE 보다 낮은 개시 전위를 나타내었다. 또한 실시간 (Operando) 분광 연구를 통해 고성능의 암모니아 산화반응을 위한 기존의 간접 라디칼 매개 암모니아 산화반응 매커니즘이 아닌 비라티칼 친핵성 매커니즘을 확인했다. 1 MND3를 포함하는 D2O 전해질을 이용한 동위원소 실험과 함께 감쇠 전반사-푸리에 변환 적외선(ATR-FTIR)분석을 통해 Fe-N 종에 대한 암모니아의 친핵성 공격을 의미하는 1445, 1330, 1243 cm-1 세 개의 새로운 밴드를 확인하였다(Fig. 3.d). 감쇠 전반사-푸리에 변환 적외선 분석 결과를 바탕으로 전해질에 암모니아가 존재할 경우 FeIV=O 결합은 NO2를 생성하는 N-O 결합 형성이 우세하며, FeIII-OH와 FeIII-NH3 결합 사이의 교환반응이 일어남에 따라 FeIII-NH2 결합이 형성된다. 이후 광에 의해 생성된 정공이 FeIII-NH2을 추가로 산화시켜 FeIV=NH를 포함하는 Fe-N 종을 형성하며, 해당 위치에서 NH3의 친핵성 공격이 일어나 FeIII-N2Hy 중간체가 만들어진다. 이후 α-Fe2O3 표면에서 직접 탈착하여 N2H4로 방출되거나 탈수소화를 통해 질소 (N2)를 방출하게 된다. Fe-N 종의 형성 억제를 통한 70.6%의 높은 페러데이 효율 달성 (Fig. 3.f) 또는 Fe-N 종의 생성 촉진을 위한 Ov의 도입으로 N2 선택성을 높일 수 있으며 (Fig. 3.g), 결과적으로 α-Fe2O3 광양극은 중성 pH(9-11)조건에서 80%를 초과하는 암모니아 산화반응의 페러데이 효율을 달성을 통해 암모니아 산화에 대한 효율과 안정성을 보고하였다.
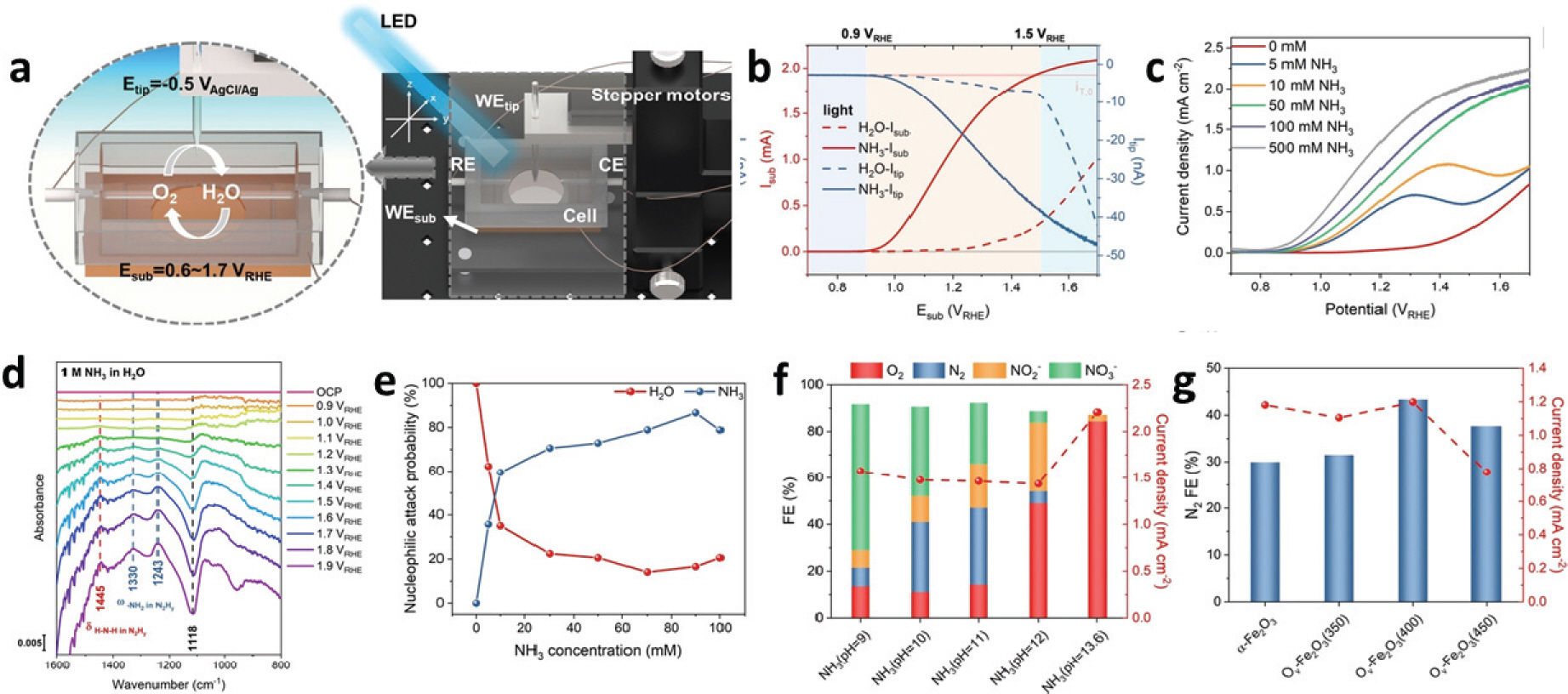
PEC ammonia oxidation. a. Schematics of SG/TC SECM experiments. b. under 470-nm frontside irradiation. iT,0 represented the background of tip current due to the dissolved oxygen in the solution. c. LSV curves of α-Fe2O3 in the 0.1 M NaClO4 electrolytes with different NH3 concentrations. d. The ATR-IR spectra of the α-Fe2O3 photoanodes acquired simultaneously with multi-potential steps in 1 M NH3-H2O system. e. The plots of the nucleophilic attack probability of NH3 and H2O as a function of NH3 concentration. f. The FEs and the average current density at 1.3 V RHE for α-Fe2O3 photoanodes in the 0.1 M 4 electrolytes containing 0.1 M NH3 under different pH conditions. g. Comparison of FE(N2) before and after introducing Ov. Reproduced from Lei et. al. Angew. Chem. Int. Ed. 2022; 61, e202214580 with permission of John Wiley and Sons Ltd [17]
한편, Chengkai Xia 그룹에서는 α-Fe2O3를 나노 로드 구조 형태로 FTO (Fluorine doped tin oxide coated glass) 기판에 성장시킨 뒤 인화철 (FePi) 층을 표면에 형성한 α-FePi/Fe2O3 광전극을 합성하여, Fe2O3의 암모니아 산화 효과를 높임과 함께 α-FePi/Fe2 O3 광양극의 반응 메커니즘에 대한 연구결과를 발표하였다.[18] 전극의 제조는 α-Fe2O3 수열 합성 (Hydrothermal synthesis) 후 550℃와 800℃에서의 어닐링 (Annealing) 공정을 거쳐 나노 로드 형태의 α-Fe2O3를 FTO 표면에 형성하였다. 그 위에 CVD로 FePi 층을 형성하는 총 2단계 공정을 통해 FePi/Fe2O3 광양극을 형성하였다. 0.1 M NaOH와 0.1 M NaOH +500 ppm NH3 전해질로 광전기화학적 암모니아 산화반응 실험을 진행하였다. Fe2 O3와 α-FePi/Fe2O3의 CV를 통한 광활성도 및 암모니아 산화반응 활성도를 비교하였으며, 빛을 조사하는 동안 산소발생반응 활성에는 차이가 없었으나, 암모니아 존재 시 1.3 VRHE 전위 하에서 α-FePi/Fe2O3의 전류밀도가 Fe2O3의 전류밀도에 비해 2배 이상으로 높게 나타났다. 빛이 없는 암흑 상태에서 개시전위는 빛을 조사할 때와 비교해 어둠 상태에서 약 1.7 VRHE의 전위를 나타내어 (빛 조사할 경우 약 0.9 VRHE) EC 시스템과 비교하여 높은 바이어스를 인가해야 하는 반면, PEC 시스템의 경우 비교적 낮은 바이어스를 요구하여 광 활성이 과전압을 개선하는데 있어 주요하게 작용함을 확인하였다. α-FePi/Fe2O3 광양극에 대하여 PC, EC, PEC의 각 시스템에서 3시간 동안의 암모니아 분해능을 비교한 결과 PEC>PC>EC 순의 분해능을 나타냈으며, 각 54.4%, 32.0%, 22.6%의 암모니아 감소량을 확인하였다. EC와 PC 시스템의 경우 각각 단독으로는 활성이 크게 나타나지 않았지만 PEC 시스템에서 EC와 PC 두 시스템의 시너지 효과가 일어남을 보여준다. 반응 메커니즘의 이해를 위하여, 광전기화학적 암모니아 산화반응 실험 후의 α-FePi/Fe2O3의 XPS 스펙트럼을 분석한 결과 실험 후 α-FePi/Fe2O3의 Fe 2p 스펙트럼에서 Fe-O-P 결합의 디컨볼루션 피크의 강도가 Fe-OOH 종의 디컨볼루션 피크보다 반응 전과 같이 여전히 낮게 나타났으며, 이는 암모니아 산화반응 중 α-FePi/Fe2O3 표면의 전기화학적 암모니아 산화반응이 완전히 가역적인 반응 경로를 따르는 것이 아님을 의미한다. O 1s 스펙트럼에서 -OOH 라디칼 변형과 말접한 관계가 있는 실험 전과 후의 스펙트럼 차이가 크게 나타나는데, P-O 결합의 피크의 세기는 반응 전보다 크게 감소한 반면, O-H 결합의 피크 세기가 강하게 나타남과 함께 P 2p 스펙트럼에서도 P-O 결합의 피크의 강도가 현저히 감소한 것으로 나타났다. 이 결과는 α-FePi/Fe2O3 표면에서 암모니아 산화반응이 일어나는 동안 인산 이온이 계속해서 -OOH 라디칼로 산화되고, 생성된 -OOH 라디칼이 암모니아 산화반응의 주요 촉매 활성 물질로서 이 산화환원 반응에 참여함을 나타낸다. 최종적으로 FePi 코팅층에 의해서 Fe2O3의 암모니아 산화 활성 및 광전류밀도 향상을 달성하였으며, 염화물 매개체가 없는 수용액에서 광전기화학적 암모니아 산화가 가능함을 보여주었다.
현재 염화물을 제외한 직접적인 광전기화학적 암모니아 전해에 대한 연구가 활발하지 않은 상황이고, 광 활성 및 암모니아 산화 모두에 장점을 갖는 물질의 지속적인 탐구와 더불어 암모니아 산화 반응의 생성물에 대하여 질소 산화물이 차지하는 비율을 낮추기 위한 생성물 선택성 개선 등의 연구들이 이루어져야 할 것으로 보인다.
2.2 광전기화학적 요소 전해
요소 (CO(NH2)2)를 희생물질로 이용하는 요소 전해 반응은 인간 및 가축 등의 소변에 포함된 요소를 산화하여 산소발생반응의 과전압을 개선함과 함께 수소 발생을 통한 재에너지화를 주 목적으로 한 연구들이 이루어지고 있다. 요소 산화반응에 대한 반응식은 다음과 같다 (Eq 3).
위 반응식에 따르면 요소 전해는 −0.46 VRHE의 낮은 반응 전위를 바탕으로 보다 낮은 전위에서 수전해를 유도할 수 있다. 광전기화학적 요소 산화반응 (Photoeletrochemical urea oxidation reation, PEC UOR)은 광흡수 및 전달층으로 이용되는 광양극과 요소 산화 활성을 띄는 전기 촉매가 광양극 표면에 자리하도록 설계된 전극을 활용해 요소 산화 반응을 유도 한다.[urea1,2,3] 광전기화학적 암모니아 전해와는 다르게 광전기화학적 요소 전해는 비교적 많은 연구가 이루어지고 있다.
Rong Zhao 그룹은 TiO2에 CdS 층을 형성하고, 외피에 Ni(OH)2 층을 추가로 형성시킨 광활성전극을 이용한 광전기화학적 요소 산화를 보고하였다 (Fig. 4. a-c).[19] TiO2를 광활성층으로 두고 요소 산화에 활성을 갖는 Ni 기반 물질을 적용하여 NiOOH를 활용해 Ni(OH)2를 형성한 캐스케이드 시스템으로 적용하였다. 1 M NaOH 수용액에 0.33 M 요소가 포함된 전해질에서 전류응답은 약 0.33 V(vs Ag/AgCl)에서 나타나 요소 산화에 효과를 나타내었다. 하지만, TiO2의 넓은 밴드갭 (약 3.5 eV)은 가시광선의 흡수를 어렵게 만들기 때문에 CdS 나노 결정을 도입하여 가시광선 영역대의 광효율을 높이기 위한 밴드 구조를 형성하였다. 해당 촉매는 CdS-Ni 전극을 ZnS 보호층 (passivation layer)으로 코팅함으로써 광안정성을 개선하여 촉매 표면의 트랩 사이트에서 발생하는 전자-정공 재결합을 최소화됨과 함께 CdS 층의 수분에 의한 광부식 반응을 보호하도록 설계되었다. ZnS 보호층이 형성된 CdS-Ni (CdS-ZnS-Ni)은 선형주사전위법 (Linear Sweep Voltametry, LSV) 스캔에서 안정적인 모습을 보였으며, ZnS에 의해 향상된 광안정성 및 광전류밀도를 적절히 향상시킴으로써 요소 산화 시스템에서 안정성 있는 광전극으로 사용 가능성을 입증하였다.

PEC urea oxidation. a. Schematic representation of the dynamical processes initiated upon photon absorption in a chalcogenide-sensitized electrode architecture with Ni(OH)2 catalyst. b. Evaluation of Ni(OH)2 electrocatalytic response in three-electrode cell in the presence of urea. c. I– t curves of CdS-ZnS– Ni photoanodes in three-electrode tests using 1 M NaOH + 0.33 M urea electrolyte solutions under illumination using AM 1.5 simulated sunlight. Reproduced from Rong et. al. J. Phys. Chem. C 2018; 122, 13995-14003 with permission of American Chemical Society [19]. d. Schematic diagram of a PEC device consisting of a SnO2@BiVO4 NRAs photoanode decorated with the Co-Pi catalyst, and a Pt counter electrode. e. The square box shows the energy diagram of the SnO2@BiVO4 heterojunction photoanode and illustrates the basic operation mechanism for solar driven water splitting and urea oxidation. f. Photocurrent– potential curves under chopped illumination. g. Photocurrent– time response curves at 1.23 V RHE under illumination. Reproduced from Jingchao et. al. J. Mater. Chem. A, 2019; 7, 6327 with permission of Royal Society of Chemistry [20]
Jingchao Liu 그룹은 SnO2@BiVO4 광양극과 Co-Pi 전기 촉매를 조촉매로 하여 결합한 형태의 광전극의 합성 및 광전기화학적 요소 산화반응을 보고하였다 (Fig. 4. d-g).[20] CVD 기법을 통해 FTO 표면에 코어인 SnO2를 형성하고 이후 전기 증착을 통해 BiVO4를 SnO2를 감싸는 쉘 형태로 증착해 코어-쉘 나노 로드 구조 (Nano Rod Arrays, NRA)를 제작하고, 2차적으로 전기 증착으로 조촉매인 Co-Pi를 NRA의 표면에 형성되도록 광전극을 제조하였다. 매우 높은 고유 전자 이동도를 가진 SnO2가 전자 수용체 역할을 하여 전하 수송을 촉진하고 FTO와 BiVO4 사이의 버퍼층으로 작용해 정공 차단 역할까지 수행하게 dd 되며, BiVO4는 전하 분리 및 재결합 감소 역할을 하면서 표면 전기 촉매 역할을 하는 Co-Pi의 느린 동역학을 개선하도록 설계되었다. 이를 바탕으로 선형주사전위법을 통해 SnO2@BiVO4 나노 로드 구조체 광양극이 빠른 빛 반응을 나타냄을 확인할 수 있다. 2% 요소가 첨가된 0.1 M PBS 전해질에서의 요소 산화반응에 대하여 요소 산화의 개시전위는 빛을 가할 때 0.2 VRHE에서 시작되며, 요소 전기분해에 필요한 전위(1.6 VRHE)보다 훨씬 낮게 나타나 EC 시스템 대비 과전압을 크게 줄일 수 있음을 보였다.
현재 광전기화학적 요소 전해에 대한 연구가 활발히 이루어지고 있으며, 최근 발표되는 연구들에서 광양극 표면에 요소에 높은 활성을 갖는 전기촉매를 설계한 광전극이 주로 보고되고 있다. 요소 산화는 폐수로 취급되는 요소를 에너지원으로 사용하는 촉매 반응으로, 생성물로 이산화탄소가 배출되기 때문에 이에 대한 해결책이 더불어 연구된다면 친환경적인 기술이 될 것으로 예상된다.
2.3 광전기화학적 알코올 전해
알코올을 희생물질로 이용하는 알코올 산화 반응은 유망하지만, 수용액을 이용한 광전기화학 시스템에서 광양극 물질의 낮은 안정성, 페러데이 효율 그리고 생성물 선택성 등과 제한된 pH 범위로 인해 제약이 발생한다.[21] 수계 전해질과 비수계 전해질을 혼합한 수계-비수계 혼합 전해질을 사용하는 방식은 이를 개선할 수 있는 한 방법이 될 수 있다. 하지만, 이 경우 수소발생반응이 느려지는 단점이 따라온다. 결국 이를 해결하기 위한 새로운 광양극 탐구가 필요하다. 알코올에 포함되는 메탄올 (Methanol), 에탄올 (Ethanol), 이소프로판올 (iso-Propanol), 에틸렌 글리콜 (Ethylene glycol), 글리세롤 (Glycerol) 산화반응에 대한 반응식은 다음과 같다 (Eq 4-8).[22]
Sheng Huang 그룹에서는 α-Fe2O3/CoFe2O4 나노 튜브 구조 (Nano tube arrays, NTAs)를 제조하여 메탄올 산화 반응 결과를 보고하였다 (Fig. 5. a, b).[23] 광양극으로 다양한 반응에 활용되는 α-Fe2 O3를와 스피넬 구조의 CoFe2O4와 함께 동시에 형성하기 위해 FTO 위에 성장한 ZnO 나노 로드 구조체에 대하여 전해조 증착 (Chemical Bath Deposition) 방법을 활용하여 Fe와 Co 전구체의 양에 따른 여러 비율의 α-Fe2O3/CoFe2O4를 제조하였다. 이렇게 합성된 광전극은 α-Fe2O3를 CoFe2O4가 이종 접합을 형성하였고, 이에 따라 캐리어 분리속도가 가속화되는 효과를 나타냈다. ZnFeCo-2로 명명된 비율을 바탕으로 합성된 전극의 경우 ZnFe 으로 명명된 비율로 합성된 전극보다 높은 광전류와 메탄올 산화 성능이 향상되었는데 이는 Co의 존재 유무에 따른 광전기화학 특성 차이와 이로 인한 광 조사 시 전류밀도의 차이에 기인한다. ZnFeCo-2 비율로 합성된 α-Fe2O3/CoFe2O4 광전극은 CoFe2O4 계면에서의 C-H 결합 활성화를 비롯하여 낮은 포름알데히드 (Formaldehyde) 탈착 에너지와 낮은 활성화 에너지를 유도하며, 두 물질 사이의 이종 구조 형성에 의한 광 생성 운반체의 분리 및 수송을 촉진시키며, 통해 97.8%의 패러데이 효율을 달성하여 효과적이고 효율적인 메탄올 산화 반응을 보임에 따라 광전기화학적 메탄올 산화 반응에 대한 가능성을 제시하였다.

PEC alcohol oxidation. a. Growth mechanism of α-Fe2O3/CoFe2O4 NTAs. b. Faraday efficiency of ZnFe and ZnFeCo-2. Reproduced from Sheng et. al. Adv. Mater. 2022; 34, 2208438 with permission of Wiley-Blackwell [23]. c. PEC oxidation scheme of primary alcohols using a CN film on a transparent conductive fluorine-doped tin oxide (FTO) electrode as the photoanode in the presence of O2 as the oxidant and a Pt cathode. d. PEC oxidation of BnOH over CN photoanodes; Conversion and corresponding selectivity of BZD or BZA vs. reaction time. Reproduced from Neeta et. al. J. Mater. Chem. A, 2022; 10, 16585–16594 with permission of Royal Society of Chemistry [25]
Olga A. Baturina 그룹에서는 보편적으로 널리 사용되는 광촉매 중 하나인 TiO2 매트릭스에 넓은 태양광 흡수 스펙트럼을 지닌 TiN를 잘 분산시켜 합성한 TiN/TiO2 광전극을 제조하여 이에 대한 메탄올 산화 반응 효과를 보고하였다.[24] TiN/TiO2는 Au/TiO2와 비교되었으며, 1.23 VRHE 전위 하에서 TiN/TiO2은 광전기화학적 물 산화에 대해 광전류가 더 크게 향상되는 결과를 나타냈다. TiN은 넓은 태양광 흡수 스펙트럼에 기반한 플라즈몬 공명, 결정 가장자리 (Edge)에서의 전계의 향상을 갖고, 추가적으로 TiN과 TiO2 사이의 옴 접합을 형성하여 전자의 흐름에 대해 이를 방해하는 장벽이 없어 전자 효율이 더 높기 때문이다. 이러한 특성으로 인해 Au과 비교하여 약한 플라즈몬 광촉매 임에도 불구하고 TiN 나노 입자 (Nano particle, NP)는 비용 효율적인 광전기화학적 메탄올 산화 반응에 대한 적합성을 보여준다.
Neeta Karjule 그룹에서는 광양극으로 고분자 CN층을 합성하여 광전기화학 전지를 구성하여 벤질 알코올 산화반응을 통해 수소 생산과 더불어 알데히드 및 카르복실산의 합성을 보고하였다 (Fig. 5. c, d).[25] 가시광선을 CN 표면에 조사하게 되면 광생성 전자-정공 쌍이 분리되면서 전자는 O2 분자를⋅ O2- 라디칼로 활성화시키고, 정공은 BnOH를 벤즈알데하이드 (Benaldehyde, BZD) 또는 벤조산(Benzoic acid, BZA)로 산화시킨다. 벤질 알코올 산화 반응의 패러데이 효율은 90% 이상으로 모든 기질에 대해 높게 나타나고 높은 생성물 선택성을 보여, 생성물에 대해 제어가 가능성을 확인했다.
2.4 광전기화학적 바이오매스 전해
재생 가능한 바이오매스 파생물은 수계 환경에서 광전기화학 시스템에 의해 수소 생산이 가능하고, 청정한 화학 연료를 생산하는 하나의 방법이 될 수 있으며, 수전해와 비교하여 해당 방식은 열역학 관점에서도 효율적이다. 바이오매스는 앞서 언급한 암모니아, 요소, 메탄올 등을 포괄하는 표현이나 그 이외에도 글루코스 (Glucose), 푸르푸랄 (Furfural), 타타르산 (Tartaric acid), 구연산 (Citric acid), 말산 (Malic acid) 등 다양한 바이오매스들이 존재하며 이에 대한 광전기화학적 산화 반응들도 연구가 되고 있다.[26,27] 여러가지 바이오매스 물질 중 글루코스와 타타르산에 대한 산화 반응식은 다음과 같다 (Eq. 9).
Chia-Yu Lin 그룹은 나노 크기로 성장된 CuBi2O4 (nanoCuBi2O4)를 광양극으로 활용한 광전기화학적 글루코스 산화반응에 대하여 보고하였다 (Fig. 6. a-d).[28] 전해조 증착 합성법을 이용하여 FTO 기판에 CuBi2O4의 성장에 따른 3가지 형태의 광전극을 제작하여 비교하였다. He I 방사선 (hn = 21.22 eV)을 사용하여 CuBi2O4의 자외선 광전자 스펙트럼 (UPS)을 분석 결과에 따르면, microCuBi2O4, nanoCuBi2O4, c-nanoCuBi2O4에 대하여 페르미 준위 (Fermi level) 아래 0.55, 0.42, 0.50eV에 위치한 가전자대 최대값을 확인하였으며, 방사선 광에너지의 운동에너지 컷오프는 각 5.67, 5.60, 5.64 eV로 이를 환산하면 1.17, 1.10, 1.14 VRHE로 도출된다. 광학적 밴드갭으로부터 유도된 전도대 최소값 (EC)은 0.10, 0.31, 0.16 V로 태양광 수소 생성이 가능함을 확인할 수 있었다 (Fig. 5.d). 1.64 VRHE에서 2시간 동안 CPE 실험을 통해 생성물 분석을 진행한 결과 생성물 중 세가지 형태의 CuBi2O4 모두 포름산염에 대한 패러데이 효율이 90% 이상을 달성하였으며, nanoCuBi2O4의 전류밀도가 가장 높게 형성되어 약 71 μ mol cm-2의 포름산염 생성량을 달성해 비교군 대비 높은 생성량을 나타냈으며, 포도당은 미미한 수준으로 나타났다. 수소의 경우 낮은 광전류로 인해 감지할 수 없었다.
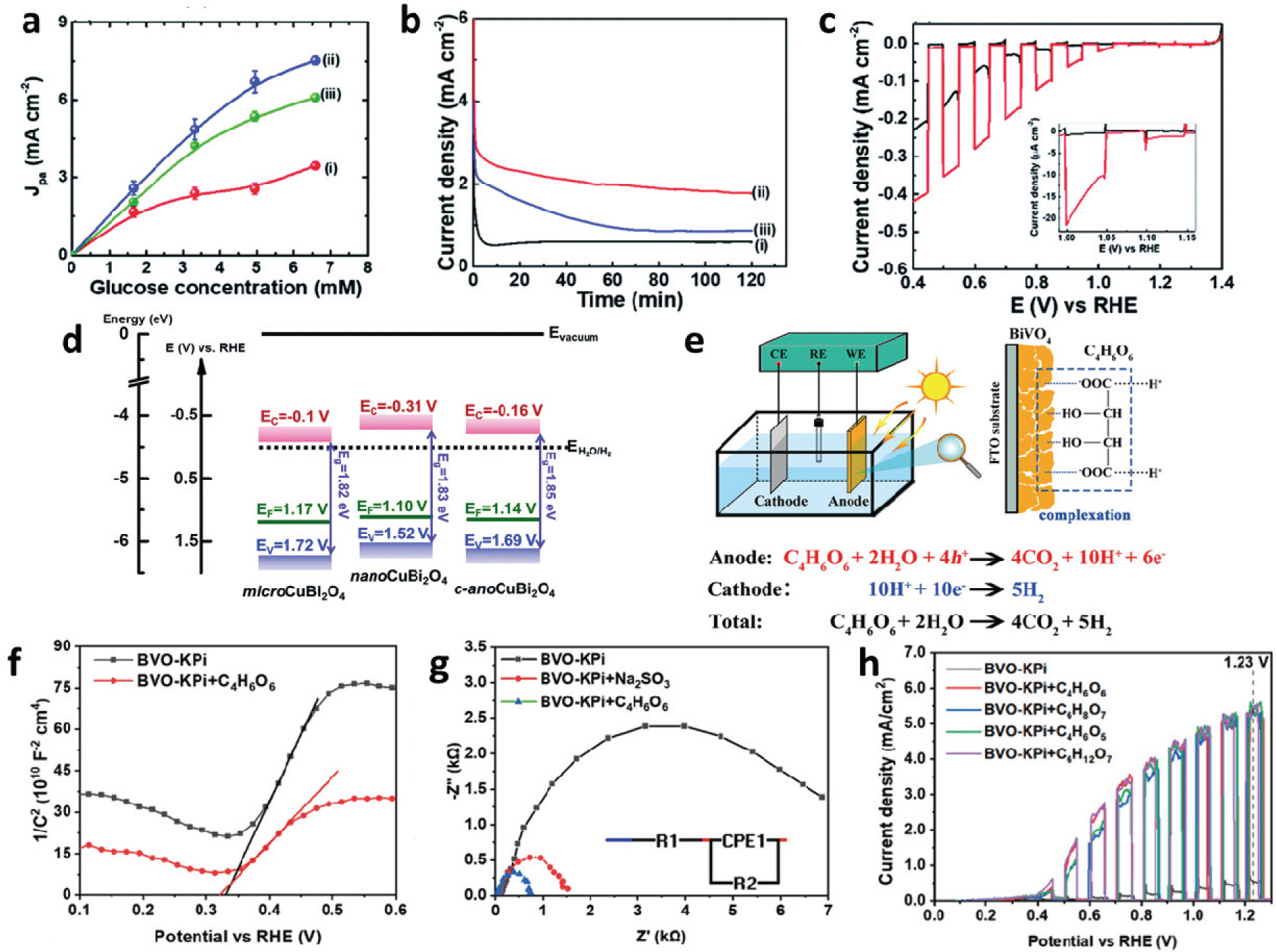
a. Growth mechanism of α-Fe2O3/CoFe2O4 A plot of anodic peak current density (Jpa) vs. glucose concentration for microCuBi2O4 (i), nanoCuBi2O4 (ii), and c-nanoCuBi2O4 (iii). b. Typical chronoamperograms of (i) microCuBi2O4, (ii) nanoCuBi2O4, and (iii) c-nanoCuBi2O4 recorded at an applied potential of 1.64 V vs. RHE in NaOH solution (0.1 M) containing glucose (9.80 mM). c. Typical linear sweep voltammograms, recorded at a scan rate of 10 mV s−1, of nanoCuBi2O4 in NaOH solution (0.1 M) under chopped light illumination under N2 (black trace) and O2 (red trace) atmospheres. d. Schematic illustration of the band structures of microCuBi2O4, nanoCuBi2O4, and c-nanoCuBi2O4. Reproduced from Chia-Yu et. al. Sustain. Energy Fuels, 2020; 4, 625–632 with permission of Royal Society of Chemistry [28]. e. Schematic illustration of the detailed reaction process in the BiVO4 PEC fuel cell system. f. Mott–Schottky plots of the BVO photoanode in KPi and KPi + C4H6O6 solutions. g. EIS Nyquist plots of the BVO photoanode measured at 1.23 VRHE under AM1.5G in KPi, KPi + 0.5 m Na2SO3, and KPi +0.5 m C4 H6O6 solutions. h. Current density versus potential curves of the BVO photoanode in KPi, KPi + 0.5 M C4 H6O5, KPi + 0.5 m C6H8O7, KPi + 0.5 m C6H12O7, and KPi + 0.5 m C4H6O6 solutions under AM 1.5G or in the dark. The pH values of all the electrolytes were adjusted to 7 by NaOH or HCl, and the concertation of KPi was 0.5 m. Reproduced from Zhaoqi et. al. Adv. Mater., 2022; 34, 2201594 with permission of Wiley-Blackwell [29]
Zhaoqi Wang 그룹에서는 전해질에 하이드록실 및 카르복실 그룹을 포함하는 저비용 바이오매스 물질을 첨가한 광전기화학적 산화반응에 대해 보고하였다 (Fig. 6. e-h).[29] MOD 기법을 이용해 FTO를 기판으로 하여 BiVO4 광양극을 성장시켰으며, 모트-쇼트키 (Mott-Shottky) 측정을 통해 Kpi 전해질과 Kpi와 타타르산을 첨가한 전해질에서 BiVO4 광양극 특성을 비교하였다. 전해질에 타타르산이 존재할 때, BiVO4의 Nd 값은 1.70 × 1018 cm-3 로 나타나 BiVO4 광양극 표면의 전하 밀도가 증가하는 결과를 보였다 (Fig. 6.f). 또한 전기화학 임피던스 분광법 (Elecrochemistry Impedance Spectrosopy, EIS) 분석 결과에 따르면 KPi 전해질에 Na2SO3 또는 C4 H6O6를 첨가하는 것만으로도 전해질의 전기적 특성이 개선되어 저항이 낮아지는 것을 확인할 수 있었다 (Fig. 6.g). 광전기화학적 안정성 실험을 2시간 진행한 결과 BiVO4 광양극의 전류 밀도는 바이오매스인 타타르산이 전해질에 존재할 때 더 안정적인 결과를 나타내었으며, KPi 전해질에 타타르산 외에도 다양한 하이드록실 및 카르복실 그룹을 포함하는 바이오매스 물질을 각각 첨가하여 I-V 곡선을 측정한 결과 다른 바이오매스 물질들도 비슷한 수준의 광전기화학적 전류밀도 개선을 나타내었다 (Fig. 6.e).
앞서 제시된 물질들 이 외에 다양한 물질을 희생물질로 사용한 여러 형태의 하이브리드 수전해 연구가 지속적이고 점진적으로 이루어지고 있다. 많은 물질들이 하이브리드 수전해에 적용하다는 결과들이 보고되었지만, 현재 암모니아 또는 알코올의 상용화가 가장 유망한 것으로 사료된다. 암모니아는 현재 전세계적으로 청정 수소를 위한 수소 캐리어로써 청정 암모니아 합성 연구가 활발이 이루어지고 있으며, 인프라 및 다양한 사용처 또한 갖춰져 있거나 갖춰지고 있는 상황이다. 현재 광전기화학적 암모니아 산화의 패러데이 효율은 약 70.6%가 보고되었다.[22] 또한 메탄올 및 에탄올 등의 알코올 또한 널리 사용되고 있고 탄소저감을 위한 이산화탄소 환원 반응 등의 생성물로 알코올을 확보할 수 있는 기술들이 상당 수준으로 연구되고 있어 이를 바탕으로 수소 생산 원료로 활용할 수 있는 기반이 확보되고 있으며, 광전기화학적 알코올 산화의 패러데이 효율은 메탄올 산화 반응에서 약 97.8%로 매우 높다.[7] 하지만, 메탄올 산화의 경우 생성물로 물이 형성되는 반응과 수소가 발생하는 반응 메커니즘이 있다. 수소 발생에 대한 평가는 이루어지지 않았기 때문에 이에 대한 추가적인 평가는 분명히 필요하다. 그럼에도 불구하고 높은 패러데이 효율을 토대로 광전기화학적 하이브리드 수전해 기술의 가능성을 보여주었다.
3. 결론
지속가능한 발전 및 차세대 에너지 발굴은 시급한 상황이다. 이에 따라 탄소 중립 달성 및 미래 에너지 확보를 위해서 신재생 에너지이자 청정 에너지원인 태양에너지를 활용할 수 있는 광전극을 제조하여 광전기화학 시스템을 구성하고, 수전해 과정에서의 에너지 효율을 더욱 향상시키기 위해 전해질에 희생물질을 첨가하여 과전압을 개선하기 위한 다양한 하이브리드 수전해 연구들을 확인하였다. 최근 암모니아를 비롯하여 요소, 알코올, 바이오매스 등의 다양한 물질을 활용한 광전기화학적 하이브리드 수전해 연구들이 점차 활발해지고 있다. 하지만 전해질에서의 광양극의 안정성 문제와 내구성 그리고 광전기화학 촉매 성능의 개선에 대한 연구가 더욱 필요한 상황이다. 고성능 촉매를 탑재한 태양에너지 기반 광전기화학적 하이브리드 수전해 시스템을 이용하여 비용 효율적인 청정 수소 생산은 지속 가능한 미래 에너지 자원 확보에 크게 기여할 것으로 예상된다.
References
Biography

◉◉ 조찬민
◉ 2021년 전남대학교 신소재공학과 석사
◉ 2022년-현재 한국에너지공과대학교 수소에너지트랙 박사과정

◉◉ 이동규
◉ 2018년-전남대학교 신소재공학부 학사
◉ 2022년-현재 한국에너지공과대학교 수소에너지트랙석박사통합과정

◉◉ 이현정
◉ 2009년 TOHOKU UNIVERSITY (JAPAN) 공학박사
◉ 2014년 한국과학기술연구원 박사후연구원
◉ 2020년 바이오나노헬스가드연구단 책임연구원
◉ 2021년 한국과학기술원 연구교수
◉ 2022년-현재 한국에너지공과대학교 수소에너지트랙 연구교수

◉◉ 박태언
◉ 2005년 조선대학교 금속재료공학과 박사
◉ 2007년 조선대학교 금속재료공학과 연구교수
◉ 2009년 조선대학교 금속재료공학과 초빙객원교수
◉ 2023년-현재 한국에너지공과대학교 수소에너지트랙 연구교수

◉◉ 심욱
◉ 2016년 서울대학교 재료공학부 박사
◉ 2016년 삼성전기 책임연구원
◉ 2016년 스탠퍼드대학교 박사후과정 연구원
◉ 2017년 전남대학교 신소재공학부 조교수/부교수
◉ 2022년-현재 한국에너지공과대학교 수소에너지트랙 부교수

◉◉ 윤영훈
◉ 2001년 한양대학교 세라믹공학과 박사
◉ 2004년 한양대학교 연구교수
◉ 2006년 동신대학교 수소에너지학과 교수
◉ 2007년-현재 동신대학교대학원 에너지공학과 교수
◉ 2017년-현재 동신대학교 신재생에너지학과 교수
◉ 2023년-현재 동신대학교 에너지리사이클링학과 교수