전기화학적 저분자 유기물 직접산화반응을 위한 금속 촉매 탐색 연구
Surveying Metal Catalysts for Electrochemical Direct Oxidation of Small Organic Compounds
Article information
Trans Abstract
Electrochemical degradation of organic molecules is important in wastewater treatment. In addition, the direct oxidation of small organics can be utilized for electrochemical hydrogen production or fuel cell. This study aimed to provide database for various anode catalysts that can degrade organic molecules such as urea, methanol, ethanol, glucose, ammonia, formic acid, acetic acid, oxalic acid in various pH conditions. Pt, Ni, Cu anodes were employed, and the target molecule concentration was 0.3 M. The activity was analyzed by the peak current densities of cyclic voltammetry. The Cu showed activity in the reaction of decomposing glucose and ammonia at pH 14. The Ni was active in ammonia degradation at pH 7, and the Pt was active in oxalic acid oxidation at pH 0. Relevant mechanisms were proposed for these reactions. We suggest Cu-Ni composites for toilet wastewater treatment and Pt for handling anaerobic digestor effluent.
1. 서론
인류의 과학기술이 발전하는 만큼, 배출하는 유기 폐기물의 종류가 점점 늘어나서 수질오염도 가속화되고 있다. 이에 따라 2020년, 환경부는 수질 관리 기준을 강화하였다. 이에 따라 폐수 속에 포함된 탄소가 포함된 유기물, 그리고 영양염류를 제거하는 것은 중요한 과제가 되었다. 유기물이 포함된 폐수를 처리는 물질의 크기에 따라 1차, 2차, 그리고 3차로 나뉜다. 1차와 2차에서 고형물들을 모두 걸러내고, 2차에서는 생물학적인 방법으로 유기물을 제거하는 것이 보통이다. 3차 처리는 2차 처리 후 남은 오염물질을 제거하는 방식으로, 고도처리로고 불린다. 전기화학적인 방법은 3차 처리 과정에 해당한다. 여기에는 여러가지 강점들이 존재한다. 우선, 전기화학적인 처리 과정은 다양한 방면에서 활용될 수 있고, 처리할 수 있는 오염물질의 종류도 다양하다. 전기화학적인 반응을 이용한 상분리, 산화 등 여러 방법이 있다. 상분리는 오염 물질과 금속 이온 등을 반응시켜 오염 물질을 응결(coagulation) 혹은 응집(flocculation)하는 방법이다. 화학적 상분리에서는 금속염을 물에 용해시킨 후 유기물과 반응시키는 데 비해, 전기화학적 상분리에서는 전극 물질을 산화시켜 유기물과 반응시키는 방식이다. 따라서 별도의 화학적 첨가물을 최소한으로 사용할 수 있다. 또한, 정화 작업 이후에 생성되는 슬러지의 양도 최소화할 수 있다는 장점이 있다.[1] 물질들을 결합시켜 상을 분리시키는 방법과 달리, 전기화학적 산화반응을 통해 물질을 분해하는 방식은, 전극에서 직접 유기물을 반응시키는 직접 산화법 (direct oxidation)과 전기화학적으로 전극에서 일어나는 반응으로, 활성 염소 등 강한 산화제가 만들어져 이를 통해 유기물을 산화시키는 방법이다.[2] 두 번째로 전기화학적인 처리는 친환경적이다. 앞서 언급한 내용처럼, 양극에서의 반응이 주를 이루기 때문에 별도의 산화제, 혹은 금속염 등을 사용하지 않고도 반응을 진행시킬 수 있다. 또한, 에너지의 관점에서도 효율적이다. 일반적으로 전기화학적 산화 반응에서 온도는 큰 영향을 미치지 않아 상온에서 구동이 가능하다.[3] 이는 물의 임계점인 374 ℃, 22.1 MPa 이상에서 일어나는 산화 반응인 초임계수 산화 방법이나 정화 작업 후 나온 슬러지를 소각시키는 방법보다 열에너지 소비가 적다는 이점을 가지고 있고, 더 나아가 소각 시에 나오는 독성 물질이 나오지 않는다는 장점이 있다.[4,5] 세 번째로는 경제적인 이점이다. 전기분해 장치는 구조가 매우 간단하기 때문에 적은 비용으로도 크게 만들 수 있다는 강점이 있다.[6]
한편, 전기분해를 위한 전해질 조건과 활성이 좋은 촉매는 유기물을 연료로 하는 연료 전지에도 활용할 수 있어 유기 폐기물을 이용 가치가 있게 사용할 수 있으며, 전기분해 시 cathode에서 나오는 수소 기체 또한 연료전지에 활용할 수 있기 때문에, 그 응용 가능성이 매우 높다. 특히, 저분자 유기물의 전기화학적 직접산화 반응은 전기화학적 물분해를 통한 수소생산공정에서 산소발생반응을 대체하여 에너지 효율을 높일 수 있다는 점에서 최근 많은 관심을 받고 있다. 유기물의 직접산화 반응은 촉매와 유기물 기능기 간의 상호작용에 의해 그 활성이 결정되는 바, 하폐수 중에 고농도로 존재하는 저분자 유기물들과 대표적인 금속 촉매와의 상호작용을 스크리닝하는 연구가 필요하다. 따라서, 본 연구에서는 생활 및 산업폐수에 포함되어 있는 유기화합물들의 종류와 분해에 사용되는 금속촉매 전극을 조사하였고 그 활성을 다양한 pH에서 분석하였다. 이에 따라 각 전극 촉매의 활성을 평가 및 비교하여 물질 별, 촉매 별 성능에 대한 종합적인 정보를 통일하여 제공하고자 한다.
2. 본론
2.1. 선행 연구
본 연구에서는 폐수에 포함된 유기물 중 메탄올, 에탄올, 글루코오스, 포름산, 아세트산, 옥살산, 그리고 암모니아를 타겟 물질로 설정하였고, 선행연구가 되어 있던 요소(urea)를 비교를 위해 추가하였다. 메탄올은 석유 정제 과정,[7] 제약 산업[8] 등에서 배출되고, 에탄올은 증류 산업[9]의 폐수에 많이 포함되어 있다. 글루코오스는 농식품 산업 폐수,[10] 암모니아는 생활폐수와 혐기성소화조 등에 포함되며,[11] 아세트산은 석유 정제 과정에서,[7] 포름산은 디티온산나트륨[12]과 네오펜틸글리콜의 제조 산업[13]에서 배출된다. 그리고, 옥살산은 염색 산업[14]에서 배출되는 것으로 알려져 있다.
위에서 열거한 유기물들을 전기화학적인 방법으로 분해하기 위해 사용하는 촉매와 전해질 조건을 탐색하였다 (Table 1). 메탄올은 염기 조건에서 CuO, Ni, Pt 기반의 전극을,[15-17] 에탄올은 산성 혹은 염기성 조건에서 Ni이나 Pt 전극을 사용하는 사례가 있다.[18,19] 글루코오스는 염기 조건에서 Ni과 Fe 기반,[20,21] 암모니아는 염기 조건에서 Pt와 Ni 기반의 전극을 사용하였다.[22,23] 포름산의 경우, 산성 혹은 중성 조건에서 Pt 기반의 전극을 사용하는 사례를 발견하였다.[24,25] 문헌 조사를 통해 대부분의 유기물을 전기분해할 때 Pt, Ni, Cu 기반의 전극을 사용하는 것을 확인하였다. 본 연구에서는 폐수에서 발견할 수 있는 유기화합물을 Pt, Ni, Cu 전극을 사용하여 여러 전해질 조건에서 분석해보고, 이를 통해 각 전해질 조건 별로 각 전극이 가지고 있는 촉매 활성을 비교 및 평가하였다.
2.2 전기화학적 분석
전극은 별도의 표면 합성 없이 3 cm × 1 cm 크기로 잘라 에탄올과 아세톤 혼합 용액에 넣어 30분 동안 초음파 세척 후 사용하였다. 상대전극은 Pt/Ti 전극을 사용하였는데, 이를 선택한 이유는 수소발생반응 활성이 우수하며 대상 유기물 또는 분해산물과의 부반응이 알려지지 않았기 때문이다. 기준전극은 염기성 조건에서는 Hg/HgO 전극을, 중성과 산성 조건에서는 Ag/AgCl 전극을 사용하였으며, 실험 데이터는 reversible hydrogen electrode (RHE) 기준으로 통일시켜 보정하였다. 이때 전위의 범위는 염기성에서 0.97 V∼1.97 V, 중성에서 0.62 V∼2.62 V, 산성에서는 0.21 V∼2.21 V이었다. 전해질은 1 M KOH, 0.5 M Na2SO4, 0.5 M H2SO4를 제조하여 사용하였다. 타겟 물질의 농도는 0.3 M로 맞추었다. 반응조에 전해질 60 mL를 채워 사용하였고, 전극이 전해질과 접촉하는 면적은 2 cm2가 되도록 하여 진행하였다.
산화전극 촉매의 활성 평가를 위해 CV (cyclic voltammetry)와 LSV (linear sweep voltammetry)를 활용하였다. Scan rate는 20 mV s-1로 고정하여 실험했다. 염기성 전해질에서는 0-1 V 범위에서 측정하였고, 중성과 산성에서 측정할 때에는 1 V 전에는 전류가 크게 증가하지 않았기 때문에 0-2 V까지 늘려서 측정하였다. CV 그래프가 스캔 횟수에 따라 변화가 없을 때까지 안정화 시킨 후, 마지막에서 두 번째 그래프를 사용하였다. 타겟 물질이 있는 용액의 CV 데이터에서 전해질 데이터를 빼서 산소발생반응 (OER, Oxygen Evolution Reaction)의 효과를 최대한 배제하였다. 측정 과정에서 Cu 전극은 염기성에서의 메탄올, 그리고 중성 상태에서의 물질들에서 전극이 산화되어 녹는 현상이 발생하여 염기성 조건에서 메탄올을 제외한 물질들의 실험 데이터만 얻을 수 있었다. 산성 용액에서는 Ni과 Cu의 Pourbaix diagram 상에서 2가 양이온으로 산화되어 전극이 용해되는 현상이 나타나기 때문에 Pt 전극으로만 실험하였다.[26,27]
3. 결과 및 고찰
3.1 전류 밀도 최대치를 이용한 대상 유기물별 촉매활성 평가
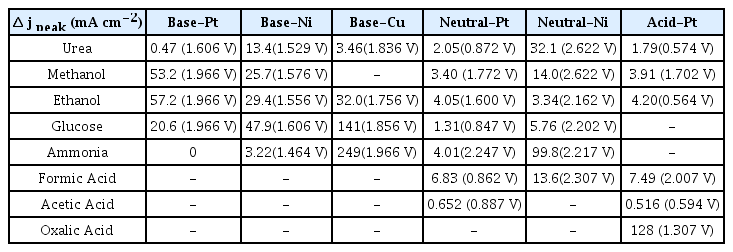
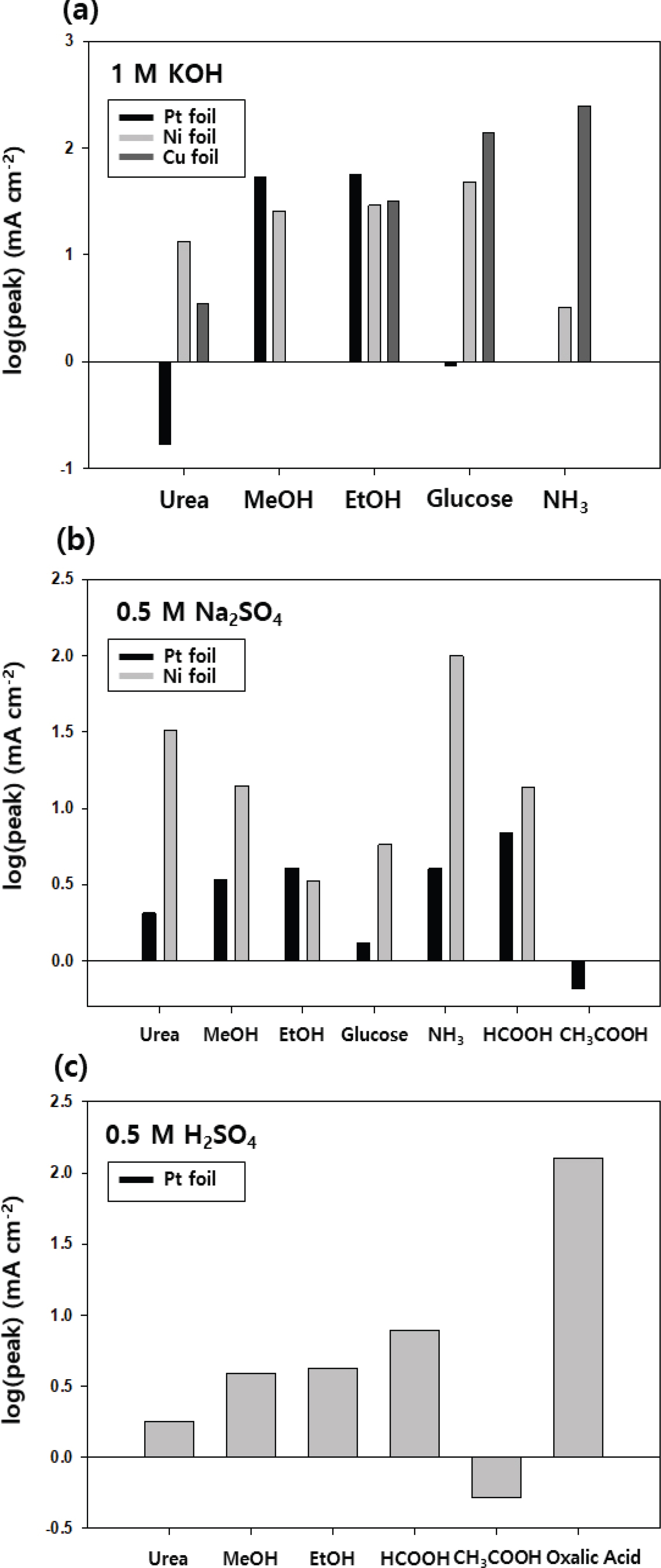
진행한 실험 전체의 최대 전류밀도를 구하여 Table 2에 나타내었다. 이는 유기물에 의한 효과만 반영된 값이다. 즉, 유기물 수용액에서의 전류밀도애서 전해질만 존재할 때의 전류밀도를 뺀 Differential Cyclic Voltammetry 중 가장 전류 밀도가 높은 값(Δ jsubscript)으로 설정하였다. Fig. 1은 대표적인 CV의 경향을 보여주고 있고, 실험 전체의 Δ jsubscript 값을 Fig. 2에 나타내었다. 물질에 따라 그 값의 차이가 커서 log scale로 표현하였다. 실험 결과, 전류 밀도 최대값이 90 mA cm-2 을 기준으로 잡고, 그보다 활성이 좋은 조건들을 다음 네 가지로 선정하였다.
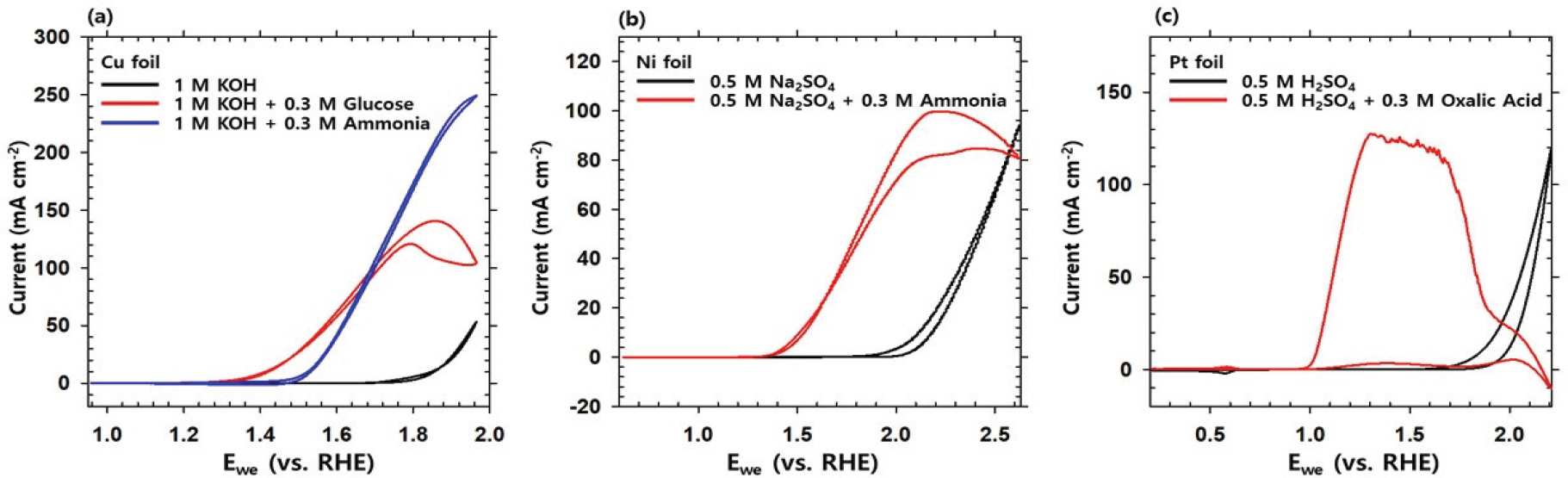
염기성 조건에서의 Cu 전극은 글루코오스와 암모니아를 분해하는 반응에서 각각 141 mA cm-2 (1.86 V), 249 mA cm-2 (1.97 V)의 전류 밀도 최대값을 가졌다. 중성 조건에서는 Ni 전극으로 암모니아를 분해할 때 전류 밀도 최대치는 99.8 mA cm-2 (2.22 V)을 가져 우수한 성능을 보였다. 산성에서는 Pt 전극이 옥살산을 분해할 때 전류밀도 최대치는 128 mA cm-2 (1.31 V) 활성이 좋은 촉매임을 알 수 있었다. 활성이 좋은 네 가지 촉매들은 onset potential의 관점으로도 우수한 모습을 보였다. 10 mA cm-2를 넘는 지점을 onset potential이라고 설정할 때, 염기성 전해질에서 구리 전극의 onset potential 은 1.85 V였던 것에 비해, 글루코오스를 첨가했을 때에는 1.42 V로, 암모니아를 첨가했을 때에는 1.53 V로 감소하였다. 중성 전해질에서 니켈 전극의 onset potential은 2.12 V였지만, 암모니아를 첨가했을 때 1.51 V로 줄어들었으며, 산성 전해질 조건에서의 onset potential은 1.86 V로 측정되었지만, 옥살산을 첨가했을 때 1.04 V로 크게 감소하는 것을 확인하였다 (Fig. 1).
그 외에도 전류밀도 최대값은 낮지만, 활성을 가지는 촉매를 발견하였다. 염기성 조건에서 Ni 전극은 유레아, 메탄올, 에탄올, 그리고 글루코오스까지 그래프 개형이 매우 유사하게 나타나는 것을 확인하였다. 1.5∼1.6 V 부근의 최대치 이후 OER onset인 1.6 V 이후로는 유기물의 존재 하에서 오히려 전류 밀도가 감소하는 것으로 나타났다. 이를 통해 염기성 조건 Ni 촉매에서 유기물 분해 반응은 수산화 이온의 산화반응 (OER)에 의해 저해되는 것을 확인할 수 있었다. 염기성 조건의 Pt 전극도 메탄올, 에탄올, 글루코오스에서 계속 증가하는 모양의 그래프 개형을 보이며 활성을 나타냈다. 염기성 조건에서의 구리 전극은 에탄올을 분해하는 과정에서 용해가 되지는 않았지만 검게 변하는 모습을 보였다. 이는 구리 수산화물의 형성에 기인한 것으로 추측되며 추후 연구에서 재료분석을 통한 검증이 필요하다. 이 또한 32 mA cm-2의 전류 밀도로 활성을 보였다. 중성과 산성 조건의 경우, 염기성에 비해 활성을 가진 물질들이 적었다. 중성의 경우, Pt 전극은 활성이 전혀 없었으며, Ni 전극에서만 약간의 활성을 가졌다. 앞서 언급한 암모니아를 제외하면, 유레아에서 32.1 mA cm-2, 메탄올에서 14.0 mA cm-2, 포름산에서 13.6 mA cm-2의 전류밀도 최대치 가졌다. 염기성 조건에 비해서 활성을 적게 가지며, 그 활성 또한 좋지 못한 모습을 보였다. 산성 조건에서는 옥살산을 제외하면 활성을 가지지 않는 것으로 판단된다.
3.2 반응 메커니즘 분석을 통한 결과 고찰
글루코오스가 산화될 떄에는 OH-가 수소를 떼어내는 과정이 다수 관여하여 염기성에서 가장 좋은 활성을 보인다. 글루코오스 산화 촉매의 경우 구리와 금 등의 11족 원소들이 많이 사용되는 것으로 알려져 있다.[28] 글루코오스의 직접산화 메커니즘은 식(1)∼(4)로 표현할 수 있다.[29]
실험 데이터 상에서는 1.86 V 근방에서 최대치가 크게 나타났다. 이는 C-C 결합이 끊어지는 반응에 대한 것이며, 글루코오스 뿐 아니라 글루콘산, 글루쿠론산, 글루카르산의 CV 데이터에서도 보인다. 이 부분에서 결합이 끊겨 최종 결과물은 포름산 등 분자의 크기가 작은 산이 되는 것으로 알려져 있다.[30] 알려진 글루코오스의 CV 데이터와는 다르게 산화 전류에서 전류밀도 최대차가 발생한 것을 확인하였는데, 이 모양은 글루콘산의 데이터와 유사하였다. 이는 초기에 용액 속에 있던 글루코오스가 반응을 통해 일부 글루콘산으로 바뀐 결과임을 짐작할 수 있다.
암모니아의 산화 반응 메커니즘 중 널리 알려진 것은 두 가지가 있다. 첫 번째는 수식 (5)∼(8)에 해당하는 방법으로, 암모니아가 금속 촉매에 흡착하여 OH-와 반응하며 수소를 하나씩 잃은 뒤 수소를 모두 잃은 흡착된 질소가 결합하여 N2 분자를 형성하는 메커니즘이다. 전류 밀도가 낮을 때에는 속도결정단계가 NH2, ads에서 수소가 떨어지는 과정으로, 높을 때는 N-N 결합이 형성되는 과정으로 알려져 있다.[31]
두 번째 메커니즘은 Gerischner and Mauerer 메커니즘으로 알려진 과정이다. 첫 번째와 동일하게 질소가 금속에 흡착한 뒤에 수소가 모두 떨어지지 않은 상태로 질소끼리 결합한 다음 수소가 떨어지며 N2가 생성되는 방식이다. 첫 번째 메커니즘에서는 N 원자의 흡착 에너지가 강해서 N2를 만들기에는 부적합하기 때문에 두 번째 메커니즘이 제안되었다.[32]
구리와 질소 사이 흡착 에너지는 타 금속에 비해 낮은 것으로 알려져 있다. 따라서 느린 반응인 금속과 질소가 떨어지고 N-N 결합이 생기는 반응의 속도가 다른 촉매에 비해 빨라진 것으로 보인다.[33] Ni 전극의 암모니아 산화 반응에서는 알려진 바와 다르게 결과가 도출되었다. 일반적으로 니켈은 암모니아 산화에 활성이 없는 것으로 알려져 있으며, Ni foam을 이용한 전기분해에서는 Ni(OH)2 혹은 NiOOH로의 산화 반응이 일어나야 활성이 생긴다.[34] 전극에서의 산화 반응은 염기성 조건의 경우 +2가와 +3가 이온으로의 산화 환원 반응이 CV 그래프 1.3 V∼1.5 V 사이에서 나타나는 것을 확인할 수 있다. 반면, 중성 조건의 경우에는 전해질 속 OH- 이온의 양이 적어 산화가 일어나지 않은 것으로 추정된다. 전극 산화전류는 보이지 않았지만 중성 조건에서 염기성 조건보다 좋은 활성을 보였다. 이에 대해서는 보고되지 않았기 때문에 전극 표면에서의 반응에 대해 추가적인 연구가 필요할 것으로 보인다.
옥살산의 경우, Pt 전극에서의 산화 메커니즘은 아래의 식(11)∼(13)과 같다.
산성 조건에서 전해질에 전류를 흘릴 경우, Pt는 +2가로 산화되었다가 0.6 V 부근의 환원 전류에서 다시 Pt(0)으로 돌아오는 신호가 CV 그래프 상에 나타난다 (Fig. 1c). 옥살산 산화 반응의 경우, Pt의 환원 전류가 보이지 않는데, 산화된 Pt 이온은 용액에 있는 옥살산과 빠르게 반응하여 환원되기 때문이다. 흡착된 옥살산은 Pt를 환원시키며 CO2와 H+ 이온으로 분해된다. CV 그래프에서 높은 전압 조건에서 생긴 최대치는 HC2 O4-과 금속 이온과의 반응으로 인한 것으로 알려져 있다.[35] 약 1.2 V 이상의 조건에서 전류는 오히려 감소하게 되는데 이는 Pt가 3가 이상으로 산화되면서 옥살산과의 반응성이 감소하고 흡착된 옥살산이 산소발생 활성을 저해하기 때문인 것으로 추측된다. 하지만 옥살산의 분해산물이 촉매독으로 작용했을 가능성도 배제할 수 없으므로 추후 연구에서는 장기 운전을 통한 반응의 안정성을 평가할 필요가 있다. 본 반응에서 전해질 조건을 염기 혹은 중성을 사용하는 경우, Pt에 옥살산이 흡착되며 H+가 떨어져 나가는 반응이 아닌, 중화 반응이 우위를 보일 것으로 예상되어 산성 조건에서 실험을 진행하였다.
3.3 폐수전해 및 폐수연료전지 구현을 위한 촉매연구 방향 고찰
본 연구에서 Cu 촉매는 염기성 조건에서 글루코오스 및 암모니아에 대한 직접산화 활성을 보였다. 이는 화장실 폐수를 활용한 전기분해 및 연료전지에 활용될 수 있는데, 소변 중의 유레아는 저장 과정에서 생물학적 가수분해에 의해 pH가 10까지 증가하면서 고농도의 암모니아를 생성하는 것으로 알려져 있다. 또한 화장실 폐수 중 글루코오스와 유사한 기능기를 갖는 탄화수소를 활용할 경우 일반적인 수전해보다 높은 에너지 효율로 수소를 생산하는 전해공정을 구현하거나 폐수 중 암모니아 및 탄화수소의 화학에너지를 전기에너지로 변환하는 폐수연료전지의 구현이 가능할 것으로 예상된다. 일반적으로 염기조건에서 Ni 기반 촉매가 유레아 또는 암모니아 직접산화를 널리 연구되어 왔지만, 본 연구의 결과에서 Ni 기반 촉매는 OER에 의해 심각하게 저해를 받는 것으로 나타났다. 반면에, Ni 촉매는 중성 pH 조건에서 암모니아 직접산화 활성을 보였으며 Cu 촉매는 이 영역에서의 활성이 확인되지 않았다. 따라서 향후 연구에서는 Cu와 Ni를 조합한 복합 촉매를 연구할 경우 각 구성요소의 단점을 상호 보완할 수 있을 것으로 예상된다.
한편, Pt 촉매는 옥살산을 포함한 산성용액에서 높은 활성을 보이는 것으로 나타났다. 하폐수 중 음식물 폐수, 축산폐수, 슬러지 등 고농도 유기폐수의 혐기성 소화를 거친 유출수는 옥살산을 포함한 고농도의 Carboxylic acid를 함유하는 것으로 알려져 있다. 현재 혐기소화 유출수는 하수처리장의 부하를 야기하는 사회적 이슈 중 하나로 인식되고 있는 바, Pt 기반 촉매를 활용하여 악성폐수의 정화와 에너지 변환/회수의 동시 달성을 기대할 수 있다.
본 연구는 영가 금속 촉매를 활용하였고 촉매의 활성을 전류밀도에 근거해 평가했다는 점에서 한계가 있다. 즉, 촉매 금속의 산화수, 화합물 형태, 구조에 따라 활성의 양상이 크게 바뀔 수 있고, 발생한 전류밀도의 일부는 금속 용출 등 부반응에 기인할 것일 수 있다. 따라서 본 연구에서 가능성을 확인한 기질 (하폐수종) 및 촉매 조합에 대한 추가적인 연구가 필요하다.
4. 결론
본 연구는 전기화학적인 유기물 산화 촉매에 대한 스크리닝을 진행하여 pH 별, 타겟 물질 별, 전극 별 데이터베이스를 만들어 추후 연구에 활용할 수 있는 정보를 제공하고자 진행하였다. pH 0, 7, 14 조건에서 Pt, Ni, Cu 전극으로 유레아, 메탄올, 에탄올, 글루코오스, 암모니아, 포름산, 아세트산 및 옥살산을 대상 물질로 실험하였다. 그 결과, 염기성 조건에서는 Cu 전극이 글루코오스와 암모니아 분해 성능이 좋았고, 중성 조건에서는 Ni 전극이 암모니아 분해에 좋은 활성을 보였다. 산성 조건에서는 Pt 전극이 옥살산 분해 성능이 우수한 것을 확인하였다. 염기성에서 Cu 전극의 글루코오스 분해의 경우, C-C 결합이 끊어질 때 가장 높은 전류밀도가 생성되었으며, 생성물인 글루콘산이 다시 전기분해되는 모습을 확인할 수 있었다. 또한, Cu 전극은 염기성 조건에서 암모니아 분해에 활성이 좋았는데, 구리와 암모니아의 흡착 에너지가 다른 촉매에 비해 낮은 것을 이유로 추측해볼 수 있었다. 중성 조건의 Ni의 경우 암모니아 분해에 활성이 좋았지만, 그 메커니즘은 염기성 조건에서 알려진 바와 달랐다. 그러나, 중성 조건에서 구동이 가능하고 염기성 조건보다 활성이 더 좋았기 때문에 추가적인 연구가 필요할 것으로 보인다. 마지막으로 산성 조건에서 Pt 전극의 옥살산 분해는 산화된 Pt에 옥살산이 흡착되며 환원되고, 이 과정에서 CO2로 산화되는 메커니즘임을 조사했다. 본 연구에서 진행한 스크리닝 데이터 중 좋은 활성을 보인 네 가지 물질들은 유기 폐기물 중에서도 화장실 폐수, 혐기성 소화 유출수 등에 포함된 물질들이다. 이들은 폐수 중에서도 큰 비율을 차지하기 때문에 본 연구는 추후 유기 폐기물 정화 기술 연구에 좋은 정보를 제공할 것으로 보인다.
References
Biography

◉◉ 이상원
◉ 현재 포항공과대학교 학부과정 재학중

◉◉ 김지선
◉ 2017년 영남대학교 학사
◉ 현재 포항공과대학교 석박통합과정 재학중

◉◉ 조강우
◉ 2014년 Caltech 박사
◉ 2006∼2016년 한국과학기술연구원 (선임)연구원
◉ 2017년∼현재 포항공과대학교 교수