ņä£ļĪĀ
ĻĖłņåŹ(ņłś)ņé░ĒÖöļ¼╝Ļ│╝ Ļ░ÖņØĆ ņåīņ×¼ļŖö ņ×ÉņŚ░Ļ│äņŚÉ ļäÉļ”¼ ņĪ┤ņ×¼ĒĢśļ®░, ņØĖļźśņØś ņŚŁņé¼ņÖĆ ĒĢ©Ļ╗ś ĻĘĖ ņō░ņ×äņāłņÖĆ ĒÖ£ņÜ®ļÅäĻ░Ć ņ¦ĆņåŹņĀüņ£╝ļĪ£ Ļ░£ļ░£ļÉśĻ│Ā ņ׳ļŗż. ļīĆĒæ£ņĀüņØĖ ĻĖłņåŹ(ņłś)ņé░ĒÖöļ¼╝ņØĆ ņĀÉĒåĀĻ┤æļ¼╝ ļĪ£ņä£ ņĢīļŻ©ļ»ĖļģĖņŗżļ”¼ņ╝ĆņØ┤ĒŖĖ ĻĖ░ļ░śņØś ĒÖöĒĢÖņĪ░ņä▒ņØä Ļ░¢Ļ│Ā ņ׳ņ£╝ļ®░, ļÅäņ×ÉĻĖ░ ņøÉļŻīņŚÉņä£ļČĆĒä░ ņÖĖņāü ņ╣śļŻīņĀ£ ļō▒ņ£╝ļĪ£ ņśżļ×½ļÅÖņĢł ņé¼ņÜ®ļÉśņ¢┤ ņÖöļŗż.1 ņĀÉĒåĀ ļ┐É ņĢäļŗłļØ╝ ĒÖ®ĒåĀļéś ĻĖ░ĒāĆ Ļ┤æļ¼╝ņ¦łļōżņØĆ Ļ▒┤ņČĢņåīņ×¼ņÖĆ ņØ╝ņāüņāØĒÖ£ņØä ņĀ£ņĪ░ĒĢśļŖö ņøÉļŻīļĪ£ ņé¼ņÜ®ļÉśņ¢┤ ņÖöņ£╝ļ®░, Ļ│╝ĒĢÖņĀüņ£╝ļĪ£ ĻĘ£ļ¬ģĒĢĀ ņłś ņ׳ļŖö ĻĖ░ļŖź ļ┐É ņĢäļŗłļØ╝ Ļ│╝ĒĢÖņĀü ĻĘ£ ļ¬ģņØĆ ņ¢┤ļĀĄņ¦Ćļ¦ī Ļ▓ĮĒŚśņĀüņ£╝ļĪ£ ņĢīĻ▓ī ļÉ£ ļŗżņ¢æĒĢ£ ĻĖ░ļŖźņä▒ņ£╝ļĪ£ ņØĖĒĢśņŚ¼ ņØĖļźś ņŚŁņé¼ņŚÉņä£ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉśņ¢┤ ņśżĻ│Ā ņ׳ļŗż. ņĄ£ĻĘ╝ņŚÉļŖö ņ▓£ņŚ░ņŚÉņä£ ņ¢╗ņØä ņłś ņ׳ļŖö ĻĖłņåŹ(ņłś)ņé░ĒÖöļ¼╝ņØä ļ¼╝ļ”¼ĒÖöĒĢÖņĀü ņä▒ņ¦łņŚÉ ļö░ļØ╝ ļČäļ”¼ĒĢśļŖö ĻĖ░ņłĀ ļ┐É ņĢäļŗłļØ╝ ņøÉĒĢśļŖö ļ¼╝ņä▒ņØä Ļ░¢ļŖö ĒśĢĒā£ļĪ£ ņĀ£ņĪ░ĒĢĀ ņłś ņ׳ļŖö ĻĖ░ņłĀ ļśÉĒĢ£ Ļ░£ļ░£ļÉśĻ│Ā ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņØ┤ļ¤¼ĒĢ£ ļ¼╝ņ¦łļōżņØś ņä▒ļŖźņØĆ ņóĆ ļŹö ņäĖļ░ĆĒĢśĻ▓ī ņĪ░ņĀłļÉĀ ņłś ņ׳ļŗż. ĒŖ╣Ē׳, ņĄ£ĻĘ╝ ņłśņŗŁļģäĻ░ä ļ╣äņĢĮņĀüņØĖ ļ░£ņĀäņØä ņØ┤ļŻ©ņ¢┤ ņś© ļéśļģĖĻĖ░ņłĀņŚÉ Ēלņ×ģņ¢┤ ĻĖłņåŹ(ņłś)ņé░ĒÖöļ¼╝ņØś Ēü¼ĻĖ░ļź╝ ņĪ░ņĀłĒĢśĻ▒░ļéś, Ēæ£ļ®┤ ĒŖ╣ņä▒ņØä ņĀ£ņ¢┤ĒĢśĻ│Ā, ļŗżļźĖ ņĪ░ņä▒ņØ┤ļéś ņä▒ņ¦łņØś ļ¼╝ņ¦łĻ│╝ ĻĘĀņØ╝ĒĢśĻ▓ī Ēś╝ĒĢ®ĒĢśļŖö ņØ╝ļōżņØ┤ Ļ░ĆļŖźĒĢśĻ▓ī ļÉśņŚłĻĖ░ņŚÉ ĻĖłņåŹ(ņłś)ņé░ĒÖöļ¼╝ņØś ĒÖ£ņÜ®ļÅäļŖö ļŹöņÜ▒ļŹö ļåÆņĢäņ¦ĆĻ│Ā ņ׳ļŗż.
ļ│Ė ļģ╝ļ¼ĖņŚÉņä£ļŖö ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒĢŁĻĘĀ ņ▓£ņŚ░ņåīņ×¼ļź╝ ļŗ┤ņ¦ĆĒĢśņŚ¼ ĒĢŁĻĘĀņåīņ×¼ĒÖöĒĢśļŖö ņŚ░ĻĄ¼ļź╝ ņåīĻ░£ĒĢśĻ│Āņ×É ĒĢ£ļŗż. ļŗżņ¢æĒĢ£ ņ▓£ņŚ░ ļ¼┤ĻĖ░Ļ│ä ņåīņ×¼ ņżæ ĒŖ╣ļ│äĒ׳ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ Ļ┤Ćņŗ¼ņØä Ļ░¢ļŖö Ļ░Ćņן Ēü░ ņØ┤ņ£ĀļŖö ņØ┤ ļ¼╝ņ¦łņØ┤ 2ņ░©ņøÉņØś ļ╣äļō▒ļ░®ņĀü ĻĄ¼ņĪ░ļź╝ Ļ░¢Ļ│Ā ņ׳ņ£╝ļ®░, ņĀüņĖĄ ĻĄ¼ņĪ░ļź╝ ņØ┤ļŻ©ļŖö ļéśļģĖņĖĄņØś ļæÉĻ╗śĻ░Ć ņŚ¼ĒāĆ ņĢīļĀżņ¦ä ļ¼╝ņ¦łņŚÉ ļ╣äĒĢ┤ņä£ ļ¦żņÜ░ ņ¢ćĻ│Ā, ņżĆņĢłņĀĢ ĻĄ¼ņĪ░(meta-stable structure) ļĢīļ¼ĖņŚÉ ņŚ¼ļ¤¼Ļ░Ćņ¦Ć ļ░śņØæņä▒ņŚÉ ļīĆĒĢ£ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż.2
Ļ┤æļ¼╝ĒĢÖņĀü Ļ┤ĆņĀÉņŚÉņä£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØĆ ņłśņé░ĒÖöļ¦łĻĘĖļäżņŖś(Mg(OH)2)ņØĖ ļĖīļŻ©ņé¼ņØ┤ĒŖĖ ĻĄ¼ņĪ░ņŚÉņä£ļČĆĒä░ ņŗ£ņ×æĒĢ£ļŗż. ļĖīļŻ©ņé¼ņØ┤ĒŖĖļŖö D4 hņĀÉĻĄ░ ļīĆņ╣ŁņØä Ļ░¢ļŖö Mg(OH)6Ēīöļ®┤ņ▓┤ļōżņØ┤ ļ¬©ņä£ļ”¼ļź╝ Ļ│Ąņ£ĀĒĢśļ®┤ņä£ 2ņ░©ņøÉņ£╝ļĪ£ ĒÄ╝ņ│Éņ¦ä ĻĄ¼ņĪ░ļź╝ Ļ░¢Ļ│Ā ņ׳ļŗż.3ŌĆō5 ņØ┤ļŖö ņĢöņŚ╝ ĻĄ¼ņĪ░ņŚÉņä£ ņ×ģļ░®ņĪ░ļ░Ćņīōņ×äļÉ£ Ēīöļ®┤ņ▓┤ļōżņØ┤ ĒĢ£ ņĖĄ Ļ▒┤ļäł ĒĢśļéśņö® ļ╣Āņ¦ä Ļ▓āĻ│╝ Ļ░ÖĻ│Ā Ļ▓░ņĀĢĒĢÖņĀüņ£╝ļĪ£ļŖö CdI2ĻĄ¼ņĪ░ņŚÉ Ļ░ĆĻ╣Øļŗż. ļĖīļŻ©ņé¼ņØ┤ĒŖĖļŖö Mg(OH)2ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ä ņ¢ćņØĆ ņĖĄļōżņØ┤ ņłśņåī Ļ▓░ĒĢ®ņŚÉ ņØśĒĢśņŚ¼ Ļ░ĢĒĢśĻ▓ī Ļ▓░ĒĢ®ļÉśņ¢┤ ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņŗżņĀ£ļĪ£ļŖö 2ņ░©ņøÉ ņä▒ņ¦łļ│┤ļŗżļŖö 3ņ░©ņøÉ ņä▒ņ¦łņØä ļØĀļŖö Ļ▓āņŚÉ Ļ░ĆĻ╣Øļŗż. ņØ┤ļ¤¼ĒĢ£ ļĖīļŻ©ņé¼ņØ┤ĒŖĖņŚÉņä£ ņØ╝ļČĆ Mg2+Ļ░Ć ņóĆ ļŹö ļåÆņØĆ ņé░ĒÖöņłśļź╝ Ļ░¢ļŖö ĻĖłņåŹ(ņśłļź╝ ļōżņ¢┤ Al3+)ļĪ£ ņ╣śĒÖśļÉśļ®┤, ņĀäņ▓┤ ĻĄ¼ņĪ░ļŖö ņØ╝ņĀĢĒĢśĻ▓ī ņ£Āņ¦ĆļÉ£ ņāüĒā£ņŚÉņä£ ņĖĄ ĻĄ¼ņĪ░ņŚÉ ņ¢æņĀäĒĢśĻ░Ć ĒĢśņĀäļÉ£ļŗż. ņ¢æņ£╝ļĪ£ ĒĢśņĀäļÉ£ ņĖĄļōżņØĆ ļŹö ņØ┤ņāü ņłśņåīĻ▓░ĒĢ®ņ£╝ļĪ£ Ļ░ĢĒĢśĻ▓ī Ļ▓░ņåŹļÉśņ¦Ć ļ¬╗ĒĢśļ»ĆļĪ£ ņĖĄĻ░äņŚÉ ņØīņØ┤ņś©ņØä ņĪ┤ņ×¼ņŗ£ņ╝£ ņĀĢņĀäĻĖ░ņĀü ņØĖļĀźņ£╝ļĪ£ ņĢłņĀĢĒÖöļÉ£ļŗż. ņĖĄĻ░äņØś ņØīņØ┤ņś©ņØĆ Ļ░ĢĒĢ£ Ļ▓░ĒĢ®ņ£╝ļĪ£ ņåŹļ░ĢļÉ£ Ļ▓āņØ┤ ņĢäļŗłĻĖ░ ļĢīļ¼ĖņŚÉ ņÖĖļČĆņØś ņØīņØ┤ņś© ņäĖĻĖ░Ļ░Ć ņ╗żņ¦Ćļ®┤ ļŗżļźĖ ņØ┤ņś©ņ£╝ļĪ£ ĻĄÉĒÖśļÉĀ ņłś ņ׳ļŗż.6ŌĆō9
ņØ┤ļĀćĻ▓ī ņāØņä▒ļÉ£ ļ¼╝ņ¦łņØ┤ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝(layered double hydroxide: LDH)ņØ┤ļ®░, ņ×ÉņŚ░Ļ│äņŚÉņä£ļŖö ĒĢśņØ┤ļō£ļĪ£Ēāłņé¼ņØ┤ĒŖĖ(Mg6 Al2(OH)16┬Ę H2 O)ĒśĢĒā£ļĪ£ ļ¦ÄņØ┤ ļ░£Ļ▓¼ļÉ£ļŗż.4, 5 ĒĢśņØ┤ļō£ļĪ£Ēāłņé¼ņØ┤ĒŖĖ ņÖĖņŚÉļÅä ļŗżņ¢æĒĢ£ ĻĖłņåŹņ¢æņØ┤ņś©Ļ│╝ ņĖĄĻ░äņØīņØ┤ņś©ļōżņØ┤ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØä ņØ┤ļŻ░ ņłś ņ׳ļŖöļŹ░, ņØ┤ ļ¼╝ņ¦łņØś ņØ╝ļ░śņĀüņØĖ ĒÖöĒĢÖņŗØņØĆ M(II)1-x M(III) x(OH)2(A n-) x/n┬ĘmH2 O(0<x<1,n-:ņØīņØ┤ņś©ņØś ņĀäĒĢśļ¤ē, mņØĆ Ļ▓░ņĀĢņłś)ļĪ£ ļéśĒāĆļé┤ņ¢┤ņ¦äļŗż. xņØś Ļ░ÆņØĆ 0ņŚÉņä£ 1ņé¼ņØ┤ļĪ£ ņØ┤ņĢ╝ĻĖ░ļÉśĻ│Ā ņ׳ņ£╝ļéś, ņŗżņĀ£ 2Ļ░Ć ĻĖłņåŹĻ│╝ 3Ļ░Ć ĻĖłņåŹņØś ļ╣äņ£©(M(II)/M(III))ņØĆ 1/1Ōł╝5/1 ņé¼ņØ┤ ņĀĢļÅäļĪ£ ĒĢ£ņĀĢļÉśņ¢┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. 3Ļ░Ć ņ¢æņØ┤ņś©ņØ┤ 1/1 ļ╣äņ£©ļ│┤ļŗż ļŹö ļåÆņĢäņ¦ĆĻ▓ī ļÉśļ®┤ ņĖĄņØ┤ Ļ░¢ļŖö ņ¢æņØ┤ņś©ņØś ņĀäĒĢśļ¤ēņØ┤ ļäłļ¼┤ ļåÆņĢäņ¦ĆĻ▓ī ļÉśņ¢┤ ņĢłņĀĢĒĢ£ ņĀüņĖĄĻĄ¼ņĪ░ļź╝ ņØ┤ļŻ░ ņłś ņŚåĻ▓ī ļÉśĻ│Ā, 3Ļ░Ć ņØ┤ņś©ņØś ļ╣äņ£©ņØ┤ 5/1ļ│┤ļŗż ļŹö ļé«ņĢäņ¦Ćļ®┤ ņĖĄņØś ņżæĻ░äņżæĻ░äņŚÉ ļĖīļŻ©ņé¼ņØ┤ĒŖĖņÖĆ Ļ░ÖņØĆ ņ¦ĆņŚŁļōżņØ┤ ņāØņä▒ļÉśĻĖ░ ļĢīļ¼ĖņŚÉ ļŗ©ņØ╝ņāüņØś ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ļĪ£ ņĪ┤ņ×¼ĒĢśĻĖ░ ņ¢┤ļĀĄļŗż.
ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØĆ ĻĖ░ļ│ĖņĀüņ£╝ļĪ£ ļĖīļŻ©ņé¼ņØ┤ĒŖĖ(Mg(OH)2)ļéś Ļ╣üņé¼ņØ┤ĒŖĖ(Al(OH)3)ņÖĆ Ļ░ÖņØĆ ĻĖłņåŹņłśņé░ĒÖöļ¼╝ Ēīöļ®┤ņ▓┤ļź╝ ĻĖ░ļ│Ėņ£╝ļĪ£ ĒĢśļŖö ļŗ©ņ£äņØ┤ļ®░, ņØ┤ļ¤¼ĒĢ£ ļŗ©ņ£äņ▓┤ļōżņØĆ ņĀÉĒåĀ(clay)ļź╝ ņØ┤ļŻ©ļŖö ĻĖ░ļ│Ėļŗ©ņ£äņÖĆ ņ£Āņé¼ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņĀÉĒåĀĻ│äņŚ┤ ļ¼╝ņ¦łļĪ£ ļČäļźśļÉ£ļŗż. ļŗżļ¦ī, ņĀÉĒåĀļōżņØĆ ļīĆņ▓┤ļĪ£ ņĖĄņĀäĒĢśļź╝ ļØĀņ¦Ć ņĢŖĻ▒░ļéś, ņØīņØś ņĖĄņĀäĒĢśļź╝ ļØĀĻ│Ā ņĖĄĻ░äņŚÉ ņ¢æņØ┤ņś©(Na+,K+,Ca2+ļō▒)ņØä ĒżĒĢ©ĒĢśĻ│Ā ņ׳ļŖö ļ░śļ®┤, ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØĆ ņ¢æņØś ņĖĄņĀäĒĢśļź╝ ļØĀĻ│Ā ņĖĄĻ░äņŚÉ ņØīņØ┤ņś©ņØä ĒżĒĢ©ĒĢśĻ│Ā ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņóģņóģ ņØīņØ┤ņś©ņä▒ ņĀÉĒåĀļØ╝Ļ│Ā ļČłļ”¼ĻĖ░ļÅä ĒĢ£ļŗż.1, 4 ņל ņĢīļĀżņ¦ä ņĀÉĒåĀ ĒÖöĒĢ®ļ¼╝ņØĖ ļ¬¼ĒŖĖļ¬©ļ”┤ļĪ£ļéśņØ┤ĒŖĖ(montmorillonite)ņÖĆ ļ╣äĻĄÉĒĢĀ ļĢī ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØĆ ņĖĄņĀäĒĢśļ░ĆļÅäĻ░Ć Ēø©ņö¼ ļåÆĻ│Ā, ņĖĄņØś ļæÉĻ╗śĻ░Ć ļŹö ņ¢ćņ£╝ļ®░, ņé░ņä▒ ņĪ░Ļ▒┤ņŚÉņä£ ņēĮĻ▓ī ņÜ®ĒĢ┤ļÉśļŖö ļō▒ ļ¼╝ļ”¼ĒÖöĒĢÖņĀü ņä▒ņ¦łņØ┤ ņāüņØ┤ĒĢśļŗż. ņØ┤ļ¤¼ĒĢ£ ļ¼╝ļ”¼ĒÖöĒĢÖņĀü ņä▒ņ¦łņŚÉ ņØśĒĢśņŚ¼ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņØæņÜ®ņä▒ņØ┤ ĒÖĢņןļÉĀ ņłś ņ׳ļŗż.
ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņ£ĀņÜ®ĒĢ£ ĒŖ╣ņä▒ ņżæ ĒĢśļéśļŖö ņŗżļ”¼ņ╝ĆņØ┤ĒŖĖļź╝ ĒżĒĢ©ĒĢśņ¦Ć ņĢŖļŖö ĻĄ¼ņĪ░ņØ┤ļÉś ļŗżņ¢æĒĢ£ 2Ļ░ĆņÖĆ 3Ļ░Ć ĻĖłņåŹņØś ņĪ░ĒĢ®ņ£╝ļĪ£ ņ£Āņé¼ĒĢ£ Ļ│©Ļ▓® ĻĄ¼ņĪ░ļź╝ ļ¦īļōż ņłś ņ׳ļŗżļŖö ņĀÉņØ┤ļŗż. ņØ┤ ĒŖ╣ņä▒ņØĆ ļÅÖņØ╝ĒĢ£ ĻĄ¼ņĪ░ ļé┤ņŚÉņä£ ļŗżņ¢æĒĢ£ ĒÖöĒĢÖņĀü ņä▒ņ¦łņØä ņāØņä▒ĒĢ┤ ļé╝ ņłś ņ׳ļŗżļŖö ņןņĀÉņØ┤ ņ׳ņ£╝ļ®░, ĒŖ╣Ē׳ ņ┤ēļ¦ż ĒŖ╣ņä▒ņØä Ļ░¢ļŖö ņĀäņØ┤ĻĖłņåŹ(Ni2+,Fe2+/Fe3+,Co2+ļō▒)ņØä Ļ│©Ļ▓®ĻĄ¼ņĪ░ņŚÉ ĒżĒĢ©ņŗ£Ēé¼ ņłś ņ׳ļŗżļŖö ņĀÉņŚÉņä£ ņØæņÜ®ņä▒ņØ┤ ļåÆļŗż. ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņĖĄĻ░ä ņØīņØ┤ņś©ņØĆ ņĀĢņĀäĻĖ░ņĀüņ£╝ļĪ£ ņĢłņĀĢĒÖöļÉśņ¢┤ ņ׳ņ£╝ļéś, ņÖĖļČĆņŚÉ ļŹö ļåÆņØĆ ņØ┤ņś©ņäĖĻĖ░ļź╝ Ļ░¢ļŖö ņØīņØ┤ņś©ļōżņØ┤ ļåŹļÅäĻĄ¼ļ░░ļź╝ ĒåĄĒĢ┤ ņĀæĻĘ╝ĒĢ┤ ņśżļ®┤ ņēĮĻ▓ī ņØ┤ņś©ĻĄÉĒÖśņ£╝ļĪ£ ņ╣śĒÖśļÉĀ ņłś ņ׳ļŗż. ĻĘĖļĀćĻĖ░ ļĢīļ¼ĖņŚÉ, ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ļé┤ ņĪ┤ņ×¼ĒĢśļŖö ņØīņØ┤ņś©ņØĆ ņĖĄĻ░äņéĮņ×ģ ļ░śņØæņŚÉ ņØśĒĢ┤ Ļ░ĆņŚŁņĀüņ£╝ļĪ£ ņ╣śĒÖśļÉĀ ņłś ņ׳Ļ│Ā, ļ│┤Ļ│ĀļÉ£ ļ░öņŚÉ ļö░ļź┤ļ®┤, ņĖĄĻ░ä ņØ┤ņś©ņ£╝ļĪ£ ņĪ┤ņ×¼ Ļ░ĆļŖźĒĢ£ Ļ▓āļōżņØĆ ļ¼┤ĻĖ░ņé░(ClŌłÆ,NO3ŌłÆ,SO42-,CO32-ļō▒), ņ£ĀĻĖ░ņé░ (CH3 COOŌłÆ,C3 H5 O (COO)33-,(CH2)2(COO)22-ļō▒), ņ»öļ╣äĒä░ņØ┤ņś©, ļ╣äĒāĆļ»╝ ļČäņ×É, ņØīņØ┤ņś©ņä▒ ņĢĮļ¼╝ļČäņ×É, ĒÅ┤ļ”¼ĒÄśļåĆ, ĻĖ┤ ņé¼ņŖ¼ņØä Ļ░¢ļŖö Ļ│äļ®┤ĒÖ£ņä▒ņĀ£, ņØīņØ┤ņś©ņä▒ Ļ│ĀļČäņ×É, DNA ļō▒ņ£╝ļĪ£ ļ¦żņÜ░ ļŗżņ¢æĒĢśĻ▓ī ĒÖĢņןļÉĀ ņłś ņ׳ļŗż.9ŌĆō18 ĒŖ╣Ē׳ ļČäņ×ÉņØś ļČĆĒö╝Ļ░Ć Ēü░ Ļ│ĀļČäņ×ÉļōżņØĆ ņĖĄĻ░äņŚÉ ĻĘ£ņ╣ÖņĀüņ£╝ļĪ£ ļ░░ņŚ┤ĒĢśļŖö ņĖĄĻ░ä ņéĮņ×ģ ļ░śņØæņØä ĒåĄĒĢ┤ ņĪ┤ņ×¼ĒĢĀ ņłśļÅä ņ׳ņ¦Ćļ¦ī, ņ╣┤ļō£ņ¦æĻĄ¼ņĪ░(house-of-cards structure)ņÖĆ Ļ░ÖņØĆ ĒśĢĒā£ļĪ£ļÅä ņĪ┤ņ×¼ĒĢĀ ņłś ņ׳ļŗż. ņ¢┤ļ¢ż ĒśĢĒā£ļĪ£ ņĪ┤ņ×¼ĒĢśļŖöņ¦ĆņØś ņ£äņ╣śņÖĆļŖö ņāüĻ┤ĆņŚåņØ┤ ĻĖłņåŹņłśņé░ĒÖöļ¼╝ ņĖĄņŚÉ ņØśĒĢ┤ ļŗ┤ņ¦ĆļÉ£ Ļ│ĀļČäņ×ÉņÖĆ ņ£ĀĻĖ░ļ¼╝ļōżņØĆ ņÖĖļČĆņØś ļ¼╝ļ”¼┬ĘĒÖöĒĢÖ┬ĘņāØļ¼╝ĒĢÖņĀü Ļ│ĄĻ▓®ņŚÉ ļīĆĒĢ┤ ņĢłņĀĢņä▒ņØä ĒÖĢļ│┤ĒĢĀ ņłś ņ׳ļŗż. ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ņØśĒĢ┤ ņĢłņĀĢĒÖöļÉ£ ļČäņ×ÉļōżņØś ņŚ┤ļČäĒĢ┤ ņś©ļÅäĻ░Ć ļåÆņĢäņ¦äļŗżļŹśņ¦Ć,19ŌĆō21 ņé░ņä▒ ņĪ░Ļ▒┤ņŚÉņä£ DNA ļČäņ×ÉļōżņØś ļČäĒĢ┤Ļ░Ć ļŹöļÄīņ¦äļŗżļŹśņ¦Ć,22, 23 Ēś╣ņØĆ DNA ļČäĒĢ┤ ĒÜ©ņåīņŚÉ ņØśĒĢ£ Ļ│ĄĻ▓®ņŚÉ ļīĆĒĢ┤ ņĢłņĀĢņä▒ņØä ĒÖĢļ│┤ĒĢ£ļŗżļŹśņ¦Ć18, 24 ĒĢśļŖö ĒśäņāüļōżņØ┤ ļŗżņłś ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż.
ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ļīĆĒĢ£ ņØæņÜ® ņŚ░ĻĄ¼ļŖö ņśżļ×½ļÅÖņĢł ņ┤ēļ¦żņŚ░ĻĄ¼ Ļ┤ĆņĀÉņŚÉņä£ ņŻ╝ļĪ£ ņ¦äĒ¢ēļÉśņ¢┤ ņÖöļŗż. ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņĖĄĻ░äņŚÉ ĒŖ╣ņĀĢ ļ░░ņ£äĒÖöĒĢ®ļ¼╝ņØä Ļ│ĀņĀĢņŗ£Ēéżļ®┤ ņØ┤ņ¦łņāü ņ┤ēļ¦żļĪ£ņä£ņØś ņŚŁĒĢĀņØä ĒĢĀ ņłś ņ׳Ļ│Ā,25, 26 ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØä ņŚ┤ņ▓śļ”¼ĒĢśļ®┤ Ēś╝ĒĢ®ĻĖłņåŹņé░ĒÖöļ¼╝ņØ┤ ņāØņä▒ļÉśļ®┤ņä£ ĻĖłņåŹņØś ņ┤ēļ¦ż ņä▒ņ¦łņØ┤ ļæÉļō£ļ¤¼ņ¦ĆĻĖ░ ļĢīļ¼ĖņŚÉ ĻĘĖ ņ×Éņ▓┤ļĪ£ņä£ļÅä ņ┤ēļ¦żņØś ņä▒ļŖźņØä Ļ░¢ļŖöļŗż.26ŌĆō28 ĻĘĖļ¤¼ļéś, ņĄ£ĻĘ╝ 20ļģäļÅÖņĢłņØĆ ņāüĻĖ░ ļ¼Ėļŗ©ņŚÉņä£ ņäżļ¬ģĒĢ£ ļ░öņÖĆ Ļ░ÖņØ┤ ļČłņĢłņĀĢĒĢ£ ņ£ĀĻĖ░ļ¼╝ņØ┤ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ļé┤ņŚÉ ļŗ┤ņ¦ĆļÉĀ ņłś ņ׳Ļ│Ā, ņØ┤ļ¤¼ĒĢ£ ņ£ĀĻĖ░ļ¼╝ņØś ņóģļźśĻ░Ć ņāØļ¼╝ĒĢÖņĀü ĒÖ£ņä▒ņØä ņ¦ĆļŗłļŖö ļ¼╝ņ¦łĻ╣īņ¦Ć ĒżĒĢ©ĒĢĀ ņłś ņ׳ļŗżļŖö ņŚ░ĻĄ¼Ļ░Ć ļ│┤Ļ│ĀļÉ£14, 22, 29, 30 ņØ┤ļלļĪ£ ņāØļ¼╝ņØśĒĢÖņĀü ņØæņÜ® ņŚ░ĻĄ¼ ļśÉĒĢ£ Ēü░ Ļ┤Ćņŗ¼ņØä Ļ░¢Ļ│Ā ņ׳ļŗż.
ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØä ņāØļ¼╝ņØśĒĢÖņĀüņ£╝ļĪ£ ņØæņÜ®ĒĢśļŖö ļŹ░ ņ׳ņ¢┤ņä£ņØś ļæÉĻ░Ćņ¦Ć ĒĢĄņŗ¼ņé¼ĒĢŁņØĆ ņ¢╝ļ¦łļéś ļŗżņ¢æĒĢ£ ņāØļ”¼ĒÖ£ņä▒ņóģņØä ļŗ┤ņ¦ĆĒĢĀ ņłś ņ׳ļŖÉļāÉņÖĆ ņ¢╝ļ¦łļéś ļåÆņØĆ ņĢłņĀĢņä▒ņØä ņČöĻĄ¼ĒĢĀ ņłś ņ׳ļŖÉļāÉņØ┤ļŗż. Ēøäņ×ÉņØś Ļ▓ĮņÜ░ ņŚ¼ļ¤¼ ļ¼ĖĒŚīņŚÉņä£ ņĢłņĀĢĒÖöņŚÉ ļīĆĒĢ£ Ļ░ĆļŖźņä▒ņØ┤ ĒāĆņ¦äļÉśņŚłņ¦Ćļ¦ī, ņĀäņ×ÉņØś Ļ▓ĮņÜ░ ļŗ┤ņ¦ĆļÉĀ ļīĆņāü ļ¼╝ņ¦łņØś ļ¼╝ļ”¼ĒÖöĒĢÖņĀü ĒŖ╣ņä▒ņŚÉ ļö░ļØ╝ ļŗ┤ņ¦Ć Ļ░ĆļŖźņä▒ņØś ļ│ĆņłśĻ░Ć ļ¦ÄņØ┤ ņĪ┤ņ×¼
ĒĢ£ļŗż. ĒŖ╣Ē׳ 2ņ░©ņøÉ ņĖĄņāüĒśĢ ĻĄ¼ņĪ░ļōżņØś ņĀüņĖĄĻ│╝ ņ╣┤ļō£ņ¦æ ĻĄ¼ņĪ░ņŚÉ ņØśĒĢ┤ ņ¢╝ļ¦łļéś ļŗżņ¢æĒĢ£ ņāØļ”¼ĒÖ£ņä▒ņóģļōżņØ┤ ļŗ┤ņ¦ĆļÉĀ ņłś ņ׳ļŖöņ¦Ćļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ĻĘĖņŚÉ ļ¦×ļŖö ņĀäļץņØ┤ ĒĢäņÜöĒĢśļŗż.
ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņ¦äņØĆ ĻĖ░ņĪ┤ņØś ļŗ©ņł£ĒĢ£ ņØ┤ņś©ĻĄÉĒÖśļ▓Ģ ņÖĖņŚÉ ļ®öļ¬©ļ”¼ ĒÜ©Ļ│╝ļź╝ ņØ┤ņÜ®ĒĢ£ ņ▓£ņŚ░ņåīņ×¼ņØś ļŗ┤ņ¦Ćļź╝ ņŚ░ĻĄ¼ĒĢśĻ│Āņ×É ĒĢśņśĆļŗż. ņĢĮņÜ® ņŗØļ¼╝ļōżņØś ņČöņČ£ļ¼╝ļōżņØĆ ļŗżņ¢æĒĢ£ ņ╣śļŻīļŖźņØä Ļ░¢Ļ│Ā ņ׳Ļ│Ā, ņØ┤ļŖö ņØ┤ļ»Ė ĒĢ£ņØśĒĢÖĻ│╝ ņä£ņ¢æņØśĒĢÖņŚÉņä£ļÅä ņל ĒÖĢņØĖļÉĀ ņłś ņ׳ļŖö ņé¼ņŗżņØ┤ļŗż. ļŗżļ¦ī, ņČöņČ£ļ¼╝ļōżņØĆ ļäłļ¼┤ļéśļÅä ļŗżņ¢æĒĢ£ ĒÖöĒĢÖņóģņØä Ļ░¢Ļ│Ā ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņāØļ”¼ĒÖ£ņä▒ņóģļōżņØä ļČäĒÜŹĒĢśļŖö Ļ▓āņØ┤ ļ¦żņÜ░ ņ¢┤ļĀĄĻ│Ā, ņČöņČ£ļ¼╝ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ļŗżņ¢æĒĢ£ ļČäņ×ÉļōżņØä ĒĢśļéśņØś ļ¦żĒŖĖļ”ŁņŖżņŚÉ ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ļŗ┤ņ¦ĆĒĢśļŖö Ļ▓ā ņŚŁņŗ£ ņ¢┤ļĀĄļŗż. ĻĘĖļ¤¼ļéś, ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØ┤ Ļ░¢ļŖö ļ®öļ¬©ļ”¼ ĒÜ©Ļ│╝ļŖö ĻĘĖ ĒŖ╣ņłśņä▒ ļĢīļ¼ĖņŚÉ ļŗżņ¢æĒĢ£ ĒÖöĒĢÖņóģņØä ļÅÖņŗ£ņŚÉ ļŗ┤ņ¦ĆĒĢĀ Ļ░ĆļŖźņä▒ņØä Ļ░¢Ļ│Ā ņ׳ļŗż. ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØä ņĀüņĀłĒĢ£ ņś©ļÅäņŚÉņä£ Ļ░ĆņŚ┤ĒĢśļ®┤ ņĖĄņØä ņØ┤ļŻ©Ļ│Ā ņ׳ļŖö ņłśņé░ĒÖöĻĖ░ņŚÉņä£ Ēāłņłśļ░śņØæņØ┤ ņØ╝ņ¢┤ļéśĻ│Ā ņĖĄĻ░äņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ņØ┤ņś©ļōżņØĆ ĻĖ░ĒÖöļÉ£ļŗż.31, 32 ņśłņ╗©ļīĆ. Mg6 Al2 (OH)16┬Ę H2 OņØś ĒÖöĒĢÖņŗØņØä Ļ░¢ļŖö ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØä 400-600Ōäā ņĀĢļÅäņØś ņś©ļÅäņŚÉņä£ ĒĢśņåīņŗ£Ēéżļ®┤ Mg6 Al2 O9ņØś ĒÖöĒĢÖņŗØņØä Ļ░¢ļŖö ĻĖłņåŹņé░ĒÖöļ¼╝ņØ┤ ļÉ£ļŗż. ņØ┤ ļ¼╝ņ¦łņØĆ ļČäņ×É ņłśņżĆņŚÉņä£ ļ│╝ ļĢī MgO Ļ▓░ņĀĢņ×ÉļōżņØ┤ ļ»ĖņäĖĒĢśĻ▓ī ņāØņä▒ļÉśĻ│Ā, ņØ┤ļōż ņé¼ņØ┤ņé¼ņØ┤ņŚÉ AlņØ┤ Ļ░ĆĻĄÉĒÖöļÉ£ Ļ▓āņ▓śļ¤╝ ņĪ┤ņ×¼ĒĢśĻ│Ā ņ׳ļŗż. ņØ┤ ļ¼╝ņ¦łņØĆ ļ¼╝ļČäņ×ÉņØś ņĪ┤ņ×¼ĒĢśņŚÉ ļŗżņŗ£ ņłśĒÖöļÉśņ¢┤ ļ®Ģņŗ£ļäłļØ╝ņØ┤ĒŖĖ(mexinerite)Ļ░Ć ļÉśĻ│Ā,33, 34 ņØ┤ ļ░śņØæ ņżæņŚÉ ņĀüņĀłĒĢ£ ņØīņØ┤ņś©ņØ┤ ņĪ┤ņ×¼ĒĢśļ®┤ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņĀüņĖĄĻĄ¼ņĪ░ļĪ£ ļÅīņĢäņś©ļŗż.35, 36 ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØĆ ļ░śļ│ĄļÉ£ Ēāłņłś-ņłśĒÖö ļ░śņØæņŚÉņä£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝-Ēś╝ĒĢ®ņé░ĒÖöļ¼╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņāüļ│ĆĒÖöļź╝ ļ░śļ│ĄĒĢĀ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņØ┤ļź╝ ļ®öļ¬©ļ”¼ ĒÜ©Ļ│╝ļØ╝Ļ│Ā ņØ╝ņ╗½ļŖöļŗż.37 ņżæņÜöĒĢ£ ņĀÉņØĆ ļ®öļ¬©ļ”¼ ĒÜ©Ļ│╝ņŚÉ ņØśĒĢ┤ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØ┤ ņøÉļלņØś ĻĄ¼ņĪ░ļź╝ ĒÜīļ│ĄĒĢĀ ļĢī ļ¼╝ļ”¼ņĀüņØĖ ņä▒ņāüņØĆ ļ│ĆĒÖöĒĢĀ ņłś ņ׳ļŖöļŹ░, ņŻ╝ļĪ£ ļ¦żļüłĒĢ£ ņĖĄņāüĒśĢ ņä▒ņāüņŚÉņä£ Ēæ£ļ®┤ņØ┤ ņÜĖĒēüļČłĒēüĒĢ£ ļ¬©ļלņןļ»Ė(sandrose) ņä▒ņāüņ£╝ļĪ£ ļ│ĆĒÖöĒĢśĻ│Ā, ņØ┤ ļĢīņØś ļ¬©ļלņןļ»Ė ĻĄ¼ņĪ░ļŖö ņ╣┤ļō£ņ¦æ ĻĄ¼ņĪ░ņÖĆ ņ£Āņé¼ĒĢ£ ĒśĢĒā£ļź╝ ļØĀĻ▓ī ļÉ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņ¦äņØĆ ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöņŚÉ ņ░®ņĢłĒĢśņŚ¼ ĒĢśņåīļÉ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝, ņ”ē Ēś╝ĒĢ®ĻĖłņåŹņé░ĒÖöļ¼╝ņØä ņ▓£ņŚ░ ņČöņČ£ļ¼╝ ņĪ┤ņ×¼ĒĢśņŚÉ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĻĄ¼ņĪ░ļĪ£ ņ×¼Ļ▒┤ĒĢśņśĆņ£╝ļ®░, ņČöņČ£ļ¼╝ ļé┤ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ņØīņØ┤ņś©ļōżĻ│╝ ļīĆĻĖ░ ņżæņŚÉņä£ Ļ│ĄĻĖēļ░øļŖö Ēāäņé░ņØ┤ņś©ļōżļĪ£ ņøÉļלņØś ĻĄ¼ņĪ░Ļ░Ć ņ×¼Ļ▒┤ļÉĀ ļĢī ņ×ģņ×ÉļōżņØ┤ ļ¦īļōżņ¢┤ ļé┤ ļŖö ņ╣┤ļō£ņ¦æ ĻĄ¼ņĪ░ ņé¼ņØ┤ņé¼ņØ┤ņŚÉ Ēü¼ĻĖ░Ļ░Ć Ēü░ ņČöņČ£ļ¼╝ ņä▒ļČäļōżņØ┤ ļŗ┤ņ¦ĆļÉĀ Ļ▓āņØ┤ļØ╝ ĒīÉļŗ©ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒĢŁĻĘĀņä▒ņØä Ļ░¢ļŖö ņ▓£ņŚ░ņČöņČ£ļ¼╝ņØä ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ļŗ┤ņ¦ĆĒĢśņŚ¼ ĻĘĖ ĒĢŁĻĘĀ ņä▒ļŖźņØ┤ ņ£Āņ¦ĆļÉśĻ▒░ļéś ņ”ØĻ░ĆļÉśļŖö ĒśäņāüņØä Ļ┤Ćņ░░ĒĢśņśĆņ£╝ļ®░, ņØ┤ļź╝ ĒåĄĒĢ┤ ĒĢŁĻĘĀņåīņ×¼ĒÖöņŚÉņä£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņŚŁĒĢĀĻ│╝ ņ×Āņ×¼ļĀźņØä ĒāĆņ¦äĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
ņ×¼ļŻī ļ░Å ļ░®ļ▓Ģ
2.1. ņ×¼ļŻī ļ░Å ņŗ£ņĢĮ
ņ¦łņé░ļ¦łĻĘĖļäżņŖśņłśĒÖöļ¼╝(Mg(NO3)2┬Ę H2 O),ņ¦łņé░ņĢīļŻ©ļ»ĖļŖäņłśĒÖöļ¼╝(Al(NO3)3┬Ę H2 O)Ļ│╝ Ēāäņé░ņłśņåīļéśĒŖĖļź©(NaHCO3)ņØĆ Sigma-Aldrich Co. LLC. (St. Louis, MO, USA)ņŚÉņä£ ĻĄ¼ņ×ģĒĢśņśĆļŗż. ņłśņé░ĒÖöļéśĒŖĖļź©(NaOH)ņØĆ ļīĆņĀĢĒÖöĻĖłņŚÉņä£ Nutrient brothņÖĆ nutrient agarļŖö Merck KGaA (Darmstadt, Germany)ņŚÉņä£ ĻĄ¼ļ¦żĒĢśņŚ¼ ņČöĻ░ĆņĀüņØĖ ņĀĢņĀ£Ļ│╝ņĀĢ ņŚåņØ┤ ņé¼ņÜ®ĒĢśņśĆļŗż. ļ¬®ļŗ©Ēö╝(Paeonia suffruticosa Andrews)ņÖĆ ļ░▒ņ×æņĢĮ(Peaonia japonica) ņČöņČ£ļ¼╝ņØĆ Ļ▒┤ņĪ░ĒĢ£ ņČöņČ£ļ¼╝ 50 gņØä ļČäņćäĒĢ£ Ēøä 100Ōäā ņ”ØļźśņłśņŚÉņä£ 90ļČäĻ░ä ņŚ┤ņłś ņČöņČ£ĒĢśņśĆļŗż. ņŚ┤ņłśņČöņČ£ĒĢ£ ļ¬®ļŗ©Ēö╝ņÖĆ ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņŚÉņä£ ņ”Øļźśņłśļź╝ ņ¦äĻ│Ą ņ”Øļ░£ĻĖ░ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ”Øļ░£ņŗ£Ēé© Ēøä ņŚ┤ņłśņČöņČ£ļ¼╝ ļČäļ¦ÉņØä ĒÖĢļ│┤ĒĢśņśĆļŗż.
2.2. ņČöņČ£ļ¼╝ņØś ĒĢŁĻĘĀņä▒ ĒÅēĻ░Ć
ņČöņČ£ļ¼╝ņŚÉ ĒĢŁĻĘĀņä▒ņØ┤ ņ׳ļŖöņ¦Ć ņŚ¼ļČĆļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼, ĻĘĖļ×ī ņØīņä▒ĻĘĀņØĖ Escherichia coli (E.coli)ņÖĆ ĻĘĖļ×ī ņ¢æņä▒ĻĘĀņØĖ (Bacillus subtilis(B.subtilis) ļæÉ ĻĘĀņŻ╝ņŚÉņä£ paper discņŚÉ ņØśĒĢ£ ĒĢ£ņ▓£ļ░░ņ¦ĆĒÖĢņé░ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒÅēĻ░ĆĒĢśņśĆļŗż. ĒÅēĒīÉļ░░ņ¦ĆņŚÉņä£ ļ░░ņ¢æļÉ£ ļæÉ ĻĘĀņŻ╝ņŚÉņä£ 2Ōł╝3ņØś colonyļź╝ ņĘ©ĒĢ┤ nutrient brothņŚÉ ņĀæņóģĒĢśĻ│Ā, 37ŌäāņŚÉņä£ 180 rpmņ£╝ļĪ£ 24ņŗ£Ļ░ä ļÅÖņĢł ļ░░ņ¢æĒĢśņŚ¼ ĻĘĀņØä ĒÖ£ņä▒ĒÖö ņŗ£ņ╝░ļŗż. ņżĆļ╣äļÉ£ ĻĘĀ ļ░░ņ¢æņĢĪņØä ņ×ÉņÖĖņäĀĒØĪĻ┤æĻ┤æļÅäĻ│ä(UV-vis spectrometer, Biowave 2, Biochrom, Cambridge, UK)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ 595 nmņŚÉņä£ ĒØĪĻ┤æļÅäļź╝ ņĖĪņĀĢĒĢśņŚ¼ ĒØĪĻ┤æļÅäĻ░Ć 0.5Ļ░Ć ļÉśļÅäļĪØ ĻĘĀ ĒؼņäØņĢĪņØä ņżĆļ╣äĒĢśņśĆļŗż. (E. coliļŖö 1.0 ņ£╝ļĪ£ ĻĘĀņØä ĒؼņäØĒĢ£ļŗż.) ļåŹļÅäļź╝ ņĪ░ņĀłĒĢ£ ĻĘĀņØä agar plateņŚÉ ļ®ĖĻĘĀļÉ£ ļÅäļ¦Éļ┤ēņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĻĘĀ ĒؼņäØņĢĪņØä ĻĘĀņØ╝ĒĢśĻ▓ī plate Ēæ£ļ®┤ņŚÉ ļÅäļ¦ÉĒĢśņśĆļŗż. 8 mmņØś paper discļź╝ ņØ╝ņĀĢĻ░äĻ▓®ņ£╝ļĪ£ plate ņ£äņŚÉ ņś¼ļĀżļåōņØĆ Ēøä, discņŚÉ 0.25%, 0.5%, 1.0%, 2.0%ļĪ£ ļģ╣ņØĖ ļ¬®ļŗ©Ēö╝ņÖĆ ļ░▒ņ×æņĢĮ ņŚ┤ņłś ņČöņČ£ļ¼╝ņØä 50 ŃÄĢņö® ļ¢©ņ¢┤ļ£©ļ”░ Ēøä, ņČ®ļČäĒ׳ ĒØĪņłśļÉśļÅäļĪØ 10ļČäĻ░ä ļ░®ņ╣śĒĢśņśĆļŗż. ņŗ£ļŻī ņ▓śļ”¼Ļ░Ć ļüØļé£ plateļź╝ 24ņŗ£Ļ░ä ļÅÖņĢł 37Ōäā ļ░░ņ¢æĻĖ░ņŚÉ ļäŻņ¢┤ ļ░░ņ¢æĒĢśņŚ¼ ņāØņä▒ļÉ£ ļ»ĖņāØļ¼╝ ņāØņן ņ¢ĄņĀ£ĒÖśņØś ņ¦üĻ▓ĮņØä ņĖĪņĀĢĒĢśņśĆļŗż.
2.3. ņłśņŚ┤ĒĢ®ņä▒ņØä ĒåĄĒĢ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤ ļ░Å ĻĖłņåŹņé░ĒÖöļ¼╝ ņżæĻ░äņ▓┤ ĒĢ®ņä▒
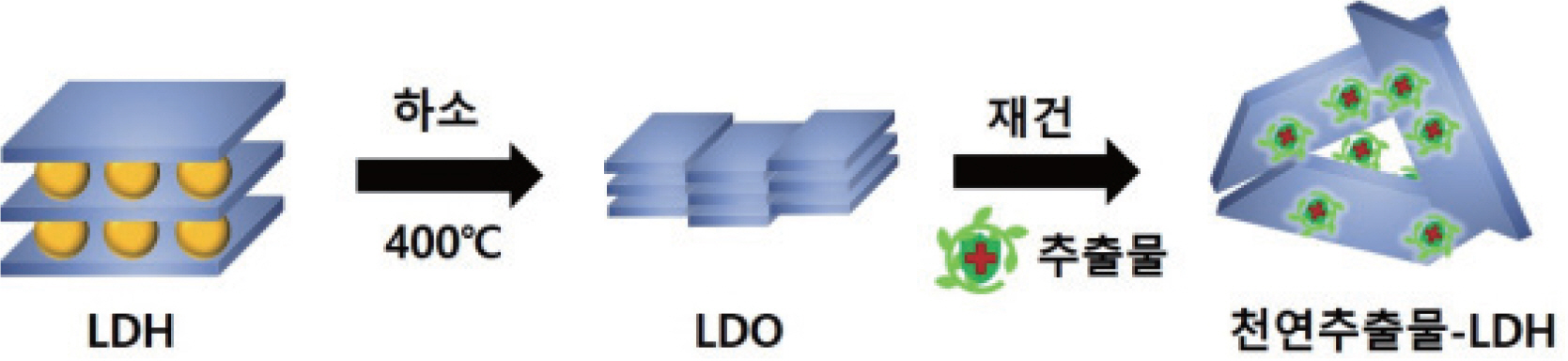
ĻĘĀņØ╝ĒĢ£ ņ×ģņ×É Ēü¼ĻĖ░ņÖĆ ĒśĢĒā£ļź╝ Ļ░¢ļŖö MgĻ│╝ Al ĻĖłņåŹ ņĪ░ņä▒ņØś ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤ļŖö ņØ┤ņĀä ņŚ░ĻĄ¼ļź╝ ņ░ĖĻ│ĀĒĢ£ ņłśņŚ┤ĒĢ®ņä▒ ņĪ░Ļ▒┤ņ£╝ļĪ£ ņĀ£ņĪ░ĒĢśņśĆļŗż.38 0.3 M ņ¦łņé░ļ¦łĻĘĖļäżņŖśņłśĒÖöļ¼╝(Mg(NO3)2┬Ę H2 O)ņÖĆ 0.15 M ņ¦łņé░ņĢīļŻ©ļ»ĖļŖäņłśĒÖöļ¼╝(Al(NO3)3┬Ę H2 O)Ēś╝ĒĢ®ņÜ®ņĢĪ 200 mLļź╝ ņĀ£ņĪ░ĒĢśņśĆļŗż. ņĀ£ņĪ░ĒĢ£ ļ¦łĻĘĖļäżņŖśĻ│╝ ņĢīļŻ©ļ»ĖļŖä ņØ┤ņś© Ēś╝ĒĢ®ņÜ®ņĢĪņØä 0.91 M ņłśņé░ĒÖöļéśĒŖĖļź©(NaOH)/0.67 M Ēāäņé░ņłśņåīļéśĒŖĖļź©(NaHCO3) ņÜ®ņĢĪņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĻĖłņåŹņØ┤ņś© Ēś╝ĒĢ®ņÜ®ņĢĪņØś pHĻ░Ć 9.5Ļ░Ć ļÉĀ ļĢīĻ╣īņ¦Ć ņĀüņĀĢĒĢśņśĆļŗż. ņŚ╝ĻĖ░ņÖĆ Ēāäņé░(CO32-)ņØīņØ┤ņś© Ēś╝ĒĢ®ņÜ®ņĢĪņØś ņĀüņĀĢņ£╝ļĪ£ ņāØņä▒ļÉ£ ĒśäĒāüņĢĪņØä ņłśņŚ┤ĒĢ®ņä▒ņÜ®ĻĖ░ļĪ£ ņś«ĻĖ┤ Ēøä, ņłśņŚ┤ĒĢ®ņä▒ ņÜ®ĻĖ░ļź╝ 150Ōäā ņśżļĖÉņŚÉ ļäŻņ¢┤ 48ņŗ£Ļ░ä ļÅÖņĢł ļ░śņØæĒĢśņśĆļŗż. 48ņŗ£Ļ░ä Ēøä ĒśäĒāüņĢĪņØś ņ╣©ņĀäļ¼╝ņØä ņøÉņŗ¼ļČäļ”¼ļź╝ ĒåĄĒĢśņŚ¼ ņ¢╗ņØĆ Ēøä, ņ”Øļźśņłśļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ 3 ĒÜī ņäĖņ▓ÖĒĢśĻ│Ā ļÅÖĻ▓░Ļ▒┤ņĪ░ļź╝ ĒåĄĒĢ┤ ļČäļ¦ÉņØä ĒÖĢļ│┤ĒĢśņśĆļŗż.
ņ×¼Ļ▒┤ļ▓Ģ ļ░®ļ▓Ģņ£╝ļĪ£ ņČöņČ£ļ¼╝Ļ│╝ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ļź╝ ĒĢ®ņä▒ĒĢśĻĖ░ ņ£äĒĢśņŚ¼, ĒĢ®ņä▒ĒĢ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤ļź╝ 400ŌäāņŚÉņä£ 9ņŗ£Ļ░ä ļÅÖņĢł ĒĢśņåīĒĢśņŚ¼ ĻĖłņåŹņé░ĒÖöļ¼╝ ņżæĻ░äņ▓┤ļź╝ ĒÖĢļ│┤ĒĢśņśĆļŗż.
2.4. ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝Ļ│╝ ļ░▒ņ×æņĢĮ-ĻĖłņåŹ ņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ ĒĢ®ņä▒
ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝Ļ│╝ ļ░▒ņ×æņĢĮ ņŚ┤ņłś ņČöņČ£ļ¼╝ņØä ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝Ļ│╝ ņ×¼Ļ▒┤ļ▓Ģ ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒĢśņØ┤ļĖīļ”¼ļō£ļź╝ ņĀ£ņĪ░ĒĢśņśĆļŗż. ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝Ļ│╝ ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ ļČäļ¦ÉņØä Ļ░üĻ░ü ņ”ØļźśņłśņŚÉ ļģ╣ņŚ¼ 6.6 mg/mL ļåŹļÅäņØś ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝Ļ│╝ 8.9 mg/mLņØś ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ ņÜ®ņĢĪņØä ņĀ£ņĪ░ĒĢśņśĆļŗż. ĻĖłņåŹņé░ĒÖöļ¼╝ ņżæĻ░äņ▓┤ 0.7 gĻ│╝ ļÅÖņØ╝ĒĢ£ Ļ│ĀĒśĢļČä ļ¼┤Ļ▓īņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ļČĆĒö╝ņØś ļ¬®ļŗ©Ēö╝ (106.424 mL) ļśÉļŖö ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝(78.888 mL)ņØä ļæźĻĘ╝ļ░öļŗźĒöīļØ╝ņŖżĒü¼ņŚÉ ļäŻĻ│Ā ņ¦łņåīĻ░ĆņŖż ņĪ░Ļ▒┤ĒĢśņŚÉ ņ░©Ļ┤æĒĢ£ ņāüĒā£ļĪ£ 24ņŗ£Ļ░äļÅÖņĢł ļ░śņØæĒĢśņśĆļŗż. ņĄ£ņóģņĀüņ£╝ļĪ£ ņ¢╗ņ¢┤ņ¦ä 2 ņóģļźśņØś ĒĢśņØ┤ļĖīļ”¼ļō£ ĒśäĒāüņĢĪņŚÉņä£ ņøÉņŗ¼ļČäļ”¼ļź╝ ĒåĄĒĢśņŚ¼ Ļ│ĀĒśĢļČäņØä ļČäļ”¼ĒĢśĻ│Ā, ĒāłņØ┤ņé░ĒÖöĒāäņåī(decarbonated water) ņ”Øļźśņłśļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ĒÖĢļ│┤ĒĢ£ Ļ│ĀĒśĢļČäņØä 2ĒÜī ņäĖņ▓ÖĒĢśņŚ¼ ļÅÖĻ▓░Ļ▒┤ņĪ░ ĒĢśņśĆļŗż.
2.5. ņČöņČ£ļ¼╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ļé┤ ņČöņČ£ļ¼╝ ĒĢ©ļ¤ē Ļ▓░ņĀĢ
ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ļ░Å ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ņŚÉ ļŗ┤ņ¦ĆļÉ£ ņČöņČ£ļ¼╝ņØś ĒĢ©ļ¤ēņØä Ļ▓░ņĀĢĒĢśĻĖ░ ņ£äĒĢśņŚ¼ Ļ▒┤ņĪ░ņżæļ¤ēļ▓ĢņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ņČöņČ£ļ¼╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢ®ņä▒Ļ│╝ņĀĢņŚÉņä£ ĒĢśņØ┤ļĖīļ”¼ļō£ ĒśäĒāüņĢĪņØä ņøÉņŗ¼ļČäļ”¼ Ēøä ņ¢╗ņØĆ ņāüņĖĄņĢĪĻ│╝ ņäĖņ▓Ö Ēøä ņ¢╗ņØĆ ņāüņĖĄņĢĪņØä ļ¬©ņĢä ĒĢśņØ┤ļĖīļ”¼ļō£ņŚÉ ļŗ┤ņ¦ĆļÉ£ ņČöņČ£ļ¼╝ ĒĢ©ļ¤ēņØä Ļ▓░ņĀĢĒĢśņśĆļŗż. ļ╣ł ļ░öņØ┤ņĢīņØś ļ¼┤Ļ▓īļź╝ ņĖĪņĀĢĒĢ£ Ēøä 1 mLņØś ĒśäĒāüņĢĪ ņøÉņŗ¼ļČäļ”¼ Ēøä ņ¢╗ņØĆ ņāüņĖĄņĢĪĻ│╝ ņäĖņ▓Ö Ēøä ņ¢╗ņØĆ ņāüņĖĄņĢĪņØä ļ╣ł ļ░öņØ┤ņĢīņŚÉ ļäŻĻ│Ā Ļ░ĆņŚ┤ĻĖ░ņŚÉņä£ 200ŌäāļĪ£ Ļ░ĆņŚ┤ĒĢśņŚ¼ ņ”Øļźśņłśļź╝ ņ”Øļ░£ņŗ£ņ╝░ļŗż. ņ”ØļźśņłśĻ░Ć ņ”Øļ░£ļÉ£ ļ░öņØ┤ņĢīņØś ļ¼┤Ļ▓īļź╝ ņĖĪņĀĢĒĢśĻ│Ā ļ╣ł ļ░öņØ┤ņĢīņØś ļ¼┤Ļ▓īļź╝ ļ╣╝ņä£ ņøÉņŗ¼ļČäļ”¼ ņāüņĖĄņĢĪ ļśÉļŖö ņäĖņ▓Ö Ēøä ņ¢╗ņØĆ ņāüņĖĄņĢĪ 1 mLņŚÉ ĒżĒĢ©ļÉśņ¢┤ ņ׳ļŖö Ļ│ĀĒśĢļČäņØś ļ¼┤Ļ▓īļź╝ ĻĄ¼ĒĢśĻ│Ā ņøÉņŗ¼ļČäļ”¼ ņāüņĖĄņĢĪĻ│╝ ņäĖņ▓Ö Ēøä ņ¢╗ņØĆ ņāüņĖĄņĢĪņØś ļČĆĒö╝ļź╝ ņĀüņÜ®ĒĢśņŚ¼ ļ░śņØæ Ēøä ļé©ņØĆ Ļ│ĀĒśĢļČäņØś ļ¼┤Ļ▓īļź╝ ĻĄ¼ĒĢśņśĆļŗż. ļ░śņØæ ņ┤łĻĖ░ņŚÉ ļäŻņ¢┤ņżĆ ņČöņČ£ļ¼╝ Ļ│ĀĒśĢļČä ļ¼┤Ļ▓īņŚÉņä£ Ļ▒┤ņĪ░ņżæļ¤ēļ▓ĢņØä ĒåĄĒĢ┤ ĻĄ¼ĒĢ£ ļ░śņØæ Ēøä ļé©ņØĆ Ļ│ĀĒśĢļČäņØś ļ¼┤Ļ▓īļź╝ ļ╣╝ņä£ ņ¢╗ņØĆ ļŗ┤ņ¦ĆļÉ£ ņČöņČ£ļ¼╝ Ļ│ĀĒśĢļČä ļ¼┤Ļ▓īņÖĆ ņČöņČ£ļ¼╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ņØś ļ¼┤Ļ▓īļĪ£ ņČöņČ£ļ¼╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ļé┤ ņČöņČ£ļ¼╝ ĒĢ©ļ¤ēņØä Ļ▓░ņĀĢĒĢśņśĆļŗż.
2.6. ņČöņČ£ļ¼╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ĒŖ╣ņä▒ĒÖö
ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ļ░Å ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ļČäļ¦ÉņØś Ļ▓░ņĀĢĻĄ¼ņĪ░ ļ│ĆĒÖöļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼, X-ņäĀ ĒÜīņĀłļČäņäØņØä D2 Phaser (Bruker AXS GmbH, Karlsruhe, Germany)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņłśĒ¢ēĒĢśņśĆļŗż. ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤, ĻĖłņåŹņłśņé░ĒÖöļ¼╝ ņżæĻ░äņ▓┤, ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ļ░Å ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ ļČäļ¦ÉņØś X-ņäĀ ĒÜīņĀłĒī©Ēä┤ņØĆ 5┬░ņŚÉņä£ 80┬░ņØś 2theta ļ▓öņ£äņŚÉņä£ 0.5ņ┤łļŗ╣ 0.02┬░ņØś ņ”ØĻ░Ćļ╣äņ£©ļĪ£ ņĖĪņĀĢņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤ņÖĆ ņČöņČ£ļ¼╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░
ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ņØś ņ×ģņ×É Ēü¼ĻĖ░ ļ░Å ĒśĢĒā£ ļ│ĆĒÖöļź╝ ņŻ╝ņé¼ņĀäņ×ÉĒśäļ»ĖĻ▓Į(Scanning electron microscope, Quanta 250 FEG, FEI, Hilsboro, OR, USA)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ┤Ćņ░░ĒĢśņśĆļŗż. ļČäļ¦É ĒśĢĒā£ņØś Ļ░ü ņāśĒöīņØä ņ╣┤ļ│ĖĒģīņØ┤ĒöäĻ░Ć ļČĆņ░®ļÉ£ ĒÖĆļŹöņŚÉ ņĀæņ░®ĒĢ£ Ēøä ņāśĒöī Ēæ£ļ®┤ņØä ļ░▒ĻĖł/ĒīöļØ╝ļōÉ(Pt/Pd)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ 60ņ┤łĻ░ä ņĮöĒīģĒĢśņśĆņ£╝ļ®░, 30 kVņØś Ļ░ĆņåŹņĀäņĢĢņ£╝ļĪ£ ņØ┤ļ»Ėņ¦Ćļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ņČöņČ£ļ¼╝Ļ│╝ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņ×¼Ļ▒┤ļ▓ĢņØä ņØ┤ņÜ®ĒĢ£ ĒĢśņØ┤ļĖīļ”¼ļō£ĒÖö ņĀäĻ│╝ Ēøä ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņ×ģņ×ÉņØś Ēæ£ļ®┤ņĀäĒĢśļź╝ ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņĀ£ĒāĆņĀäņ£ä(Zeta-potential, ELSZ-1000, Otsuka, Kyoto, Japan)ļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝Ļ│╝ ļ¬®ļŗ©Ēö╝ ņČöņČ£ļ¼╝, ļ░▒ņ×æņĢĮ ņČöņČ£ļ¼╝, ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņČ®ņĖĄņłśņé░ĒÖöļ¼╝, ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ļź╝ 1.0 mg/mLņØś ļåŹļÅäļĪ£ ņ”ØļźśņłśņŚÉ ļČäņé░ĒĢ£ Ēøä, 0.1 M ņłśņé░ĒÖöļéśĒŖĖļź©(NaOH)Ļ│╝ 0.1 M ņŚ╝ņé░(HCl)ņÜ®ņĢĪņØä ņĀüņĀĢĒĢśņŚ¼ ņÜ®ņĢĪņØś pHļź╝ 7ļĪ£ ņĪ░ņĀłĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆņ£╝ļ®░, 3ĒÜī ļ░śļ│ĄĒĢśņŚ¼ ĒÅēĻĘĀĻ░ÆņØä ĒÖĢļ│┤ĒĢśņśĆļŗż.
2.7. ņČöņČ£ļ¼╝Ļ│╝ ņČöņČ£ļ¼╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ņØś ĒĢŁĻĘĀņä▒ ĒÅēĻ░Ć
ņČöņČ£ļ¼╝Ļ│╝ ņČöņČ£ļ¼╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ņØś ĒĢŁĻĘĀņä▒ņØĆ ņ¦äĒāĢļ░░ņ¢æ Ēøä ĒśĢņä▒ļÉ£ ĻĘĀ ĻĄ░ļØĮ(bacteria colony) ņłśļź╝ ļ╣äĻĄÉĒĢśņŚ¼ ĻĘĖļ×ī ņØīņä▒ĻĘĀņØĖ E.coliņÖĆ ĻĘĖļ×ī ņ¢æņä▒ĻĘĀņØĖ B.subtilis ļæÉ ĻĘĀņŻ╝ņŚÉņä£ ĒÅēĻ░ĆĒĢśņśĆļŗż. ĻĘĀ ļ░░ņ¢æņĢĪņØś ĒØĪĻ┤æļÅäļź╝ ņ×ÉņÖĖņäĀĒØĪĻ┤æĻ┤æļÅäĻ│ä(UV-vis spectrometer, Biowave 2, Biochrom, Cambridge, UK)ļĪ£ 595 nmņŚÉņä£ ņĖĪņĀĢĒĢ£ Ēøä, ĻĘĀņłśĻ░Ć 1 ├Ś104 CFU/mLĻ░Ć ļÉśļÅäļĪØ ņé¼ņÜ®ĒĢ£ ļ░░ņ¢æņĢĪņ£╝ļĪ£ ĒؼņäØĒĢśņśĆļŗż. ĻĘĀ ļ░░ņ¢æņĢĪ 1 mLņŚÉ ņČöņČ£ļ¼╝ņØś ļåŹļÅäĻ░Ć 1%Ļ░Ć ļÉśļÅäļĪØ ņĀ£ņĪ░ĒĢ£ ļ¬®ļŗ©Ēö╝ ņČöņČ£ļ¼╝, ļ░▒ņ×æņĢĮ ņČöņČ£ļ¼╝, ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝, ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ļź╝ ņ▓©Ļ░ĆĒĢśņŚ¼ 37Ōäā ļ░░ņ¢æĻĖ░ņŚÉņä£ 180 rpmņ£╝ļĪ£ 3ņŗ£Ļ░äļÅÖņĢł ĻĘĀņØä ļ░░ņ¢æĒĢśņśĆļŗż. ņāśĒöīĻ│╝ ĒĢ©Ļ╗ś ļ░░ņ¢æĒĢ£ ĻĘĀ ļ░░ņ¢æņĢĪņØä 1000ļ░░ ĒؼņäØĒĢ£ Ēøä, ĒؼņäØĒĢ£ ĻĘĀ ļ░░ņ¢æņĢĪ 10 ŃÄĢļź╝ agar plate ņŚÉ ļ¢©ņ¢┤ļ£©ļ”░ ļÆż, ļ®ĖĻĘĀļÉ£ ļÅäļ¦Éļ┤ēņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĻĘĀņØ┤ Ļ│Āļź┤Ļ▓ī ĒŹ╝ņ¦ł ņłś ņ׳ļÅäļĪØ ļÅäļ¦ÉĒĢśņśĆļŗż. ĻĘĀņØ┤ ļÅäļ¦ÉļÉ£ agar plateļź╝ 14ņŗ£Ļ░ä ļÅÖņĢł 37Ōäā ļ░░ņ¢æĻĖ░ņŚÉņä£ ļ░░ņ¢æĒĢ£ ļÆż, ņČöņČ£ļ¼╝Ļ│╝ ņČöņČ£ļ¼╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ļź╝ ņ▓śļ”¼ĒĢ£ ĻĘĀņØś ņāØņä▒ļÉ£ ĻĘĀ ĻĄ░ļØĮņłśļź╝ ļ╣äĻĄÉĒĢśņśĆļŗż. ņØ┤ļĢī ņāśĒöīņØä ņ▓śļ”¼ĒĢśņ¦Ć ņĢŖņØĆ ĻĘĀ ļ░░ņ¢æņĢĪņØä ļÅäļ¦ÉĒĢ£ agar plateņØś ņāØņä▒ļÉ£ ĻĘĀ ĻĄ░ļØĮņłśļź╝ 100%ļĪ£ ĒĢśņŚ¼ ņāśĒöīņØä ņ▓śļ”¼ĒĢ£ ĻĘĀļ░░ņ¢æņĢĪņŚÉņä£ ņāØņä▒ļÉ£ ĻĘĀ ĻĄ░ļØĮ ļ╣äĻĄÉĒĢśņśĆļŗż.
Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
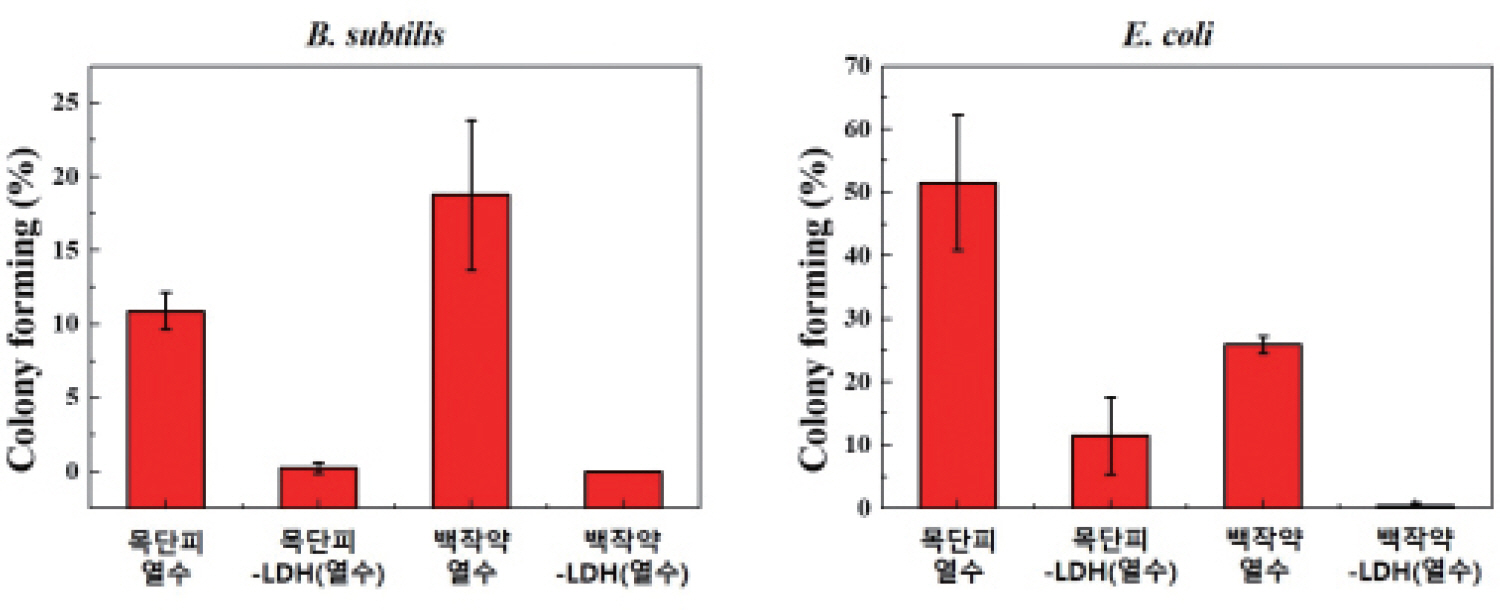
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņé¼ņÜ®ļÉ£ ņ▓£ņŚ░ ņČöņČ£ļ¼╝ņØĆ ņØ╝ļ░śņĀüņ£╝ļĪ£ ĒĢŁĻĘĀņä▒ņØä Ļ░¢Ļ│Ā ņ׳ļŗżĻ│Ā ņĢīļĀżņ¦ä ļ░ö ņ׳ļŖö ļ¬®ļŗ©Ēö╝ņÖĆ ļ░▒ņ×æņĢĮņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ņØ┤ļōż ņĢĮņÜ® ņŗØļ¼╝ļōżņØä ņŚ┤ņłś ņČöņČ£ĒĢ£ ņČöņČ£ļ¼╝ņØ┤ ĒĢŁĻĘĀņä▒ņØä ļéśĒā£ļéśļŖöņ¦Ć ņŚ¼ļČĆļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼ paper discļź╝ ņØ┤ņÜ®ĒĢ£ ĒĢ£ņ▓£ļ░░ņ¦ĆĒÖĢņé░ļ▓ĢņØä ņĀüņÜ®ĒĢśņśĆĻ│Ā, ĻĘĖļ×ī ņØīņä▒ĻĘĀņØĖ E.coliņÖĆ ĻĘĖļ×ī ņ¢æņä▒ĻĘĀņØĖ B.subtilisņŚÉņä£ Ļ░üĻ░ü ĒĢŁĻĘĀņä▒ņØä ĒÅēĻ░ĆĒĢśņśĆļŗż. Fig. 1ņØĆ ļ¬®ļŗ©Ēö╝ ļ░Å ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņØä Ļ░üĻ░ü 0.25%, 0.5%, 1.0%, 2.0% ļåŹļÅäļĪ£ ņ▓śļ”¼ĒĢśņśĆņØä ļĢīņØś ĒĢŁĻĘĀņä▒ņØä ĒÅēĻ░ĆĒĢ£ Ļ▓░Ļ│╝ņØ┤ļŗż. ņØ┤ ņŗżĒŚśņŚÉ ņØśĒĢśņŚ¼ ņČöņČ£ļ¼╝ņØś ņóģļźśņŚÉ ļö░ļźĖ ĒĢŁĻĘĀņä▒ ņŚ¼ļČĆ ļ┐Éļ¦ī ņĢäļŗłļØ╝ Ļ░ü ņČöņČ£ļ¼╝ņØś ļåŹļÅäņŚÉ ļö░ļźĖ ĒĢŁĻĘĀņä▒ ņŚ¼ļČĆļÅä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. Paper discļź╝ ņØ┤ņÜ®ĒĢ£ ĒĢ£ņ▓£ļ░░ņ¦ĆĒÖĢņé░ļ▓ĢņØĆ paper disc ņŻ╝ļ│ĆņŚÉ ņāØņä▒ļÉ£ ņ¢ĄņĀ£ĒÖśņØś ņŚ¼ļČĆ ļ░Å ņ¢ĄņĀ£ĒÖśņØś Ēü¼ĻĖ░ņŚÉ ļö░ļØ╝ņä£ ņ▓śļ”¼ļÉ£ ļ¼╝ņ¦łņØś ĒĢŁĻĘĀņä▒ ņŚ¼ļČĆ ļ░Å ĒĢŁĻĘĀņä▒ņØä ļéśĒāĆļé┤ļŖö ļåŹļÅä ļ▓öņ£äļź╝ ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŖö ļ░®ļ▓ĢņØ┤ļŗż.
Fig.┬Ā1.
Paper disc diffusion assayļź╝ ĒåĄĒĢ£ ļ¬®ļŗ©Ēö╝ ļ░Å ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņØś ĒĢŁĻĘĀņä▒ ĒÖĢņØĖ
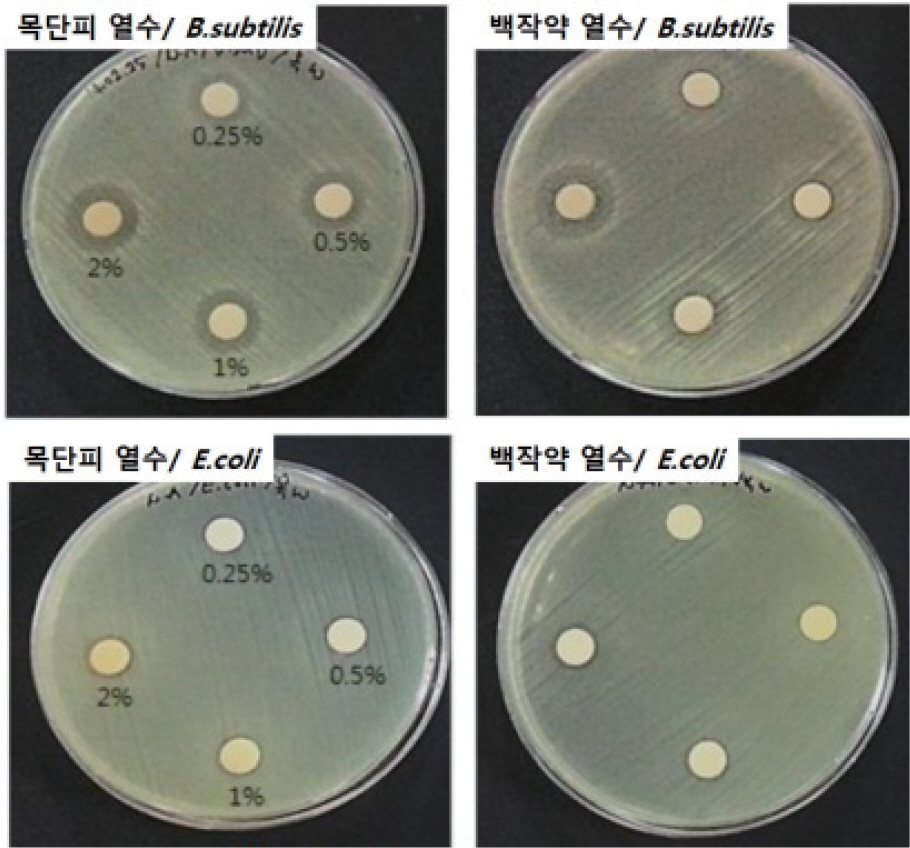
ĻĘĖļ×ī ņ¢æņä▒ĻĘĀņØĖ B.subtilisņŚÉ 0.25%, 0.5%, 1.0% ļ░Å 2.0% ļåŹļÅäņØś ļ¬®ļŗ©Ēö╝ ņŚ┤ņłś ņČöņČ£ļ¼╝ņØä ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ Ļ░üĻ░ü 13.2 mm, 14.0 mm, 14.3 mm, 15.5 mmņØś ņ¢ĄņĀ£ĒÖśņØ┤ ņāØņä▒ļÉ£ Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ Ļ▓░Ļ│╝ļź╝ ĒåĄĒĢśņŚ¼ ļ¬®ļŗ©Ēö╝ ņŚ┤ņłś ņČöņČ£ļ¼╝ņØĆ 0.25%-2.0% ļåŹļÅäņŚÉņä£ B. subtilisņŚÉ ļīĆĒĢ£ ĒĢŁĻĘĀņä▒ņØä ļ│┤ņ×äņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłĻ│Ā, ļåŹļÅäĻ░Ć ļåÆņĢäņ¦łņłśļĪØ ĒĢŁĻĘĀņä▒ņØä ļéśĒāĆļé┤ļŖö ņ¢ĄņĀ£ĒÖś(inhibition zone)ņØĆ ĻĘĖņŚÉ ļ╣äļĪĆĒĢśņŚ¼ ņ╗żņ¦ĆļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ļ░▒ņ×æņĢĮ ņŚ┤ņłś ņČöņČ£ļ¼╝ņØś Ļ▓ĮņÜ░ B.subtilisņŚÉņä£ 0.25% ļ░Å 0.5%ņØś ļ╣äĻĄÉņĀü ļé«ņØĆ ļåŹļÅäņŚÉņä£ļŖö ņ£ĀņØśļ»ĖĒĢ£ ņĀĢļÅäņØś ņ¢ĄņĀ£ĒÖśņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņŚåņŚłņ£╝ļéś, ļ░▒ņ×æņĢĮ ņ▓śļ”¼ ļåŹļÅäĻ░Ć 1.0%ņÖĆ 2.0% ņØ╝ Ļ▓ĮņÜ░ņŚÉļŖö 9.5 mm ņÖĆ 10.3 mmņØś ņ¢ĄņĀ£ĒÖśņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ Ļ▓░Ļ│╝ņŚÉ ļö░ļØ╝ ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņØĆ ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝ņŚÉ ļ╣äĒĢśņŚ¼ ņāüļīĆņĀüņ£╝ļĪ£ ļåÆņØĆ ļåŹļÅäņŚÉņä£ B.subtilisņŚÉ ļīĆĒĢ£ ĒĢŁĻĘĀļŖźņØä Ļ░¢ļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ĻĘĖļ×ī ņØīņä▒ĻĘĀņØĖ E.coliņŚÉ ļ¬®ļŗ©Ēö╝ ņŚ┤ņłś ņČöņČ£ļ¼╝ņØä ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö 0.25% ņÖĆ 0.5% ļåŹļÅäņŚÉņä£ļŖö ņ£ĀņØśļ»ĖĒĢ£ ņłśņżĆņØś ņ¢ĄņĀ£ĒÖśņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņŚåņŚłņ£╝ļéś, ņ▓śļ”¼ ļåŹļÅäĻ░Ć 1.0%ņÖĆ 2.0% ņØĖ Ļ▓ĮņÜ░ 9.25 mmņÖĆ 10.0 mmņØś ņ¢ĄņĀ£ĒÖśņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŗż. ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝ņØĆ B.subtilisņŚÉ ļīĆĒĢ┤ņä£ļŖö ļé«ņØĆ ļåŹļÅäņŚÉņä£ļÅä ĒĢŁĻĘĀņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ£╝ļéś, E.coli ņŚÉ ļīĆĒĢ┤ņä£ļŖö ĻĘĖ ĒĢŁĻĘĀļŖźņØ┤ ļ╣äĻĄÉņĀü ļåÆņØĆ ļåŹļÅä(1.0% ņØ┤ņāü)ņŚÉņä£ ļéśĒāĆļé©ņØä ņĢī ņłś ņ׳ļŗż. ļśÉĒĢ£ ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņØś Ļ▓ĮņÜ░ņŚÉļŖö E.coli ĻĘĀņŻ╝ņŚÉņä£ 0.25% ļåŹļÅäņŚÉņä£ļ¦ī ņ¢ĄņĀ£ĒÖśņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņŚåņŚłĻ│Ā, 0.5%, 1.0%, 2.0% ņ▓śļ”¼ ļåŹļÅäņŚÉņä£ļŖö Ļ░üĻ░ü 9.3 mm, 9.8 mm, 10.8 mm Ēü¼ĻĖ░ņØś ņ¢ĄņĀ£ĒÖśņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŗż. ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņØś Ļ▓ĮņÜ░ B.subtilisņŚÉņä£ļŖö ļåÆņØĆ ļåŹļÅäņŚÉņä£ ĒĢŁĻĘĀņä▒ņØä ļ│┤ņśĆņ£╝ļéś, E.coliņŚÉ ļīĆĒĢ┤ņä£ļŖö ņāüļīĆņĀüņ£╝ļĪ£ ļé«ņØĆ ļåŹļÅäņŚÉņä£ļÅä ĒĢŁĻĘĀņä▒ņØä ļ│┤ņśĆļŗż.
ņØ┤ ņŗżĒŚś Ļ▓░Ļ│╝ļź╝ ņóĆ ļŹö ņ×ÉņäĖĒ׳ ņé┤ĒÄ┤ļ│┤ļ®┤, ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ļÉ£ ļ¬®ļŗ©Ēö╝ ļ░Å ļ░▒ņ×æņĢĮ ņŚ┤ņłś ņČöņČ£ļ¼╝ņØĆ Ļ░üĻ░ü ĻĘĖļ×īņØīņä▒ĻĘĀĻ│╝ ĻĘĖļ×īņ¢æņä▒ĻĘĀņŚÉ ļīĆĒĢ┤ ņä£ļĪ£ ļŗżļźĖ ĒĢŁĻĘĀņä▒ņØä ļ│┤ņ×äņØä ņĢī ņłś ņ׳ļŗż. ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝ņØĆ ĻĘĖļ×īņ¢æņä▒ĻĘĀ(B.subtilis)ņŚÉ ļīĆĒĢśņŚ¼ ļ╣äĻĄÉņĀü ļé«ņØĆ ļåŹļÅäņŚÉņä£ļÅä ĒĢŁĻĘĀņä▒ņØä ļ│┤ņśĆņ£╝ļéś ĻĘĖļ×īņØīņä▒ĻĘĀ(E.coli)ņŚÉ ļīĆĒĢ┤ņä£ļŖö ĒĢŁĻĘĀņä▒ņØä ņ£äĒĢ£ ņĄ£ņåī ļåŹļÅäĻ░Ć ļŹö ļåÆņĢśļŗż. ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņØĆ ĻĘĖļ×īņ¢æņä▒ĻĘĀ(B.subtilis)ņŚÉ ļīĆĒĢśņŚ¼ņä£ļŖö ĒĢŁĻĘĀņä▒ņØä ļ│┤ņØ┤ļŖö ļåŹļÅäĻ░Ć ļåÆĻ▓ī ņÜöĻĄ¼ļÉśņŚłņ£╝ļéś, ĻĘĖļ×īņØīņä▒ĻĘĀ(E.coli)ņŚÉ ļīĆĒĢ┤ņä£ļŖö ļ╣äĻĄÉņĀü ļé«ņØĆ ļåŹļÅäņŚÉņä£ļÅä ĒĢŁ ĻĘĀņä▒ņØä ļ│┤ņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ņä£ļĪ£ ļŗżļźĖ ĒĢŁĻĘĀņä▒ņ¦łņØĆ ļæÉ ņóģļźśņØś ņŚ┤ņłśņČöņČ£ļ¼╝ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ĒĢŁĻĘĀ ņä▒ļČäņØś ņ░©ņØ┤, ĻĘĖļ”¼Ļ│Ā ĻĘĖļ×īņ¢æņä▒ĻĘĀĻ│╝ ĻĘĖļ×īņØīņä▒ĻĘĀņØä ĻĄ¼ņä▒ĒĢśļŖö ņäĖĒżļ▓ĮņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ņČöĻ░ĆņĀüņØĖ ļ¦ēņØś ņ░©ņØ┤ ņ£Āļ¼┤ņŚÉ ļö░ļźĖ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. ļ╣äļĪØ ļæÉ Ļ░Ćņ¦Ć ņóģļźśņØś ņČöņČ£ļ¼╝ņØ┤ ĻĘĖļ×īņ¢æņä▒ĻĘĀ ļ░Å ĻĘĖļ×īņØīņä▒ĻĘĀņŚÉ ļīĆĒĢ£ ĒĢŁĻĘĀļĀźņØä ļ│┤ņØ┤ļŖö ņĄ£ņåī ļåŹļÅäĻ░Ć ņĪ░ĻĖłņö® ņāüņØ┤Ē¢łņ¦Ćļ¦ī, ļ¬®ļŗ©Ēö╝ ļ░Å ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ ļæÉĻ░Ćņ¦Ć ļ¬©ļæÉ ņāüļŗ╣Ē׳ ļé«ņØĆ ļåŹļÅä(Ōł╝1.0%)ņŚÉņä£ļČĆĒä░ ĒĢŁĻĘĀņä▒ņØś ņ¦ĆĒæ£ņØĖ ņ¢ĄņĀ£ĒÖśņØä ļ│┤ņśĆĻĖ░ ļĢīļ¼ĖņŚÉ ņĢīļĀżņ¦ä ļ░öņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆņØś ĒĢŁĻĘĀņä▒ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ ņŗżĒŚśņŚÉņä£ ņ¢╗ņ¢┤ņ¦ä ĒĢŁĻĘĀņä▒ņØś ņĄ£ņåī ļåŹļÅäļŖö ņČöņČ£ļ¼╝ 2ņóģĻ│╝ ĻĘĖļ×īņ¢æņä▒ĻĘĀ/ĻĘĖļ×īņØīņä▒ĻĘĀņŚÉ ļīĆĒĢśņŚ¼ 1.0%ļĪ£ Ļ▓░ņĀĢļÉĀ ņłś ņ׳ņŚłĻĖ░ ļĢīļ¼ĖņŚÉ, ņČöĒøä ņ▓£ņŚ░ ņČöņČ£ļ¼╝ņØä ļŗ┤ņ¦ĆĒĢ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ĒĢŁĻĘĀņä▒ņØä ĒÅēĻ░ĆĒĢĀ ļĢī ņ▓£ņŚ░ ņČöņČ£ļ¼╝ ļåŹļÅäļź╝ ņĄ£ņåī ĒĢŁĻĘĀņä▒ņØä ļ│┤ņØ┤ļŖö 1.0% ļåŹļÅä ĻĖ░ņżĆņØä Ļ▓░ņĀĢĒĢśņśĆļŗż.
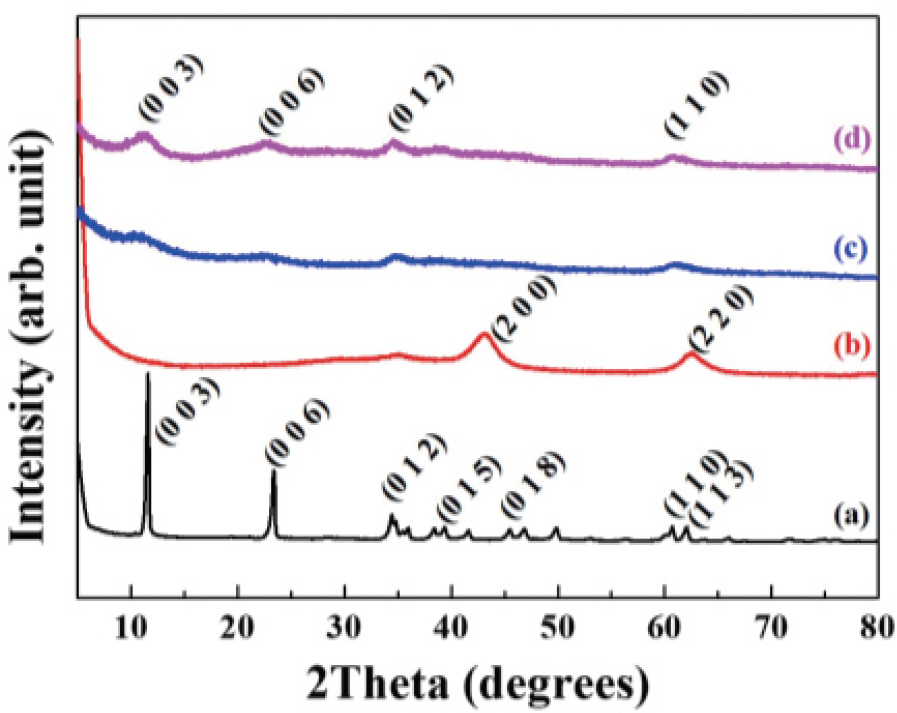
ņ▓£ņŚ░ ņČöņČ£ļ¼╝ņØĖ ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝Ļ│╝ ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņØä ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ņ×¼Ļ▒┤ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļŗ┤ņ¦ĆĒĢśļŖö Ļ│╝ņĀĢņŚÉņä£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤ņÖĆ ĻĖłņåŹņé░ĒÖöļ¼╝ ņżæĻ░äņ▓┤, ĻĘĖļ”¼Ļ│Ā ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝, ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ 2ņóģņØś ĒĢśņØ┤ļĖīļ”¼ļō£Ļ░Ć Ļ░¢ļŖö Ļ▓░ņĀĢĻĄ¼ņĪ░ņŚÉ ņ¢┤ļ¢ĀĒĢ£ ļ│ĆĒÖöĻ░Ć ņ׳ļŖöņ¦Ć ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ļČäļ¦É X-ņäĀ ĒÜīņĀłļČäņäØņØä ņłśĒ¢ēĒĢśņśĆļŗż. ņĀäĻĄ¼ņ▓┤Ļ░Ć ļÉśļŖö ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ļČäļ¦É X-ņäĀ ĒÜīņĀł Ēī©Ēä┤ņØĆ 11.6┬░, 23.4┬░, 34.5┬░, 38.4┬░, 45.5┬░, 60.7┬░, 62.0┬░ņ£äņ╣śņØś 2 thetaņŚÉņä£ Ļ░üĻ░ü hydrotalcite (Joint Commitee on Powder Diffraction Standards (JCPDS) card No. 14-0191) Ļ▓░ņĀĢĻĄ¼ņĪ░Ļ░Ć Ļ░¢ļŖö (003), (006), (012), (015), (018), (110), (113) Ļ▓░ņĀĢļ®┤ņŚÉ ļīĆĒĢ£ ļåÆņØĆ Ļ▓░ņĀĢņä▒ņØś Ēö╝Ēü¼ļź╝ ļ│┤ņŚ¼ņŻ╝Ļ│Ā ņ׳ļŗż(Fig. 2(a)). ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ļÉ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØĆ Ļ│Ąņ╣© Ļ│╝ņĀĢ ņØ┤ĒøäņŚÉ ņłśņŚ┤ĒĢ®ņä▒ ņĪ░Ļ▒┤ņŚÉņä£ Ļ▓░ņĀĢņä▒ņןņØä ņ£ĀļÅäĒĢ£ Ļ▓āņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ ņāüĻĖ░ ļ░Ćļ¤¼ņ¦Ćņłś Ļ▓░ņĀĢļ®┤ņŚÉ ļīĆĒĢ£ ļåÆņØĆ Ļ▓░ņĀĢņä▒ņØĆ ņśłņĖĪļÉśņŚłļŹś Ļ▓░Ļ│╝ņØ┤ļ®░, ņØ┤ņĀä ņŚ░ĻĄ¼ņØś ļ¼ĖĒŚīņŚÉņä£ ļéśĒāĆļé£ Ļ▓āĻ│╝ ņ£Āņé¼ĒĢ£ ņĀĢļÅäņØś Ļ▓░ņĀĢņä▒ņ×äņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż.4, 38, 39 ļČäļ¦É X-ņäĀ ĒÜīņĀł Ēī©Ēä┤ņŚÉņä£ Ļ▓░ņĀĢĒĢÖņĀü c ņČĢ ļ░®Ē¢źņØś Ēö╝Ēü¼ņØĖ (003)Ļ│╝ (006) Ēö╝Ēü¼ļź╝ ĒåĄĒĢ┤ ĻĄ¼ĒĢ£ d-spacingņØĆ 7.6 Ōä½ņ£╝ļĪ£ Ēāäņé░ņØ┤ņś©ņØ┤ ņĖĄĻ░äņØś ņĪ┤ņ×¼ĒĢśļŖö ļŗżļźĖ ņŚ░ĻĄ¼ņØś Ļ▓ĮņÜ░ņÖĆ ļ╣äņŖĘĒĢ£ d-spacingņØä ļéśĒāĆļé┤ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņĢä, ņĖĄĻ░äņŚÉ Ēāäņé░ņØ┤ņś©ņØś ņĪ┤ņ×¼ļź╝ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż.40ŌĆō42 ņØ┤ Ēāäņé░ņØ┤ņś©ņØĆ ņČöĒøä ņŚ┤ņ▓śļ”¼ļź╝ ĒåĄĒĢ£ ĒĢśņåī Ļ│╝ņĀĢņŚÉ
Fig.┬Ā2.
(a) ņĀäĻĄ¼ņ▓┤ LDH, (b) ņżæĻ░äņ▓┤ LDO, (c) ļ¬®ļŗ©Ēö╝-LDH(ņŚ┤ņłś) ļ░Å (d) ļ░▒ņ×æņĢĮ-LDH(ņŚ┤ņłś) ĒĢśņØ┤ļĖīļ”¼ļō£ņØś X-ņäĀ ĒÜīņĀłĒī©Ēä┤
ņä£ ņØ┤ņé░ĒÖöĒāäņåīļĪ£ ļ│ĆĒÖśļÉśņ¢┤ ĻĖ░ĒÖöļÉĀ Ļ▓āņØ┤ ņśłņāüļÉśļ®░, ņØ┤ Ļ│╝ņĀĢņØä ĒåĄĒĢ┤ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ĻĖłņåŹņé░ĒÖöļ¼╝ļĪ£ņØś ņāüņĀäņØ┤Ļ░Ć ņøÉĒÖ£ņØ┤ ņØ╝ņ¢┤ļéĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
ņśłņāüĒĢ£ ļ░öņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£, ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤ļź╝ ĒĢśņåīĒĢśņŚ¼ ĒÖĢļ│┤ĒĢ£ ĻĖłņåŹņé░ĒÖöļ¼╝ņØś ļČäļ¦É X-ņäĀ ĒÜīņĀł Ēī©Ēä┤ņŚÉņä£ļŖö ĻĖ░ņĪ┤ņØś ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØ┤ Ļ░¢ļŖö hydrotalcite ņØś Ļ▓░ņĀĢĻĄ¼ņĪ░Ļ░Ć ņé¼ļØ╝ņ¦ĆĻ│Ā, 43.3┬░ņÖĆ 62.5┬░ņØś 2theta ņ£äņ╣śņŚÉņä£ ņé░ĒÖöļ¦łĻĘĖļäżņŖś(MgO)ņØś periclase (JCPDS card No. 45-0946)ņØś (200)Ļ│╝ (220) Ēö╝Ēü¼ļĪ£ Ļ▓░ņĀĢĻĄ¼ņĪ░Ļ░Ć ļ│ĆĒĢ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż (Fig. 2(b)). ņØ┤ļ¤¼ĒĢ£ Ļ▓░ņĀĢĻĄ¼ņĪ░ņØś ļ│ĆĒÖöļŖö ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØä 400ŌäāņŚÉņä£ ĒĢśņåīĒĢśļŖö Ļ│╝ņĀĢņŚÉņä£ ņĖĄĻ░ä ņØīņØ┤ņś©ņØĖ Ēāäņé░ņØ┤ņś©(CO32-)Ļ│╝ ļ¼╝ļČäņ×ÉĻ░Ć CO2ņÖĆ H2 OļĪ£ ĻĖ░ĒÖöļÉśļ®┤ņä£ ņĀ£Ļ▒░ļÉśĻ│Ā, ņĖĄņØä ĒśĢņä▒ĒĢśļŖö ĻĖłņåŹņłśņé░ĒÖöļ¼╝ņŚÉņä£ ņłśņé░ĒÖöĻĖ░Ļ░Ć ņĀ£Ļ▒░ļÉśņ¢┤ ĻĖłņåŹņé░ĒÖöļ¼╝ņØ┤ ļÉśļ®┤ņä£ ņĖĄĻ░äĻĄ¼ņĪ░Ļ░Ć ļ¼┤ļäłņ¦ĆĻ▓ī ļÉśņ¢┤ ņØ┤Ļ│╝ Ļ░ÖņØĆ Ļ▓░ņĀĢĻĄ¼ņĪ░ņØś ļ│ĆĒÖöĻ░Ć ņØ╝ņ¢┤ļé£ļŗż.43 ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ļÉ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØĆ MgņÖĆ AlņØ┤ 2:1ņØś ļ╣äņ£©ļĪ£ Ēś╝ĒĢ®ļÉ£ ņĪ░ņä▒ņØä Ļ░¢Ļ│Ā ņ׳ļŖöļŹ░, ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś Ļ▓░ņĀĢĻĄ¼ņĪ░ļź╝ ab-ļ®┤ņØś 2ņ░©ņøÉņŚÉ ĻĘĖļĀżļ│┤ļ®┤, ņ£Īļ░®ņĀĢĻ│äņØś Ļ▓░ņĀĢĻĄ¼ņĪ░ ļé┤ņŚÉ Al(OH)6Ēīöļ®┤ņ▓┤ ĒĢśļéśĻ░Ć Mg(OH)6Ēīöļ®┤ņ▓┤ 6Ļ░£ņŚÉ ņØśĒĢ┤ ļæśļ¤¼ņŗĖņŚ¼ ņ׳ņØīņØä ņĢī ņłś ņ׳ļŗż. ņ”ē, Mg(OH)6Ēīöļ®┤ņ▓┤ļōżļü╝ļ”¼ļŖö ņä£ļĪ£ ņŚ░Ļ▓░ļÉśņ¢┤ ņ׳ņ¦Ćļ¦ī, Al(OH)6Ēīöļ®┤ņ▓┤ Ļ░äņŚÉļŖö ņŚ░Ļ▓░ņä▒ņØ┤ ņŚåĻĖ░ ļĢīļ¼ĖņŚÉ, ĒĢśņåī Ļ│╝ņĀĢņŚÉņä£ Ēāłņłś ļ░śņØæņŗ£ ņØ╝ņ¢┤ļéśļŖö Ļ▓░ņĀĢņØś ņłśņČĢņŗ£ MgO ļŖö ņāØņä▒ļÉĀ ņłś ņ׳ņ¦Ćļ¦ī, Al2 O3ņØś ĻĄ¼ņĪ░ļŖö ņāØņä▒ļÉśĻĖ░ ņ¢┤ļĀĄļŗż. ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØä ĒĢśņåīĒĢśņŚ¼ ņ¢╗ļŖö ĻĖłņåŹņé░ĒÖöļ¼╝ņŚÉ ļīĆĒĢ£ ļ¦żņÜ░ ĻĄ¼ņ▓┤ņĀüņØĖ ļ¼╝ļ”¼ĒÖöĒĢÖņĀü ĒĢ┤ņäØņØĆ ņ¢┤ļĀĄņ¦Ćļ¦ī, ņØ╝ļ░śņĀüņ£╝ļĪ£ MgOņØś ĻĄ¼ņĪ░ļź╝ Ļ░¢ļŖö ļ»ĖņäĖĒĢ£ Ļ▓░ņĀĢņ×ÉļōżņØ┤ ņāØņä▒ļÉśĻ│Ā, ņØ┤ļōż Ļ▓░ņĀĢņ×É ņé¼ņØ┤ņŚÉ AlņØ┤ ņĪ┤ņ×¼ĒĢśņŚ¼ Ļ▓░ņĀĢņ×ÉļōżņØä ņŚ░Ļ▓░ĒĢśņŚ¼ ņżä Ļ▓āņ£╝ļĪ£ ņśłņāüĒĢśĻ│Ā ņ׳ļŗż.44 ļ│Ė ņŚ░ĻĄ¼ņ¦äņØ┤ ņØ┤ņĀäņŚÉ ņŚ░ĻĄ¼ĒĢ£ ļ░öņŚÉ ļö░ļź┤ļ®┤, Mg-Al ņĪ░ņä▒ņØä Ļ░¢ļŖö ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØä ĒĢśņåīĒĢśļ®┤, Al3+Ļ░Ć 6ļ░░ņ£äļź╝ ĒĢśļŖö Ēīöļ®┤ņ▓┤ ņ×Éļ”¼ņŚÉņä£ ņØ╝ļČĆ 4ļ░░ņ£ä ņ×Éļ”¼ļĪ£ ņØ┤Ē¢ēļÉĀ ņłś ņ׳ļŗż.44 ņØ┤ļ¤¼ĒĢ£ Ļ│╝ņĀĢ ņåŹņŚÉņä£ Al ņ×Éļ”¼ļŖö Al2 O3ļź╝ ņāØņä▒ĒĢśĻĖ░ļ│┤ļŗżļŖö MgO ļ»ĖņäĖ Ļ▓░ņĀĢņ×ÉļōżņØä ņŚ░Ļ▓░ĒĢ┤ ņŻ╝ļŖö ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
ĻĖłņåŹņé░ĒÖöļ¼╝Ļ│╝ ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝ņØä ļ░śņØæĒĢśņŚ¼ ņ×¼Ļ▒┤ļ▓Ģņ£╝ļĪ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝ņØä ļŗ┤ņ¦ĆĒĢ£ Ļ▓ĮņÜ░ ļČäļ¦É X-ņäĀ ĒÜīņĀłĒī©Ēä┤ņŚÉņä£ļŖö 11.2┬░, 22.6┬░, 34.7┬░ņÖĆ 60.9┬░ņŚÉņä£ hydrotalciteņØś Ļ▓░ņĀĢĻĄ¼ņĪ░ņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö (003), (006), (012), (110) Ēö╝Ēü¼Ļ░Ć ĒÜīļ│ĄļÉ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż (Fig. 2(c)). ņĖĄņāüĒśĢ ĻĄ¼ņĪ░Ļ░Ć ĒÜīļ│ĄļÉ£ ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś d-spacingņØĆ 7.9 Ōä½ņ£╝ļĪ£ Ēāäņé░ņØ┤ņś©(CO32-)ņØ┤ ņĖĄĻ░äņØīņØ┤ņś©ņ£╝ļĪ£ ļōżņ¢┤Ļ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśņŚłļŗż. ļ╣äļĪØ ņĀäĻĄ¼ņ▓┤Ļ░Ć Ļ░¢ļŖö d-spacing Ļ░ÆņØĖ 7.6 Ōä½ļ│┤ļŗż ļŗżņåī c-ņČĢ ļ░®Ē¢źņ£╝ļĪ£ ĒīĮņ░ĮļÉ£ Ļ▓āņ▓śļ¤╝ ļ│┤ņØ┤ĻĖ┤ ĒĢśņ¦Ćļ¦ī, ņØ┤ļŖö ļŗżļźĖ ņóģļźśņØś ņĖĄĻ░äņØ┤ņś© ņéĮņ×ģņŚÉ ņØśĒĢ£ Ļ▓āņØ┤ ņĢäļŗī ņĖĄĻ░ä ņØ┤ņś©ņØś ņłśĒÖöņŚÉ ļö░ļźĖ Ļ▓āņ£╝ļĪ£ ĒĢ┤ņäØĒĢĀ ņłś ņ׳ļŗż. ļö░ļØ╝ņä£, ņ×¼Ļ▒┤ļ▓ĢņØś Ļ▓░Ļ│╝ļĪ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņĖĄĻ░äņŚÉ ļ¬®ļŗ©Ēö╝ ņČöņČ£ļ¼╝ ņä▒ļČäņØ┤ ņĖĄĻ░äņéĮņ×ģļÉ£ Ļ▓āņØ┤ ņĢäļŗłļØ╝, Ēāäņé░ņØ┤ņś©ņØ┤ ņØīņØ┤ņś©ņóģņ£╝ļĪ£ ņĖĄĻ░äņŚÉ ņéĮņ×ģļÉ£ ĻĄ¼ņĪ░ļĪ£ Ļ▓░ņĀĢĻĄ¼ņĪ░Ļ░Ć ĒÜīļ│ĄļÉ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ļ░▒ņ×æņĢĮņØä ļŗ┤ņ¦ĆĒĢ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ņØś ļČäļ¦É X-ņäĀ ĒÜīņĀłĒī©Ēä┤ņŚÉņä£ļÅä 11.2┬░, 22.6┬░, 34.5┬░, 60.6┬░ņŚÉņä£ hydrotalciteņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö (003), (006), (012), (110) Ēö╝Ēü¼ļź╝ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, ņĖĄņāüĒśĢ Ļ▓░ņĀĢĻĄ¼ņĪ░Ļ░Ć ĒÜīļ│ĄļÉ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż (Fig. 2(d)). ņĖĄĻ░äņØīņØ┤ņś© ņŚŁņŗ£ d-spacingņ£╝ļĪ£ ĒīÉļŗ©ņ╗©ļīĆ, ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś Ļ▓ĮņÜ░ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£, 7.9 Ōä½ ĒĢ┤ļŗ╣ĒĢśļŖö d-spacingņØä ļ│┤ņŚ¼ņŻ╝ņŚłņ£╝ļ®░, ļ░▒ņ×æņĢĮ ņČöņČ£ļ¼╝ņØś ĒżĒĢ©ļÉśņ¢┤ ņ׳ļŖö ļČäņ×ÉļōżņØĆ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņĖĄĻ░äņŚÉ ņéĮņ×ģļÉśņ¦Ć ņĢŖņØĆ ņ▒ä, Ēāäņé░ņØ┤ņś© ņØ┤ ņĖĄĻ░äņŚÉ ņéĮņ×ģļÉśņŚłņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņĀäĻĄ¼ņ▓┤ņØĖ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝Ļ│╝ ņ▓£ņŚ░ ņČöņČ£ļ¼╝ņØ┤ ļŗ┤ņ¦ĆļÉ£ ĒøäņØś ĒĢśņØ┤ļĖīļ”¼ļō£ļŖö ļ¬©ļæÉ ļÅÖņØ╝ĒĢ£ hydrotalcite Ļ▓░ņĀĢņāüņØä Ļ░¢Ļ│Ā ņ׳ņ£╝ļéś, ĒĢ£ Ļ░Ćņ¦Ć ĒÖĢņŚ░Ē׳ ņ░©ņØ┤ļéśļŖö Ļ▓āņØĆ Ļ░ü Ļ▓░ņĀĢļ®┤ņŚÉ ļīĆĒĢ£ ĒÜīņĀł Ēö╝Ēü¼ņØś Ēü¼ĻĖ░ņÖĆ ļäłļ╣äņØ┤ļŗż. ļæÉ ņŗ£ļŻīņØś (003) Ēö╝Ēü¼ņŚÉ ļīĆĒĢ£ cņČĢņ£╝ļĪ£ņØś Ļ▓░ņĀĢņä▒ņØä ļ╣äĻĄÉĒĢ┤ ļ│┤ļ®┤, ņĀäĻĄ¼ņ▓┤ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś Ļ▓ĮņÜ░ ļ░śņ╣śĒÅŁ (full width half maximum, FWHM)ņØ┤ 0.26ņØ┤ļ®░, ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ļ░śņ╣śĒÅŁņØĆ 4.70, ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ļ░śņ╣śĒÅŁņØĆ 2.93ņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ ļ░śņ╣śĒÅŁņØś ņ”ØĻ░ĆļŖö ĒĢ┤ļŗ╣ĒĢśļŖö cņČĢņØś Ļ▓░ņĀĢņä▒ņŚÉ ļīĆĒĢ£ Ļ░Éņåīļź╝ ļéśĒāĆļé┤ļ®░, Ļ▓░ņĀĢņ×ÉņØś Ļ░Éņåīļź╝ ņØśļ»ĖĒĢ£ļŗż. ņ▓£ņŚ░ņČöņČ£ļ¼╝ņØä ņ×¼Ļ▒┤ļ▓Ģņ£╝ļĪ£ ļŗ┤ņ¦ĆĒĢ£ Ļ▓ĮņÜ░ ĒÜīļ│ĄļÉ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØ┤ cņČĢ ļ░®Ē¢źņ£╝ļĪ£ Ļ▓░ņĀĢņä▒ņØ┤ ĻĖēĻ░ÉĒĢśļŖö Ļ▓āņØĆ ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ņÖĆ ļÅÖņØ╝ĒĢ£ Ļ▓āņ£╝ļĪ£ņä£, ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņĀüņĖĄļÉ£ ņĖĄņØś ņłśĻ░Ć ņżäņ¢┤ļōżĻ▒░ļéś ļ¼┤ņ¦łņä£ĒĢ£ ļ░®Ē¢źņ£╝ļĪ£ ņĖĄļōżņØ┤ ņīōņŚ¼ ņ׳ĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż.45 ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝Ļ│╝ Ļ░ÖņØĆ 2ņ░©ņøÉ ņĖĄņāüĒśĢ ĒÖöĒĢ®ļ¼╝ņØĆ ņĀüņĖĄļÉ£ ņĖĄņØś ņł½ņ×ÉĻ░Ć ņżäņ¢┤ļōż Ļ▓ĮņÜ░ ļ╣äĒæ£ļ®┤ņĀüņØ┤ ļŖśņ¢┤ļéśĻ│Ā Ļ▓░ņĀĢ Ļ▓░ĒĢ©ņØ┤ ļŖśņ¢┤ļéśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņØĖļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ Ļ▓░ņĀĢņØś Ļ▓░ĒĢ©ņØ┤ ļŖśņ¢┤ļéśļŖö Ļ▓āņØĆ ļ¼╝ņä▒ņØä ņĀ£ņ¢┤ĒĢśĻĖ░ ņ¢┤ļĀżņÜ┤ Ļ▓░Ļ│╝ļź╝ ņ┤łļלĒĢĀ ņłś ņ׳ņ£╝ļéś, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö c-ņČĢ ļ░®Ē¢źņØś Ļ▓░ņĀĢņä▒ Ļ░Éņåī, ņ”ē ņ×ģņ×É ļæÉĻ╗śņØś Ļ░ÉņåīĻ░Ć ņČöņČ£ļ¼╝ ļŗ┤ņ¦ĆņŚÉ ņ£Āļ”¼ĒĢ£ ņä▒ņ¦łļĪ£ ņ×æņÜ®ĒĢĀ ņłś ņ׳ļŗż. ļæÉĻ║╝ņÜ┤ ņ▒ģņØä ņŚ¼ļ¤¼ĻČī ņ×äņØśļĪ£ ļ░░ņŚ┤ĒĢĀ Ļ▓ĮņÜ░ ņ▒ģĻ│╝ ņ▒ģ ņé¼ņØ┤ņØś Ļ│ĄĻ░äņØ┤ Ēü¼Ļ▓ī ĒśĢņä▒ļÉśņ¦Ć ņĢŖņ£╝ļéś, ļæÉĻ║╝ņÜ┤ ņ▒ģņØä ņ¢ćņØĆ ņ▒ģņ£╝ļĪ£ ņ¬╝Ļ░Ā Ēøä ļ¼┤ņ¦łņä£ĒĢśĻ▓ī ļ░░ņŚ┤ĒĢśĻ▓ī ļÉśļ®┤ ņ▒ģĻ│╝ ņ▒ģ ņé¼ņØ┤ņØś Ļ│ĄĻ░äņØ┤ ļŹö ļ¦ÄņØ┤ ĒśĢņä▒ļÉĀ ņłś ņ׳ļŗż. ņØ┤ņÖĆ Ļ░ÖņØĆ ĒśäņāüņØ┤ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉņä£ļÅä ņØ╝ņ¢┤ļéĀ ņłś ņ׳ļŖöļŹ░, ņØ┤ ļĢī ņāØņä▒ļÉ£ ņ×ģņ×ÉņÖĆ ņ×ģņ×Éņé¼ņØ┤ņØś ļ¦ÄņØĆ Ļ│ĄĻ░äņØĆ ļŗżņ¢æĒĢ£ Ēü¼ĻĖ░ļź╝ Ļ░¢ļŖö ņ▓£ņŚ░ ņČöņČ£ļ¼╝ ņä▒ļČäņØä ļŗ┤ņ¦ĆĒĢśļŖö Ļ│ĄĻ░äņ£╝ļĪ£ ņØ┤ņÜ®ļÉĀ ņłś ņ׳ļŗż. ļ¦īņĢĮ, c-ņČĢ ļ░®Ē¢źņ£╝ļĪ£ ļæÉĻ║╝ņÜ┤ ņĀäĻĄ¼ņ▓┤ ņ×ģņ×ÉĻ░Ć ĻĘĖļīĆļĪ£ ņ×¼Ļ▒┤ļÉ£ļŗżļ®┤, ņ×ģņ×ÉņÖĆ ņ×ģņ×Éņé¼ņØ┤ņØś Ļ│ĄĻ░äņØ┤ ņČ®ļČäĒĢśņ¦Ć ņĢŖņĢäņä£ ņČöņČ£ļ¼╝ ņä▒ļČäņØä ņĄ£ļīĆĒĢ£ ļŗ┤ņ¦ĆĒĢĀ ņłś ņŚåņØä Ļ▓āņØ┤ļŗż. ĒŖ╣Ē׳, ņ▓£ņŚ░ ņČöņČ£ļ¼╝ņŚÉļŖö ņóģļźśņÖĆ ņä▒ņ¦łņØ┤ ņä£ļĪ£ ļŗżļźĖ ļ¦ÄņØĆ ĒÖöĒĢÖņóģļōżņØ┤ ņĪ┤ņ×¼ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņĄ£ļīĆĒĢ£ ļäōņØĆ Ļ│ĄĻ░äņØä ĒÖĢļ│┤ĒĢśļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ļīĆļČĆļČäņØś ņŗØļ¼╝ ņČöņČ£ļ¼╝ņØĆ ĒāäĒÖöņłśņåīĻ│äņŚ┤ņØś Ļ│ĀļČäņ×É, ņĢĮĻ░äņØś ņ¦Ćņ¦ł, ĒÅ┤ļ”¼ĒÄśļåĆļźśņØś ĒĢŁņé░ĒÖö ņä▒ļČä ļō▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖöļŹ░, ņØ┤ļōżņØĆ ļČäņ×ÉņØś Ēü¼ĻĖ░ņŚÉņä£ļČĆĒä░ ņ╣£ņłśņä▒/ņåīņłśņä▒ ņä▒ņ¦łņŚÉ ņØ┤ļź┤ĻĖ░ Ļ╣īņ¦Ć ĻĘĖ ļ¼╝ņä▒ņØ┤ ņä£ļĪ£ ļŗżļź┤ļŗż. ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņ×¼Ļ▒┤ņŗ£ ņāØņä▒ļÉśļŖö ņ×ģņ×ÉņÖĆ ņ×ģņ×ÉĻ░äņØś ļäōņØĆ Ļ│ĄĻ░äņØĆ ņØ┤ļōżņØä ļŗ┤ņ¦ĆĒĢśļŖö ļŹ░ ņ׳ņ¢┤ņä£ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
ņāüĻĖ░ņØś ļČäļ¦É X-ņäĀ ĒÜīņĀł Ēī©Ēä┤ņŚÉ ļö░ļź┤ļ®┤ ņĀäĻĄ¼ņ▓┤ņØś ĒĢśņåīņÖĆ ņ×¼Ļ▒┤ņŚÉ ļö░ļØ╝ Ļ▓░ņĀĢņāüĻ│╝ Ļ▓░ņĀĢņä▒ņØś ļ│ĆĒÖöĻ░Ć ļłłņŚÉ ļØäĻ▓ī ņśłņāüļÉ£ļŗż. ĒŖ╣Ē׳, ņ×¼Ļ▒┤ Ēøä ĒÖĢņØĖļÉśļŖö Ļ▓░ņĀĢĒĢÖņĀü c-ņČĢ ļ░®Ē¢źņØś Ļ▓░ņĀĢņä▒ Ļ░ÉņåīļŖö ņä▒ņāü ņĖĪļ®┤ņŚÉņä£ ļ│ĆĒÖö ŌĆō ņ×ģņ×ÉĒśĢ ņä▒ņāüņŚÉņä£ ļ¬©ļלņןļ»ĖĒśĢ ņ╣┤ļō£ņ¦æ ņä▒ņāüņ£╝ļĪ£ņØś ļ│ĆĒÖö ŌĆō ļź╝ ņśłņāüņ╝Ć ĒĢ£ļŗż. ņ▓£ņŚ░ņČöņČ£ļ¼╝ņØĖ ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝Ļ│╝ ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņØä ņ×¼Ļ▒┤ļ▓Ģņ£╝ļĪ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ļŗ┤ņ¦ĆĒĢśļŖö Ļ│╝ņĀĢņŚÉņä£ ņØ╝ņ¢┤ļéśļŖö ņ×ģņ×ÉņØś Ēü¼ĻĖ░ņÖĆ ĒśĢĒā£ņØś ļ│ĆĒÖöļź╝ ņóĆ ļŹö ĻĄ¼ņ▓┤ņĀüņ£╝ļĪ£ Ļ┤Ćņ░░ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤, ĻĖłņåŹņé░ĒÖöļ¼╝ ņżæĻ░äņ▓┤, ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ļ░Å ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ņØś ņŻ╝ņé¼ņĀäņ×ÉĒśäļ»ĖĻ▓Į (scanning electron microscope) ļČäņäØņØä ņłśĒ¢ēĒĢśņśĆļŗż. ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤ņØś ņ×ģņ×ÉļŖö 222 ┬▒32.6 nm Ēü¼ĻĖ░ļź╝ Ļ░Ćņ¦Ćļ®░ ĻĘĀņØ╝ĒĢ£ ĒīÉņāüĒśĢ ņ×ģņ×ÉĒśĢĒā£ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż (Fig. 3(a)). ņØ╝ļ░śņĀüņ£╝ļĪ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØä Ļ│Ąņ╣©ļ▓ĢņŚÉ ņØśĒĢ┤ ĒĢ®ņä▒ĒĢśĻ▓ī ļÉśļ®┤, 2ņ░©ņøÉ ļ╣äļō▒ļ░®ņä▒ ļĢīļ¼ĖņŚÉ Ļ▓░ņĀĢĒĢÖņĀü ab-ļ®┤ ļ░®Ē¢źņØś Ļ▓░ņĀĢņä▒ņןņØ┤ ļæÉļō£ļ¤¼ņ¦Ćļ®░ Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ ņóģĒÜĪļ╣äĻ░Ć ņāüļŗ╣Ē׳ ļåÆņØĆ ņ×ģņ×ÉĻ░Ć ņ¢╗ņ¢┤ņ¦äļŗż. ĻĘĖņŚÉ ļ╣äĒĢ┤ ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ļÉ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØĆ ņłśņŚ┤ĒĢ®ņä▒ ņ▓śļ”¼ļź╝ Ļ▒░ņ│żĻĖ░ ļĢīļ¼ĖņŚÉ ņóģĒÜĪļ╣äĻ░Ć ļé«ņĢäņĀĖ ņ׳ņ£╝ļ®░, Ļ▓░ņĀĢĒĢÖņĀü c-ņČĢ ļ░®Ē¢źņØś Ļ▓░ņĀĢ ņä▒ņןļÅä ļæÉļō£ļ¤¼ņ¦äļŗż. ĒĢ®ņä▒ļ▓ĢņŚÉ ļö░ļØ╝ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņ×ģĒśĢņØ┤ ļŗ¼ļØ╝ņ¦ł ņłś ņ׳ņØīņØĆ ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ņÖĆ ņ£Āņé¼ĒĢ£ Ļ▓░Ļ│╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż.38 ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØä ĒĢśņåīĒĢśņŚ¼ ņ¢╗ņØĆ ĻĖłņåŹņé░ĒÖöļ¼╝ ņżæĻ░äņ▓┤ņØś Ļ▓ĮņÜ░ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤ņÖĆ ņ£Āņé¼ĒĢ£ ņ×ģņ×É Ēü¼ĻĖ░ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ£╝ļ®░, ĒīÉņāüĒśĢņØś ņ×ģņ×É ĒśĢĒā£ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņĀĢļ¤ēņĀüņ£╝ļĪ£ ņ×ģņ×ÉņØś ab-ļ®┤ ļ░®Ē¢ź ļäłļ╣äņÖĆ ļæÉĻ╗śļź╝ ļ╣äĻĄÉĒĢ┤ ļ│Ė Ļ▓░Ļ│╝ ĒĢśņåī ĒøäņŚÉļŖö ab-ļ®┤ ļ░®Ē¢źņØś ļäłļ╣äļŖö ņ£Āņé¼ĒĢśĻ▓ī ņ£Āņ¦ĆļÉśļéś, c-ņČĢ ļ░®Ē¢źņØś Ēü¼ĻĖ░ļŖö ņ×æņĢäņ¦ä Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż. ņĢ×ņä£ ĻĖ░ņłĀĒĢ£ ļ░öņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØ┤ ĒĢśņåīļÉśļŖö Ļ│╝ņĀĢņŚÉņä£ ņĖĄĻ░äņŚÉ ņĪ┤ņ×¼ĒĢśļŖö Ēāäņé░ņØ┤ņś©Ļ│╝ ļ¼╝ļČäņ×ÉĻ░Ć CO2ņÖĆ H2 OļĪ£ ĻĖ░ĒÖöļÉśņ¢┤ ļ╣ĀņĀĖļéśĻ░Ćļ®░, ņĖĄņØä ņØ┤ļŻ©ļŖö ĒöäļĀłņ×äņøīĒü¼ņŚÉņä£ļÅä Ēāłņłś ļ░śņØæņØ┤ ņØ╝ņ¢┤ļé£ļŗż. Ļ▓░ņĀĢĒĢÖņĀüņ£╝ļĪ£ Mg(OH)6ņÖĆ MgOņØś Mg-O Ļ▒░ļ”¼ļŖö Ēü¼Ļ▓ī ņ░©ņØ┤ļéśņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņŚÉ, ĒĢśņåī
Fig.┬Ā3.
(a) ņĀäĻĄ¼ņ▓┤ LDH, (b) ņżæĻ░äņ▓┤ LDO, (c) ļ¬®ļŗ©Ēö╝-LDH(ņŚ┤ņłś) ļ░Å (d) ļ░▒ņ×æņĢĮ-LDH(ņŚ┤ņłś) ĒĢśņØ┤ļĖīļ”¼ļō£ņØś ņŻ╝ņé¼ņĀäņ×ÉĒśäļ»ĖĻ▓Įņé¼ņ¦ä

ļ░śņØæņØś Ļ▓░Ļ│╝ ņāØņä▒ļÉśļŖö ĻĖłņåŹņé░ĒÖöļ¼╝ņØś ab-ļ®┤ ļ░®Ē¢ź ļäłļ╣äļŖö Ēü¼Ļ▓ī ņżäņ¢┤ļōżņ¦Ć ņĢŖļŖöļŗż. ņØ┤ņŚÉ ļ╣äĒĢ┤, c-ņČĢņŚÉņä£ļŖö ņĖĄĻ░äĻĄ¼ņĪ░Ļ░Ć ļ¼┤ļäłņ¦Ćļ®░ Mg(OH)6ĒöäļĀłņ×äņøīĒü¼Ļ░Ć MgOļĪ£ ļ│ĆĒÖöĒĢśļ®░ Ļ▓░ņĀĢņ×ÉĻ░äņØś ņŚ░Ļ▓░ ŌĆō Al3+ņŚÉ ņØśĒĢ£ MgO Ļ▓░ņĀĢņ×ÉļōżņØś ņŚ░Ļ▓░ ŌĆō ņØ┤ ņØ╝ņ¢┤ļéśļ»ĆļĪ£ Ļ▓░ņĀĢņØś ņłśņČĢņØ┤ Ēü░ ĒÅŁņ£╝ļĪ£ ļéśĒāĆļé£ļŗż(Fig. 3(b)).
ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝Ļ│╝ ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ņØś Ļ▓ĮņÜ░ ļ░śņØæ ņČ£ļ░£ļ¼╝ņ¦łņØĖ ĻĖłņåŹņé░ĒÖöļ¼╝ ņżæĻ░äņ▓┤ņÖĆļŖö ļ¦żņÜ░ ļŗżļźĖ ņ¢æņāüņØä ļéśĒāĆļé┤ņŚłļŗż. ļæÉ ĒĢśņØ┤ļĖīļ”¼ļō£ņØś Ļ▓ĮņÜ░ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝Ļ│╝ ĻĖłņåŹņé░ĒÖöļ¼╝ņØś ĒīÉņāüĒśĢ ņ×ģņ×ÉņØś ĒśĢĒā£Ļ░Ć ņ£Āņ¦ĆļÉśņ¦Ć ņĢŖĻ│Ā, ļ¬©ļלņןļ»Ė Ēś╣ņØĆ ņ╣┤ļō£ņ¦æ ĒśĢĒā£ņØś ņä▒ņāüņØä ļéśĒāĆļé┤ļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŖöļŹ░, ņ×ģņ×ÉņØś ļæÉĻ╗ś ļ░Å Ēü¼ĻĖ░ ļśÉĒĢ£ X-ņäĀ ĒÜīņĀłĒī©Ēä┤ņØś cņČĢņ£╝ļĪ£ņØś Ļ▓░ņĀĢņä▒ ļ│ĆĒÖöņŚÉņä£ Ļ┤Ćņ░░ļÉ£ Ļ▓░Ļ│╝ņÖĆ ļČĆĒĢ®ļÉśĻ▓ī ņ¢ćņĢäņ¦ĆļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż (Fig. 3(c)-(d)). ņ×¼Ļ▒┤ļ▓ĢņŚÉ Ļ┤ĆĒĢ£ ļ¼ĖĒŚīļōżņØä ņé┤ĒÄ┤ļ│┤ļ®┤ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś c-ņČĢ ļ░®Ē¢ź Ļ▓░ņĀĢņä▒ņØĆ ņ£Āņ¦ĆļÉśļŖö Ļ▓ĮņÜ░ņÖĆ Ļ░ÉņåīļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¬©ļæÉ Ļ┤Ćņ░░ļÉśļŖöļŹ░, Ēśä ņŗ£ņĀÉņŚÉņä£ ļīĆĒĢ£ ļ¬ģĒÖĢĒĢ£ ņäżļ¬ģņØĆ ņ¢┤ļĀĄļŗż. ĻĘĖļ¤¼ļéś, ņ×¼Ļ▒┤Ļ│╝ņĀĢņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ĒÖöĒĢÖņóģņØ┤ļéś ņØ┤ņś©ņóģņŚÉ ņØśĒĢ┤ ņä▒ņāüņØś ņ░©ņØ┤ļéś Ļ▓░ņĀĢņä▒ņØś ņ░©ņØ┤Ļ░Ć ņāØĻĖĖ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. ņśłņ╗©ļīĆ, ņ×¼Ļ▒┤ Ļ│╝ņĀĢņŚÉņä£ ņĀäĻĄ¼ņ▓┤ņÖĆ ļÅÖņØ╝ĒĢ£ Ēāäņé░ņØ┤ņś©ņØä ņØ┤ņÜ®ĒĢ£ļŗżļ®┤, ņ┤łĻĖ░ņÖĆ Ļ▒░ņØś ņ£Āņé¼ĒĢ£ Ļ▓░ņĀĢņä▒Ļ│╝ ņä▒ņāüņØ┤ ņ×¼ĒśäļÉĀ ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ņ▓śļ¤╝ ļŗżņ¢æĒĢ£ ņóģ ļźśņØś ĒÖöĒĢÖņóģņØ┤ ņĪ┤ņ×¼ĒĢśĻ│Ā, ņØ╝ļČĆ Ļ│ĀļČäņ×Éļéś ņ┤łļČäņ×ÉņØś ĒśĢĒā£ļź╝ ļØĀļŖö ĒÖöĒĢÖņóģņØ┤ ĒĢ©Ļ╗ś ņĪ┤ņ×¼ĒĢĀ Ļ▓ĮņÜ░ņŚÉļŖö ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś Ļ▓░ņĀĢĻĄ¼ņĪ░ ĒÜīļ│Ą Ļ│╝ņĀĢņŚÉņä£ ļŗżļ░®ļ®┤ņØś ņśüĒ¢źņØä ļ░øņØä Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. ņÜöņ╗©ļīĆ, ņĖĄņāü ĻĄ¼ņĪ░ļĪ£ņØś ĒÜīĻĘĆ Ļ│╝ņĀĢņŚÉņä£ Ļ▒░ļīĆĒĢ£ ņ┤łļČäņ×É/Ļ│ĀļČäņ×ÉļōżņØ┤ ņĀüņĖĄņØä ļ░®ĒĢ┤ĒĢĀ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņĀäĻĄ¼ņ▓┤ņØĖ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ĻĘ£ņ╣ÖņĀüņØĖ ņĀüņĖĄĻĄ¼ņĪ░Ļ░Ć ļ¼┤ņ¦łņä£ĒĢ£ ļ░░ņŚ┤ļĪ£ ļéśĒāĆļéśĻ▒░ļéś ņĖĄņØś ņØ╝ļČĆĻ░Ć ļ░Ģļ”¼ĒÖöļÉśļŖö Ļ▓āĻ│╝ ņ£Āņé¼ĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņØ╝ Ļ▓āņØ┤ļØ╝Ļ│Ā ņśłņāüļÉ£ļŗż. ļśÉĒĢ£ ĒĢśņØ┤ļĖīļ”¼ļō£ņØś Ļ▓ĮņÜ░ ņ×ģņ×ÉļōżņØ┤ ņ╣┤ļō£ņ¦æ ĒśĢĒā£ņØś ĻĄ¼ņĪ░ļź╝ ņØ┤ļŻ©ļ®┤ņä£ ņ×ģņ×Éļōż ņé¼ņØ┤ņŚÉ Ļ│ĄĻ░äņØä ĒśĢņä▒ĒĢśļŖöļŹ░, ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś Ļ▓ĮņÜ░ ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ņØś Ļ▓ĮņÜ░ļ│┤ļŗż ņ×ģņ×ÉņØś Ēü¼ĻĖ░Ļ░Ć ņ×æņĢä ļ│┤ņØ┤ļ®░, ļŹö ņ×æņØĆ Ēü¼ĻĖ░ņØś ņ×ģņ×Éļōż ļĢīļ¼ĖņŚÉ ņ×ģņ×Éļōż ņé¼ņØ┤ Ļ│ĄĻ░äņØ┤ ļŹö ņ×æņØä Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. X-ņäĀ ĒÜīņĀłĒī©Ēä┤ņŚÉņä£ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļō»ņØ┤ ņĖĄĻ░äĻ│ĄĻ░äņŚÉ ļ¬®ļŗ©Ēö╝ ņČöņČ£ļ¼╝ņØ┤ļéś ļ░▒ņ×æņĢĮ ņČöņČ£ļ¼╝ņØś ļČäņ×ÉĻ░Ć ņéĮņ×ģļÉśļŖö Ļ▓āņØ┤ ņĢäļŗī Ēāäņé░ņØ┤ņś©ņØ┤ ņéĮņ×ģļÉśņ¢┤ ņ׳ļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆĻ│Ā, ļ╣äĻĄÉņĀü Ēü¼ĻĖ░Ļ░Ć Ēü░ ļ¬®ļŗ©Ēö╝ ņČöņČ£ļ¼╝ņØ┤ļéś ļ░▒ņ×æņĢĮ ņČöņČ£ļ¼╝ņØś ņä▒ļČäļōżņØ┤ Ēü¼ĻĖ░ņŚÉ ļ╣äĻĄÉņĀü ņĀ£ĒĢ£ņŚåņØ┤ ļ¼╝ņ¦łņØä ļŗ┤ņ¦ĆĻ░Ć Ļ░ĆļŖźĒĢ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņ×ģņ×Éļōż ņé¼ņØ┤ņØś Ļ│ĄĻ░äņŚÉ ņēĮĻ▓ī ļŗ┤ņ¦Ć ļÉśņŚłņØä Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
ļ¬®ļŗ©Ēö╝ņÖĆ ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņØś Ļ▓ĮņÜ░ ļŗżņ¢æĒĢ£ ĒāäņłśĒÖöļ¼╝(carbohydrate), ĒÅ┤ļ”¼ĒÄśļåĆ(polyphenol), ĒöīļØ╝ļ│┤ļģĖņØ┤ļō£(flavonoid) ļō▒Ļ│╝ Ļ░ÖņØĆ ņāØļ”¼ĒÖ£ņä▒ņóģņØä ĒżĒĢ©ĒĢśĻ│Ā ņ׳ņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ņāØļ”¼ĒÖ£ņä▒ņóģņŚÉļŖö ļŗżņ¢æĒĢ£ ņØīņØ┤ņś© ņóģļōżņØ┤ ņĪ┤ņ×¼ĒĢśņŚ¼ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝Ļ│╝ ļ░śņØæ ņŗ£ ņ¢æņØś Ēæ£ļ®┤ņĀäĒĢśļŖö Ļ░¢ļŖö ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝Ļ│╝ ņĀĢņĀäĻĖ░ņĀü ņØĖļĀźņŚÉ ņØśĒĢśņŚ¼ ļ░śņØæĒĢĀ ņłś ņ׳ļŖö Ļ░ĆļŖźņä▒ņØä Ļ░Ćņ¦ĆĻ▓ī ļÉ£ļŗż. ļö░ļØ╝ņä£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ļ¬®ļŗ©Ēö╝ ņČöņČ£ļ¼╝Ļ│╝ ļ░▒ņ×æņĢĮ ņČöņČ£ļ¼╝ņØä ļŗ┤ņ¦Ć ņĀäĻ│╝ Ēøä ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś Ēæ£ļ®┤ņĀäĒĢśļź╝ ļ╣äĻĄÉĒĢśļŖö Ļ▓āņØĆ ĻĖłņåŹņØ┤ņżæ ņĖĄņłśņé░ĒÖöļ¼╝ņØś Ēæ£ļ®┤ņŚÉņä£ ņČöņČ£ļ¼╝Ļ│╝ņØś ņāüĒśĖņ×æņÜ®ņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢśļŖö ĒśäņāüņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśļ®░, ņØ┤ļź╝ ņ£äĒĢ┤ ņĀ£ĒāĆņĀäņ£ä(zeta-potential)ļź╝ ņĖĪņĀĢĒĢśņŚ¼ Ēæ£ļ®┤ņĀäĒĢś ļ╣äĻĄÉļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż (Table 1). Ēæ£ļ®┤ņĀäĒĢśļŖö ņĖĪņĀĢĒĢśļŖö pH ņĪ░Ļ▒┤ņŚÉ ļö░ļØ╝ ļŗ¼ļØ╝ņ¦Ćļ»ĆļĪ£, ļÅÖņØ╝ĒĢ£ pH 7ņĪ░Ļ▒┤ņŚÉņä£ ņĖĪņĀĢņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤ņØś Ļ▓ĮņÜ░ Ēæ£ļ®┤ņĀäĒĢśļŖö 35.4 ┬▒0.84 mVļĪ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØ┤ Ļ░¢ļŖö ņĀäĒśĢņĀüņØĖ ņ¢æņØś Ēæ£ļ®┤ņĀäĒĢśļź╝ ļØäļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČ£ļ¼╝Ļ│╝ ļ░▒ņ×æņĢĮ ņŚ┤ņłś ņČöņČ£ļ¼╝ņØĆ Ļ░üĻ░ü ŌłÆ18.7 ┬▒6.96 mV ņÖĆ ŌłÆ35.6 ┬▒2.92 mVļĪ£ ņØīņØś Ēæ£ļ®┤ņĀäĒĢśļź╝ Ļ░¢ļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ ņČöņČ£ļ¼╝ ļé┤ ņĪ┤ņ×¼ĒĢśļŖö ņä▒ļČäļōżņØ┤ ņ×ģņ×ÉņØś Ēæ£ļ®┤Ļ│╝ ņĀĢņĀäĻĖ░ņĀü ņØĖļĀźņŚÉ ņØśĒĢ┤ ļ░śņØæĒĢśņŚ¼ Ēæ£ļ®┤ņØä ņÖäņĀäĒ׳ ļÆżļŹ«Ļ│Ā ņ׳ļŗżļ®┤, ņāØņä▒ļÉ£ ĒĢśņØ┤ļĖīļ”¼ļō£ņØś Ēæ£ļ®┤ņĀäĒĢśļŖö ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś Ēæ£ļ®┤ņØä ļÆżļŹ«Ļ│Ā ņ׳ļŖö ņČöņČ£ļ¼╝ņØś Ēæ£ļ®┤ņĀäĒĢśņÖĆ ļÅÖņØ╝ĒĢ┤ņ¦äļŗżļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż.46 ĒĢśņ¦Ćļ¦ī ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝Ļ│╝ ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś Ļ▓ĮņÜ░ Ēæ£ļ®┤ņĀäĒĢśĻ░Ć 7.91 ┬▒0.85 mVņÖĆ 21.1 ┬▒0.76 mV ļĪ£ ņČöņČ£ļ¼╝ņØś Ēæ£ļ®┤ņĀäĒĢśņÖĆļŖö ļÅÖņØ╝ĒĢśņ¦Ć ņĢŖņĢśņ£╝ļ®░, ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ļ│┤ļŗżļŖö ņØīņØś Ēæ£ļ®┤ņĀäĒĢśļź╝ ļØäļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ņä£ ņČöņČ£ļ¼╝ņØ┤ ņ×¼Ļ▒┤ļ▓ĢņØä ĒåĄĒĢśņŚ¼ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ļŗ┤ņ¦Ć ļÉĀ ļĢī, ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś Ēæ£ļ®┤ņØä ņČöņČ£ļ¼╝ņØ┤ ņÖäņĀäĒ׳ ļŹ«Ļ│Ā ņ׳ļŖö Ļ▓āņØ┤ ņĢäļŗī ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņ×ģņ×ÉļōżņØ┤ ĒśĢņä▒ĒĢśļŖö ņ×ģņ×Éņé¼ņØ┤ņØś Ļ│ĄĻ░äņŚÉ ļŗ┤ņ¦ĆļÉśņ¢┤ ļ╣äĻĄÉņĀü ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņ¢æņØśņĀäĒĢśļź╝ ļØäļŖö ļČĆļČäņØ┤ Ēæ£ļ®┤ņŚÉ ļģĖņČ£ļÉ©ņ£╝ļĪ£ņŹ© ņ¢æņØś Ēæ£ļ®┤ņĀäĒĢśļź╝ ļéśĒāĆļéĖļŗżĻ│Ā ĒīÉļŗ©ĒĢĀ ņłś ņ׳ņŚłļŗż. ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØ┤ ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ ļ│┤ļŗż ļŹö Ēæ£ļ®┤ņĀäĒĢśĻ░Ć 0ņŚÉ Ļ░ĆĻ╣īņÜ┤ Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŖöļŹ░, ņŻ╝ņé¼ņĀäņ×ÉĒśäļ»ĖĻ▓Į ļČäņäØņŚÉņä£ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļō»ņØ┤ ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖī ļ”¼ļō£Ļ░Ć ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ļ│┤ļŗż ļŹö ņ×æņØĆ ņ×ģņ×É ņé¼ņØ┤ņØś Ļ│ĄĻ░äņØä ĒśĢņä▒ĒĢśņŚ¼ ļŗ┤ņ¦Ć ļÉ£ ņČöņČ£ļ¼╝ ņżæ ņ×ģņ×Éņé¼ņØ┤ņØś Ļ│ĄĻ░äņŚÉ ļŗ┤ņ¦Ć ļÉ£ ņ¢æņØ┤ ļŹö ņĀüĻ│Ā Ēæ£ļ®┤ņŚÉ ĒØĪņ░®ļÉśņ¢┤ ņ׳ļŖö ņČöņČ£ļ¼╝ņØ┤ ļŹö ļ¦ÄĻĖ░ ļĢīļ¼ĖņŚÉ ļŹö 0ņŚÉ Ļ░ĆĻ╣īņÜ┤ Ēæ£ļ®┤ņĀäĒĢśļź╝ ļéśĒāĆļé┤ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ĻĘĖļ¤¼ļéś ņČöņČ£ļ¼╝ņØä ļŗ┤ņ¦ĆĒĢ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś Ļ▓ĮņÜ░ ļ¬©ļæÉ ņ¢æņØś Ēæ£ļ®┤ņĀäĒĢśļź╝ Ļ░¢ĻĖ░ ļĢīļ¼ĖņŚÉ, ņČöĒøä ĒĢŁĻĘĀņØä ņ£äĒĢ┤ ņé¼ņÜ®ļÉĀŃĆĆļĢī ņØīņØś Ēæ£ļ®┤ņĀäĒĢśļź╝ Ļ░¢ļŖö ĻĘĀ Ēæ£ļ®┤ņŚÉ ļŹöņÜ▒ ņל ļČĆņ░®ļÉĀ ņłś ņ׳ņ¢┤ ĻĘĀņŚÉ ĒĢŁĻĘĀņä▒ņØä Ļ░¢ļŖö ņä▒ļČäņØä ļŹö ņל ņĀäļŗ¼ĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
Table┬Ā1.
ļ¬®ļŗ©Ēö╝-LDH(ņŚ┤ņłś) ļ░Å ļ░▒ņ×æņĢĮ-LDH(ņŚ┤ņłś) ĒĢśņØ┤ļĖīļ”¼ļō£ņØś ņĀ£ĒāĆņĀäņ£ä
Table┬Ā2.
ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņČ®ņłśņé░ĒÖöļ¼╝ ļ░Å ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ ļé┤ ņČöņČ£ļ¼╝ ĒĢ©ļ¤ē
| ĒĢśņØ┤ļĖīļ”¼ļō£ ļé┤ ņČöņČ£ļ¼╝ ĒĢ©ļ¤ē (%) | |||
|---|---|---|---|
| ļ¬®ļŗ©Ēö╝-LDH(ņŚ┤ņłś) | 20.1 | ļ░▒ņ×æņĢĮ-LDH(ņŚ┤ņłś) | 20.5 |
ĻĖłņåŹņØ┤ņżæņČ®ņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤, ĻĖłņåŹņé░ĒÖöļ¼╝ ņżæĻ░äņ▓┤, ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝Ļ│╝ ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ņØś X-ņäĀ ĒÜīņĀłĒī©Ēä┤, ņŻ╝ņé¼ņĀäņ×ÉĒśäļ»ĖĻ▓Į ņé¼ņ¦ä, ņĀ£ĒāĆņĀäņ£ä ņĖĪņĀĢĻ▓░Ļ│╝ļź╝ ĒåĄĒĢ┤ņä£ Fig. 4ņŚÉņä£ņÖĆ Ļ░ÖņØ┤ Ēāäņé░ņØ┤ņś©(CO32-)ņØä ņØīņØ┤ņś© ņóģņ£╝ļĪ£ ĒżĒĢ©ĒĢśļŖö ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØ┤ 400ŌäāņŚÉņä£ ĒĢśņåīĒĢśņŚ¼ ĻĖłņåŹņłśņé░ĒÖöļ¼╝ņØ┤ ĻĖłņåŹņé░ĒÖöļ¼╝ļĪ£ ļ│ĆĒśĢļÉśļ®┤ņä£ MgO Ļ▓░ņĀĢņØ┤ ņāØņä▒ļÉśĻ│Ā, ņØ┤ļ¤¼ĒĢ£ Ļ▓░ņĀĢļōż ņé¼ņØ┤ņŚÉ AlņØ┤ Ļ░ĆĻĄÉĒÖöļÉ£ Ļ▓āņ▓śļ¤╝ ņĪ┤ņ×¼ĒĢśļŖö ĒśĢĒā£ļĪ£ Ļ▓░ņĀĢĻĄ¼ņĪ░ņØś ļ│ĆĒÖöĻ░Ć ņāØĻĖ░ļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ļśÉĒĢ£ ņØ┤ļĀćĻ▓ī ņāØņä▒ļÉ£ ĻĖłņåŹņé░ĒÖöļ¼╝ņØä ņ▓£ņŚ░ņČöņČ£ļ¼╝Ļ│╝ Ēś╝ĒĢ®ĒĢśņŚ¼ ņ×¼Ļ▒┤ļ▓Ģņ£╝ļĪ£ ĒĢśņØ┤ļĖīļ”¼ļō£ļź╝ ņĀ£ņĪ░ĒĢĀ ļĢī, ļ¼╝ļČäņ×ÉņÖĆ ņØīņØ┤ņś© ļČäņ×ÉņØś ņĪ┤ņ×¼ĒĢśņŚ¼ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņĀüņĖĄĻĄ¼ņĪ░Ļ░Ć ļÅīņĢäņśżļŖö ļÅÖņŗ£ņŚÉ ņ×ģņ×Éļōż ņé¼ņØ┤ņØś ļ░śņØæņŚÉ ņØśĒĢ£ ņ╣┤ļō£ņ¦æ ĻĄ¼ņĪ░Ļ░Ć ņāØņä▒ļÉśļ®┤ņä£ ņ×ģņ×Éņé¼ņØ┤ņØś Ļ│ĄĻ░ä ļśÉļŖö Ēæ£ļ®┤ņŚÉ ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝ ļśÉļŖö ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņØ┤ ļŗ┤ņ¦ĆļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż.
Ē¢źĒøä ĒĢ®ņä▒ĒĢ£ ņ▓£ņŚ░ņČöņČ£ļ¼╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖī ļ”¼ļō£ņØś ĒĢŁĻĘĀņä▒ņØä ņ▓£ņŚ░ņČöņČ£ļ¼╝ļ¦ī ņ▓śļ”¼ĒĢśņśĆņØä ļĢīņÖĆ ļ╣äĻĄÉ ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢ┤ņä£, ņ×¼Ļ▒┤ļ▓ĢņØä ĒåĄĒĢśņŚ¼ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ļŗ┤ņ¦ĆĒĢ£ ļ¬®ļŗ©Ēö╝ ļ░Å ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņØś ņ¢æņØä ĒÖĢņØĖĒĢĀ ĒĢäņÜöĻ░Ć ņ׳ļŗż. ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ļŗ┤ņ¦ĆļÉ£ ņČöņČ£ļ¼╝ņØś ĒĢ©ļ¤ēņØĆ ĒĢ®ņä▒ ņŗ£ņŚÉ ĒÖĢļ│┤ĒĢ£ ņāüņĖĄņĢĪņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ņČöņČ£ļ¼╝ņØś ņ¢æņØä Ļ▒┤ņĪ░ņżæļ¤ēļ▓Ģņ£╝ļĪ£ ĻĄ¼ĒĢ£ Ēøä ņŚŁņé░ĒĢśņŚ¼ ĒĢśņØ┤ļĖīļ”¼ļō£ņŚÉ ļŗ┤ņ¦ĆļÉ£ ņČöņČ£ļ¼╝ņØś ĒĢ©ļ¤ēņØä Ļ▓░ņĀĢĒĢśņśĆļŗż. ņØ┤ņÖĆ Ļ░ÖņØĆ ļ░®ļ▓Ģņ£╝ļĪ£ Ļ▓░ņĀĢĒĢ£ ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ ļé┤ ļ¬®ļŗ©Ēö╝ ņČöņČ£ļ¼╝ņØś ĒĢ©ļ¤ēņØĆ 20.1% ņØ┤Ļ│Ā, ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ ļé┤ ļŗ┤ņ¦ĆļÉ£ ļ░▒ņ×æņĢĮ ņČöņČ£ļ¼╝ņØś ĒĢ©ļ¤ēņØĆ 20.5%ļĪ£, ļæÉ ņČöņČ£ļ¼╝ņØ┤ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ļé┤ņŚÉ ļÅÖņØ╝ĒĢ£ ĒĢ©ļ¤ēņ£╝ļĪ£ ļŗ┤ņ¦Ć ļÉśņŚłņØīņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö ņŻ╝ņé¼ņĀäņ×ÉĒśäļ»ĖĻ▓ĮĻ│╝ ņĀ£ĒāĆņĀäņ£ä ņĖĪņĀĢĻ▓░Ļ│╝ņÖĆ ņŚ░Ļ┤Ćņ¦Ćņ¢┤ ļ│╝ ļĢī, ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£Ļ░Ć ļ╣äĻĄÉņĀü ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉņä£ļ│┤ļŗż ņ×æņØĆ Ēü¼ĻĖ░ņØś ņ×ģņ×Éņé¼ņØ┤ņØś Ļ│ĄĻ░äņØä ĒśĢņä▒ĒĢśņŚ¼ ņČöņČ£ļ¼╝ ļé┤ ļ¦żņÜ░ Ēü░ ļČäņ×ÉņØś Ļ▓ĮņÜ░ ņ×ģņ×Éņé¼ņØ┤ņØś Ļ│ĄĻ░äņŚÉ ļŗ┤ņ¦ĆļÉśņ¦Ć ļ¬╗ĒĢśĻ│Ā Ēæ£ļ®┤ņŚÉ ĒØĪņ░®ļÉ©ņ£╝ļĪ£ņŹ© ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝Ļ│╝ ļ╣äņŖĘĒĢ£ ĒĢ©ļ¤ēņØś ņČöņČ£ļ¼╝ņØä ļŗ┤ņ¦Ć Ē¢łņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ļŹö 0ņŚÉ Ļ░ĆĻ╣īņÜ┤ Ēæ£ļ®┤ņĀäĒĢśļĪ£ ņłśļĀ┤ĒĢ£ļŗżļŖö Ļ▓░Ļ│╝ņÖĆ ņל ļČĆĒĢ®ĒĢ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ļśÉĒĢ£, ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś Ļ▓ĮņÜ░ ļīĆļČĆļČäņØś ņČöņČ£ļ¼╝ņØ┤ Ēü░ ņ×ģņ×Éņé¼ņØ┤ņØś Ļ│ĄĻ░äņŚÉ ļŗ┤ņ¦ĆļÉśĻ│Ā ņØ╝ļČĆĻ░Ć Ēæ£ļ®┤ņŚÉ ĒØĪņ░®ļÉśņ¢┤ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ĒŖ╣ņä▒ņØä ļØĀļŖö Ēæ£ļ®┤ņØ┤ ļŹöņÜ▒ ņÖĖļČĆņŚÉ ļģĖņČ£ļÉ©ņ£╝ļĪ£ņŹ© ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ļ│┤ļŗż ņóĆ ļŹö ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņĀäĻĄ¼ņ▓┤ņŚÉ ĻĘ╝ņĀæĒĢ£ ņ¢æņØś Ēæ£ļ®┤ņĀäĒĢśļź╝ ļéśĒāĆļé┤ļŖö Ļ▓āņ£╝ļĪ£, ņØ┤ Ļ▓░Ļ│╝ ņŚŁņŗ£ ņŻ╝ņé¼ņĀäņ×ÉĒśäļ»ĖĻ▓Į, ņĀ£ĒāĆņĀäņ£ä Ļ▓░Ļ│╝ņÖĆ ĒĢ©ļ¤ēĻ▓░Ļ│╝ļŖö ņל ļČĆĒĢ®ļÉśļŖö Ļ▓░Ļ│╝ņ×äņØä ĒÖĢņØĖĒĢśņśĆļŗż.
ĒĢŁĻĘĀņä▒ņØä ļØĀļŖö ļ¬®ļŗ©Ēö╝ņÖĆ ļ░▒ņ×æņĢĮ ņČöņČ£ļ¼╝ņØ┤ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ļŗ┤ņ¦ĆļÉ£ ĒøäņŚÉ ĒĢŁĻĘĀņä▒ ļ│ĆĒÖöļź╝ Ļ┤Ćņ░░ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņ¦äĒāĢļ░░ņ¢æļ▓Ģņ£╝ļĪ£ ĻĘĀņŻ╝ņŚÉ ņŗ£ļŻīļź╝ ņ▓śļ”¼ĒĢśņŚ¼, ņāØņä▒ļÉ£ ĻĘĀ ĻĄ░ļØĮ(bacteria colony) ņłśļź╝ ļ╣äĻĄÉĒĢśņŚ¼ ĒÅēĻ░ĆĒĢśņśĆļŗż. ļīĆļČĆļČäņØś ņäĖĻĘĀņØĆ ņäĖĻĘĀņØś ņäĖĒżļ▓ĮņŚÉ ņ¢ćņØĆ ĒÄ®Ēŗ░ļÅäĻĖĆļ”¼ņ╣Ė (peptidoglycan) ņĖĄĻ│╝ ņ¦Ćņ¦łļŗ©ļ░▒ņ¦ł ļ░Å ņ¦Ćņ¦łļŗ╣ņ£╝ļĪ£ ĻĄ¼ņä▒ļÉ£ ņÖĖļČĆļ¦ēņØ┤ ņĪ┤ņ×¼ĒĢśļŖö ĻĘĖļ×ī ņØīņä▒ĻĘĀĻ│╝ ņÖĖļČĆļ¦ēņØ┤ ņŚåļŖö ĻĘĖļ×ī ņ¢æņä▒ĻĘĀņ£╝ļĪ£ ļČäļźśļÉĀ ņłś ņ׳ņ£╝ļ®░, paper discļź╝ ņØ┤ņÜ®ĒĢ£ ĒĢ£ņ▓£ļ░░ņ¦ĆĒÖĢņé░ļ▓ĢņØä ĒåĄĒĢ┤ ņČöņČ£ļ¼╝ņØś ĒĢŁĻĘĀņä▒ņØä ĒÖĢņØĖĒ¢łņØä ļĢīņÖĆ ļÅÖņØ╝ĒĢ£ ĻĘĖļ×ī ņØīņä▒ĻĘĀĻ│╝ E.coli ņÖĆ ĻĘĖļ×ī ņ¢æņä▒ĻĘĀ B.subtilis ļæÉ ĻĘĀņŻ╝ņŚÉņä£ ĒĢŁĻĘĀņä▒ņØä ĒÅēĻ░ĆĒĢśņśĆļŗż (Fig. 5). ĻĘĖļ×ī ņØīņä▒ĻĘĀņØĖ E.coliņŚÉ ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝, ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£, ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝, ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ĒĢśņØ┤ļĖīļ”¼ļō£ļź╝ ņ▓śļ”¼ĒĢ£ Ēøä ņāØņä▒ļÉśļŖö ĻĘĀ ĻĄ░ļØĮņłśļź╝ ļ╣äĻĄÉĒĢ£ Ļ▓░Ļ│╝, ņŗ£ļŻīļź╝ ņ▓śļ”¼ĒĢśņ¦Ć ņĢŖņØĆ ļīĆņĪ░ĻĄ░ņŚÉņä£ ņāØņä▒ļÉ£ ĻĘĀ ĻĄ░ļØĮņłśļź╝ 100%ļĪ£ ĒĢśņśĆņØä ļĢī, ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝ņØä ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ 51.6% ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ 11.5%ņØś ĻĘĀ ĻĄ░ļØĮņØ┤ ĒśĢņä▒ļÉśņŚłņØīņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ņØ┤ Ļ▓░Ļ│╝ļŖö ļÅÖņØ╝ĒĢ£ ļåŹļÅäņØś ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśņČöņČ£ļ¼╝ņØä ĒżĒĢ©ĒĢśļŖö ņāśĒöīņØä ņ▓śļ”¼ĒĢśņśĆņØä ļĢī ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ņČöņČ£ļ¼╝ņØä ļŗ┤ņ¦ĆĒĢ£ Ļ▓ĮņÜ░ ļŹö ĒĢŁĻĘĀĒÖ£ņä▒ņØ┤ ņ”ØĻ░ĆĒĢ©ņØä ļéśĒāĆļāäņØä ļ│┤ņŚ¼ņżĆļŗż. E.coliņŚÉ ļīĆĒĢśņŚ¼ ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝Ļ│╝ ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØä ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ 26.0%ņÖĆ 0.38%ņØś ĻĘĀ ĻĄ░ļØĮņØ┤ ņāØņä▒ļÉśņŚłņØīņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ņØ┤ ņŚŁņŗ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ ĒÖöļ¼╝ņŚÉ ņČöņČ£ļ¼╝ņØä ļŗ┤ņ¦ĆĒĢ£ Ļ▓ĮņÜ░ ĒĢŁĻĘĀņä▒ņØ┤ ņ”ØĻ░ĆĒĢĀ ņłś ņ׳ņØīņØä ļéśĒāĆļé┤ņŚłļŗż. ĻĘĖļ×ī ņ¢æņä▒ĻĘĀņØĖ B.subtilis ņŚÉņä£ļŖö ņŗ£ļŻīļź╝ ņ▓śļ”¼ĒĢśņ¦Ć ņĢŖņØĆ ļīĆņĪ░ĻĄ░Ļ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ļ¬®ļŗ©Ēö╝ ņŚ┤ņłśļŖö 10.9%, ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ 0.22%ņØś ĻĘĀ ĻĄ░ļØĮ ĒśĢņä▒ņØä ļ│┤ņśĆņ£╝ļ®░, ļ¬®ļŗ©Ēö╝-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉņä£ ļŹö ļåÆņØĆ ĒĢŁĻĘĀņä▒ņØä ļ│┤ņśĆļŗż. ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝Ļ│╝ ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś Ļ▓ĮņÜ░ņŚÉļÅä ņŗ£ļŻīļź╝ ņ▓śļ”¼ĒĢśņ¦Ć ņĢŖņØĆ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĻĄÉĒĢśņŚ¼ Ļ░üĻ░ü 18.8%ņÖĆ 0%ņØś ĻĘĀ ĻĄ░ļØĮ ĒśĢņä▒ņØä ļ│┤ņśĆņ£╝ļ®░, ļ░▒ņ×æņĢĮ-ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉņä£ ĒĢŁĻĘĀņä▒ņØ┤ ņ”ØĻ░ĆĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņ▓£ņŚ░ņČöņČ£ļ¼╝ņØä ņ×¼Ļ▒┤ļ▓Ģņ£╝ļĪ£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ļŗ┤ņ¦ĆĒĢ£ ļ¬©ļōĀ ņŗ£ļŻīņŚÉņä£ ņ▓£ņŚ░ņČöņČ£ļ¼╝ņØś ņØśĒĢ£ ņäĖĻĘĀņØś ņä▒ņןņØ┤ ņČöņČ£ļ¼╝ļ¦īņØä ņ▓śļ”¼Ē¢łņØä ļĢīļ│┤ļŗż ļŹöņÜ▒ ņל ņ¢ĄņĀ£ļÉ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ļŖö ĒĢŁĻĘĀņä▒ņØä ļ│┤ņ£ĀĒĢśĻ│Ā ņ׳ļŖö ņ¦ÜņŗĀļéśļ¼╝ ņČöņČ£ļ¼╝ņØä ņé░ņ▓śļ”¼ļź╝ ĒåĄĒĢ┤ ļ╣äĒæ£ļ®┤ņĀüĻ│╝ ĻĖ░Ļ│ĄļČĆĒö╝ļź╝ Ļ░£ņäĀĒĢ£ ņĀÉĒåĀĻ┤æļ¼╝ņŚÉ ņČöņČ£ļ¼╝ņØä ļŗ┤ņ¦ĆĒĢ£ ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£, ņČöņČ£ļ¼╝ļ¦īņØä ņ▓śļ”¼ĒĢ£ ĻĘĀņØś Ļ▓ĮņÜ░ļ│┤ļŗż ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ņČöņČ£ļ¼╝ņØä ļŗ┤ņ¦ĆĒĢśņŚ¼ ĻĘĀņŚÉ ņ▓śļ”¼ĒĢśņśĆņØä Ļ▓ĮņÜ░ ĻĘĀņŚÉ ļŹö ņל ļČĆņ░®ĒĢĀ ņłś Ļ░ĆļŖźņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ņśüĒ¢źņ£╝ļĪ£ ĒĢśņØ┤ļĖīļ”¼ļō£Ļ░Ć ļČĆņ░®ļÉ£ ĻĘĀņØś ņŻ╝ņ£äņØś ĒĢŁĻĘĀņä▒ņØä ļé┤ļŖö ņČöņČ£ļ¼╝ ņä▒ļČäņØś ļåŹļÅäĻ░Ć ņāüļīĆņĀüņ£╝ļĪ£ ļåÆņĢäņ¦ĆĻ▓ī ļÉśņ¢┤ ļŹö ļåÆņØĆ ĒĢŁĻĘĀņä▒ņØä ļé╝ ņłś ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.46
Ļ▓░ļĪĀ
ļ│Ė ņŚ░ĻĄ¼ņ¦äņØĆ ļ¬®ļŗ©Ēö╝ņÖĆ ļ░▒ņ×æņĢĮ ņŚ┤ņłśņČöņČ£ļ¼╝ņØ┤ Ļ░¢ļŖö ĒĢŁĻĘĀ ņä▒ļŖźņØś ņ”ØļīĆļź╝ ņ£äĒĢśņŚ¼ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ļ®öļ¬©ļ”¼ĒÜ© Ļ│╝ļź╝ ņØ┤ņÜ®ĒĢ£ ņ×¼Ļ▒┤ļ▓ĢņØä ĒåĄĒĢśņŚ¼ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ļé┤ņŚÉ ņ▓£ņŚ░ņČöņČ£ļ¼╝ņØä ļŗ┤ņ¦ĆĒĢśņśĆļŗż. X-ņäĀ ĒÜīņĀł ļČäņäØņØä ĒåĄĒĢśņŚ¼ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØ┤ ņ×¼Ļ▒┤ļ▓Ģ Ļ│╝ņĀĢņØś ĒĢśļéśņØĖ 400ŌäāņŚÉņä£ņØś ĒĢśņåī Ļ│╝ņĀĢ ņżæ ņĖĄĻ░ä ņØīņØ┤ņś©Ļ│╝ ļ¼╝ļČäņ×ÉĻ░Ć ĻĖ░ĒÖöļÉśĻ│Ā ĻĖłņåŹņłśņé░ĒÖöļ¼╝ņĖĄņØ┤ ĻĖłņåŹņé░ĒÖöļ¼╝ļĪ£ ļ│ĆĒÖöļÉśļ®┤ņä£ ņĖĄņāüĒśĢĻĄ¼ņĪ░Ļ░Ć ļ¼┤ļäłņ¦ĆļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ĻĖłņåŹņé░ĒÖöļ¼╝ņØä ļ¬®ļŗ©Ēö╝ ņČöņČ£ļ¼╝ ļśÉļŖö ļ░▒ņ×æņĢĮ ņČöņČ£ļ¼╝Ļ│╝ ļ░śņØæĒĢśņśĆņØä ļĢī ņĖĄĻ░äņŚÉ ļīĆĻĖ░ņżæņØś Ēāäņé░ņØ┤ņś©ņØ┤ ņéĮņ×ģļÉ£ ņ▒äļĪ£ ņĖĄņāüĒśĢ ĻĄ¼ņĪ░Ļ░Ć ĒÜīļ│ĄļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. ļśÉĒĢ£ ņŻ╝ņé¼ņĀäņ×ÉĒśäļ»ĖĻ▓Į ņśüņāüĻ│╝ Ēæ£ļ®┤ņĀäĒĢś ĒÖĢņØĖņØä ņ£äĒĢ£ ņĀ£ĒāĆņĀäņ£ä ņĖĪņĀĢ ļ░Å ĒĢśņØ┤ļĖīļ”¼ļō£ ļé┤ ļÅÖņØ╝ĒĢśĻ▓ī ļŗ┤ņ¦ĆļÉ£ ņČöņČ£ļ¼╝ ĒĢ©ļ¤ēņØä ĒåĄĒĢśņŚ¼ ĒĢśņØ┤ļĖīļ”¼ļō£ļé┤ ļŗ┤ņ¦ĆļÉ£ ņČöņČ£ļ¼╝ņØ┤ ņ×¼Ļ▒┤Ļ│╝ņĀĢņŚÉņä£ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ ņ×ģņ×ÉļōżņØ┤ ĒśĢņä▒ĒĢśļŖö ņ×ģņ×Éņé¼ņØ┤ņØś Ļ│ĄĻ░ä ļ░Å ņ×ģņ×ÉņØś Ēæ£ļ®┤ņŚÉ ļŗ┤ņ¦ĆļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. ļÅÖņØ╝ĒĢ£ ņČöņČ£ļ¼╝ ĒĢ©ļ¤ēņØś ņČöņČ£ļ¼╝ ņ×Éņ▓┤ņÖĆ ļæÉ Ļ░Ćņ¦Ć ĒĢśņØ┤ļĖīļ”¼ļō£ļź╝ ĻĘĖļ×ī ņØīņä▒ĻĘĀņØĖ E.coliņÖĆ ĻĘĖļ×ī ņ¢æņä▒ĻĘĀņØĖ B.subtilisņŚÉ ņ▓śļ”¼ĒĢśņŚ¼ ņ¦äĒāĢļ░░ņ¢æļ▓Ģņ£╝ļĪ£ ĒĢŁĻĘĀņä▒ļŖźņØä ļ╣äĻĄÉĒĢśņśĆņØä ļĢī, ĒĢśņØ┤ļĖīļ”¼ļō£Ļ░Ć Ļ░¢ļŖö ņ¢æņØś Ēæ£ļ®┤ņĀäĒĢśĻ░Ć ņØīņØś Ēæ£ļ®┤ņĀäĒĢśļź╝ ļØĀļŖö ņäĖĻĘĀņŚÉ ļŹö ņל ļČĆņ░®ļÉśņ¢┤ ņäĖĻĘĀ ņŻ╝ļ│ĆņØś ĒĢŁĻĘĀņä▒ņØä Ļ░¢ļŖö ņČöņČ£ļ¼╝ņØś ļåŹļÅäļź╝ ļåÆņŚ¼ņżīņ£╝ļĪ£ņŹ© ņČöņČ£ļ¼╝ļ¦ī ņ▓śļ”¼ĒĢĀ ļĢīļ│┤ļŗż ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņŚÉ ļŗ┤ņ¦ĆĒĢśņŚ¼ ņ▓śļ”¼ĒĢĀ ļĢī ĒĢŁĻĘĀņä▒ļŖźņØś Ē¢źņāüņØä Ļ░ĆņĀĖņś┤ņØä ĒÖĢņØĖĒĢśņśĆļŗż. ļö░ļØ╝ņä£, ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢśņŚ¼ ĻĖłņåŹņØ┤ņżæņĖĄņłśņé░ĒÖöļ¼╝ņØś ņ×¼Ļ▒┤ļ▓ĢņØä ņØ┤ņÜ®ĒĢ£ ņ▓£ņŚ░ņČöņČ£ļ¼╝ņØś ĒĢŁĻĘĀņåīņ×¼ĒÖöņØś ņŚŁĒĢĀĻ│╝ ņ×Āņ×¼ļĀźņØ┤ ņ׳ņØīņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż.