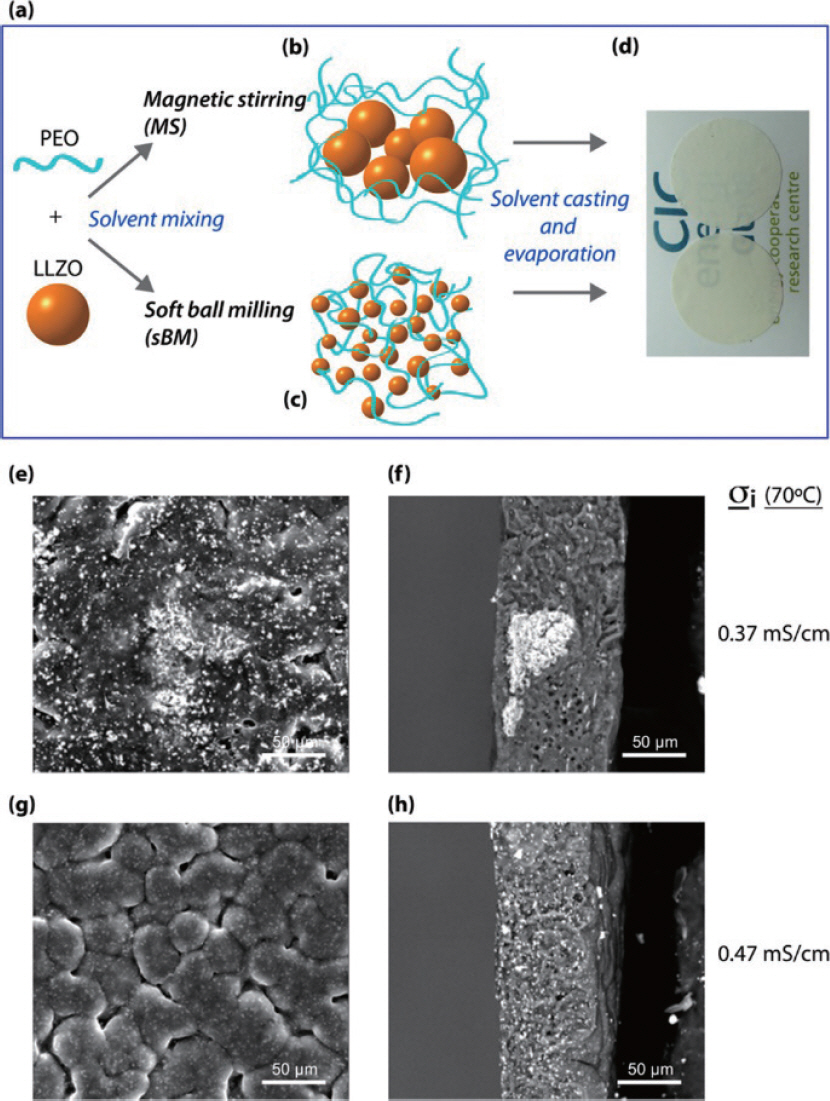
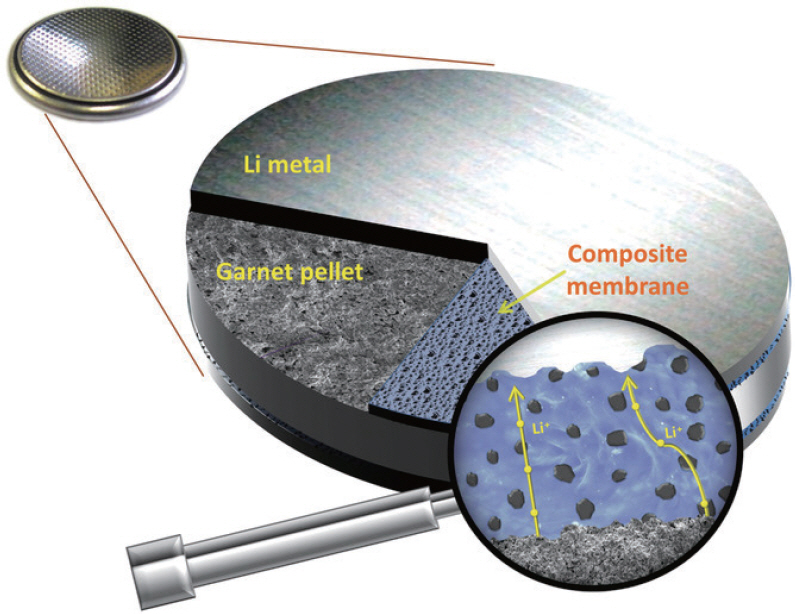
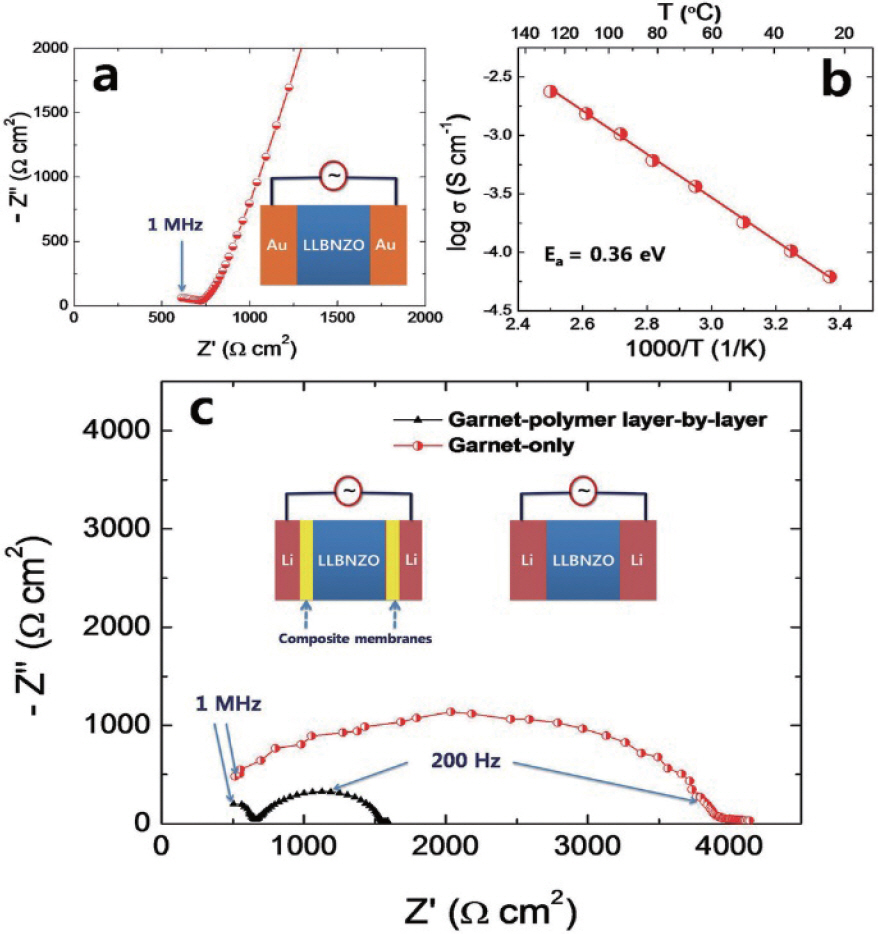
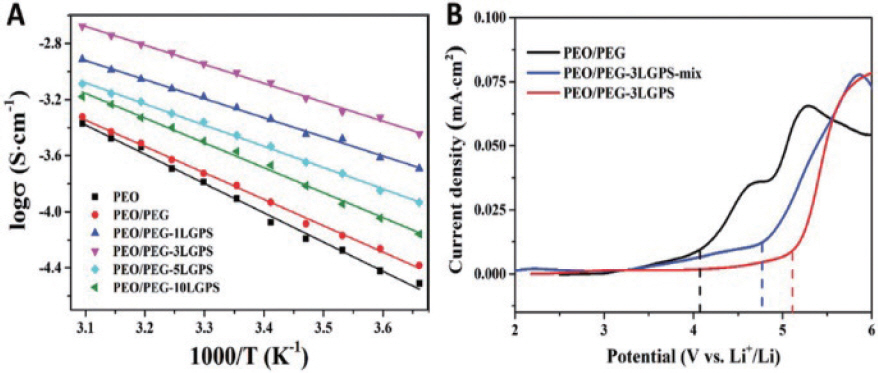
1. H. J. Lee, J. H. Lee, ŌĆ£Review of High Performance Aqueous Rechargeable Batteries Based on Layered Double Hydroxide.ŌĆØ
Ceramist.
24(1): 22ŌĆō34 (2021).

2. J. Kim, J. Oh, Y. Kim Ju, Y.-G. Lee, M. Kim Kwang, ŌĆ£ļ”¼ĒŖ¼ņØ┤ņ░©ņĀäņ¦ĆņÜ® Ļ│Āņ▓┤ ņĀäĒĢ┤ņ¦łņØś ņĄ£ĻĘ╝ ņ¦äņĀäĻ│╝ ņĀäļ¦Ø.ŌĆØ ņĀäĻĖ░ĒÖöĒĢÖĒÜīņ¦Ć. 22(3): 87ŌĆō103 (2019).
3. K.-N. Jung, H.-S. Shin, M.-S. Park, J.-W. Lee, ŌĆ£Solid-State Lithium Batteries: Bipolar Design, Fabrication, and Electrochemistry.ŌĆØ
ChemElectroChem.
6(15): 3842ŌĆō3859 (2019).

4. L. Zhu, J. Li, Y. Jia, P. Zhu, M. Jing, S. Yao, X. Shen, S. Li, F. Tu, ŌĆ£Toward high performance solid-state lithium-ion battery with a promising PEO/PPC blend solid polymer electrolyte.ŌĆØ
Int. J. Energy Res..
44(13): 10168ŌĆō10178 (2020).

5. S. Lee, ŌĆ£Spark Plasma Sintering Technique and Application for All-Solid-State Batteries.ŌĆØ
Ceramist.
22(2): 170ŌĆō181 (2019).

6. W. Zhao, J. Yi, P. He, H. Zhou, ŌĆ£Solid-State Electrolytes for Lithium-Ion Batteries: Fundamentals, Challenges and Perspectives.ŌĆØ
Electrochemical Energy Reviews.
2(4): 574ŌĆō605 (2019).

7. H. Morimoto, H. Awano, J. Terashima, Y. Shindo, S. Nakanishi, N. Ito, K. Ishikawa, S.-I. Tobishima, ŌĆ£Preparation of lithium ion conducting solid electrolyte of NASICON-type Li1+xAlxTi2ŌĆōx(PO4)3 (x = 0.3) obtained by using the mechanochemical method and its application as surface modification materials of LiCoO2 cathode for lithium cell.ŌĆØ
J. Power Sources.
240, 636ŌĆō643 (2013).

8. D. Safanama, N. Sharma, R. P. Rao, H. E. A. Brand, S. Adams, ŌĆ£Structural evolution of NASICON-type Li1+xAlxGe2ŌĆōx(PO4)3 using in situ synchrotron X-ray powder diffraction.ŌĆØ
J. Mater. Chem. A.
4(20): 7718ŌĆō7726 (2016).

9. D. Zhou, D. Shanmukaraj, A. Tkacheva, M. Armand, G. Wang, ŌĆ£Polymer Electrolytes for Lithium-Based Batteries: Advances and Prospects.ŌĆØ
Chem.
5(9): 2326ŌĆō2352 (2019).

10. C. Wang, T. Wang, L. Wang, Z. Hu, Z. Cui, J. Li, S. Dong, X. Zhou, G. Cui, ŌĆ£Differentiated Lithium Salt Design for Multilayered PEO Electrolyte Enables a High-Voltage Solid-State Lithium Metal Battery.ŌĆØ
Adv. Sci..
6(22): 1901036(2019).

11. C.-W. Yi ņä£ņł£ņä▒, K. Kim, ŌĆ£ļ”¼ĒŖ¼ ņØ┤ņ░©ņĀäņ¦ĆņÜ® Ļ│Āņ▓┤ņĀäĒĢ┤ņ¦ł Ļ░£ļ░£ ļÅÖĒ¢ź.ŌĆØ ņĀäĻĖ░ĒÖöĒĢÖĒÜīņ¦Ć. 15(1): 1ŌĆō11 (2012).
12. Z. Xue, D. He, X. Xie, ŌĆ£Poly(ethylene oxide)-based electrolytes for lithium-ion batteries.ŌĆØ
J. Mater. Chem. A.
3(38): 19218ŌĆō19253 (2015).

13. A. Manuel Stephan, ŌĆ£Review on gel polymer electrolytes for lithium batteries.ŌĆØ
Eur. Polym. J..
42(1): 21ŌĆō42 (2006).

14. I. Osada, H. de Vries, B. Scrosati, S. Passerini, ŌĆ£Ionic-Liquid-Based Polymer Electrolytes for Battery Applications.ŌĆØ
Angew. Chem. Int. Ed..
55(2): 500ŌĆō513 (2016).

15. B. De, A. Yadav, S. Khan, K. K. Kar, ŌĆ£A Facile Methodology for the Development of a Printable and Flexible All-Solid-State Rechargeable Battery.ŌĆØ
ACS Appl. Mater. Interfaces.
9(23): 19870ŌĆō19880 (2017).


16. Z. Zhang, Y. Zhao, S. Chen, D. Xie, X. Yao, P. Cui, X. Xu, ŌĆ£An advanced construction strategy of all-solid-state lithium batteries with excellent interfacial compatibility and ultralong cycle life.ŌĆØ
J. Mater. Chem. A.
5(32): 16984ŌĆō16993 (2017).

17. Y.-T. Chen, A. Jena, W. K. Pang, V. K. Peterson, H.-S. Sheu, H. Chang, R.-S. Liu, ŌĆ£Voltammetric Enhancement of Li-Ion Conduction in Al-Doped Li7ŌĆōxLa3Zr2O12 Solid Electrolyte.ŌĆØ
J. Phys. Chem. C.
121(29): 15565ŌĆō15573 (2017).

18. X. Zhang, T. Liu, S. Zhang, X. Huang, B. Xu, Y. Lin, B. Xu, L. Li, C.-W. Nan, Y. Shen, ŌĆ£Synergistic Coupling between Li6.75La3Zr1.75Ta0.25O12 and Poly(vinylidene fluoride) Induces High Ionic Conductivity, Mechanical Strength, and Thermal Stability of Solid Composite Electrolytes.ŌĆØ
J. Am. Chem. Soc..
139(39): 13779ŌĆō13785 (2017).


19. H. Yang, J. Bright, B. Chen, P. Zheng, X. Gao, B. Liu, S. Kasani, X. Zhang, N. Wu, ŌĆ£Chemical interaction and enhanced interfacial ion transport in a ceramic nanofiberŌĆōpolymer composite electrolyte for all-solid-state lithium metal batteries.ŌĆØ
J. Mater. Chem. A.
8(15): 7261ŌĆō7272 (2020).

20. Y. Liang, Z. Lin, Y. Qiu, X. Zhang, ŌĆ£Fabrication and characterization of LATP/PAN composite fiber-based lithium-ion battery separators.ŌĆØ
Electrochim. Acta.
56(18): 6474ŌĆō6480 (2011).

21. D. Zhou, Y.-B. He, R. Liu, M. Liu, H. Du, B. Li, Q. Cai, Q.-H. Yang, F. Kang, ŌĆ£In Situ Synthesis of a Hierarchical All-Solid-State Electrolyte Based on Nitrile Materials for High-Performance Lithium-Ion Batteries.ŌĆØ
Adv. Energy Mater..
5(15): 1500353(2015).

22. T. Janaki Rami Reddy, V. B. S. Achari, A. K. Sharma, V. V. R. Narasimha Rao, ŌĆ£Preparation and electrical characterization of (PVC + KBrO3) polymer electrolytes for solid state battery applications.ŌĆØ
Ionics.
13(6): 435ŌĆō439 (2007).

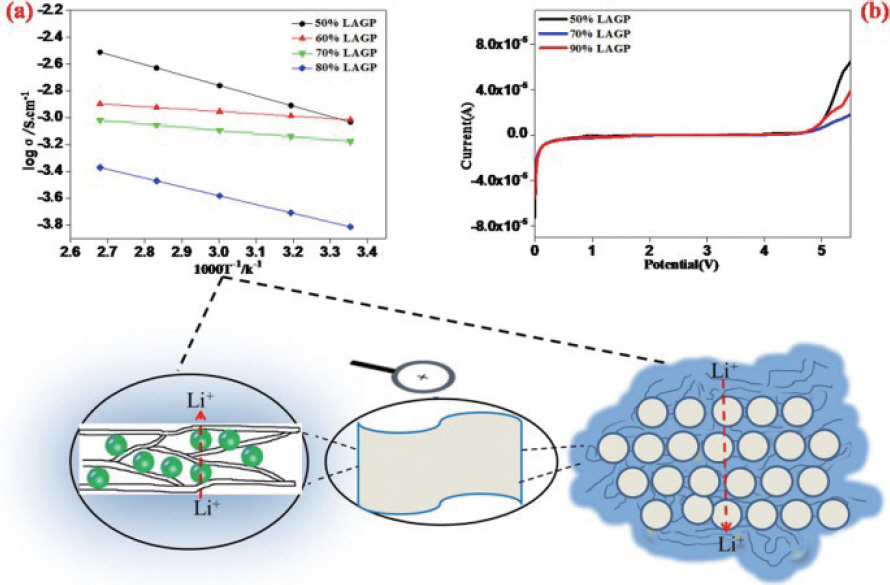
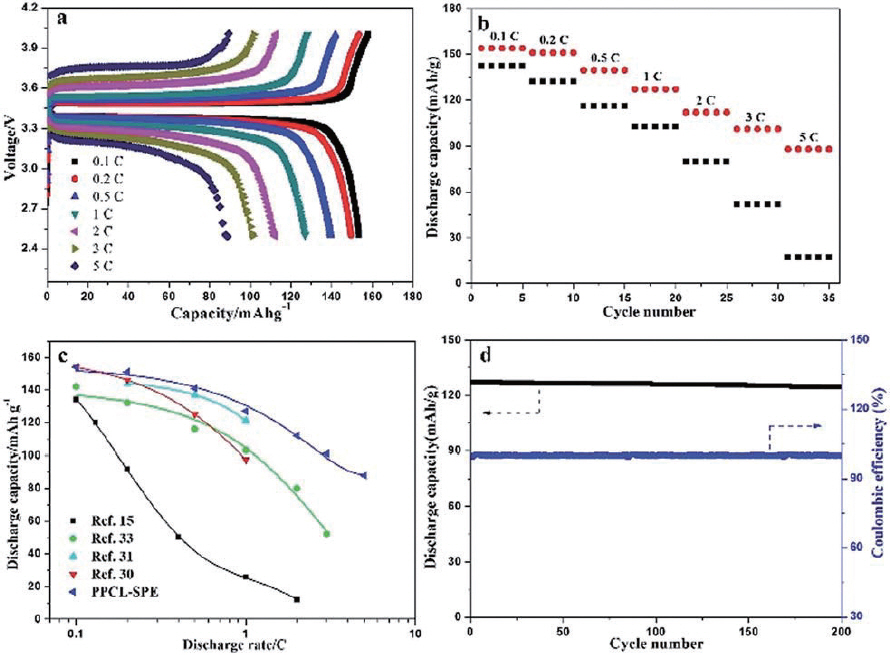
23. J. Bae, Y. Li, F. Zhao, X. Zhou, Y. Ding, G. Yu, ŌĆ£Designing 3D nanostructured garnet frameworks for enhancing ionic conductivity and flexibility in composite polymer electrolytes for lithium batteries.ŌĆØ
Energy Storage Mater..
15, 46ŌĆō52 (2018).

24. S. A. Pervez, P. Ganjeh-Anzabi, U. Farooq, M. Trifkovic, E. P. L. Roberts, V. Thangadurai, ŌĆ£Fabrication of a Dendrite-Free all Solid-State Li Metal Battery via Polymer Composite/Garnet/Polymer Composite Layered Electrolyte.ŌĆØ
Adv. Mater. Interfaces.
6(11): 1900186(2019).

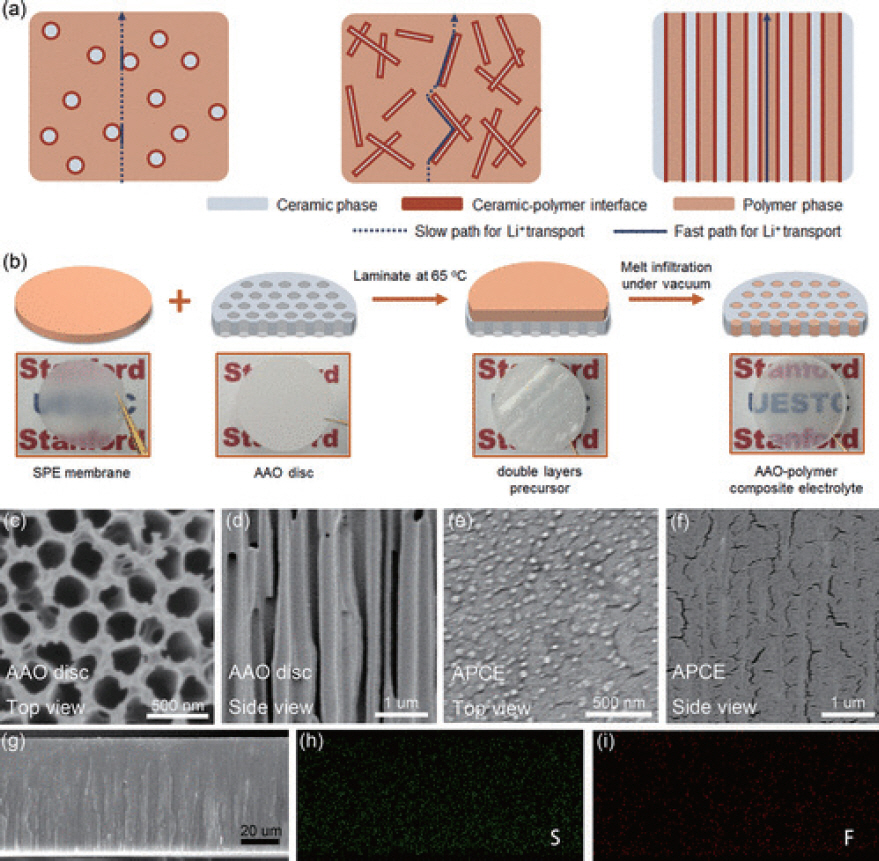
25. X. Zhang, J. Xie, F. Shi, D. Lin, Y. Liu, W. Liu, A. Pei, Y. Gong, H. Wang, K. Liu, Y. Xiang, Y. Cui, ŌĆ£Vertically Aligned and Continuous Nanoscale CeramicŌĆōPolymer Interfaces in Composite Solid Polymer Electrolytes for Enhanced Ionic Conductivity.ŌĆØ
Nano Lett..
18(6): 3829ŌĆō3838 (2018).


26. Z. Xu, T. Yang, X. Chu, H. Su, Z. Wang, N. Chen, B. Gu, H. Zhang, W. Deng, H. Zhang, W. Yang, ŌĆ£Strong Lewis AcidŌĆōBase and Weak Hydrogen Bond Synergistically Enhancing Ionic Conductivity of Poly(ethylene oxide)@SiO2 Electrolytes for a High Rate Capability Li-Metal Battery.ŌĆØ
ACS Appl. Mater. Interfaces.
12(9): 10341ŌĆō10349 (2020).


27. O. L. Kang, A. Ahmad, N. H. Hassan, U. A. Rana, ŌĆ£[MG49-LiClO4]:[TiO2-SiO2] Polymer Electrolytes: In Situ Preparation and Characterization.ŌĆØ
Int. J. Polym. Sci..
2016, 9838067(2016).

28. N. S. T. Do, D. M. Schaetzl, B. Dey, A. C. Seabaugh, S. K. Fullerton-Shirey, ŌĆ£Influence of Fe2O3 Nanofiller Shape on the Conductivity and Thermal Properties of Solid Polymer Electrolytes: Nanorods versus Nanospheres.ŌĆØ
J. Phys. Chem. C.
116(40): 21216ŌĆō21223 (2012).

29. Y. Lin, X. Wang, J. Liu, J. D. Miller, ŌĆ£Natural halloysite nano-clay electrolyte for advanced all-solid-state lithium-sulfur batteries.ŌĆØ
Nano Energy.
31, 478ŌĆō485 (2017).

30. M. Yuan, J. Erdman, C. Tang, H. Ardebili, ŌĆ£High performance solid polymer electrolyte with graphene oxide nanosheets.ŌĆØ
RSC Adv..
4(103): 59637ŌĆō59642 (2014).

31. Z. Yang, Z. Sun, C. Liu, Y. Li, G. Zhou, S. Zuo, J. Wang, W. Wu, ŌĆ£Lithiated nanosheets hybridized solid polymer electrolyte to construct Li+ conduction highways for advanced all-solid-state lithium battery.ŌĆØ
J. Power Sources.
484, 229287(2021).

32. Q. Han, S. Wang, Z. Jiang, X. Hu, H. Wang, ŌĆ£Composite Polymer Electrolyte Incorporating MetalŌĆōOrganic Framework Nanosheets with Improved Electrochemical Stability for All-Solid-State Li Metal Batteries.ŌĆØ
ACS Appl. Mater. Interfaces.
12(18): 20514ŌĆō20521 (2020).


33. G. Wang, P. He, L.-Z. Fan, ŌĆ£Asymmetric Polymer Electrolyte Constructed by MetalŌĆōOrganic Framework for Solid-State, Dendrite-Free Lithium Metal Battery.ŌĆØ
Adv. Funct. Mater..
31(3): 2007198(2021).

34. Q. Pan, D. M. Smith, H. Qi, S. Wang, C. Y. Li, ŌĆ£Hybrid Electrolytes with Controlled Network Structures for Lithium Metal Batteries.ŌĆØ
Adv. Mater..
27(39): 5995ŌĆō6001 (2015).


35. H. Park, E. G. Lee, D. Kim, Y. Kang, S. Choi, ŌĆ£Development of free-standing phosphate/polymer composite electrolyte films for room temperature operating Li+ rechargeable solid-state battery.ŌĆØ
Solid State Ion..
344, 115137(2020).

36. J. Zag├│rski, B. Silv├Īn, D. Saurel, F. Aguesse, A. Llord├®s, ŌĆ£Importance of Composite Electrolyte Processing to Improve the Kinetics and Energy Density of Li Metal Solid-State Batteries.ŌĆØ
ACS Appl. Energy Mater..
3(9): 8344ŌĆō8355 (2020).

37. S. Chen, D. Xie, G. Liu, J. P. Mwizerwa, Q. Zhang, Y. Zhao, X. Xu, X. Yao, ŌĆ£Sulfide solid electrolytes for all-solid-state lithium batteries: Structure, conductivity, stability and application.ŌĆØ
Energy Storage Mater..
14, 58ŌĆō74 (2018).

38. C. Xu, B. Sun, T. Gustafsson, K. Edstr├Čm, D. Brandell, M. Hahlin, ŌĆ£Interface layer formation in solid polymer electrolyte lithium batteries: An XPS study.ŌĆØ
J. Mater. Chem. A.
2(20): 7256ŌĆō7264 (2014).

39. Y. Zhu, X. He, Y. Mo, ŌĆ£Origin of Outstanding Stability in the Lithium Solid Electrolyte Materials: Insights from Thermodynamic Analyses Based on First-Principles Calculations.ŌĆØ
ACS Appl. Mater. Interfaces.
7(42): 23685ŌĆō23693 (2015).


40. V. Thangadurai, S. Narayanan, D. Pinzaru, ŌĆ£Garnet-type solid-state fast Li ion conductors for Li batteries: critical review.ŌĆØ
Chem. Soc. Rev..
43(13): 4714ŌĆō4727 (2014).


41. C. Monroe, J. Newman, ŌĆ£The Impact of Elastic Deformation on Deposition Kinetics at Lithium/Polymer Interfaces.ŌĆØ
J. Electrochem. Soc..
152(2): A396(2005).

42. L. Porz, T. Swamy, B. W. Sheldon, D. Rettenwander, T. Fr├Čmling, H. L. Thaman, S. Berendts, R. Uecker, W. C. Carter, Y.-M. Chiang, ŌĆ£Mechanism of Lithium Metal Penetration through Inorganic Solid Electrolytes.ŌĆØ
Adv. Energy Mater..
7(20): 1701003(2017).

43. L. Cheng, W. Chen, M. Kunz, K. Persson, N. Tamura, G. Chen, M. Doeff, ŌĆ£Effect of Surface Microstructure on Electrochemical Performance of Garnet Solid Electrolytes.ŌĆØ
ACS Appl. Mater. Interfaces.
7(3): 2073ŌĆō2081 (2015).


44. S. Kalnaus, A. S. Sabau, W. E. Tenhaeff, N. J. Dudney, C. Daniel, ŌĆ£Design of composite polymer electrolytes for Li ion batteries based on mechanical stability criteria.ŌĆØ
J. Power Sources.
201, 280ŌĆō287 (2012).

45. L. Chen, Y. Li, S.-P. Li, L.-Z. Fan, C.-W. Nan, J. B. Goodenough, ŌĆ£PEO/garnet composite electrolytes for solid-state lithium batteries: From ŌĆ£ceramic-in-polymerŌĆØ to ŌĆ£polymer-in-ceramicŌĆØ.ŌĆØ
Nano Energy.
46, 176ŌĆō184 (2018).

46. S.-S. Chi, Y. Liu, N. Zhao, X. Guo, C.-W. Nan, L.-Z. Fan, ŌĆ£Solid polymer electrolyte soft interface layer with 3D lithium anode for all-solid-state lithium batteries.ŌĆØ
Energy Storage Mater..
17, 309ŌĆō316 (2019).

47. F. Chen, D. Yang, W. Zha, B. Zhu, Y. Zhang, J. Li, Y. Gu, Q. Shen, L. Zhang, D. R. Sadoway, ŌĆ£Solid polymer electrolytes incorporating cubic Li7La3Zr2O12 for all-solid-state lithium rechargeable batteries.ŌĆØ
Electrochim. Acta.
258, 1106ŌĆō1114 (2017).

48. C. Yan, P. Zhu, H. Jia, J. Zhu, R. K. Selvan, Y. Li, X. Dong, Z. Du, I. Angunawela, N. Wu, M. Dirican, X. Zhang, ŌĆ£High-Performance 3-D Fiber Network Composite Electrolyte Enabled with Li-Ion Conducting Nanofibers and Amorphous PEO-Based Cross-Linked Polymer for Ambient All-Solid-State Lithium-Metal Batteries.ŌĆØ
Advanced Fiber Materials.
1(1): 46ŌĆō60 (2019).

49. M. J. Palmer, S. Kalnaus, M. B. Dixit, A. S. Westover, K. B. Hatzell, N. J. Dudney, X. C. Chen, ŌĆ£A three-dimensional interconnected polymer/ceramic composite as a thin film solid electrolyte.ŌĆØ
Energy Storage Mater..
26, 242ŌĆō249 (2020).

50. X. Wang, H. Zhai, B. Qie, Q. Cheng, A. Li, J. Borovilas, B. Xu, C. Shi, T. Jin, X. Liao, Y. Li, X. He, S. Du, Y. Fu, M. Dontigny, K. Zaghib, Y. Yang, ŌĆ£Rechargeable solid-state lithium metal batteries with vertically aligned ceramic nanoparticle/polymer composite electrolyte.ŌĆØ
Nano Energy.
60, 205ŌĆō212 (2019).

51. L. Zhu, P. Zhu, Q. Fang, M. Jing, X. Shen, L. Yang, ŌĆ£A novel solid PEO/LLTO-nanowires polymer composite electrolyte for solid-state lithium-ion battery.ŌĆØ
Electrochim. Acta.
292, 718ŌĆō726 (2018).

52. L. Zhu, P. Zhu, S. Yao, X. Shen, F. Tu, ŌĆ£High-performance solid PEO/PPC/LLTO-nanowires polymer composite electrolyte for solid-state lithium battery.ŌĆØ
Int. J. Energy Res..
43(9): 4854ŌĆō4866 (2019).

53. H. Al-Salih, A. Huang, C.-H. Yim, A. I. Freytag, G. R. Goward, E. Baranova, Y. Abu-Lebdeh, ŌĆ£A Polymer-Rich Quaternary Composite Solid Electrolyte for Lithium Batteries.ŌĆØ
J. Electrochem. Soc..
167(7): 070557(2020).

54. N. Kamaya, K. Homma, Y. Yamakawa, M. Hirayama, R. Kanno, M. Yonemura, T. Kamiyama, Y. Kato, S. Hama, K. Kawamoto, A. Mitsui, ŌĆ£A lithium superionic conductor.ŌĆØ
Nat. Mater..
10(9): 682ŌĆō686 (2011).


55. Y. Zhao, C. Wu, G. Peng, X. Chen, X. Yao, Y. Bai, F. Wu, S. Chen, X. Xu, ŌĆ£A new solid polymer electrolyte incorporating Li10GeP2S12 into a polyethylene oxide matrix for all-solid-state lithium batteries.ŌĆØ
J. Power Sources.
301, 47ŌĆō53 (2016).

56. K. Pan, L. Zhang, W. Qian, X. Wu, K. Dong, H. Zhang, S. Zhang, ŌĆ£A Flexible Ceramic/Polymer Hybrid Solid Electrolyte for Solid-State Lithium Metal Batteries.ŌĆØ
Adv. Mater..
32(17): 2000399(2020).

57. Z. Gadjourova, Y. G. Andreev, D. P. Tunstall, P. G. Bruce, ŌĆ£Ionic conductivity in crystalline polymer electrolytes.ŌĆØ
Nature.
412(6846): 520ŌĆō523 (2001).


58. C. Zhang, S. Gamble, D. Ainsworth, A. M. Z. Slawin, Y. G. Andreev, P. G. Bruce, ŌĆ£Alkali metal crystalline polymer electrolytes.ŌĆØ
Nat. Mater..
8(7): 580ŌĆō584 (2009).


59. H. T. T. Le, D. T. Ngo, R. S. Kalubarme, G. Cao, C.-N. Park, C.-J. Park, ŌĆ£Composite Gel Polymer Electrolyte Based on Poly(vinylidene fluoride-hexafluoropropylene) (PVDF-HFP) with Modified Aluminum-Doped Lithium Lanthanum Titanate (A-LLTO) for High-Performance Lithium Rechargeable Batteries.ŌĆØ
ACS Appl. Mater. Interfaces.
8(32): 20710ŌĆō20719 (2016).


60. T. Liu, Z. Chang, Y. Yin, K. Chen, Y. Zhang, X. Zhang, ŌĆ£The PVDF-HFP gel polymer electrolyte for Li-O2 battery.ŌĆØ
Solid State Ion..
318, 88ŌĆō94 (2018).

61. S. M. Cho, J. Shim, S. H. Cho, J. Kim, B. D. Son, J.-C. Lee, W. Y. Yoon, ŌĆ£Quasi-Solid-State Rechargeable LiŌĆōO2 Batteries with High Safety and Long Cycle Life at Room Temperature.ŌĆØ
ACS Appl. Mater. Interfaces.
10(18): 15634ŌĆō15641 (2018).


62. Q. Guo, Y. Han, H. Wang, S. Xiong, Y. Li, S. Liu, K. Xie, ŌĆ£New Class of LAGP-Based Solid Polymer Composite Electrolyte for Efficient and Safe Solid-State Lithium Batteries.ŌĆØ
ACS Appl. Mater. Interfaces.
9(48): 41837ŌĆō41844 (2017).


63. Q. Liu, Y. Liu, X. Jiao, Z. Song, M. Sadd, X. Xu, A. Matic, S. Xiong, J. Song, ŌĆ£Enhanced ionic conductivity and interface stability of hybrid solid-state polymer electrolyte for rechargeable lithium metal batteries.ŌĆØ
Energy Storage Mater..
23, 105ŌĆō111 (2019).

64. J. Hu, P. He, B. Zhang, B. Wang, L.-Z. Fan, ŌĆ£Porous film host-derived 3D composite polymer electrolyte for high-voltage solid state lithium batteries.ŌĆØ
Energy Storage Mater..
26, 283ŌĆō289 (2020).

65. J. Zhang, X. Zang, H. Wen, T. Dong, J. Chai, Y. Li, B. Chen, J. Zhao, S. Dong, J. Ma, L. Yue, Z. Liu, X. Guo, G. Cui, L. Chen, ŌĆ£High-voltage and free-standing poly(propylene carbonate)/Li6.75La3Zr1.75Ta0.25O12 composite solid electrolyte for wide temperature range and flexible solid lithium ion battery.ŌĆØ
J. Mater. Chem. A.
5(10): 4940ŌĆō4948 (2017).

66. J. Zhou, P. S. Fedkiw, ŌĆ£Ionic conductivity of composite electrolytes based on oligo(ethylene oxide) and fumed oxides.ŌĆØ
Solid State Ion..
166(3): 275ŌĆō293 (2004).

67. W. Liu, D. Lin, J. Sun, G. Zhou, Y. Cui, ŌĆ£Improved Lithium Ionic Conductivity in Composite Polymer Electrolytes with Oxide-Ion Conducting Nanowires.ŌĆØ
ACS Nano.
10(12): 11407ŌĆō11413 (2016).


68. L. Wang, W. Yang, J. Wang, D. G. Evans, ŌĆ£New nanocomposite polymer electrolyte comprising nanosized ZnAl2O4 with a mesopore network and PEO-LiClO4.ŌĆØ
Solid State Ion..
180(4): 392ŌĆō397 (2009).

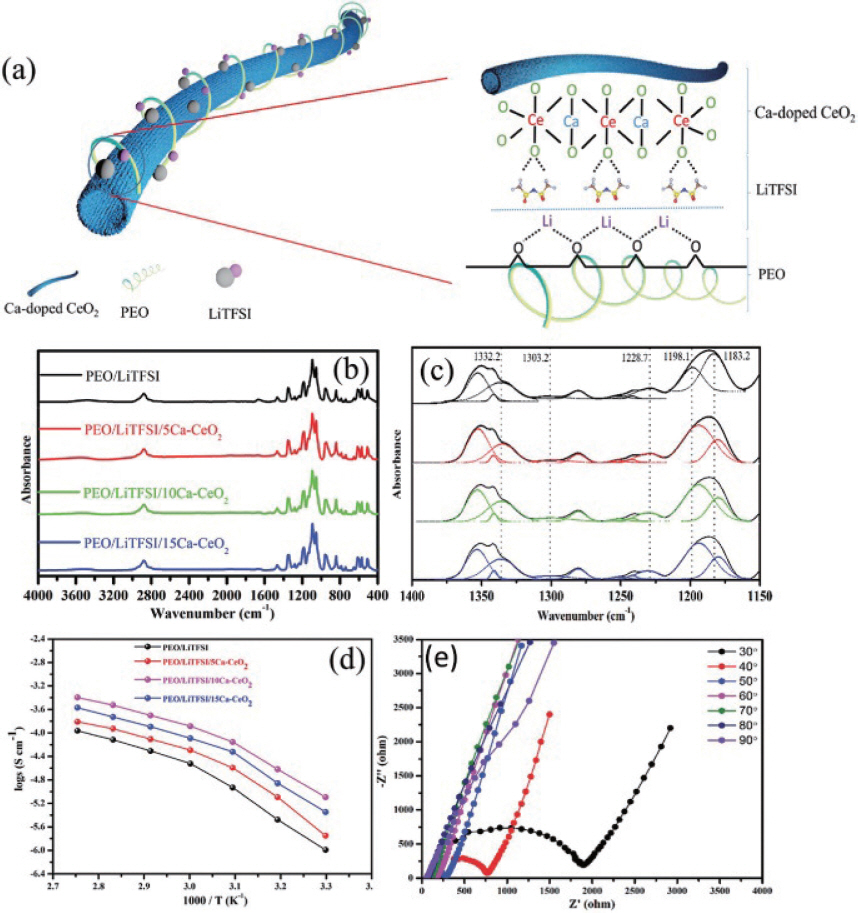
69. H. Chen, D. Adekoya, L. Hencz, J. Ma, S. Chen, C. Yan, H. Zhao, G. Cui, S. Zhang, ŌĆ£Stable Seamless Interfaces and Rapid Ionic Conductivity of CaŌĆōCeO2/LiTFSI/PEO Composite Electrolyte for High-Rate and High-Voltage All-Solid-State Battery.ŌĆØ
Adv. Energy Mater..
10(21): 2000049(2020).

70. X. Chen, G. Li, Y. Su, X. Qiu, L. Li, Z. Zou, ŌĆ£Synthesis and room-temperature ferromagnetism of CeO2nanocrystals with nonmagnetic Ca2+doping.ŌĆØ
Nanotechnology.
20(11): 115606(2009).


71. Z. Wei, Y. Ren, M. Wang, J. He, W. Huo, H. Tang, ŌĆ£Improving the Conductivity of Solid Polymer Electrolyte by Grain Reforming.ŌĆØ
Nanoscale Res. Lett..
15(1): 122(2020).



72. C. Niu, J. Liu, G. Chen, C. Liu, T. Qian, J. Zhang, B. Cao, W. Shang, Y. Chen, J. Han, J. Du, Y. Chen, ŌĆ£Anion-regulated solid polymer electrolyte enhances the stable deposition of lithium ion for lithium metal batteries.ŌĆØ
J. Power Sources.
417, 70ŌĆō75 (2019).

73. M. M. Abutalib, A. Rajeh, ŌĆ£Structural, thermal, optical and conductivity studies of Co/ZnO nanoparticles doped CMC polymer for solid state battery applications.ŌĆØ
Polym. Test..
91, 106803(2020).

74. R. Alves, J. P. Donoso, C. J. Magon, I. D. A. Silva, A. Pawlicka, M. M. Silva, ŌĆ£Solid polymer electrolytes based on chitosan and europium triflate.ŌĆØ
J. Non-Cryst. Solids.
432, 307ŌĆō312 (2016).

75. I. Dueramae, M. Okhawilai, P. Kasemsiri, H. Uyama, R. Kita, ŌĆ£Properties enhancement of carboxymethyl cellulose with thermo-responsive polymer as solid polymer electrolyte for zinc ion battery.ŌĆØ
Sci. Rep..
10(1): 12587(2020).



76. B. Gilbert, R. K. Ono, K. A. Ching, C. S. Kim, ŌĆ£The effects of nanoparticle aggregation processes on aggregate structure and metal uptake.ŌĆØ
J. Colloid Interface Sci..
339(2): 285ŌĆō295 (2009).


77. Z. Wang, S. Wang, A. Wang, X. Liu, J. Chen, Q. Zeng, L. Zhang, W. Liu, L. Zhang, ŌĆ£Covalently linked metalŌĆōorganic framework (MOF)-polymer all-solid-state electrolyte membranes for room temperature high performance lithium batteries.ŌĆØ
J. Mater. Chem. A.
6(35): 17227ŌĆō17234 (2018).

78. W. Wieczorek, J. R. Stevens, Z. Florja┼äczyk, ŌĆ£Composite polyether based solid electrolytes. The Lewis acid-base approach.ŌĆØ
Solid State Ion..
85(1): 67ŌĆō72 (1996).

79. S. Suriyakumar, S. Gopi, M. Kathiresan, S. Bose, E. B. Gowd, J. R. Nair, N. Angulakshmi, G. Meligrana, F. Bella, C. Gerbaldi, A. M. Stephan, ŌĆ£Metal organic framework laden poly(ethylene oxide) based composite electrolytes for all-solid-state Li-S and Li-metal polymer batteries.ŌĆØ
Electrochim. Acta.
285, 355ŌĆō364 (2018).

80. J.-F. Wu, X. Guo, ŌĆ£MOF-derived nanoporous multifunctional fillers enhancing the performances of polymer electrolytes for solid-state lithium batteries.ŌĆØ
J. Mater. Chem. A.
7(6): 2653ŌĆō2659 (2019).

81. C. Yuan, J. Li, P. Han, Y. Lai, Z. Zhang, J. Liu, ŌĆ£Enhanced electrochemical performance of poly(ethylene oxide) based composite polymer electrolyte by incorporation of nano-sized metal-organic framework.ŌĆØ
J. Power Sources.
240, 653ŌĆō658 (2013).

82. H. Huo, B. Wu, T. Zhang, X. Zheng, L. Ge, T. Xu, X. Guo, X. Sun, ŌĆ£Anion-immobilized polymer electrolyte achieved by cationic metal-organic framework filler for dendrite-free solid-state batteries.ŌĆØ
Energy Storage Mater..
18, 59ŌĆō67 (2019).

83. G. Zhang, Y.-L. Hong, Y. Nishiyama, S. Bai, S. Kitagawa, S. Horike, ŌĆ£Accumulation of Glassy Poly(ethylene oxide) Anchored in a Covalent Organic Framework as a Solid-State Li+ Electrolyte.ŌĆØ
J. Am. Chem. Soc..
141(3): 1227ŌĆō1234 (2019).


84. W. Sun, J. Zhang, M. Xie, D. Lu, Z. Zhao, Y. Li, Z. Cheng, S. Zhang, H. Chen, ŌĆ£Ultrathin Aramid/COF Heterolayered Membrane for Solid-State Li-Metal Batteries.ŌĆØ
Nano Lett..
20(11): 8120ŌĆō8126 (2020).


85. D. Dong, H. Zhang, B. Zhou, Y. Sun, H. Zhang, M. Cao, J. Li, H. Zhou, H. Qian, Z. Lin, H. Chen, ŌĆ£Porous covalent organic frameworks for high transference number polymer-based electrolytes.ŌĆØ
ChemComm.
55(10): 1458ŌĆō1461 (2019).

86. Z. Zhang, Y. Huang, H. Gao, C. Li, J. Huang, P. Liu, ŌĆ£3D glass fiber cloth reinforced polymer electrolyte for solid-state lithium metal batteries.ŌĆØ
J. Membr. Sci..
621, 118940(2021).

87. C. Zuo, M. Yang, Z. Wang, K. Jiang, S. Li, W. Luo, D. He, C. Liu, X. Xie, Z. Xue, ŌĆ£Cyclophosphazene-based hybrid polymer electrolytes obtained via epoxyŌĆōamine reaction for high-performance all-solid-state lithium-ion batteries.ŌĆØ
J. Mater. Chem. A.
7(32): 18871ŌĆō18879 (2019).

88. Y. Li, Z. Sun, D. Liu, S. Lu, F. Li, G. Gao, M. Zhu, M. Li, Y. Zhang, H. Bu, Z. Jia, S. Ding, ŌĆ£Bacterial Cellulose Composite Solid Polymer Electrolyte With High Tensile Strength and Lithium Dendrite Inhibition for Long Life Battery.ŌĆØ
Energy Environ. Mater.
0, 1ŌĆō10 (2020).

89. E. Caldeweyher, S. Ehlert, A. Hansen, H. Neugebauer, S. Spicher, C. Bannwarth, S. Grimme, ŌĆ£A generally applicable atomic-charge dependent London dispersion correction.ŌĆØ
J. Chem. Phys..
150(15): 154122(2019).


90. F. Croce, S. D. Brown, S. G. Greenbaum, S. M. Slane, M. Salomon, ŌĆ£Lithium-7 NMR and ionic conductivity studies of gel electrolytes based on polyacrylonitrile.ŌĆØ
Chem. Mater..
5(9): 1268ŌĆō1272 (1993).

91. K. Xu, ŌĆ£Electrolytes and Interphases in Li-Ion Batteries and Beyond.ŌĆØ
Chem. Rev..
114(23): 11503ŌĆō11618 (2014).


92. P.-J. Alarco, Y. Abu-Lebdeh, A. Abouimrane, M. Armand, ŌĆ£The plastic-crystalline phase of succinonitrile as a universal matrix for solid-state ionic conductors.ŌĆØ
Nat. Mater..
3(7): 476ŌĆō481 (2004).