모델 전기화학 셀을 이용한 고체산화물 연료전지 연료극 반응 연구
A Review of Electrochemical Cells with Geometrically Well-defined Interfaces for Solid Oxide Fuel Cell Anodes
Article information
Trans Abstract
A solid oxide fuel cell (SOFC) is a high-temperature (above 750℃) energy conversion device that generates electricity with high efficiency and low CO2 emission. It is essential to develop high-activity electrodes for its commercialization by lowering the operating temperature to below 700℃. Understanding the electrode reaction kinetics can provide fundamental insights for the rational design of high-performance electrodes. However, the three-dimensional porous microstructures of the SOFC electrodes make it difficult to analyze the reaction processes precisely. To overcome this issue associated with the conventional electrodes, the model electrodes with geometrically well-defined interfaces have been widely employed. In this paper, focusing on the SOFC anodes, the fabrication techniques, cell types, analysis tools, and the modeling studies in the literature will be reviewed.
1. 서론
연료전지 (Fuel cell)는 연료의 화학에너지를 전기에너지로 직접 변환시키는 에너지 변환 장치로, 일반적인 카르노식 열기관의 효율 한계를 극복하여 고효율 전기 생산이 가능하고 공해 문제로부터 크게 자유로운 친환경 발전 장치이다.[1] 특히 750℃ 이상의 온도에서 작동하는 것을 특징으로 하는 고체산화물 연료전지 (solid oxide fuel cell, SOFC)는 높은 전기효율과 생성된 과잉열을 열병합 발전에 활용할 경우 전체 효율이 80% 이상으로 증가시키는 것이 가능하다.[2,3] 또한 내부 개질을 통해 천연가스, 바이오매스 등의 연료를 직접 주입하여 운전할 경우 연료전지의 이상적인 연료인 수소 공급이 경제성을 지니기 전 현재의 인프라 기반의 고효율 발전을 통해 경제적 이익을 제공하고 환경오염을 최소화할 수 있다는 점에서 많은 관심을 받고 있다.[4–6]
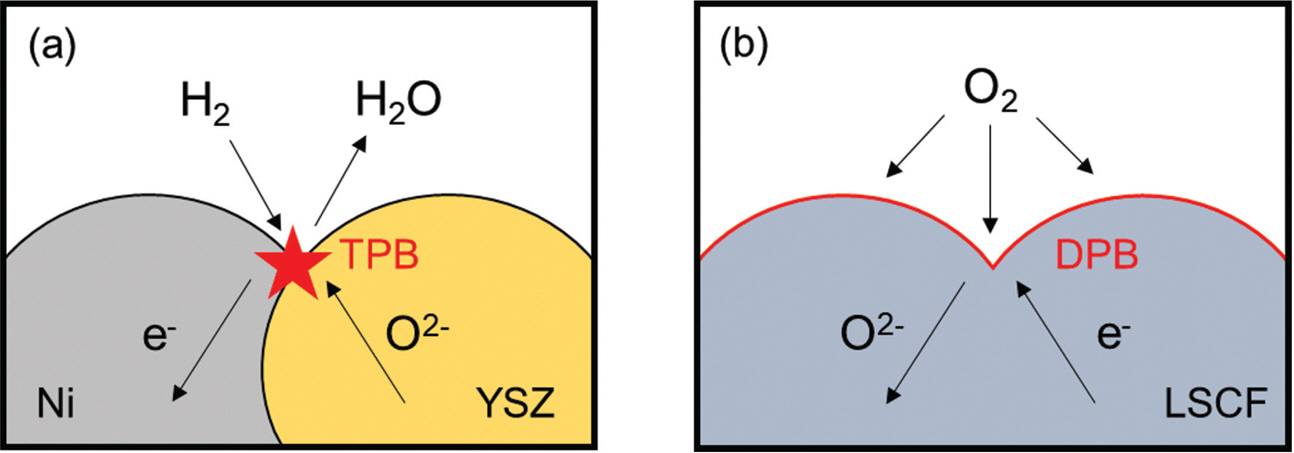
일반적으로 SOFC는 주로 산소이온 (O2-) 전도성 Y 안정화 지르코니아 (Yttria-stabilized ZrO2, YSZ)나 Gd이 첨가된 세리아 (Gd-doped CeO2, GDC) 등의 고체산화물 전해질을 기반으로, 전해질 양면에 각각 연료와 공기가 주입되는 연료극과 공기극으로 구성되어 있다. Fig. 1에 보이는 바와 같이 SOFC의 작동은 각 전극에서의 연료의 산화반응 식 (1)과 공기의 환원반응 식 (2), 그리고 전해질을 통한 공기극으로부터 연료극으로의 O2-의 전도 및 외부 도선을 따라 연료극으로부터 공기극으로의 e- 흐름을 통해 최종적으로 전기와 물, 그리고 열을 생성함으로써 이루어진다 식 (3).
SOFC의 상용화를 위한 주요 연구개발 방향 중 하나는 작동온도를 중저온 (500-700℃)영역대로 낮추는 것으로, 이는 고온의 환경이 열화학 내구성이 높은 고가의 소재를 사용하도록 제한하고 열화로 인한 장기 수명 문제를 야기함과 함께 전반적인 시스템 제작·운영을 더욱 복잡하게 하여 가격을 상승시키기 때문이다.[7] 그러나 SOFC의 작동온도가 낮아짐에 따라 열적 활성 과정인 이온 물질 전달과 전극 표면 반응 속도가 크게 저하되어 그 성능이 급격히 감소되는 문제가 발생한다.[8–10] 특히 상대적으로 큰 활성화에너지 (activation energy, EA)를 갖는 전극 분극 저항 (electrode polarization resistance, RP)으로 인해 중저온 영역에서 전극의 성능이 전체 SOFC의 성능에 큰 영향을 미친다. 뿐만 아니라 전극 지지형 셀을 활용하여 전해질의 두께를 수 ㎛까지 낮출 수 있게 되면서 고성능의 SOFC 전극을 개발하는 것이 관련 연구에서 작동온도를 낮추는 데 더욱 중요한 역할을 하게 되었다.
이러한 관점에서 전극에서 발생하는 전기화학 반응을 심도 있게 이해하는 것은 수많은 실험적 시행착오로부터 벗어나 고성능 SOFC 전극 설계를 위한 근본적인 통찰력을 제공할 수 있기 때문에 매우 중요하다. 그러나 위 반응식 1과 2를 통해 표현된 바와 같이 각 전극 반응에는 기체 분자, 이온, 그리고 전자가 동시에 수반될 뿐만 아니라 실제로는 여러 기본 단계 (elementary step)로 복잡하게 진행되므로 이를 정확히 이해하는 것이 매우 어렵다. 또한 전극은 높은 전기화학적 성능을 얻기 위해 각 물질을 빠르게 운반할 수 있는 전도성 소재들의 3차원 다공성의 구조로 구성되어 있기 때문에 실제 반응이 일어나는 활성 영역을 정량적으로 파악하거나 활성 반응 영역에서의 반응 과정만을 선택적으로 관찰하는 것이 더욱 어렵다.
지난 수십년간 많은 연구자들은 이 문제를 극복하여 실험적으로 전극 반응 매커니즘을 규명하고 성능 향상을 위한 이론적 근거들을 제시하기 위한 다양한 연구들을 수행해왔다. 한 가지 유용한 접근법은 구조적으로 잘 제어된, 단순화된 계면을 갖는 전극을 이용한 모델링 연구이다.[11] 단순화된 전극 구조를 활용할 경우 활성 계면을 정량적으로 파악하는 것이 가능하고, 전극 반응에 참여하는 물질 전달을 단순화하거나 전극 전반에 걸쳐 균일하게 함으로써 일반적인 전극 내 불균일한 구조적 인자로 인해 본질적으로 발생하는 실험적 오차로부터 자유로워질 수 있다. 본 투고문에서는 실제 SOFC의 연료극을 모사한 모델 전극 기반의 전기화학 셀에 대하여 구조, 제작 방법, 그리고 이를 다양한 분석 기법과 결합함으로써 전극 소재 특성을 명확히 파악하거나 반응에 대한 속도 결정단계 등을 규명하는 연구 사례들을 정리하고 소개하고자 한다.
2. 모델 전기화학 셀
2.1. SOFC 전극의 활성 계면
전극 소재가 어떤 전하 운반체 (charge carrier)를 전달하는가에 따라 달라지는 전극 반응의 주요 활성 계면을 분류하여 이해하는 것은 모델 전기화학 셀을 어떻게 설계·제작·분석할 것인지를 결정하는 데 중요이다.[12] 먼저 일반적으로 전극은 순수 산소이온 전도성 물질 (pure ionic conductor)과 순수 전자 전도성 물질 (pure electronic conductor)의 복합체로 구성할 수 있는데, 전자의 경우 대게 전해질과 동일한 조성의 금속 산화물이고 후자의 경우는 환원분위기의 연료극에서는 금속, 산화분위기의 공기극에서는 페로브스카이트 (perovskite)계 금속 산화물이 각각 주로 사용되고 있다. 예를 들어, SOFC의 가장 일반적인 연료극은 순수 산소 이온 전도성 YSZ 전해질과 전자 전도성 Ni 금속의 복합체로 구성되어 있다 (Ni-YSZ cermet).[15] 따라서 이 경우 전기화학적 반응은 연료 기체와 YSZ 그리고 Ni 의 세 가지 상이 동시에 만나는 3상계면 (triple-phase boundary, TPB)에서 발생한다 (Fig. 2a). 한편 일부 소재들로부터 산소이온과 전자를 동시에 운반할 수 있는 혼합전도 특성이 보고되었으며, 이러한 혼합전도성 산화물 (mixed ionic and electronic conductor, MIEC) 기반의 전극이 많은 주목을 받고 있다. MIEC 기반의 전극에서는 전기화학 반응이 소재 표면 전체, 즉 기체와 전극이 만나는 2상계면 (double-phase boundary, DPB)에서 발생하게 되어 훨씬 많은 활성 계면을 제공할 수 있기 때문이다 (Fig. 2b). 연료극의 Gd 또는 Sm-doped CeO2, 공기극의 La0.6 Sr0.4 Co0.2 Fe0.8 O3-δ (LSCF), Ba0.5 Sr0.5 Co0.8 Fe0.2 O3-δ (BSCF), PrBaCo2-x Fex O5+δ (PBCF) 등의 페로브스카이트계 소재가 대표적인 MIEC 의 예이다.[13–15]
2.2. 모델 전기화학 셀의 제작 기법
실제 매우 복잡한 전극을 단순화하여 구현하기 위해 가장 널리 활용되는 기술은 박막 증착 공정과 포토리소그래피 (photolithography) 기반의 금속 리프트-오프 (lift-off) 패터닝 공정이다. 먼저 높은 퀄리티의 세라믹 박막을 얻는 것은 모델 전극 연구에서 획득한 정보로부터 소재의 결정구조, 결정성, 변형도 (strain), 결정립계 (grain boundary) 밀도, 표면 특성, 결정면 등의 영향을 다각도로 분석하기 위해 매우 중요하다. 이러한 측면에서 널리 활용되는 대표적인 고품질 세라믹 박막 증착 기법 중 하나는 펄스-레이저 증착법 (pulsed laser deposition, PLD)이다. PLD는 물리 증착법 (physical vapor deposition)의 하나로, 펄스 형태의 엑시머 레이저 (예: KrF 248 nm)를 광학 렌즈를 통해 높은 한 점에 집중시켜 높은 에너지로 세라믹 타겟에 조사함으로써 플라즈마를 발생, 원자, 분자, 이온 또는 작은 입자 등으로 구성된 플라즈마 기둥 (plume)이 맞은 편의 기판에 향하도록 하여 타겟 물질이 기판에 증착되도록 한다 (Fig. 3a). 이때 레이저의 펄스 주기, 펄스 수, 타겟-기판간 거리, 증착 진공도 및 분위기 등의 여러 공정을 제어하여 수 ㎚에서 수 ㎛에 이르는 다양한 두께의 단결정 또는 다결정 세라믹 박막을 획득할 수 있다. 많은 연구에서 PLD를 통해 타겟의 조성과 크게 일치하는 조성의 박막을 얻을 수 있다는 것이 잘 알려져 있다. PLD 외에도 RF 마그네트론 스퍼터링 역시 널리 활용되고 있는 세라믹 증착기법 방법 중 하나이다.

The fabrication techniques for the model electrodes. (a) Schematic illustration of the pulsed-laser deposition (PLD) for the ceramic thin-films, (b) Schematic illustration of the Ni stripe-pattern fabrication using the lift-off process.
Fig. 3b는 Fig. 2a에 나타낸 Ni-YSZ 전극의 3상계면을 모사하기 위한 줄무늬 형태를 갖는 모델 전극을 제작하는 lift-off 공정 과정을 보여준다. Fig.3b의 예는 자외선 노출에 의해 현상액에 녹기 쉽게 화학구조가 변하는 positive 감광액 (photoresist, PR)의 경우이다. 최근에는 0.01 nm 이하의 매우 짧은 파장의 전자 빔을 이용한 전자선 리소그래피 (electron beam lithography) 등의 개발으로 수십 ㎚ 스케일에서 일어나는 현상을 관찰하기 위한 입자 패터닝 등도 활용되고 있다.[16] 즉, 이러한 리소그래피 방식의 패터닝 공정을 활용할 경우 필요에 따라 ㎚에서부터 ㎜ 스케일의 다양한 전극 계면 구현이 가능하다. 정리하면, SOFC 전극에서 일어나는 전기화학 반응을 연구함에 있어 구조적으로 잘 정의된 활성 계면을 갖도록 정교하게 제작된 전극을 포함하는 셀을 모델 전기화학 셀이라고 할 수 있다.
2.3. 모델 전기화학 셀 분석 기법
모델 전기화학 셀과의 조합을 통해 전극 반응 매커니즘 이해에 대한 강력한 실험적 근거들을 제공할 분석기법으로는 분극 곡선 (polarization curve), 교류 임피던스 기법 (AC impedance spectroscopy, ACIS)과 X선 광전자분광기 (X-ray photoelectron spectroscopy) 등이 활용되고 있다. 주로는 반응의 기본 반응 단계들을 구성, 이들 장비를 활용하여 주변 환경 (온도, 가스 조성 (pH2, pH2 O), 인가 과전압 등)이나 모델 전극 구조 (전극의 두께 및 간격) 제어에 따라 변하는 전기화학적 응답 신호나 흡착종 및 전극 조성 변화를 관찰함으로써 가장 유력한 반응속도 결정단계 (rate-determining step, RDS)를 유추하는 방식이 채택되고 있다. 이밖에도 여러 기본 반응 단계를 화학반응의 반응속도 식으로 나타내거나 Butler-Volmer 형태의 일반적인 전기화학 반응속도 식으로 표현하여 분극 곡선이나 임피던스 스팩트럼을 수학적으로 모델링하는 접근법이 모델 전기화학 셀과 결합하여 반응 매커니즘을 밝히는 좋은 궁합으로 적극적으로 활용되고 있다. 이는 거시적 관점에서 벌크나 표면에서의 전극 반응에 수반되는 다양한 물질 전달 과정을 모델링하는 과정이 단순한 구조의 계면을 가정할 뿐만 아니라 가능한 반응 경로를 보다 간결하게 나타낼 수 있으며 필요한 실험적 데이터를 가정 또는 생략하게 함으로써 계산의 정확도를 높이는 데 기인한다. 이어지는 제3장에서는 다양한 구조의 모델 전기화학 셀을 이용하여 연료극 반응을 연구한 몇 가지 대표 사례에 대해 알아보겠다.
3. 모델 전기화학 셀 적용 연구 사례
3.1. Ni-YSZ cermet 연료극
Ni-YSZ cermet은 가장 널리 사용되고 있는 연료극 물질로 모델 전극을 활용하여 H2 또는 CO의 전기화학적 산화 과정에 대한 이해를 목적으로 많은 연구가 수행되어 왔다.[17,18] Fig. 4는 대표적으로 관련 연구에서 Ni 줄무늬 패턴 전극을 이용한 2차원 Ni-YSZ 모델 전극 구조이다. 이러한 전극을 얻기 위해 J. Mizusaki 그룹은 단결정의 YSZ 기판에 포토리소그래피와 ionized cluster beam 증착법을 이용하였다.[19] 그들은 모델 전극이 포함된 3전극 기반의 정상 상태 분극-전류밀도 측정을 통해 700℃에서의 전기화학 반응속도를 실험적으로 pH2, pH2 O및 산소 활동도 (aO)에 대한 수식으로 표현하였고, 결과적으로 니켈 표면에서의 흡착 또는 확산 과정이 속도 결정 단계임을 실험적으로 보였다. J. Gauckler 그룹의 일련의 연구는 또 다른 대표적인 예로,[20,21] 그들은 마찬가지로 줄무늬 Ni 패턴 제작을 통해, Ni의 노출 면적은 동일하되 TPB의 길이만을 0.04 ~ 12.85 m/㎠의 범위를 갖도록 하였다. 이러한 모델 전극을 사용한 임피던스 분석법을 통해 정교하게 제어한 TPB 길이에 선형으로 반비례하는 분극 저항을 확인함으로써 실제 Ni-YSZ-gas 3상계면이 활성 계면임을 명확히 하였다. 또한 그들은 분극 저항 활성화에너지 및 가스 분압에 대한 의존성으로부터 Ni-YSZ에서 일어나는 수소 산화반응 속도를 결정짓는 가장 주요 과정을 수소의 흡·탈착 또는 전해질로부터 산소 이온의 제거 과정임을 제안하였다. 더욱이 이 과정이 H2 O에 의해 어떻게 촉진될 수 있는지 그 매커니즘을 제안하였는데, 연료에 함께 주입하는 H2 O로 인한 연료극 pO2의 증가에도 불구하고 Ni-YSZ cermet 전극의 성능을 향상시키는 현상을 TPB에서 YSZ표면으로의 반응 계면 확대로 설명하였다. 이어 앞서 설명한 J. Gaukler 그룹의 실험 결과를 총 일곱 가지의 서로 다른 반응 경로를 다룬 수학적 계산을 통해 재현 및 비교하는 모델링 연구가 W. G. Bessler그룹에 의해,[22] J. Mizusaki 그룹의 실험 결과를 세 가지 반응 경로로 계산하는 연구가 R. J. Kee 그룹에 의해 각각 수행되었다.[23] 비록 상당히 상이한 실험 결과를 각각 모델링했음에도 그들의 결과를 통해 공통적으로 Ni-YSZ연료극에서 수소의 산화반응이 H spillover 매커니즘으로 설명 가능하다는 사실을 보여주었다.
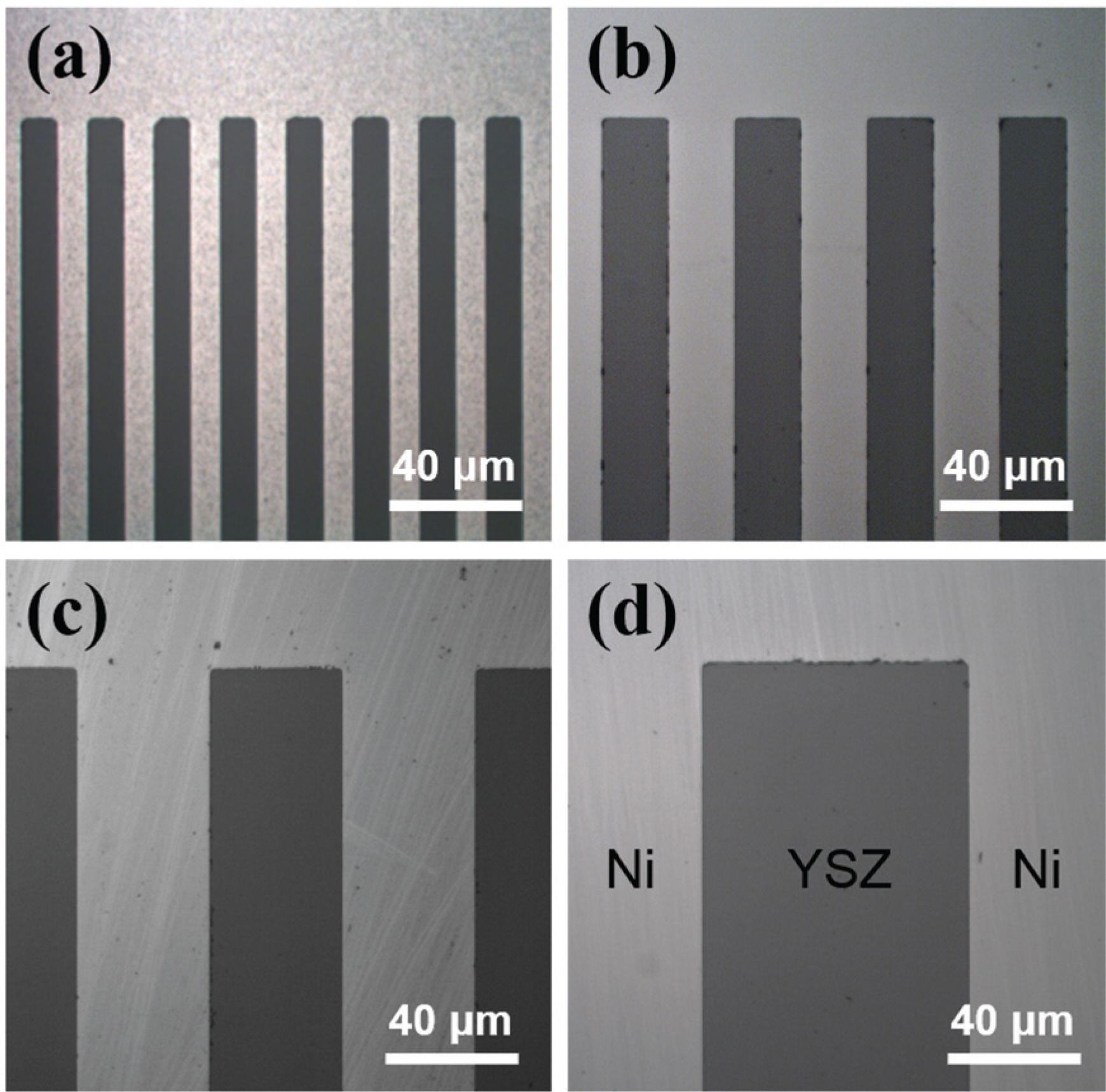
Optical microscope images of the patterned Ni-YSZ model anodes where the widths of Ni and YSZ are (a) 10-10, (b) 20-20, (c) 40-40, and (d) 80-80 ㎛, respectively. The corresponding TPB lengths are (a) 6.448, (b) 3.248, (c) 1.648, and (d) 0.848 m cm-2, respectively, Adapted from Jung et al. Nano Energy 2016;23;161-71, with permission of Elsevier S&T Journals [27]
한편 이러한 모델 전극 구조의 고온환경 구조적 안정성은 정확한 실험을 위해 매우 중요하다. 특히 금속의 응집은 관찰하고자 하는 TPB 길이에 직접적인 영향을 주는 요인이다. 이점에 주목하여 I. Ivers-Tiffeé 그룹은 Ni-YSZ-H2 계면 구조에 대한 가습 및 온도의 영향을 체계적으로 분석하여, 700℃ 이상의 고온 영역에서의 모델 전극 활용을 위해서는 0.8 ㎛ 이상의 Ni 두께를 사용할 것을 제안하였다.[24] 또한 그들은 고온에 노출된 금속 Ni 박막의 구조적 재구성이 수증기를 포함하는 다양한 환경에 크게 의존한다는 점을 들어 초기 제작한 패턴 구조의 TPB 길이와 장기 분석 후 TPB 길이 변화를 감안한 보정 지수 (correction factor) 등을 고려해야 한다고 설명하였다. 이후 E. Croiset은 유사한 연구를 수행하였는데, 다른 두께로 패터닝된 Ni전극에 대한온도 및 가스 환경에서의 미세구조 변화를 관찰하여 가습 환경에서 Ni 응집 가속 현상을 확인하였으며, 안정적 셀 평가를 위해 0.8 ㎛ 두께의 Ni에 대한 750 또는 800℃ 수소 분위기에서의 사전 열처리가 도움을 줄 수 있음을 보였다.[25]
Ni-YSZ 전극에 대한 촉매 도입, 코팅층 도입 등 다양한 표면 처리 기술은 연료극의 성능 또는 내구성을 향상시키기 위해 매우 광범위하게 연구되어 왔다.[26] 그러나 앞서 언급한 바와 같이 Ni-YSZ cermet의 구조적 복잡성으로 인해 도입한 촉매 또는 코팅층의 역할을 정밀하게 분석하는 데에는 한계가 있다. W. Jung은 도입한 Sm-doped CeO2 (SDC) 촉매층의 특성을 Ni-YSZ 자체의 구조적 요인으로부터 배제하여 평가하기 위해 줄무늬 Ni-YSZ 모델 전극을 활용하였으며 (Fig. 5), 이로부터 나노구조 SDC 층의 형상의 영향과 촉매층 도입 전/후의 반응 활성점 변화를 관찰하거나 Ni의 촉매적 기여 없이 SDC 표면에서 수소 또는 메탄의 전기화학적 산화반응이 일어날 수 있다는 사실 등을 확인하였다.[27,28]
3.2. CeO2 전해질 기반 연료극
세리아 (CeO2)는 결정 내 Ce4+를 Sm3+, Gd3+와 같은 억셉터 치환을 통해 산소 기공을 형성, YSZ보다 더 높은 산소 전도도를 갖는 물질로 SOFC 분야에서 활발히 연구되어온 대표적인 소재이다. 특히 세리아는 YSZ 와 달리 고온의 환원분위기에서 Ce4+의 환원으로 형성된 small polaron (Ce3+에 해당)의 hopping을 통해 전자 전도가 가능한 혼합전도 특성을 갖는 것을 특징으로한다.[29] 이는 앞서 2.1장에서 언급한 MIEC에 해당하는 것으로, 연료극에 적용될 경우 세리아 표면 전체가 반응에 참여하는 활성 계면이 되어 우수한 전극 성능을 구현하는 것이 가능하다. 이러한 특성에 대해 S. M. Haile 그룹은 실제로 Fig. 6과 같이 PLD와 금속 lift-off 공정을 이용하여 metal/SDC/gas 3상계면의 밀도 (dTPB)와 SDC/gas 2상계면의 밀도 (dDPB)를 제어한 다양한 모델 전극 구조를 제작하였다.[30] 임피던스 분석을 통해 분극 저항과 계면 밀도와의 상관 관계를 명확히 함으로써 SDC가 포함된 연료극에 대한 지배적인 반응 경로가 SDC 표면임을 증명하였다. 그들의 임피던스 결과는 후에 F. Ciucci 그룹의 2D 수치해석 모델링 의해 매우 일치되게 재현되었으며, SDC의 두께, 금속 패턴 간격 등 모델 전극 구조에 따라 달라지는 임피던스를 산소 결함과 전자의 전달 과정, 표면 반응성 등으로 정량적으로구분함으로써 보다 정확한 연구를 위한 모델 전극 구조 설계의 중요성에 대한 이론적 근거를 제공하였다.[31,32]이후 SDC 표면에서 발생하는 수소 산화/수증기 분해 반응 경로에 대한 반응 매커니즘은 W. Eichhorn 그룹과 W. Chueh 그룹에 의해 서로 다른 구조의 모델 전극과 in operando X-ray photoelectron spectroscopy (XPS)를 이용해 실험적으로 연구되었다. W. Eichhorn 그룹은 Fig. 7a과 같이 in-plane 방향으로 전압을 인가할 수 있는 약 50 ㎚의 두께로 제작된 모델 전극을 제작하였다. 그들은 750℃ 1mbar의 H2/H2 O 가스 환경에서 전압을 인가함에 따라 달라지는 binding energy 이동, Ce4+/Ce3+의 산화 상태를 분석함으로써 금속 전극으로부터 벗어난 약 150㎛의 SDC 활성 영역을 확인하였고, 결과적으로 표면 반응성과 세리아 박막 내 전자의 전달 과정이 동시에 전체 반응 속도를 결정한다는 결과를 발표하였다.[33] 한편 W. Chueh 그룹은 인가된 전압 강하가 오직 SDC/gas 계면에서 발생하도록 하는 표면 반응 지배형 모델 전기화학 셀을 제작하여 정교하게 표면 반응만을 관찰하였다 (Fig. 7b).[34,35] 500℃ 0.3 Torr의 H2/H2 O 가스 환경에서 SDC 표면에서의 전기화학적 수소 산화/수증기 분해 중 산소 이온의 전달이 표면에 응집되어 존재하는 산소 기공을 통해 매우 빠르게 발생한다는 사실을 밝혔으며, 동시에 상대적으로 전자의 전달 과정이 전체 반응 속도를 결정한다는 실험적 근거를 제시하였다.

Schematics depicting the two reaction sites in the patterned metal-SDC electrodes, (a) the metal-exposed sample and (b) the metal embedded sample, respectively. (c-h) The SEM images of the corresponding model electrode structures, Adapted from Haile et al. Nat Mater 2012;11;155-61, with permission of Springer Nature [30]
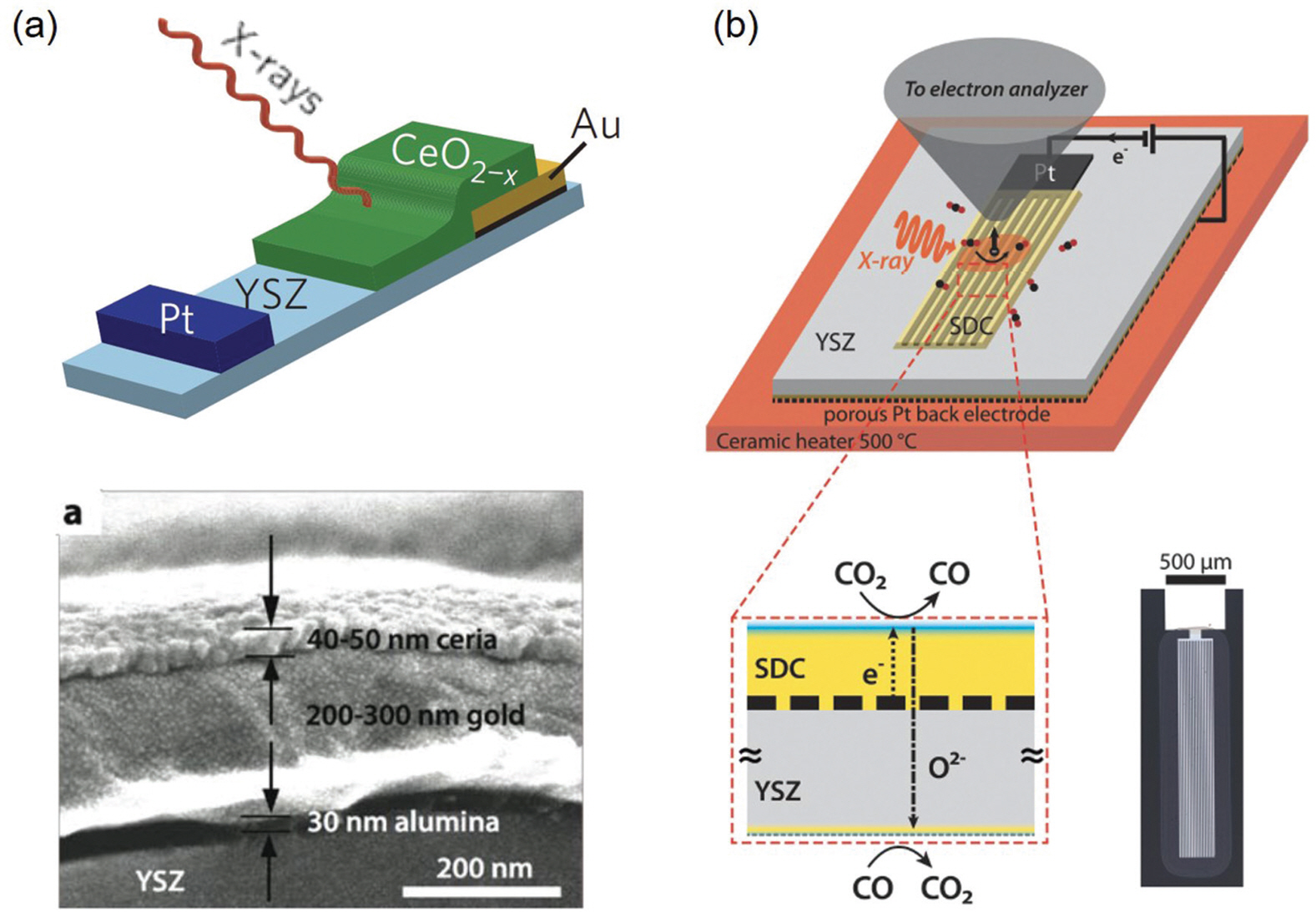
Two different types of the model electrochemical cells with the ceria thin-film electrodes for in operando XPS studies. (a) The cell with the in-plane O2- transport pathway, Reproduced from Eichhorn et al. Nat Mater 2010;9;944-49, with permission of Springer Nature [33], (b) The cell with the out-of-plane O2- transport pathway, Adapted from Chueh et al. Phys Chem Chem Phys 2015;17;12273, with permission of Royal Society of Chemistry [35]
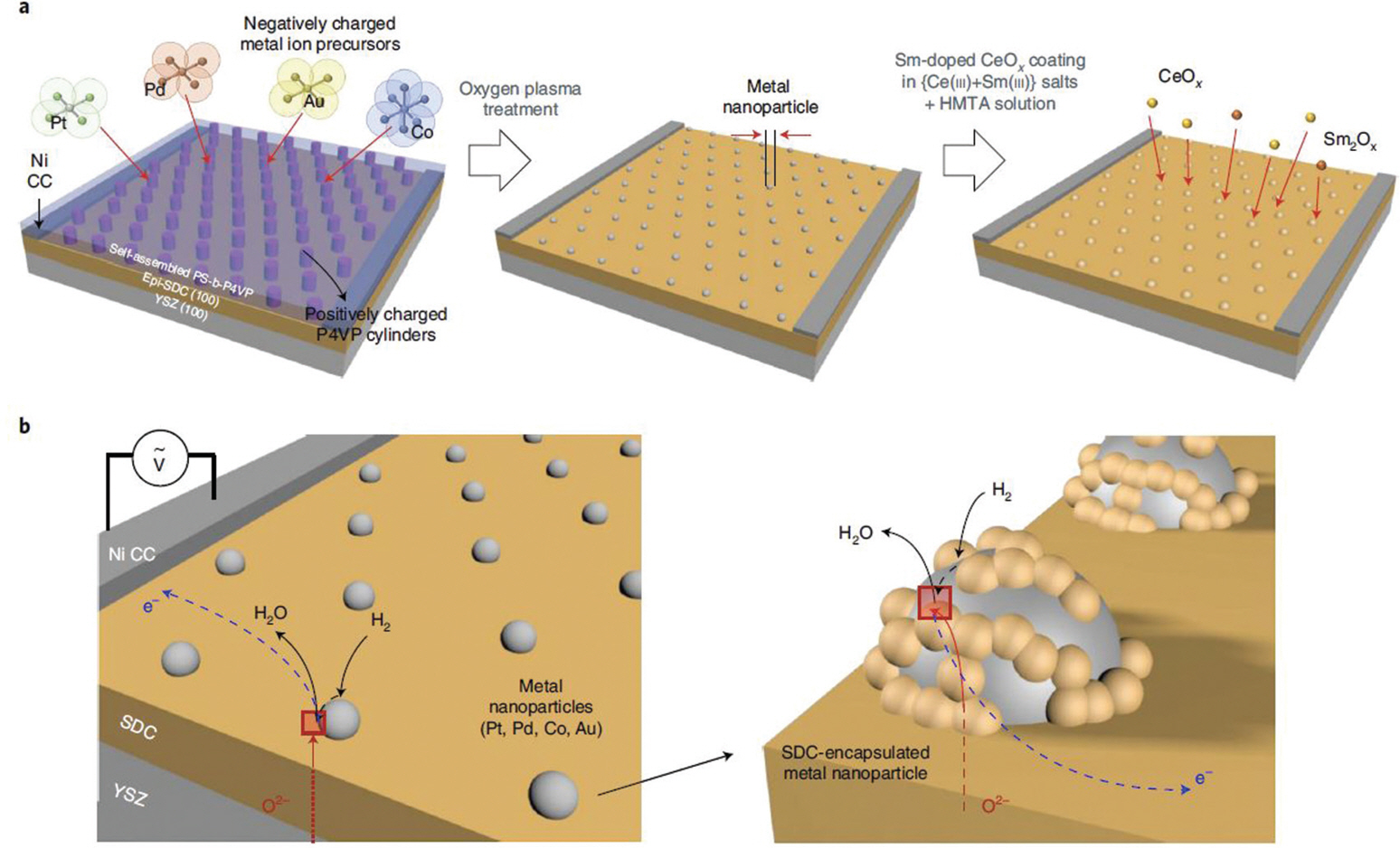
최근 W. Jung 그룹은 SDC와 같은 MIEC의 표면에 도입된 금속 나노입자가 수소의 산화반응 (또는 반대)을 크게 향상시킬 수 있다는 사실에 주목하여, 그들의 전기화학적 촉매 특성을 정량적으로 파악하기 위한 나노 단위 모델 시스템을 제작하였다. 그들의 모델 전기화학 셀은 Fig. 8과 같이 일정하게 노출된 SDC 전극 위에 블록공중합체 (Block copolymer)를 이용한 리소그래피 방식으로 일정한 간격을 지니고 거의 동일한 크기를 갖도록 금속 나노입자를 패터닝하였다.[36] 이와 같이 주요 활성 계면을 정량화할 수 있는 나노 단위 모델 전극을 플랫폼화 할 경우 단순히 분극 저항의 크기를 비교하여 나노 촉매의 성능을 비교 분석하거나 촉매의 역할을 규명하는 것이 가능함을 보고하였다.
3.3. Perovskite계 산화물 연료극
비록 Ni은 환원분위기의 연료극에 가장 널리 사용되는 촉매이자 전자 전도체이지만 탄화수소와 같은 연료 또는 가습의 가스 분위기 등에서 화학적 불안정성으로 인해 열화가 가속되는 문제가 있다. 이러한 이유로 많은 연구자들은 니켈을 대체할 수 있는 MIEC 산화물 연료극을 개발하는 데 많은 노력을 쏟고 있다.[37] 모델 전기화학 셀은 이러한 산화물 연료극의 물성, 반응 경로, 화학적 안정성 등을 정밀하게 파악하는 데 중요한 역할을 하고 있다. J. Fleig 그룹은 Sr(Ti, Fe)O3-δ (STF),[38,39] La0.75 Sr0.25 Cr0.5 Mn0.5 O3±δ (LSCM),[40] La0.6 Sr0.4 FeO3-δ (LSF),[41,42] 등의 perovskite계 산화물 연료극에 대한 임피던스 분석법, in situ XPS, in situ XRD 등의 다양한 기법을 모델 전기화학 셀과 연계하여 활발한 연구를 수행하고 있다. 그들은 [38]에서 환원분위기에서 대게 낮은 전자 전도도를 갖는 MIEC 연료극을 연구하기 위한 모델 전기화학 셀의 구조적 설계와 임피던스 해석을 위한 등가 회로에 대해 논의하였다. 특히 최근 perovskite계 산화물 연료극의 가장 큰 화두 중 하나는 exsolution (용출 현상)의 활용과 이 현상에 대한 심도 있는 이해로,[43,44] 다양한 소재 특성으로부터 나노 입자의 exsolution을 제어하고, 이를 정량적으로 표면 전기화학적 촉매 특성과 연계하기 위해 산화물 박막 기반의 모델링 연구가 활발히 이루어지고 있다. 최근 J. Fleig 그룹의 [45] 연구에서는 LSF 모델 전극에 대한 in situ XRD 분석을 통해 표면에 용출된 Fe의 상의 조성 변화가 전기화학적 특성에 미치는 영향을 확인하였다. 그들의 결과에 따르면, (산화과 환원) 전환 가능한 촉매는 궁극적으로 Fe의 모상으로의 복귀 (reintegration) 또는 재용출이 아닌 용출된 Fe 입자의 금속상으로의 전환이 결정적인 성능 향상 요인임을 밝혔다.
4. 결론
차세대 친환경 발전 장치로 주목받고 있는 고체산화물 연료전지의 높은 성능 구현을 위해 고활성 전극 개발은 필수적이다. 이 투고문에서는 고성능 전극 개발을 위해 전극 반응에 대한 깊이 있는 이해를 목적으로 활용되고 있는 구조적으로 잘 정의된 계면을 갖는 모델 전극의 제작과 관련 연구 결과들에 대해 설명하였다. 가장 활발한 연구가 수행되어 온 연료극을 예로 살펴본 바와 같이 모델링 접근법은 다공성의 구조로 인해 파악하기 힘든 소재 고유의 물성을 정량적으로 파악하거나 매우 복잡하게 일어나는 전극 표면에서의 전기화학반응 매커니즘을 연구한 데 큰 역할을 하고 있다. 한편 본문에서 다루지 않았지만 또다른 중요 전극 반응인 산소환원과정에 대한 공기극 연구도 활발히 연구되고 있다. 최근에는 모델 전기화학 셀을 기반으로 한 in operando 분석 기술이 주목 받고 있으며 전통적인 전기화학적 분석만으로 부족한 전극 반응에 대한 보다 다양한 정보를 얻을 수 있다. 또한 모델 전극은 패터닝 기술의 발전과 함께 보다 정교한 실험 설계가 가능해졌으며, 금속 나노입자 함침, exsolution 등과 같이 그 중요성이 날로 증가하고 있는 SOFC전극에 대한 나노 촉매의 활용 연구에도 그 활용도가 계속해서 증가할 것으로 기대된다.
Acknowledgement
이 논문은 2021년도 대한민국 정부(과학기술정보통신부)의 재원으로 한국연구재단 미래수소원천기술개발사업의 지원을 받아 수행된 연구임 (과제번호: 2021M3I3A1084931)
References
Biography

◉◉최윤석
◉ 2013년 한양대학교 신소재공학부 학사
◉ 2015년 KAIST 신소재공학과 석사
◉ 2019년 KAIST 신소재공학과 박사
◉ 2019년 3월 – 9월 KAIST 응용과학연구소 박사후연구원
◉ 2019년 9월 - 현재 한국에너지기술연구원 에너지소재연구실 선임연구원