소기공 제올라이트 분자체 촉매상 메탄올-올레핀 전환반응의 형상선택성 이론 도출 과정
Development of shape selectivity theory of methanol-to-olefins reaction over small-pore zeolite molecular sieves
Article information
Trans Abstract
The methanol-to-olefins reaction is regarded as an important technology capable of meeting today's rising demand for light olefins. The regioselective confinement effect of small-pore, cage-type zeolites on hydrocarbon pool intermediates results in strong shape selectivity determining the product olefin distribution. Despite decades of effort, a direct correlation between zeolite cage topologies and olefin selectivity distributions had remained elusive. The cage-defining ring theory is the first general catalytic shape selectivity theory that can predict the selectivity distribution of product light olefins from the given crystallographic information of the small pore zeolite catalysts. This article outlines the development procedure of the cage-defining ring theory. To aid readers’ comprehension, brief introductions to the structures and properties of zeolites and related molecular sieves, which are an important class of ceramic catalysts, are also provided.
1. 서론
촉매의 활용은 현재의 인류문명을 가능케 한 가장 중요한 화학기술 중 하나이다. 공기의 대부분을 이루는 질소로부터 비료를 생산하는 것을 가능케 하여 인구부양의 한계에 대한 맬서스 트랩(Malthus trap)을 근본적으로 해소한 하버-보슈 질소고정법(Haber-Bosch process), 석유의 활용을 극대화하여 자동차, 선박, 항공기의 발전을 이끈 접촉분해공정(catalytic cracking process), 고분자 시대의 서막을 연 치글러-나타 촉매(Ziegler-Natta catalyst) 등 촉매를 활용한 다양한 화학기술은 인류 현대문명의 발전을 이끌어 온 중추 기술이자, 기후변화 등 인류가 직면한 환경문제를 포함한 미래의 난제들를 해결할 수 있는 핵심적인 기술로 평가된다. 현재 산업에서 응용되는 화학반응 중 80%가 촉매를 사용하고 있으며, 세계 총생산량(world GDP)의 35%가 촉매공정과 직간접적 연관이 있다.[1]
촉매는 소량만으로도 화학반응의 활성화에너지 (activation energy)를 낮추고 반응좌표(reaction coordinate)를 개선함으로써 반응을 더 낮은 온도에서 더 빠르게 진행시키며, 동시에 원하는 생성물의 선택도(selectivity) 또한 향상시킬 수 있다. 이를 통하여 유용한 화학반응을 현실화하고, 반응기 운전에 소요되는 에너지를 감축하고 생산성을 증진하여 경제성을 부여한다. 촉매는 그 성상에 따라 반응물과 단일상을 이루는 균일촉매(homogeneous catalyst), 표면에서 화학반응을 촉진하는 고체상의 불균일촉매(heterogeneous catalyst), 그리고 생물학적 촉매인 효소(enzyme)으로 분류된다. 그 중 불균일촉매는 높은 안정성과 분리의 용이성으로 인해 가장 광범위하게 사용되며, 2019년 기준 전 세계 촉매시장의 71.9%를 차지한다.[2] 불균일촉매는 금속 촉매를 제외하면 금속산화물이나 제올라이트(zeolite)와 같은 세라믹 소재가 가장 널리 사용된다. 촉매활성점을 지지하는 다공성 소재인 담체(support)와 성형촉매에 역학적 특성을 부여하는 바인더(binder) 소재 또한 실리카(silica), 알루미나(alumina), 점토(clay) 및 제올라이트와 같은 세라믹 계열의 소재가 가장 많이 사용된다.
그 중 제올라이트는 촉매 및 담체로 가장 많이 사용되는 세라믹 소재이다. 제올라이트는 2 nm 이하의 결정학적으로 잘 정의된 미세세공(micropore)를 가진 알루미노실리케이트(aluminosilicate)로 정의된다.[3] 제올라이트는 그 기공의 크기에 따라 소기공(small-pore, 3–4.5 Å), 중기공(medium-pore, 5–7 Å), 대기공(large-pore, 7 Å 이상) 제올라이트로 분류된다. 대표적인 소기공, 중기공, 대기공 구조인 CHA, MFI, ∗ BEA 제올라이트의 구조를 Fig. 1에 나타내었다. 미세세공의 크기에 따라 결정 내부에서 전달 및 형성될 수 있는 반응물(reactant), 중간체(intermediate) 및 전이상태(transition state), 생성물(product) 분자의 크기가 결정되며, 결과적으로 제올라이트를 활용할 수 있는 반응의 종류가 결정된다. 특히 결정학적으로 잘 정의된 분자 수준 크기의 미세세공은 반응에 있어서 강한 형상선택성(shape selectivity)을 보인다. 형상선택성은 촉매의 형상과 구조가 화학반응의 반응물, 중간체, 생성물에 물리화학적인 제한 효과(confinement effect)를 행사하여 최종생성물의 선택도를 제어하는 성질을 의미한다. 제올라이트에서 형상선택성은 반응메커니즘상의 화학종들의 크기가 미세세공의 크기와 유사하여 제한 효과가 극대화될 때 가장 강하게 나타난다.
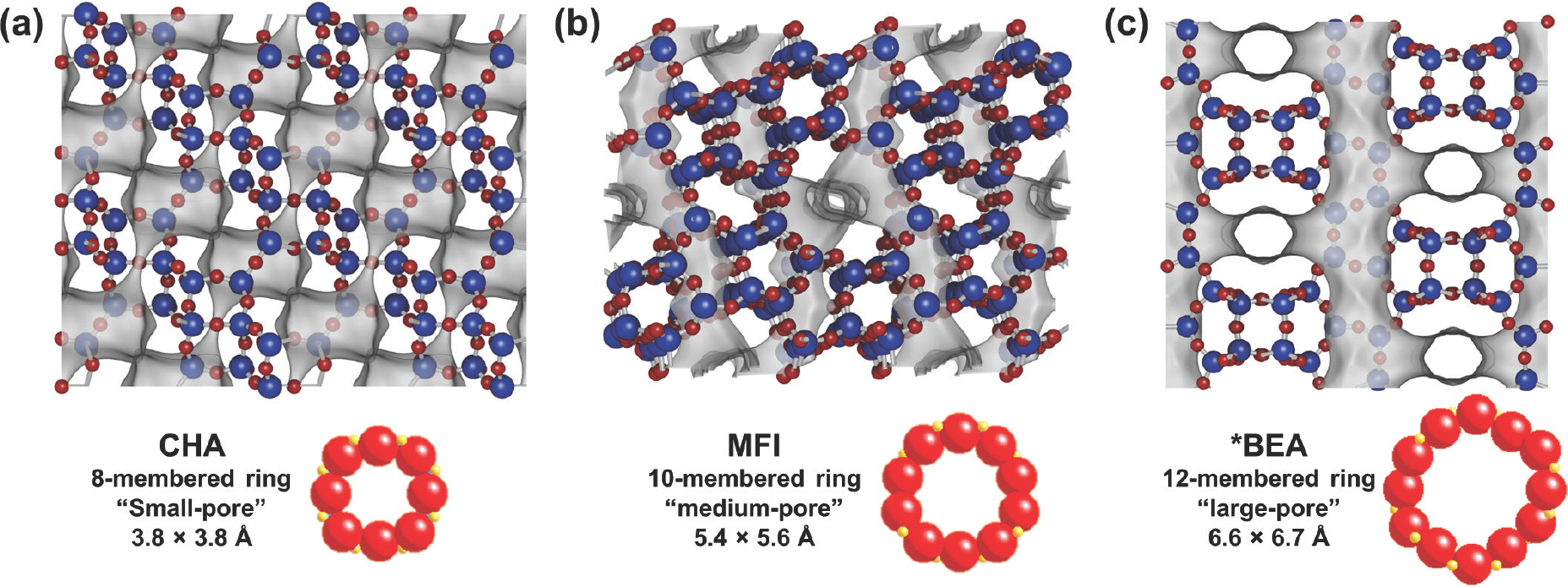
Crystal and pore structures of (a) CHA, (b) MFI, and (c) ∗BEA. Tetrahedral sites and bridging oxygen atoms are denoted in blue and red colors, respectively. Adsorption surfaces of intracrystalline micropores are visualized in gray color.
제올라이트의 강한 촉매 형상선택성이 가장 효과적으로 활용되는 대표적인 반응은 메탄올을 에틸렌과 프로필렌과 같은 경질 올레핀(light olefins)로 전환하는 메탄올-올레핀 전환반응(methanol-to-olefins reaction, 이하 MTO반응)이다.[4] 경질 올레핀은 가장 많이 생산되는 유기화합물이며, 반도체와 마찬가지로 ‘산업의 쌀’이라 불릴 정도로 화학산업에서 가장 중요한 위치를 차지하고 있다. 경질 올레핀은 납사와 같은 석유 유분의 수증기 분해공정(steam cracking) 및 유동화 접촉분해공정(fluidized catalytic cracking)의 부생성물로서 주로 생산된다. 하지만 유가는 국제정세에 따라 민감하게 요동치고, 21세기 들어 주요 자원국들이 자국의 국익을 위해 자원 무기화 정책을 채택하는 사례가 늘어나며 각국은 석유에 의존하지 않고 경질 올레핀을 생산할 수 있는 공정 개발에 관심을 보이고 있다. 이에 더해서 최근 세계적인 프로필렌 수요량의 급증에 의한 수요-공급의 불균형 또한 관련 연구개발의 큰 동력으로 작용하고 있다. 1970년에 개발된 MTO반응은 이러한 세계적인 상황 하에서 비석유계 경질 올레핀 생산공정으로서 많은 관심을 받고 있다. 2015년 기준, 전체 메탄올 소비량의 세계적으로는 5%, 관련 기술에 가장 많은 투자를 한 중국[4]의 경우 22%가 MTO공정에 사용되어 경질 올레핀으로 전환되고 있으며, 이 비율은 계속 증가 추세에 있다.[5]
MTO반응에 사용되는 제올라이트 촉매는 내부에 7–10 Å 크기의 새장(cage) 구조를 갖는 소기공 제올라이트이다.[6–7] 소기공 제올라이트의 3–4 Å 크기의 세공으로 반응물인 메탄올 분자들과 생성물인 에틸렌, 프로필렌, 뷰틸렌 분자들은 통과할 수 있어 외부와 물질전달이 가능하지만, 새장 내에 형성되는 반응중간체인 방향족 카르보양이온은 통과할 수 없다.[8] Fig. 2에 대표적인 소기공 제올라이트인 chabazite(CHA) 결정의 새장구조를 바탕으로 전술한 바를 도식하였다. 현재 상용화된 유일한 MTO용 제올라이트 촉매는 CHA 구조를 갖는 포스페이트계 유사제올라이트인 SAPO-34(silicoaluminophosphate-34)이다.[4] CHA구조 이외에도 마찬가지로 3–4 Å의 소기공에 의해 세공 내 물질전달이 제한되면서 동시에 내부에 7–10 Å 크기의 새장 구조를 가진 구조의 제올라이트는 MTO반응에 적용이 가능하다. 이때 MTO반응의 중간체인 방향족 카르보양이온의 크기를 제한 효과에 의해 결정하는 새장의 크기가 최종 생성물인 에틸렌, 프로필렌, 뷰틸렌의 선택도 분포를 결정하는 것으로 알려져 있다.[7–8]
일반적으로 소기공 제올라이트의 새장의 크기가 클수록 제한 효과에 의해서 더 많은 치환기를 가진 방향족 반응중간체가 형성되고[9–10], 방향족 반응중간체의 치환기가 많고 크기가 클수록 경질 올레핀 생성물의 평균 분자량이 증가하는 것으로, 다시 말해서 에틸렌-프로필렌-뷰틸렌(C2-C3-C4)에서 생성물의 선택도가 C4 쪽으로 치우치는 것으로 알려져 있다.[8] 하지만 소기공 제올라이트의 새장구조는 단순히 ‘크기’나 ‘부피’로 계측하기에는 그 3차원 형상이 매우 다양하다. 3-4종의 제올라이트[11–12]나 동형의 포스페이트 분자체[13–14] 구조를 비교하여 형상선택성을 도출하려 시도한 기존 연구들은 존재하지만, 제올라이트의 구조와 경질 올레핀의 선택도 분포간의 상관관계를 직접 도출한 연구는 없었다. 본 고에서는 내용의 이해를 돕기 위해 핵심이 되는 세라믹 소재의 촉매인 제올라이트의 구조 및 조성에 대하여 먼저 간략히 다룬다. 그리고 MTO반응의 메커니즘과 제올라이트의 구조와의 관계에 의한 형상선택성을 다룬다. 이어서 제올라이트의 구조 및 조성과 생성물의 상관관계를 밝히기 위한 기존 연구의 흐름을 고찰한다. 그리고 MTO반응의 형상선택성을 예측하는 최초의 일반이론인 ‘새장고리이론(cage-defining ring theory)’의 도출 과정을 소개한다.[6, 15] 새장고리이론은 다양한 소기공 제올라이트의 결정학적 새장구조에서 MTO반응의 형상선택성을 결정하는 ‘새장고리’를 식별하고, 그의 크기와 반응생성물의 선택도 분포간의 상관관계를 바탕으로 형상선택성을 직접적으로 예측할 수 있는 이론이다. 마지막으로 새장고리이론을 뒷받침하는 주요 후속 연구들의 흐름과 여전히 해결해야 할 남은 과제들을 조명한다.
2. 제올라이트의 구조와 조성
2.1. 제올라이트의 구조와 명명
엄밀한 의미의 제올라이트는 ‘결정성(crystalline), 미세다공성(microporous), 망상형(tecto-) 알루미노실리케이트’로 정의된다. 제올라이트의 골격구조 (framework)는 끊어짐 없이 3차원 망상형으로 연결된 TO4 사면체(T=Si, Al, 등)를 기본 구조단위(primary building unit)로 하여 이루어진 직경 2 nm 이하의 미세세공을 가지는 규칙적인 결정구조이다. 열역학적으로 안정한 제올라이트의 결정구조는 대략 5백만 종이 가능한 것으로 알려져 있지만, 2022년 현재 알려진 결정구조는 자연계에 존재하는 천연제올라이트와 인공적으로 합성법이 밝혀진 합성제올라이트, 그리고 동형의 분자체(molecular sieve) 소재들을 모두 합쳐 260여가지의 구조에 불과하다. 각각의 독특한 결정구조는 알파벳 3글자로 된 약어로 명명되며, 신규구조제올라이트가 발견될 때마다 국제제올라이트협회(international zeolite association, IZA)의 구조위원회(structure commission)에서 공식적으로 3글자 약어를 부여해 공표한다. 예를 들어 대표적 소기공 제올라이트의 chabazite의 구조는 CHA, 파라자일렌 생산공정, 톨루엔 알킬화 공정 등 다양한 촉매공정에 활용되는 ZSM-5의 구조는 MFI, 유동화 접촉분해공정에 사용되는 zeolite Y의 faujasite 구조는 FAU라는 3글자 약어로 칭해진다. 현재까지 알려진 모든 제올라이트 및 관련 분자체의 구조는 IZA의 데이터베이스에서 확인할 수 있다.[16] 새로운 구조를 가진 제올라이트의 합성법 개발은 새로운 촉매 형상선택성의 도출가능성을 내포하기 때문에 언제나 관련 학계의 주목을 받는다. 2020년대 들어서도 신규구조 제올라이트를 발견하기 위한 노력은 지속되고 있으며, 전 세계적으로 3–7종의 새로운 제올라이트 구조가 매년 보고되고 있다.
제올라이트의 미세세공의 크기는 관습적으로 세공 내 분자확산을 제한하는 가장 작은 ‘고리(ring)’를 이루는 TO4 사면체의 개수를 바탕으로 표현된다. 만약 어떤 제올라이트의 세공 내 분자확산이 n개의 사면체가 이루는 고리(n-membered ring, nMR)에 의해서 제한된다면 그 제올라이트는 ‘nMR 세공을 가졌다’고 표현한다. 소기공 제올라이트는 8MR 세공 구조를 가지며, 3–4.5 Å 이내 크기의 분자(메탄올, 경질 올레핀, 저비점의 선형 탄화수소 등)가 통과할 수 있다. 산업적으로 활용되는 대표적 소기공 제올라이트 구조에는 CHA, ERI, LTA 등이 있다. 소기공 제올라이트는 작은 분자의 확산이 중요한 반응에서 활용되며, 예시로는 본 고의 주제인 MTO반응을 포함, 메틸아민 생산공정, 질소산화물의 선택적 촉매환원반응(selective catalytic reduction, SCR)이 있다. 중기공과 대기공 제올라이트는 각각 10MR(5–7 Å), 12MR(7 Å 이상)로 정의되며, 방향족 분자나 그보다 더 큰 분자가 통과할 수 있다. (Fig. 1 참고) 산업적 활용도가 높은 중기공 구조에는 MFI, MEL, FER 등이 있고, 대기공 구조에는 MOR, ∗ BEA, FAU가 있다. 중기공 및 대기공 제올라이트가 가장 많이 사용되는 분야는 유동층 접촉분해공정이다. 14MR 이상의 경우는 ‘특대기공(extra large-pore)’이라 불리나 상대적으로 드물고, 산업적으로 활용된 예시는 거의 없다. 6MR 이하의 고리는 너무 작아서 어떤 분자도 통과하지 못한다. 본 고는 MTO반응에 활용되는 다양한 8MR 제올라이트 및 분자체에 대해 주로 다룬다.
2.2. 제올라이트의 조성과 산점
제올라이트의 기본 조성은 실리카(SiO2, Fig. 3(a))에서 Si(IV) 4면체 중심이온의 일부가 Al(III) 이온으로 치환된 알루미노실리케이트(Fig. 3(b))로 이해될 수 있다. 구조 내 Si(IV)의 일부가 Al(III)으로 치환되면 골격에 음전하가 도입되며, 전하균형을 맞추기 위해서 양이온이 구조 내에 포함된다. 만약 이 양이온이 양성자(proton, H+)인 경우 표면에 산성을 띄게 되고, 결과적으로 제올라이트는 고체상의 산촉매로 기능할 수 있게 된다. 양성자를 양이온으로 갖는 제올라이트는 고체산으로서 브뢴스테드 산점(Br⊘nsted acid site, Fig. 3(b))과 루이스 산점(Lewis acid site, Fig. 3(c))의 거동을 모두 보인다. 그리고 이 두 산점의 시너지로 인하여 제올라이트는 탄화수소와 반응하여 카르보양이온(carbocation) 중간체를 형성할 수 있을 만큼 강한 산성을 띄게 된다. MTO 반응에서는 제올라이트의 산성으로 인해 형성된 방향족 카르보양이온 중간체가 반응메커니즘에 있어서 경질 올레핀 생성에 있어서 핵심적인 역할을 한다. 알루미노실리케이트로서 제올라이트의 조성은 통상 골격 내 Si/Al 비 또는 SiO2/Al2 O3 비로 표현된다. Si/Al 비의 하한선은 뢰벤슈타인 규칙(Lö wenstein rule)[17]에 의해서 1로 정해지며, 순실리카의 경우 무한대(∞)에 해당한다. 자연적으로 형성된 천연제올라이트의 Si/Al비는 대부분 5 이하인 저실리카(low-silica)인 반면, 통상적으로 촉매로 활용되는 제올라이트는 Si/Al 비 10–300의 고실리카(high-silica) 인공제올라이트가 활용된다.
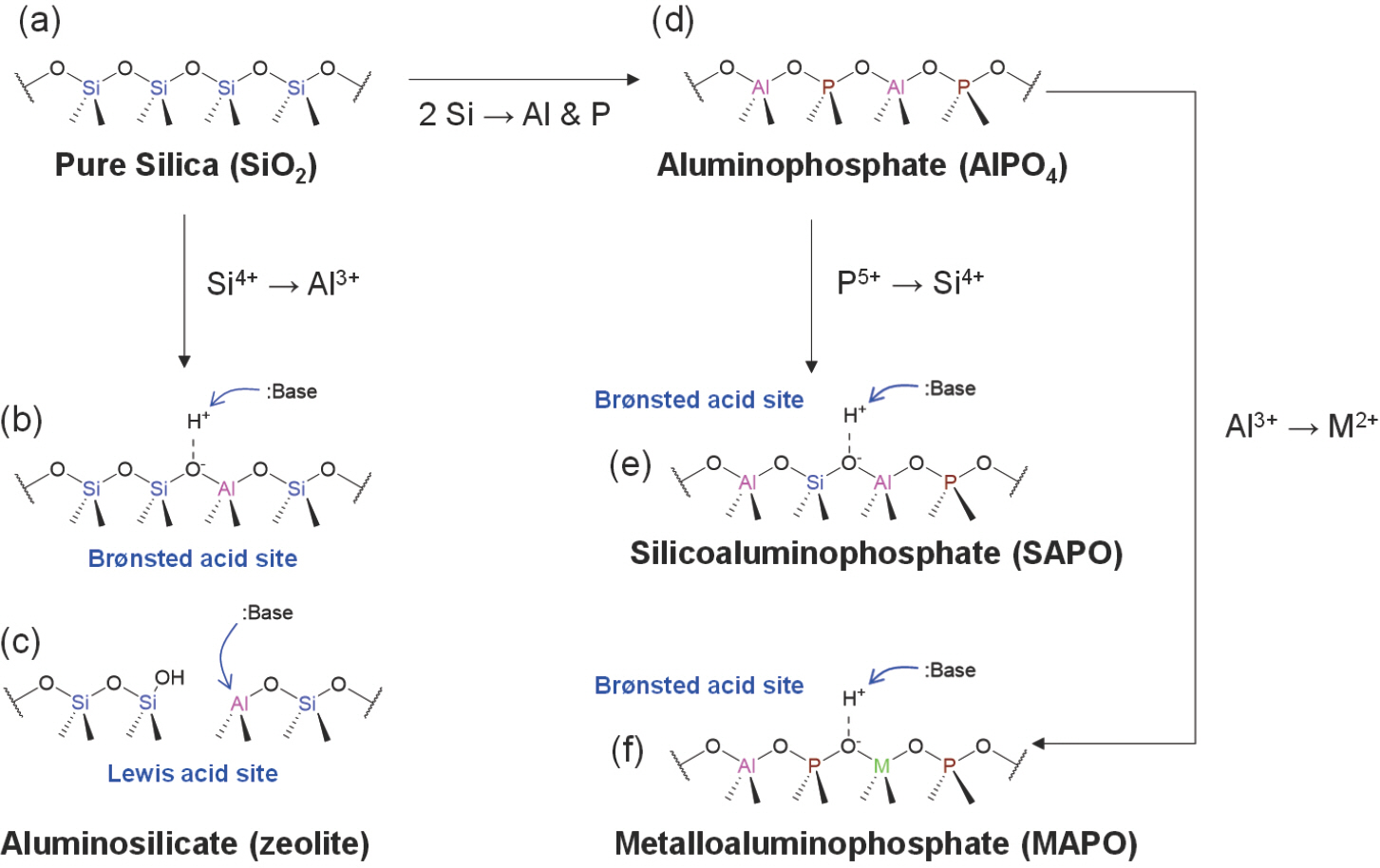
Acidity and elemental composition of silicate and phosphate surfaces: (a) pure silica, (b and c) aluminosilicate (c) Br⊘nsted and (c) Lewis acid sites, (d) aluminophosphate, (e) silicoaluminophosphate and (f) metalloaluminophosphate.
한편 제올라이트 소재에 대한 연구가 지속적으로 진행되면서 골격을 이루는 원소의 조성도 Si와 Al의 틀을 벗어나 다변화되어 왔다. 제올라이트 구조의 골격 내에서 안정한 4면체 자리를 형성할 수 있는 원소에는 Ga, Ge, P, Ti, Sn, Zn 등이 있으며, 이에 따라서 ‘제올라이트’라는 용어의 정의 또한 확장되었다. Al 이외의 이종원소의 도입은 다양한 새로운 구조의 제올라이트의 발견[18]과 조성에 기인한 독특한 촉매반응의 활용으로 이어져 해당 분야에서 하나의 큰 흐름이 되었다고 평가된다. 전통적인 제올라이트에 해당하는 알루미노실리케이트 이외에 산업적으로 가장 중요한 조성의 분자체은 알루미노포스페이트(aluminophosphate, 이하 AlPO4) 기반의 분자체이다. AlPO4는 상응하는 SiO2에서 인접한 한 쌍의 Si(IV) 4면체 중심이온이 각각 Al(III)과 P(V) 사면체 중심으로 치환된 동형(isomorphous)의 결정으로 이해될 수 있다. (Fig. 3(d)) 순수한 AlPO4는 SiO2와 마찬가지로 중성이지만, 제올라이트의 경우와 마찬가지로 P(V)자리가 Si(IV)로 치환되거나 Al(III)가 Co(II), Mg(II), Mn(II) 등으로 치환되는 경우 양성자를 포함한 산촉매로서 기능할 수 있다. Si가 포함되는 경우 silicoaluminophosphate(SAPO, Fig. 3(e))라 불리고, 그리고 기타 금속원소가 포함되는 경우 metalloaluminosilicate(MAPO, Fig. 3(f))라 칭해진다. SAPO와 MAPO는 양성자를 양이온으로 가질 때 동일한 구조의 제올라이트에 비해서 다소 약한 산성을 가지는 경향이 있다.[19–20] 결과적으로 고온의 탄화수소 촉매반응에서 코크 형성에 의한 촉매 비활성화(deactivation)가 속도론적으로 늦추어져 수명 측면에서 이점을 가진다. 본 고의 주제인 MTO반응에서 상용화된 촉매 또한 앞서 언급한 바와 같이 소기공의 CHA구조를 갖는 SAPO소재인 SAPO-34이다.[4]
3. 메탄올-올레핀 전환반응
3.1. 탄화수소 활성체 메커니즘
제올라이트와 같은 고체산 촉매의 표면에서 메탄올이 탄화수소로 전환되는 메탄올-탄화수소 전환반응(methanol-to-hydrocarbon, MTH반응)은 1970년대 美 Mobil 사의 Chang과 Silvestri에 의해서 보고되었다.[21] 최초에는 10MR 제올라이트인 ZSM-5가 촉매로 사용되었었고, 중기공 구조를 갖는 ZSM-5의 형상선택성의 영향으로 가솔린 대역의 비점에 해당하는 탄화수소가 생성물로 얻어졌다 (methanol-to-gasoline, MTG 반응).[22] 당시 오일 쇼크에 의한 유가 폭등 상황 하에서 비석유계 원료로부터 가솔린을 얻을 수 있는 MTG공정은 유효한 대응수단으로 각광받았고, 1985년 뉴질랜드에 첫 번째 MTG 플랜트가 건설되어 뉴질랜드 전체 가솔린 수요의 30%를 충당하기도 했다.[23] 한편 1980년대 Union Carbide의 Flanigen 등에 의해 최초의 AlPO4-계 분자체로서 8MR 소기공과 새장구조를 가진 CHA 구조의 SAPO-34가 보고되었다.[24] SAPO-34의 MTH반응의 적용은 에틸렌 및 프로필렌과 같은 경질 올레핀을 생산하는 MTO반응공정의 개발로 이어졌다.[22] SAPO-34의 소기공을 통해서 반응물인 메탄올과 생성물인 경질 올레핀은 쉽게 촉매결정을 드나들 수 있으며, 특유의 새장구조는 반응이 일어나는 동안 MTO 반응의 방향족 중간체를 잘 가두어 둘 수 있다. MTO반응의 메커니즘과 밀접하게 연관된 이러한 구조적 특성으로 인해 SAPO-34는 현재까지도 상용 MTO반응에서 필수적인 촉매로 활용되고 있다.[4]
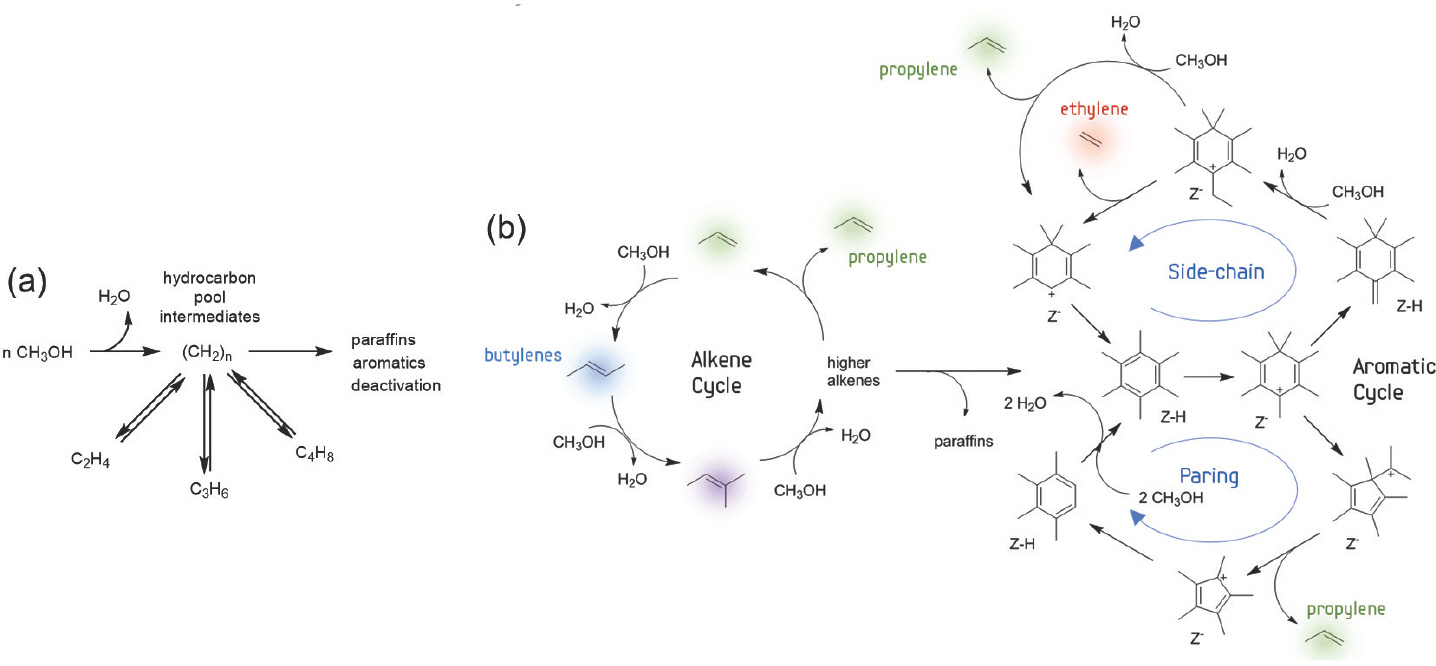
MTO반응의 메커니즘은 지난 수십 년 동안 활발히 연구되어 왔다. MTO반응의 반응물은 C1 화합물인 메탄올이기 때문에 필연적으로 C-C결합의 형성을 수반한다. MTO반응은 통상적으로 반응온도 350–450°C에서 일어나며, 주 생성물인 경질 올레핀 뿐만 아니라 프로페인과 같은 포화 탄화수소와 C5이상의 탄화수소의 다양한 이성질체 또한 생성물로 얻어진다. 탄화수소를 형성하고 남은 메탄올의 산소는 물(H2 O)의 형태로 빠져나온다. 반응의 첫 단계가 2개의 메탄올 분자가 제올라이트의 산점에 의해 탈수 및 이량화되어 디메틸에터(DME)를 형성하는 것임에는 이견이 없지만, 그 이후의 C-C결합의 형성에 관해서는 다양한 메커니즘이 제안되어 왔다.[21, 25] 현재 가장 널리 받아들여지는 이론은 1990년대에 Dahl과 Kolboe에 의해 제안된 탄화수소 활성체 메커니즘(hydrocarbon pool mechanism, Fig. 4(a))이다.[26–28] 탄화수소 활성체 메커니즘의 주된 반응중간체는 4–7개의 메틸 치환기를 갖는 5각, 또는 6각 ring의 방향족 카르보 양이온으로 밝혀졌다. 이후의 메커니즘 연구는 이 탄화수소 활성체 메커니즘을 토대로 세부적인 사항을 수정하고 개선하는 방식으로 이루어져 왔다. 현재 가장 최신화된 MTO반응의 메커니즘은 Olsbye 등에 의해 제안된 알킨 사이클(alkene cycle)과 방향족 사이클(aromatic cycle)로 이루어진 이중 사이클(dual-cycle) 메커니즘(Fig. 4(b))이다.[22] 여기서 에틸렌은 주로 방향족 사이클에서 생성되며[29], 프로필렌은 양쪽 사이클 모두에서 생성되는 것으로 각각 여겨지고 있다.[30]
3.2. 제올라이트의 형상선택성과 MTO반응
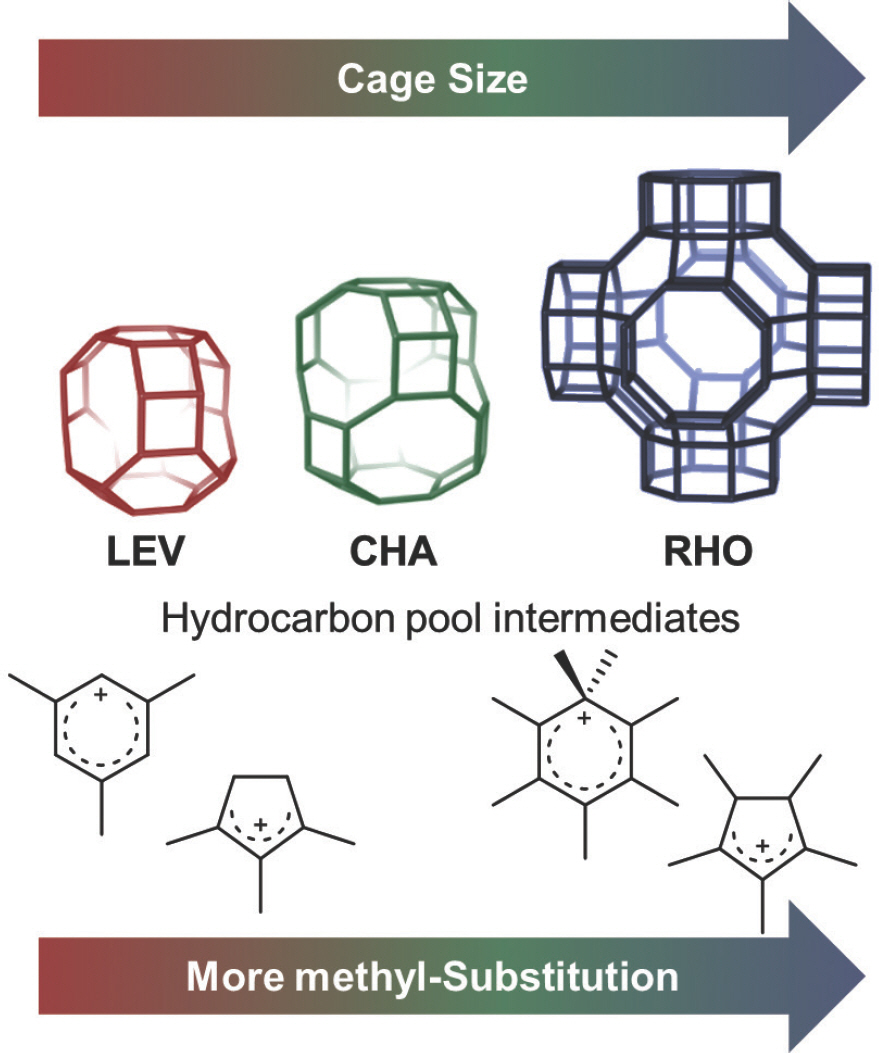
소기공 제올라이트의 새장구조 안에서 형성되는 탄화수소 활성체 메커니즘의 중간체의 종류는 새장구조에 의한 입체화학적 제한 효과에 의해서 결정된다. 중국 다롄화학물리학연구소(DICP)의 Zhongmin Liu 교수의 연구팀은 소기공과 새장구조를 갖는 CHA, LEV, RHO 구조의 SAPO기반 촉매에서 새장구조에 따라 서로 다른 탄화수소 활성체 메커니즘의 방향족 중간체가 형성됨을 규명하였고[31–33], 탄화수소 활성체 메커니즘 사이클도 촉매의 새장구조의 형상에 따라 별도로 존재함을 제시하였다 (Fig. 5).[10] 한편, 탄화수소 활성체 메커니즘의 중간체의 구조와 생성되는 경질 올레핀의 선택도 분포(C2-C3-C4 selectivity distribution) 사이에 어떤 상관관계가 존재할 것이라는 관점 또한 제시되어 있었다.[34] J. F. Haw 등은 치환이 더 많이되고 더 커다란 방향족 중간체가 형성될수록 경질 올레핀의 선택도가 C3, C4쪽으로 치우칠 것이라고 예측하였다.[8] 종합하면, 소기공 제올라이트계 분자체의 새장구조는 반응메커니즘과 그 중간체의 구조를 결정하고, 그 중간체의 구조적 특성은 최종적으로 올레핀의 선택도 분포를 결정하는 것이 된다. MTO반응의 형상선택성에 관련된 이러한 명제는 MTO반응 분야의 연구자들에게 일반적인 사실로 받아들여져 왔으나, 소기공 제올라이트의 새장구조와 반응생성물의 선택도 분포 사이의 직접적인 상관관계는 밝혀져 있지 않았다.
물론 다양한 제올라이트 또는 SAPO계열의 소기공 촉매를 동일한 조건에서 비교하여 결정구조와 반응생성물의 선택도 분포 사이의 상관관계를 수립하려는 시도는 여러 차례 있어 왔다. P. A. Wright와 S. B. Hong 의 공동 연구진은 SAV, KFI, CHA 구조의 SAPO 조성 촉매의 350 °C에서 MTO반응 거동을 관찰 및 비교한 결과를 바탕으로 경질 올레핀 생성물의 선택도 분포는 새장구조 내에서 형성되는 방향족 중간체에 의해 결정될 것이라는 관점을 발표하였다.[34] 그러나 해당 연구에서 새장구조와 중간체, 생성물 선택도 분포의 구체적 상관관계까지 제안되지는 않았다. 유사한 관점에서 Y. Bhawe 등은 비슷한 Si/Al비를 가진 CHA, LEV, AFX 구조의 제올라이트의 400°C에서의 MTO거동을 비교하고 생성되는 에틸렌/프로필렌 비(olefin C2/C3 ratio)가 새장구조의 크기 순서인 LEV-CHA-AFX 순으로 낮아진다는 것을 보였다.[11] 다만, 해당 연구에서 비교에 사용된 AFX 제올라이트의 활성의 경우 메탄올 전환율이 100%에 이르지 못했다는 점에서 표준적인 결과로 받아들이기에는 부족함이 있다. 또한 J. Goetze 등은 CHA, LEV, DDR 제올라이트의 새장구조 내에 형성되는 방향족 중간체와 그의 비활성화 산물의 형성을 operando UV-Vis 분광학으로 관찰하고 새장구조에 따라서 내부에 형성되는 중간체와 코크의 구조가 실시간적으로 결정됨을 실험적으로 입증하였다.[35] 반면 I. Pinilla-Herrero 등은 SAPO조성의 LEV, AFX, LTA, SAV구조의 촉매상에서 MTO거동을 비교하고 새장구조보다는 생성물의 확산을 제한하는 8MR 소기공의 크기에 의해서 경질 올레핀의 선택도 분포가 결정될 것이라는 관점을 내놓았다.[13–14] 이외에도 많은 실험결과가 보고되었으며, 각각의 소기공 제올라이트계 분자체에서 형성되는 MTO 반응생성물의 선택도 분포에 관한 기존 연구결과들은 M. Dusselier와 M. E. Davis의 소기공 제올라이트에 관한 리뷰에 잘 정리되어 있다.[7] 기존에 보고된 결과들은 각각의 특이한 결정구조와 올레핀 선택도 분포의 대략적인 경향을 보여주었으나, 실험적 비교에 동원된 제올라이트계 소기공 분자체의 수와 조성이 제한적이고, 새장구조에서 선택도를 결정하는 데 가장 중요한 기하학적 척도가 제시되지 않았으며, 반응결과도 통일된 반응조건(온도, 공간속도 등)에서 비교되지 못했다는 점에서 한계가 있었다.
3.3. 새장고리이론의 도출 및 후속연구
소기공 제올라이트계 분자체 촉매의 결정구조와 그의 MTO반응에서 경질 올레핀 선택도 사이의 직접적인 상관관계를 구축하기 위해서는 다음과 같은 조건이 만족되어야 한다. 첫째로, 최대한 많은 종류의 소기공/새장구조의 제올라이트 및 AlPO4-기반 촉매를 확보해야 한다. 이를 통해서 촉매 결정구조와 반응물 선택도 분포 간에 도출된 실험적 상관관계의 신뢰성을 높일 수 있을 뿐만 아니라, 반응물 선택도 분포에 영향을 줄 수 있는 또 하나의 인자인 촉매의 원소 조성의 상대적인 영향도 확인할 수 있다. 둘째로, 모든 촉매는 동일한 반응조건에서 평가되어야 한다. MTO반응의 통상적인 반응온도는 350–450 °C이다. 해당 반응공정을 연구하는 개별 연구진들은 이 온도구간 내에서 각각 상이한 반응온도를 선택하여 기존 연구결과를 보고하여 왔다. 일반적으로 온도가 증가할 수록 경질 올레핀의 선택도 분포는 에틸렌 쪽으로 치우치는 것으로 알려져 있다.[35] 하지만 촉매의 종류에 따라 온도의존성의 경향이 달라서 서로 다른 온도의 결과를 비교하는 것은 제한적이다. 마지막으로 다양한 3차원적 형상의 새장구조들로부터 반응물의 선택도를 결정하는 기하학적인 인자를 도출하여 그를 수치화하여야 한다. 기존의 연구들은 새장구조의 ‘크기’를 평가하는 방식에 있어서 길이, 부피, 폭 등 통일되지 않은 인자들을 사용하였으며, 실제 실험결과와 해당 기하학적 인자간의 상관관계 또한 명확히 도출되지 않았다.
이와 같은 기존 연구의 한계를 인식하고 본 고의 필자가 포함된 Caltech의 M. E. Davis와 쉐브런에너지기술연구소의 S. I. Zones의 공동 연구팀은 고도의 제올라이트 및 AlPO4-기반 분자체 합성 기술과 수 년간 누적된 MTO반응 결과를 바탕으로 결정구조와 반응생성물 사이의 직접적인 상관관계를 도출하는 과제에 착수하였다. 반응온도 400 °C, 메탄올의 공간속도 1.3 hr−1의 동일한 조건에서 평가된 선행연구들로부터 (1) LEV 는 1보다 큰 C2/C3 ratio를[11], (2) CHA는 1에 가까운 C2/C3 ratio를[36], (3) AEI와 RTH는 1보다 작은 C2/C3 ratio를[37–38], (4) LTA구조는 1:1:1=C2:C3:C4에 가까운 올레핀 선택도 분포를 보인다는 결과[39]에 착안하여, 다양한 소기공 제올라이트들을 위와 같은 올레핀 선택도에 따라 4개의 군(category)으로 나누는 시도를 하였다. 이를 위하여 SSZ-16(AFX), SSZ-52(SFW), SSZ-27, SSZ-28(DDR), ITQ-3(ITE), SSZ-99(CHA/GME intergrowth), SSZ-98(ERI), SSZ-104(CHA-related), SSZ-105(ERI/LEV intergrowth)를 포함한 다수의 소기공 제올라이트 촉매를 합성하고, 마찬가지로 반응온도 400 °C, 메탄올의 공간속도 1.3 hr−1의 동일한 조건에서 평가하였다. 최종적으로 CHA, AFX, SFW 구조의 제올라이트는 1에 가까운 C2/C3 ratio를(제 1군), ERI와 LEV 제올라이트는 1보다 큰 C2/C3 ratio를(제 2군), AEI, RTH, ITE, SSZ-27, DDR 제올라이트는 1보다 작은 C2/C3 ratio를(제 3군), 그리고 LTA와 RHO는 1:1:1=C2:C3:C4에 가까운 경질 올레핀 선택도 분포를(제 4군) 보이는 것을 확인하였다 (Fig. 6(a)).[15] 실험 결과 AEI나 DDR은 AFX나 SFW에 비하여 훨씬 ‘작은’ 새장구조를 가짐에도 더 많은 프로필렌을 형성하였고, ERI는 CHA보다 ‘긴’ 형상의 새장구조를 가짐에도 더 많은 에틸렌을 형성하였다. 이 결과는 올레핀의 선택도 분포를 결정하는 기하학적 인자가 단순히 새장구조의 부피나 길이가 아님을 보여준다. 특이하게도, 반응 초기에만 생성이 관찰되는 포화탄화수소인 프로페인의 초기 선택도(initial selectivity)는 위 4개의 군과는 상이한 거동을 보였으며, 오히려 이 쪽이 통념적인 새장의 부피(또는 크기) 순서와 높은 상관관계를 보였다.[15]

(a) cage topologies classified into four categories according to the olefin selectivity distribution. (b) hypothetical ellipsoidal cage and hydrocarbon pool intermediate (c) correlation between the olefin selectivity distribution and the cage-defining ring size. (d) product selectivity distributions from CHA and AEI-type molecular sieve catalysts. Reproduced from J. H. Kang et al., ACS Catal., 9, 6012-6019 (2019) with permission of American Chemical Society. [6]
위 연구는 다양한 소기공 제올라이트에서 MTO반응의 생성물 선택도를 평가하고 결정구조를 기반으로 4개의 군으로 분류할 수 있다는 것을 보였지만, 이 분류는 여전히 알루미노실리케이트 조성에 국한된다는 한계를 지니고 있다. 4개의 군을 구분할 수 있는 결정구조 기반의 기하학적인 척도 또한 제시하지 않고 있다. 후속 연구로서 해당 공동연구진은 AlPO4-기반 분자체 또한 위 분류에 속하는지 평가하기 위하여 동일한 구조들을 갖는 SAPO와 MAPO 분자체를 합성하고 그의 MTO반응 거동을 반응온도 400 °C, 메탄올 공간속도 1.3 hr−1에서 평가하였다.[6] CHA와 AEI는 SAPO, MgAPO, CoAPO 의 조성으로 추가적으로 합성되었으며, AFX, SFW, LEV, KFI, LTA, RHO, SAV는 SAPO 조성으로 합성되었다. 그리고 UFI구조를 갖는 제올라이트 UZM-5를 추가하였다. 이로서 총 14개 구조, 30종의 서로 다른 소기공/새장구조의 제올라이트 및 AlPO4-기반 분자체의 MTO반응 거동을 동일한 조건에서 평가할 수 있었다.[6, 15] 그 결과 AlPO4-기반 분자체 역시 구조에 따라 제올라이트 계열 촉매와 동일한 올레핀 선택도 분포 경향성을 보인다는 것을 확인하였다 (Fig. 6(d)). 이로써 MTO반응의 올레핀 생성물의 선택도는 조성보다 결정구조에 훨씬 더 크게 의존하는 것을 확인하였다. 종합적으로, 오직 결정구조에 근거해 총 14종의 서로 다른 소기공/새장구조의 분자체를 위와 동일한 4개의 군으로 분류할 수 있었다. C2/C3~1에 해당하는 제 1군에는 CHA, AFX, SFW가, C2/C3>1의 비를 보이는 제 2군에는 ERI, LEV, C2/C3<1의 비를 보이는 제 3군에는 AEI, DDR, RTH, ITE, SAV, 2×C4/(C2+C3)>1의 비를 보이는 제 4군에는 LTA, RHO, KFI, UFI가 각각 분류되었다 (Fig. 6(a)).
올레핀 생성물 선택도와 연관지을 수 있는 결정구조 기반의 기하학적인 척도를 도출하기 위하여, 가상적인 3차원 타원체(ellipsoid) 형태의 새장구조를 가정하고, MTO반응 메커니즘의 중간체인 탄화수소 활성체 방향족 중간체가 어떤 방향으로 배향될 확률이 높을지 사고실험을 진행하였다 (Fig. 6(b)). 서로 다른 길이의 3개 축(a<b<c)을 갖는 가상의 타원체 새장 내에서, 평면 구조를 갖는 방향족 중간체는 가장 짧은 a축에 수직한 bc 평면에 평행하게 배열되는 것이 에너지적으로 유리할 것이라 가정하였다. 만약 그렇다면 방향족 중간체의 크기를 제한하는 축의 길이는 b축과 c축 중 짧은 쪽인 b 축이 될 것이다. 여기서 a축과 b축으로 결정되는 타원을 해당 타원체 새장의 ‘새장고리(cage-defining ring)’로, 중간체의 크기와 밀접한 연관이 있는 b축의 길이를 ‘새장고리 크기(cage-defining ring size)’로 각각 명명하였다. 다음 단계로 실험에 적용된 14개의 실제 새장구조에서 새장고리 크기에 해당하는 길이를 각각의 결정학적 정보를 바탕으로 각각 추출하였다. 그 결과 제 1군에 속하는 구조의 새장고리 크기는 모두 7.45 Å였고, 제 2군의 경우는 7.45 Å보다 작았으며, 제 3군의 경우는 7.45 Å와 10 Å사이의 크기를 가졌고, 제 4군은 10 Å보다 컸다.[6] Fig. 6(c)는 새장고리 크기와 4개의 군에 속하는 결정구조의 상관관계를 보여준다. 새장고리의 크기는 MTO반응에서 올레핀 생성물의 선택도 분포와 기존에 논의된 어떠한 척도보다도 더 강한 상관관계를 보여주었다. 또한 새장고리 이론은 기존의 제올라이트 촉매는 물론, 새로이 합성된 신규구조 제올라이트 뿐만 아니라, 심지어 합성법이 밝혀지지 않은 가상의 제올라이트의 경우에도 결정학적 정보로부터 새장고리의 크기에 해당하는 기하학적 인자를 추출하여 반응결과를 예측할 수 있다는 강점이 있다. 새장고리 이론은 MTO반응에서 제올라이트의 결정학적 특성과 촉매반응생성물의 선택도 분포 사이의 직접적인 상관관계를 도출한 최초의 형상선택성 일반이론이다.
새장고리 이론은 결정구조와 반응물 선택도 간의 가장 거시적인 경향성에 관한 것이다. 따라서 몇몇 소기공 제올라이트 또는 AlPO4-기반 촉매는 이론에 위배되는 정도는 아니지만, 예측된 선택도 분포로부터 설명이 필요한 정도의 편차를 보이는 경우가 있다. 예를 들어 SAPO-34는 SSZ-13, CoAPO-34, MgAPO-34와 동일한 CHA구조를 갖지만 다소 높은 프로필렌 선택도를 보여준다 (Fig. 6(d)).[6, 15] A. Corma의 연구진은 계산화학적 방법을 이용해서 AlPO4-기반인 SAPO-34의 새장고리가 제올라이트 기반인 SSZ-13의 새장고리보다 다소 유연해서 더 큰 탄화수소 활성체 메커니즘 중간체를 형성할 수 있음을 보였다 (Fig. 7(a)).[40] 밀도범함수이론(density functional theory)에 기반한 계산결과, 7개의 메틸기가 치환된 헵타메틸벤제니움 (heptamethylbenzenium, 7MB+) 중간체는 SSZ-13보다 AlPO4-34에서, 5개의 메틸기를 가진 펜타메틸벤제니움(pentamethylbenzenium, 5MB+) 중간체는 AlPO4-34보다 SSZ-13에서 더 잘 안정화되는 것으로 나타났다.[40] (Fig. 7(b)) 이 결과는 AlPO4-34기반인 SAPO-34에서 메틸기의 치환이 더 많이 일어나 더 높은 프로필렌 선택도가 얻어짐을 간접적으로 시사한다.

(a) Schematic illustrations of CHA-type cages of SSZ-13 and SAPO-34 accommodating a 5MB+ and a 7MB+ cations, respectively. (b) The calculated energies of interactions between 5MB+/7MB+ cations and CHA-type cages of SSZ-13 and SAPO-34. Reproduced from P. Ferri et al., Angew. Chem. Int. Ed., 59, 19708-19715 (2020) with permission of Wiley-VCH GmbH. [40]
또한 더 놓은 에틸렌의 선택도를 보이는 제 2군에 속하는 구조의 경우 그 조성에 따라서 심한 C2/C3비의 편차를 보이는 문제가 있었다. 특히 ERI 구조의 경우 높은 Al 함량을 갖는 SSZ-98 제올라이트의 경우 2에 가까운 높은 C2/C3비를 보인 반면, 동일한 구조를 갖는 SAPO-17 분자체의 경우 Si 함량이 낮은 경우 C2/C3비가 1보다 작아서 오히려 프로필렌이 더 많이 형성되었다. F. H. Alshafei 등은 새장고리 이론의 후속/보완 연구로서, ERI 구조에서는 산점의 밀도가 너무 적거나 약한 경우 탄화수소 활성체 메커니즘의 중간체가 느리게 형성되고, 프로필렌이나 뷰틸렌의 형성을 유도하는 더 긴 알킬 치환기가 형성되는 것을 실험적으로 밝혀내었다.[41] 본 고의 필자는 똑같이 제 2군에 속하는 LEV 구조의 SSZ-17 제올라이트 및 SAPO-35 분자체 또한 비슷한 거동을 보일 것이라 예측한다. 이 연구 결과는 새장고리 이론에서 예측하는 거동으로부터의 편차의 크기가 촉매의 구조에 따라서 달라질 수 있고, 이론을 더욱 보완하기 위하여 해당 분야의 연구의 필요성이 있음을 시사한다.
5. 결론
유가불안 및 자원무기화에 대응하기 위해 석유의존도를 감축하면서 동시에 지속적으로 증가하는 경질 올레핀의 수요를 감당해야 하는 2020년대 현재의 시대적 배경에서 MTO반응에 대한 관심은 계속해서 높아지고 있다. MTO반응에 사용되는 촉매는 새장구조의 기공을 갖는 8MR 소기공 제올라이트 및 AlPO4-계열 분자체로, 탄화수소 활성체 메커니즘의 중간체의 크기를 입체화학적으로 제한하여 생성물의 선택도 분포에 영향을 끼치는 강한 형상선택성을 보인다. MTO반응이 처음 상용화된 80년대 중반부터 40년에 가까운 기간 동안 반응메커니즘과 형상선택성에 관한 연구는 지속적으로 이루어져 왔다. 촉매의 결정구조와 생성물 올레핀의 선택도 분포의 직접적 상관관계를 나타내는 형상선택성에 대한 최초의 일반이론으로서 새장고리 이론이 제안되었다. 새장고리 이론을 활용하면 소기공/새장구조 제올라이트 및 AlPO4-계열 분자체의 결정구조로부터 높은 신뢰도로 결정구조로부터 경질 올레핀 생성물의 선택도 분포를 예측할 수 있다. 이 이론은 거시적인 경향성에 관한 것으로 예측치로부터 큰 편차를 보이는 소수의 사례들이 있다는 한계가 있다. 이에 대해서는 후속 연구를 통하여 부분적인 설명을 제시할 수 있었으나, 새장고리 이론으로부터 편차를 보이는 구조에 대한 추가적인 연구가 여전히 필요함을 확인할 수 있다. 해당 이론을 더욱 보완함으로써 MTO반응과, 그보다 더 넒은 범주의 반응인 MTH반응의 형상선택성에 대한 이해를 더욱 깊게 할 수 있다.
Acknowledgement
이 연구는 서울대학교 신임교수 연구정착금(과제번호: 0668-20200245)으로 지원되는 연구비에 의하여 수행되었음.
References
Biography

◉◉강종헌
◉ 2009년 서울대학교 재료공학부 학사
◉ 2014년 서울대학교 재료공학부 석사
◉ 2019년 Caltech 화학공학과 박사
◉ 2019년 9월–2020년 7월 MIT 화학공학과 박사후연구원
◉ 2020년 9월–현재 서울대학교 화학생물공학부 조교수