(광)전기화학 시스템 전극 재료 분석의 기초
The basics of electrode material evaluation in (photo)electrochemical system
Article information
Abstract
Abstracts
Investigation of the targeted electrode in (photo)electrochemical system is typically carried out in a conventional three-electrode system, which is comprised of working, counter, and reference electrodes in a batch-type electrochemical reactor. Depending on the nature of targeted electrode, appropriate use of the counter electrode, which balances the charge transfers from the working electrode, is recommended to avoid any contaminations. However, this analytical basic has been often ignored, producing non-negligible but incognizant artifact in experimental results and finally leading to a failure in their correct interpretations. Herein, we highlight the importance of selection on counter electrode and cell configuration for achieving the best practice of (photo)electrochemical investigations with two different model systems, i.e., photoelectrochemical hydrogen evolution reaction (HER) on a p-Si photocathode and electrochemical oxygen reduction reaction (ORR) on a polycrystalline platinum. From the model studies, we further discuss about the suitable electrochemical systems for accurate measurements of (photo)electrode materials.
1. 서론
전기촉매작용은 전극/전해질 계면의 물리화학적 이해를 바탕으로 연구가 진행된다. 이를 위한 전극 물질의 정밀한 전압 전류 반응 분석은 일반적으로 작업전극, 상대전극 그리고 기준전극으로 구성 된 3 전극 반응기에서 이뤄진다.1) 전극셀에세는 전류가 작업전극과 상대전극 사이에서 흐르고, 작업전극의 전위는 기준전극을 기준으로 하여 전위조절기로 조절된다. 백금(Pt)은 흔히 사용하는 상대전극으로, 다양한 전기화학 반응에서 높은 안정성과 활성을 띄기 때문이다.2–5) 하지만, 전기화학 반응 도중 Pt 상대전극의 용해/재퇴적(dissolution/redeposition)으로 인해 작업전극의 고유한 특성 평가의 어려움이 존재한다.2–7) 따라서, 백금이 아닌 graphite을 상대전극으로 대체하여 활용하고 있지만, 이에 대한 안정성 및 유효성에 대한 연구는 미미하다. 또는, 작업전극에서 생성된 전류를 상쇄시키기 위해 높은 전압이 graphite 상대전극으로 유도되고, 이는 카본이 열역학적으로 부식(corrosion)됨에 따라 일산화탄소(CO) 혹은 이산화탄소(CO2)가 생성될 수 있다.8,9) 중간체인 CO는 금속 물질에 강하게 흡착하는 종으로 활성점을 피독시킬 수 있는 것으로 알려져 있다.10,11) 상대전극뿐만 아니라 기준전극을 은/염화은(Ag/AgCl)으로 직접 반응기에 이용할 경우 AgCl 염 형태로 반응기 내에 리칭(leaching)을 야기시킬 수 있기에 double junction 을 통한 Ag 불순물의 영향을 배제해야 한다.7,12) 본론에서는 (광)전기화학 시스템 내에서의 수소발생반응과 더불어 산소환원반응을 기반으로 정밀한 특성 평가 시스템의 타당성을 논의하였다.
2. 광전기화학 시스템 내에서 수소 발생 반응 특성 평가
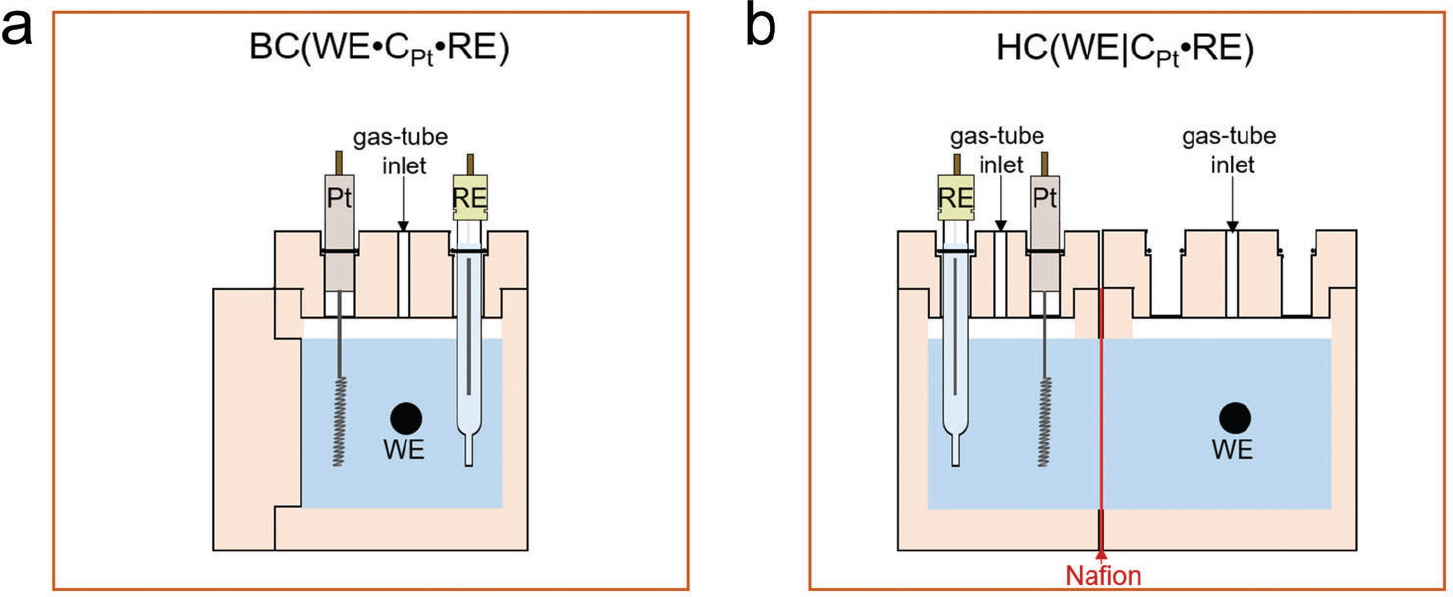
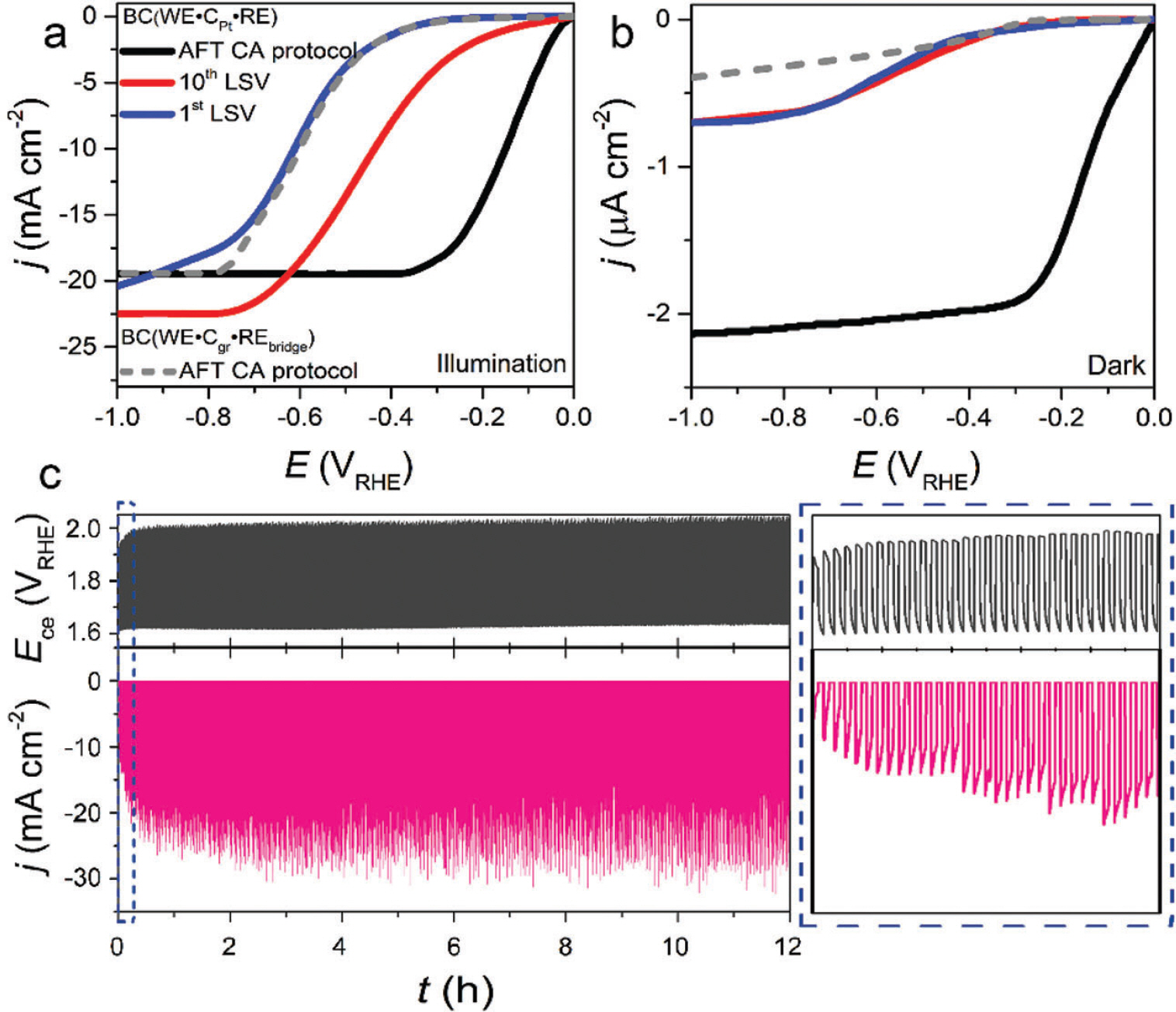
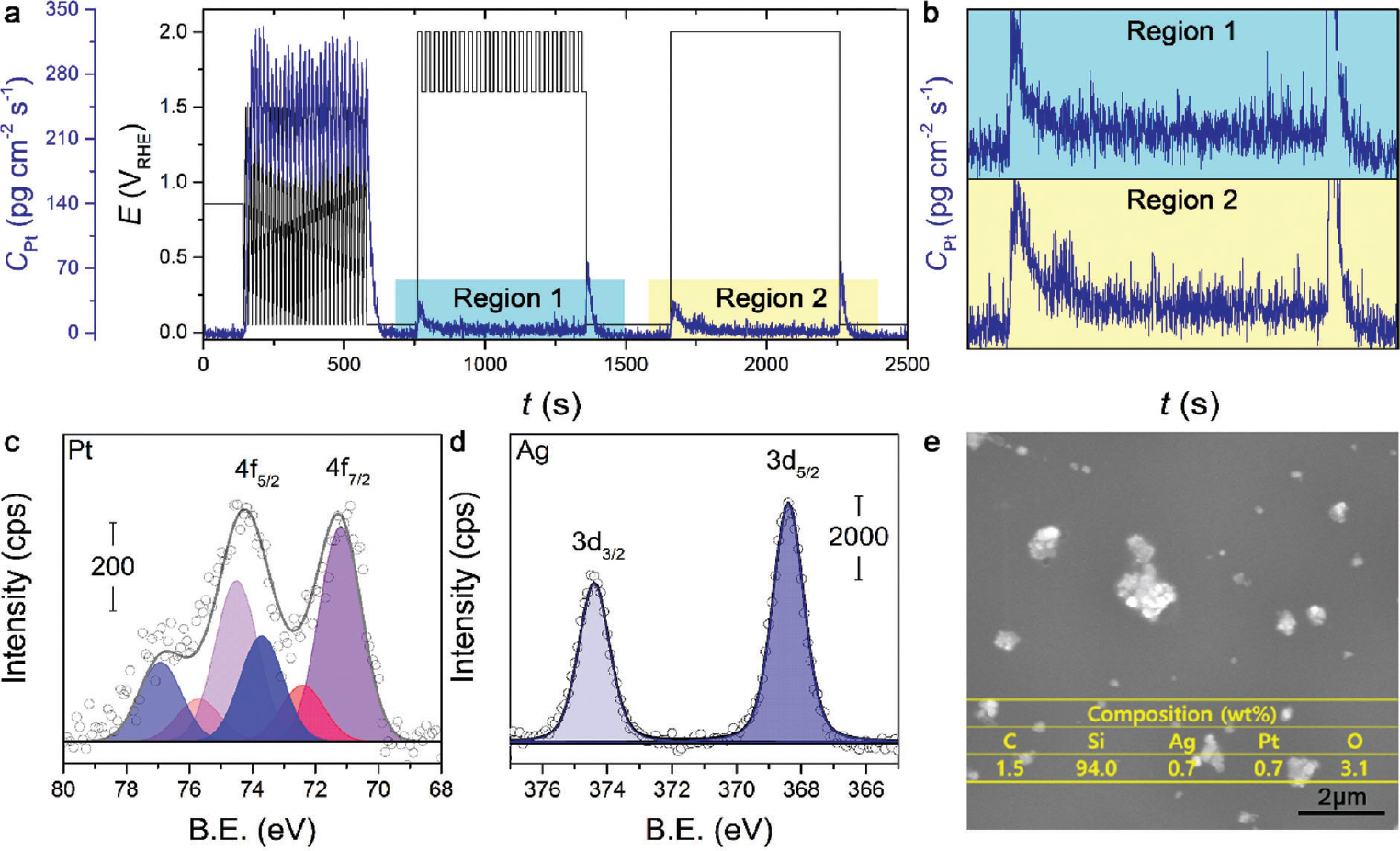
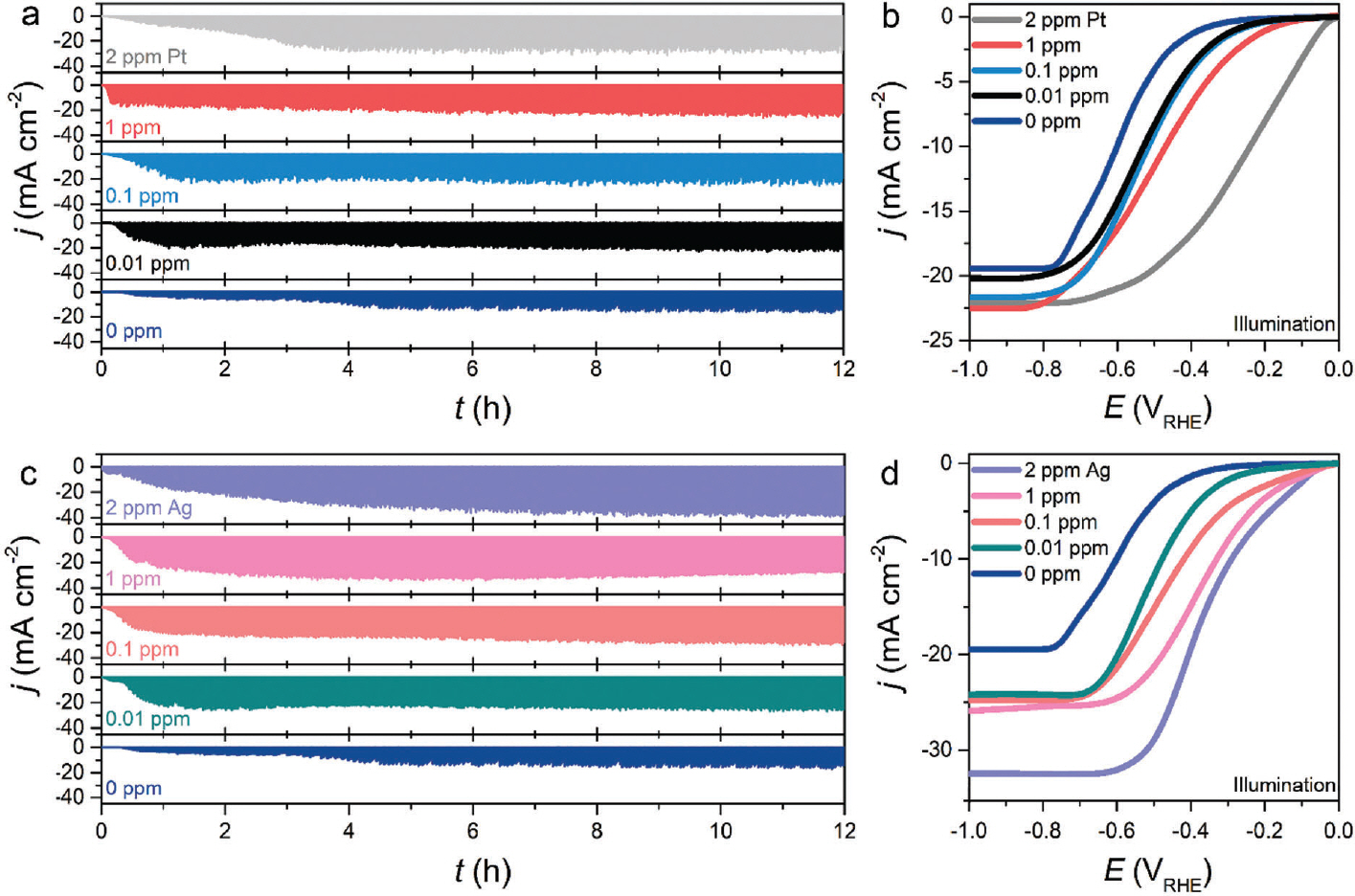
광전기화학 시스템에서 전극 촉매의 정밀한 특성 평가를 위해 H-type 혹은 batch-type cell 형태로 변환 가능한 반응기를 직접 제작하였다 (Fig. 1). 타당성 평가를 위해 Pt 혹은 흑연(graphite) 전극을 필요에 따라 상대전극으로 구성하였으며 Ag/AgCl을 기준전극으로 적용했을 때, double junction 사용 여부에 따른 활성 변화를 비교하였다. 가장 일반적으로 사용하는 batch-type cell에서 수소발생반응을 모델 반응으로 선정하여 활성 변화를 확인했다. Fig. 2는 작업전극, 상대전극 및 기준전극을 p-Si, 백금 와이어(Pt wire) 및 Ag/AgCl 을 이용하여 수소발생반응 활성을 확인했다. 아르곤(Ar)이 충분히 포화된 0.5 M H2 SO4 전해질에서 선형주사전위법(linear sweep voltammetry, LSV)을 통해 수소발생반응 성능을 확인했다(Fig. 2 (a)). 빛이 조사된(light illumination) 조건에서 첫번째와 열번째의 LSV 스캔을 비교해 본 결과, 전류밀도 값이 −1 mA cm−2에 도달할 때 개시 전위(onset potential)는 대략 −0.37 그리고 −0.15 V RHE로 수소발생반응 활성은 스캔 수가 증가 다(Region 1). 또한 지속적인 빛의 조사 조건을 모방하기 위해, 2.0 V RHE에서 정전압을 걸어줌에 따른 Pt 녹는 정도를 확인했다(Region 2). Region 1과 유사하게 Pt이 녹는 것을 확인했고, 그 양은 대략 0.072 ng cm−2으로 정전압 및 전압이 변동하는 구간에서 Pt가 용해될 수 있음을 확인했다. 하지만, Pt가 용해됐더라도 실제로 작업전극에 재퇴적이 가능한지에 대한 여부는 확실치 않다. 따라서 Pt의 용해/재퇴적 현상을 확인하기 위해 엑스선광전자분광법(X-ray photoelectron spectroscopy, XPS) 및 주사전자현미경(Scanning electron microscopy, SEM) 그리고 에너지 분산형 X-선 분광법(Energy-dispersive X-ray spectroscopy, EDX)을 통해 면밀히 분석했다. 앞서 안정성 평가를 진행한 시료를 토대로 분석했고, 결과는 Fig. 3 (c), (d)에 나타냈다. Fig. 3 (c)로부터 표시된 Pt4f 스펙트럼(spectrum)으로부터 3개의 전자 상태(electronic state)인 Pt0(71.2 eV), Pt2+(72.4) 그리고 Pt4+(73.7 eV)로 확인된다. 주요한 state는 Pt0으로 작업전극에 metallic한 Pt 형태로 재퇴적 될 수 있음을 확인했다. 놀랍게도, 작 업전극 표면에 Ag의 재퇴적을 XPS Ag 스펙트럼으로부터 확인했고, metallic한 Ag 형태로 존재한다(Fig. 3 (d)). 이를 토대로, 기준 전극인 Ag/AgCl를 직접 반응기에 배치할 경우, AgCl 염 형태로 전해질에 용해/ 재퇴적될 수 있음을 보여준다. 위 결과를 토대로, Pt 및 Ag는 작업전극인 p-Si에 재퇴적 될 수 있음을 보여준다. 이는 Fig. 3 (e)의 SEM 및 EDX로부터 Pt, Ag 혹은 Pt-Ag 합금 형태로 작업전극 표면에 재퇴적됨을 확인했다. 실험적 근거를 통해 Pt 그리고 Ag가 재퇴적됨에 따른 수소발생반응 활성 영향을 확인하기 위해 불순물이 포함되어 있는 염(염화백금산(chloroplatinic acid) 및 질산은(silver nitrate))을 0.01-2 ppm 농도로 조절하여 Ar이 충분히 포화된 0.5 M H2 SO4 전해질에 녹여 앞서 진행한 CA protocol을 동일하게 측정했다. 또한, Pt 대신 graphite을 상대전극으로 사용했고, 기준전극에는 double junction을 사용하여 기존 시스템에서 Pt 혹은 Ag의 용해/재퇴적 가능성을 배제하고자 하였다. Pt 염이 0.01부터 2 ppm까지 증가할 때, 과전압이(전류 밀도 값이 10 mA cm−2에 도달할 때 값) 530에서 240 mV까지 감소하는 것으로부터 활성 증가를 야기시켰고, 이는 Ag 염 농도의 양이 증가함에 따라 과전압이 감소되는 현상을 확인했다(480에서 290 mV로 감소). 이 결과를 토대로, 소량의 Pt 그리고 Ag 불순물은 무시하지 못할 정도의 활성 향상을 야기시킬 수 있다. 이는 Chung group으로부터 p-Si에 AgPt 합금 나노 입자(AgPt alloyed nanoparticles)를 갈바닉 교환(galvanic exchange) 방법으로 증착함에 따른 수소발생반응 활성 증가 경향성과 비슷한 효과를 보인다.13) 위 그룹에서는 Ag에서 Pt로 수소 스필오버(hydrogen spillover) 효과뿐만 아니라 Pt의 일함수(work function)을 완화시킴에 따른 효율적인 광전자 추출이 주요 원인이라 주장했다. 따라서, 광전기화학을 모델 시스템으로 Pt 상대전극과 Ag/AgCl 기준전극을 이용했을 경우 금속 물질의 용해/재퇴적에 의한 수소발생반응의 활성 증가를 야기시킨다는 것을 확인했다.
3. Graphite 상대전극에 대한 적합성 평가
Pt는 화학적 내구성이 뛰어나고 훌륭한 전기전도체 물질로 다양한 전기화학 반응에 상대전극으로 이용되고 있다. 하지만, 정밀한 전기화학 특성 평가에 대한 적합성에 대해서는 부정적인 영향을 야기시킬 수 있다고 보고된 바 있다. 이는 특정 조건에서 Pt는 열역학적으로 이온 형태로 용해될 수 있고 재퇴적됨에 따라 활성 평가에 상당한 영향을 미친다.2–7) 이와 같은 이유로 graphite 상대전극을 대체제로 사용하고 있다. 하지만, graphite을 상대전극으로 이용했을 경우, 정밀한 전기화학 특성 평가에 적합한지에 대한 의구심이 생긴다. 카본(carbon) 물질은 열역학적으로 E0 – 0.207V RHE 이상부터 부식됨에 따라 CO2를 발생시킬 수 있고 E0 – 0.518 V RHE 이상부터는 중간 생성물인 CO를 생성할 수 있기 때문이다. 14,15) CO는 다양한 금속과 강한 결합 친화성을 갖고 있고 기존의 카본을 지지체로 이용한 Pt/C 그리고 단원자 촉매인 Fe-N-C는 1.2 V RHE 이상의 전압을 가했을 때, CO가 생성될 수 있음을 보고했다.16–18) Graphite 상대전극을 이용할 경우, 금속의 부재로 인해 카본 부식은 다른 반응 경로 혹은 높은 과전압이 걸릴 것으로 예상한다. 하지만, 상대전극은 작업전극으로부터 생성된 전류를 상쇄시키기 위해 자동적으로 전압이 조절되는데, 일반적으로 많은 환원 전류가 발생될 경우, 상대전극에서는 높은 전압이 유도됨에 따라 CO2 혹은 CO가 생성될 수 있는 사실을 무시하지 못한다.19) 본론에서는 graphite를 상대전극으로 이용하였을 때, 전기화학촉매작용에 적합한지 평가했다.
4. Pt 작업전극을 기반한 3 전극셀에서 수소발생 및 산소환원반응 활성 평가
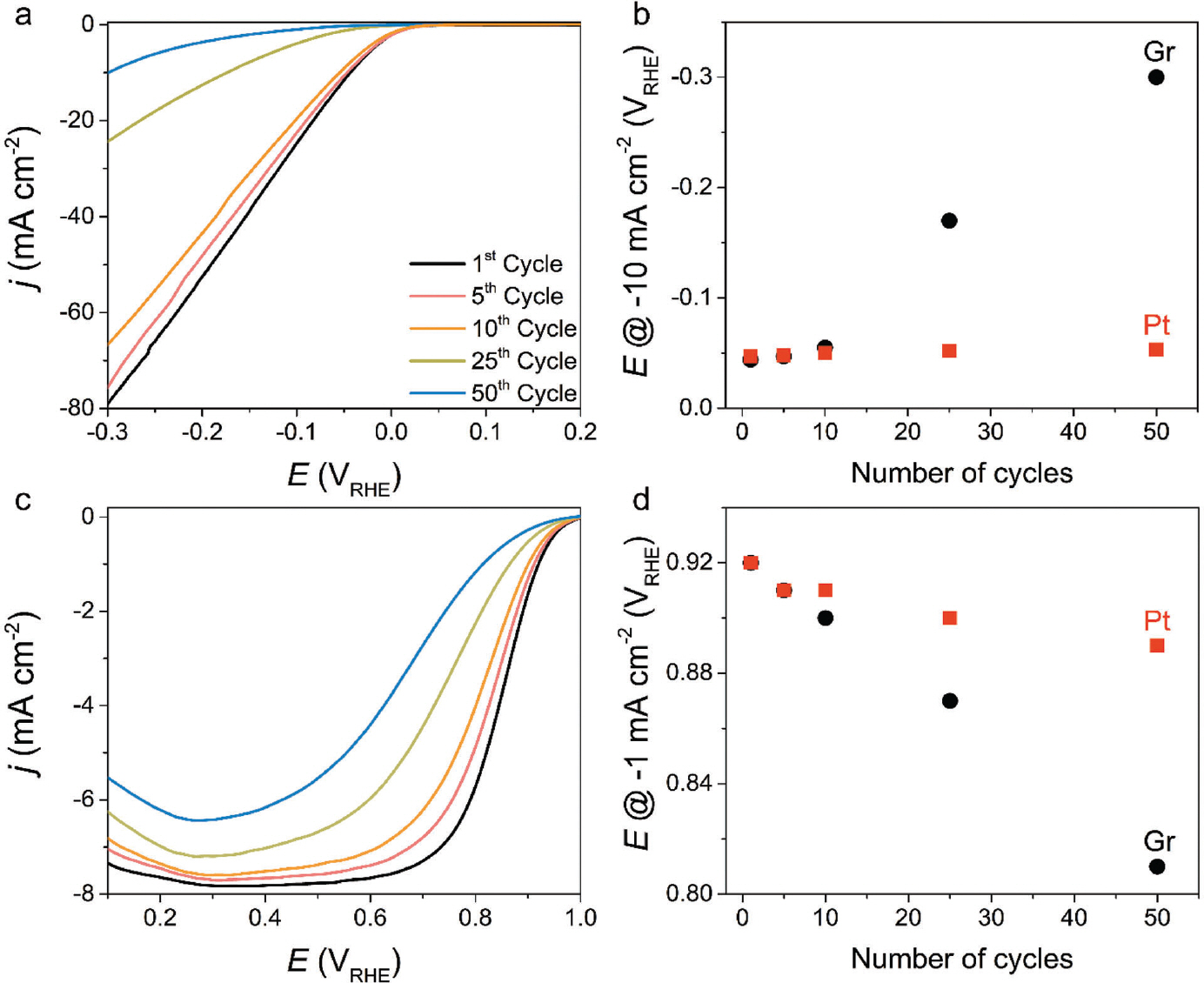
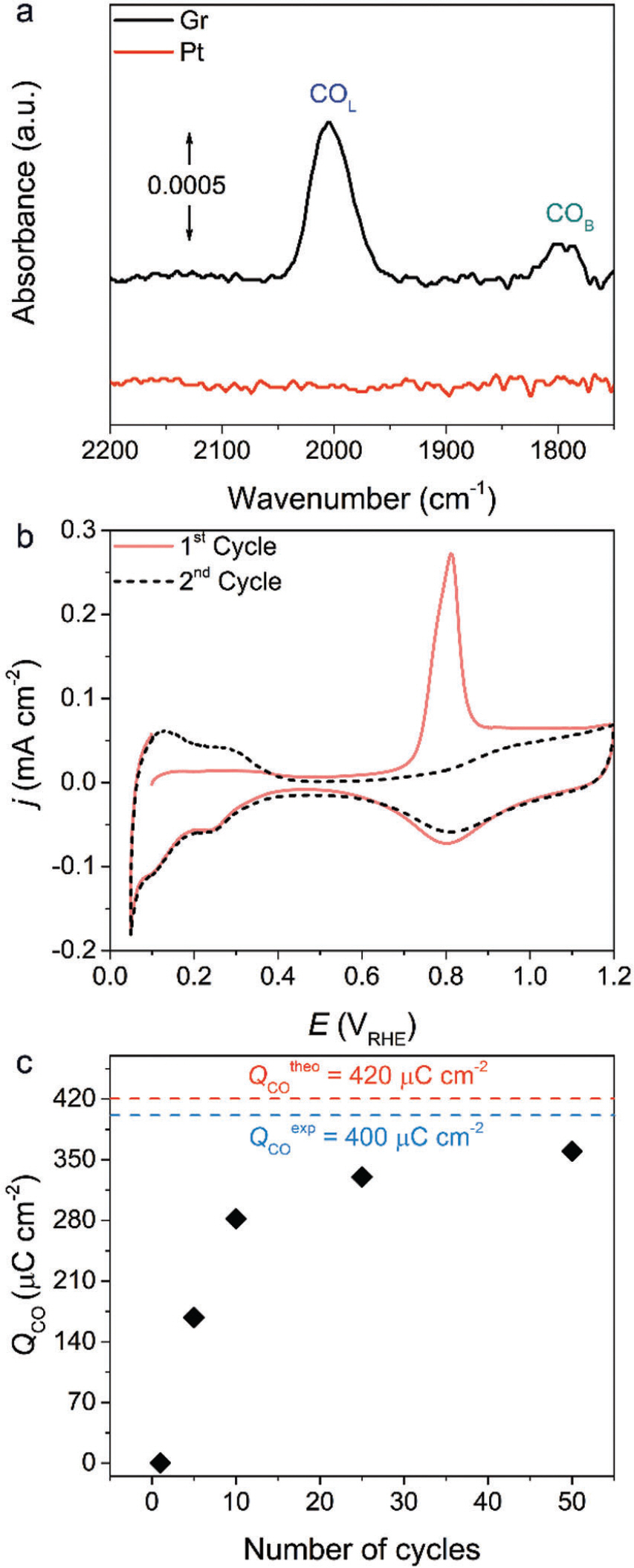
Graphite 상대전극 사용에 대한 타당성을 확인하기 위해 모델 촉매인 polycrystalline Pt를 작업전극으로 이용하여 수소발생 및 산소환원반응 활성을 평가했 다. Ar이 충분히 포화된 0.1 M HClO4 전해질에서 총 50 사이클의 순환전압전류법(cyclic voltammetry)을 통해 수소발생반응을 평가했다(Fig. 5 (a)). 전체적으로 사이클수가 증가함에 따라 활성이 감소하는 것을 확인했고, 이는 생성된 전류 밀도 값이 10 mA cm−2일 때의 과전압을 비교해 본 결과(Fig. 5 (b)), 첫번째 사이클에 비해 50번째 사이클에서 256 mV만큼 증가한 과전압을 확인했다. 또한, Pt를 상대전극으로 사용했을 경우에는 6 mV만큼의 과전압 증가를 확인했을 때, 상당한 활성 감소를 야기시켰다. 비슷한 경향성은 총 50 사이클의 CV를 이용하여 산소환원반응 활성을 측정했을 때도 확인할 수 있었다(Fig. 5 (c)). 첫번째 스캔에서는 polycrystalline Pt의 onset potential 및 확산 전류 밀도(diffusion current density) 값이 대략 1 V RHE 및 −8 mA cm−2으로 4 전자 반응 경로에 인한 산소를 물로 환원시키는 반응이 주요한 것을 확인하였다. 하지만 사이 클 수가 증가함에 따라 onset potential 그리고 확산 조절 영역(diffusion-controlled regions)에서의 전류 밀도가 감소함에 따라 반응 경로가 4 전자에서 2 전자로 바뀌는 것으로 확인됐다. 더 면밀한 비교를 위해 사이클 수에 따라 생성된 전류밀도 값이 −1 mA cm−2일 때의 과전압을 도표했다(Fig. 5 (d)). 첫번재와 50번째의 스캔을 비교했을 때, 110 mV의 과전압 증가를 보였고, 이는 Pt 상대전극을 사용했을 때(30 mV 증가)보다 심화된 비활성화를 야기시켰다. 수소발생 및 산소환원반응 도중 Pt 전극의 빠른 비활성화 원인을 규명하기 위해 우선적으로 graphite 상대전극에 유도된 전압을 확인했다(Fig. 6 (a), (b)). 수소발생반응 중 graphite 상대전극에 걸린 전압은 1.6-1.8V RHE 범위 내에서 동적으로 진동했고, 상대적으로 낮은 전류 밀도를 생성한 산소환원반응에서는 1.4-1.5V RHE 범위 내에서 전압이 변동하였다. 해당하는 전압 범위 내에서는 graphite 상 대전극은 충분히 카본 부식에 의해 CO 및 CO2를 생성할 수 있으며, 이는 금속/carbon 기반 촉매 및 고온에서 일어날 수 있음을 보고했다. 하지만, 본고에서는 상온 조건 및 금속 components가 없기 때문에, 급격한 활성 감소 원인을 설명하기에는 부족하다. 따라서 실시간 전기화학 반응 도중 생성된 휘발성 물질을 분석할 수 있는 online differential electrochemical mass spectrometry(DEMS)를 통해 CO(m/z – 28) 혹은 CO2(m/z – 44)의 생성 여부를 확인했다(Fig. 6 (c)). DEMS 시그널을 향상시키기 위해 다공성 carbon black(Vulcan XC 72R)을 사용했다. 부식 경향성은 수소생성 및 산소환원반응 중 graphite 상대전극에 유도된 전압을 모방하여 전압이 지속적으로 변동한 조건과 정전압 조건에서 확인했다. ‘ORR region’에서 총 20 CV 사이클을 진행함에 따라 발생한 CO2 및 CO의 질량 시그널(mass signal)을 확인했고, ‘HER region’에서는 상 대적으로 더 향상된 질량 시그널을 확인했다. 이 결과를 토대로 수소생성 및 산소환원반응 중 급격한 활성 감소의 원인은 CO라고 추측된다. 이는 Pt랑 강한 결합 친화성(binding affinity)를 갖는 CO는 활성점을 피독시킬 수 있기 때문이다. 하지만, 이 결과만으로 비활성화 향상에 대한 이유를 설명하기에는 불충분하다. CO가 생성되었다 하더라도, 활성을 감소시키기에 충분한 농도인지에 대한 의문 때문이다. 따라서, 강한 결합력을 갖는 CO가 Pt 전극의 흡착 여부를 확인하기 위해 graphite 를 상대전극으로 이용하여 in situ attenuated total reflection surface-enhanced infrared absorption spectroscopy(ATR-SEIRAS)를 도입했다(Fig. 7 (a)). 수소발생반응에 적용한 실험 절차를 이용하여 확인해 본 결과, Pt 표면에 CO는 linear 그리고 bridge 형태로 흡착된 것을 확인했다. 반면, Pt를 상대전극으로 바꿔 확인해 본 결과, 어떠한 시그널도 관찰되지 않았다. 또한, 총 50 사이클의 수소발생반응 후, electrochemical stripping 방법을 통해 CO 피독 효과를 더 면밀히 확인했다(Fig 7 (b)). 첫번째 스캔(0.05-1.2 V RHE)에서는 Pt 의 CV 특성이 보이지 않았고, 대략 0.8 VRHE에서 강한 산화 픽을 확인했다. 두번째 스캔에서는 Pt 전극의 본래 전기화학적 특성이 회복되는 것을 확인함에 따라, 전형적인 CO-stripping 결과와 거의 일치하는 모습을 보인다. 이에 따라, online DEMS, in situ ATR-SEIRAS 그리고 CV 결과로부터, graphite 상대전극을 사용할 경우, CO의 생성/피독에 의해 Pt 전기화학촉매작용의 활성 감소를 야기시킨다. CV 사이클 수의 증가에 따른 피독 경향성을 전하 밀도로 계산해 볼 결과, 50 사이클의 수소발생반응 측정 후, 대략 360 μC cm−2의 전하 밀도가 축적되어 있다(Fig. 7 (c)). 이는 polycrystalline Pt 에 이론적인 흡착 값인 420 uC cm−2에 근접한 값으로 대부분의 활성점을 피독시킨 결과로 보인다. 20) 산소환원반응 평가 후 stripping voltammogram에서는 CO 의 산화 픽이 관찰되지 않았는데, 이는 산소환원반응의 전압 범위가 CO가 산화되는 영역과 중복됨에 따라 경쟁 반응으로 일어났을 것이라고 추측한다. 또한, 수소발생반응 조건과 비교했을 때, 비활성화 정도가 완화되 었고, online DEMS로부터 생성된 CO의 양이 상대적으로 적었기 때문에 상대적으로 낮은 비활성화 정도를 야기시킨것으로 추정한다. CO 피독에 대한 영향을 배제하기 위해 직접 제작한 H-type cell을 적용하여 활성 변화를 비교했다. Catholyte과 anolyte를 분리시키기 위해 양성자 전도성 고분자막인 nafion을 도입하여 graphite 상대전극과 polycrystalline Pt를 분리하였다. Batch-type cell을 이용하여 수소발생반응을 측정했을 때 비해 과전압 증가는 대략 4 mV로 상당히 미미한 활성 변화를 보인다(Fig. 8 (a), (b)). 이러한 경향성은 총 50 사이클의 산소환원반응 측정 후 비교한 과전압으로부터 유사하게 보이고, 대략 40 mV 증가를 야기시켰다(Fig. 8 (c), (d)). 과전압 증가 정도는 Pt를 상대전극으로 이용하여 batch-type cell에서 측정한 수소발생 및 산소환원반응 조건과 유사하다. 이에 따라, H-type cell을 사용했을 때의 활성 감소 요인은 다른 실험적 조건들(e.g., halide 음이온들부터 poisoning 야기)로부터 발생한 것으로 추정된다. 산 분위기에서 graphite 상대전극을 사용할 경우, 수소발생 및 산소환원반응 중 polycrystalline Pt 전극이 오염될 수 있는 사실을 입증했다.
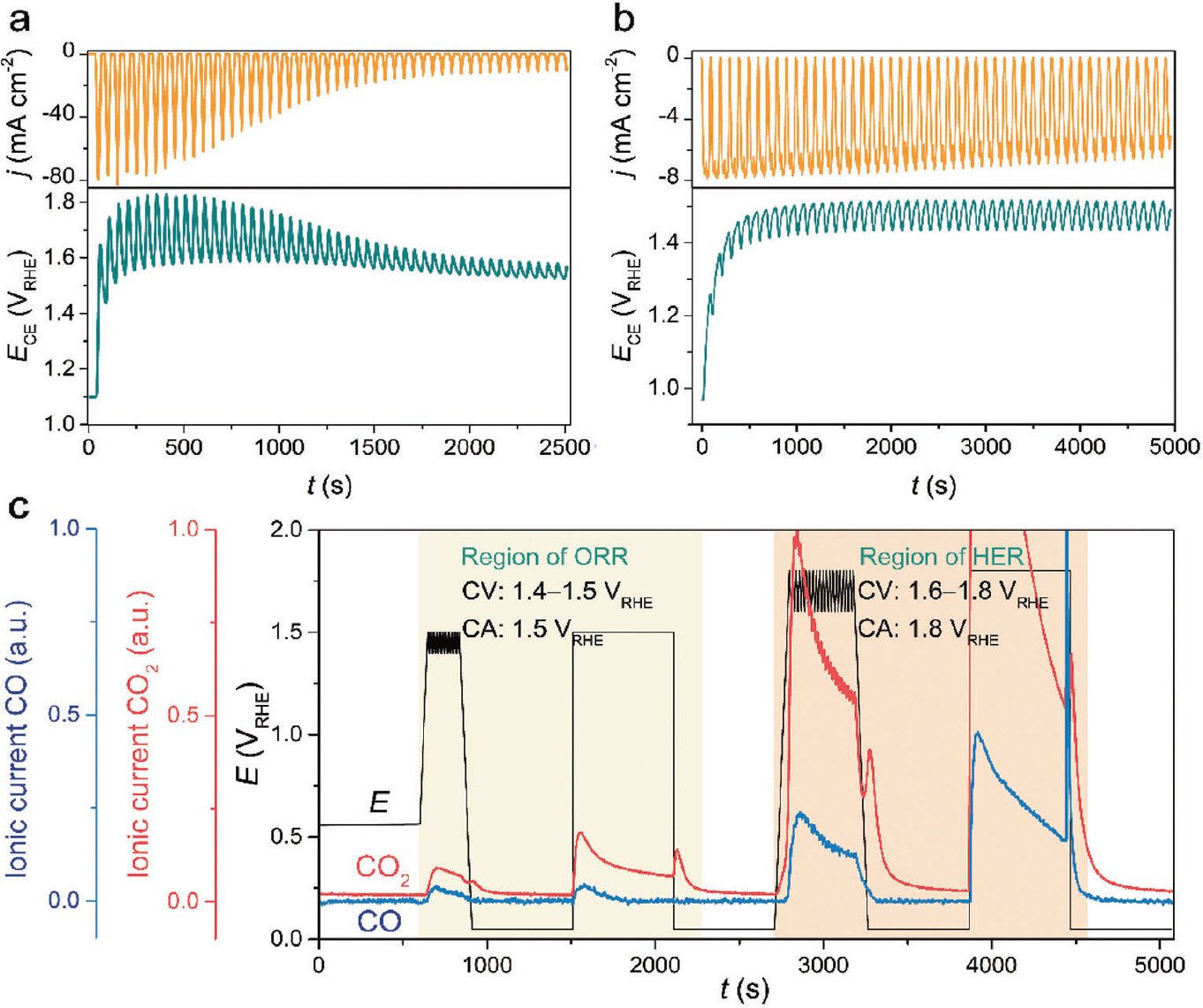
50 사이클의 (a) 수소발생 및 (b) 산소환원반응 동안 polycrystalline Pt의 측정된 전류 밀도(upper panel) 및 동시에 graphite 상대전극에 유도된 전압(lower panel). 다공성 carbon black(Vulcan XC 72R)을 모델 촉매로, 실시간 전기화학 반응 도중 생성된 CO 및 CO2를 online DEMS을 이용하여 확인.19) Reprinted with permission from (ACS Catal. 2020, 10, 18, 10773–10783). Copyright (2020) American Chemical Society.
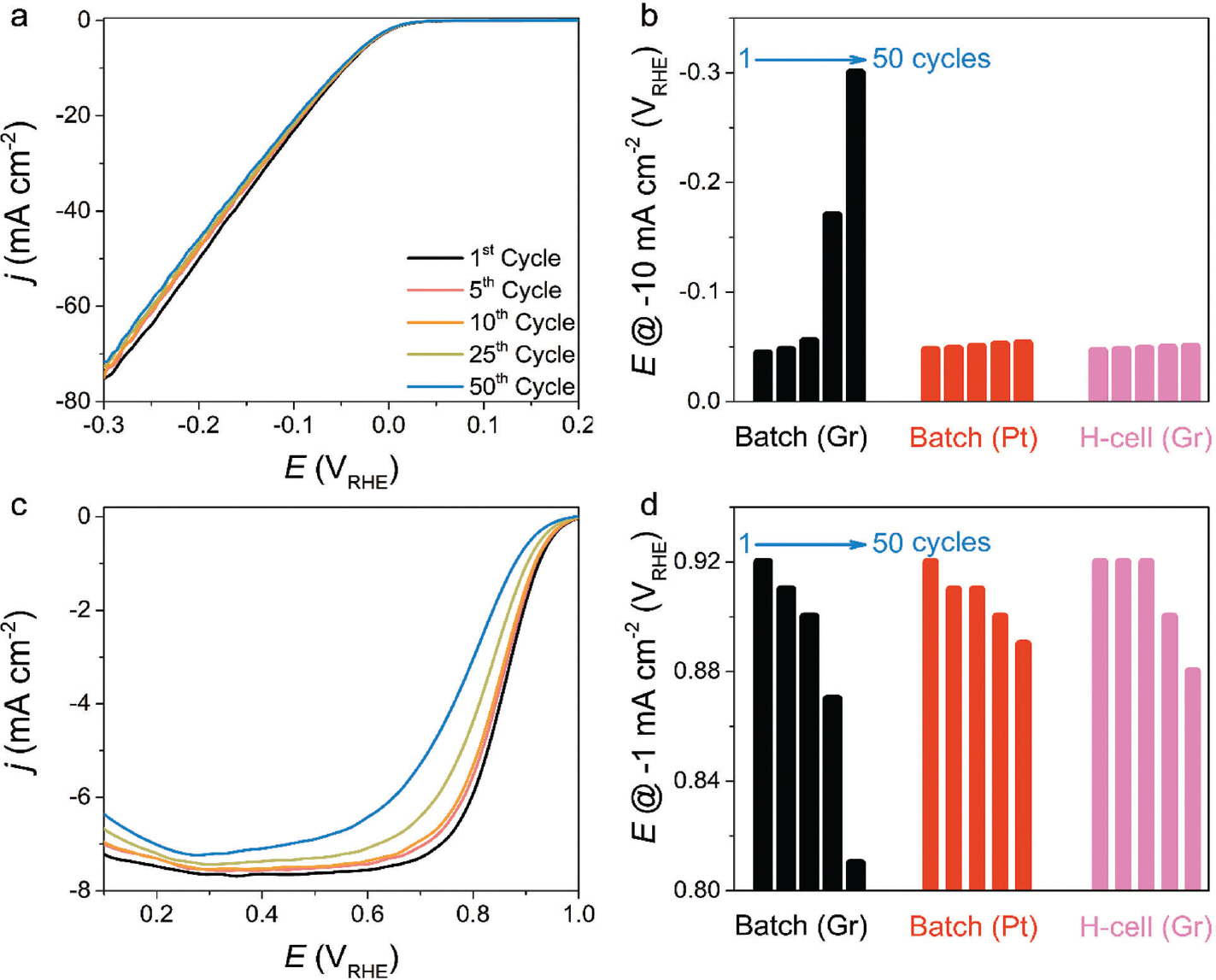
H-type cell을 이용한 polycrystalline Pt의 (a) 수소발생 및 (c) 산소환원반응 활성 측정. Graphite 상대전극은 nafion 멤브레인을 통해 분리. Batch type 및 H-type cell에서 측정한 전류 밀도가 (b) −10 mA cm−2(수소발생반응) 그리고 (d) −1 mA cm−2(산소환원반응)의 과전압 비교. 비교를 위해 Pt 상대전극이 배치되어 있는 batch type cell 이용(‘Batch (Pt)).19) Reprinted with permission from (ACS Catal. 2020, 10, 18, 10773–10783). Copyright (2020) American Chemical Society.
5. 결론
본론에서는 (광)전기화학 시스템을 모델로 3전극 시스템 내에서 상대전극 및 기준전극의 타당성을 평가했다. 광전기화학 시스템내에서 Pt 그리고 Ag/AgCl를 batch-type cell에 적용할 경우, 용해/재퇴적 현상에 의해 수소발생반응 성능이 과대평가될 수 있음을 보여줬다. 또한, 전기화학 시스템에서는 graphite 상대전극 으로 대체할 경우, 생성된 CO가 Pt 활성점을 피독시켜 전기촉매작용에 상당한 과소평가를 미칠 수 있음을 입증했다.21) 본 연구의 결과로부터, 촉매 표면에 오염될 수 있는 원인을 방지하기 위해서는 세심한 주의를 기울여 평가하고자 하는 시스템을 설계하는 것이 중요하다. 작업전극, 전기화학반응, 전위창 범위를 고려하여 적절한 상대전극을 선택하는 것을 추천한다.
References
Biography

◉◉지 상 구
◉ 2018년 서울대학교 재료공학부 석사
◉ 2018년-현재 광주과학기술원 신소재공학부 박사과정

◉◉최 창 혁
◉ 2012년 한국과학기술원 생명화학공학 박사
◉ 2014년 한국과학기술원 생명화학공학 포닥연구원
◉ 2016년 Max-Planck-Institut für Eisenforschung 포닥연구원
◉ 2016년-현재 광주과학기술원 신소재공학부 조교수, 부교수