ņä£ļĪĀ
ĒÖöņäØņŚ░ļŻīņØś ņŚ░ņåīļŖö ļģ╝ļ×ĆņØś ņŚ¼ņ¦ĆņŚåņØ┤ ņś©ņŗżĒÜ©Ļ│╝ņŚÉ ņāüļŗ╣ ļČĆļČä ĻĖ░ņŚ¼ĒĢśļ®░ ļīĆĻĖ░ ņżæņ£╝ļĪ£ ļ¦ēļīĆĒĢ£ ņ¢æņØś ņØ┤ņé░ĒÖöĒāäņåīļź╝ ļ░®ņČ£ĒĢ©ņ£╝ļĪ£ņŹ© ĒÖśĻ▓ĮņŚÉ ļ¦ēļīĆĒĢ£ Ēö╝ĒĢ┤ļź╝ ņ×ģĒ׳Ļ│Ā ņ׳ļŗż1,2). ņØ┤ņé░ĒÖöĒāäņåī ņ▓śļ”¼ ĻĖ░ņłĀņØĖ Ēāäņåī Ēżņ¦æ ļ░Å ņĀĆņן (Carbon capture and storage) ĻĖ░ņłĀņØĆ ņØ┤ņé░ĒÖöĒāäņåīĻ░Ć ļīĆĻĖ░ ņżæņ£╝ļĪ£ ņ£Āņ×ģļÉśļŖö Ļ▓āņØä ļ¦ēņĢäņŻ╝ļŖö ņżæņÜöĒĢ£ ĻĖ░ļŖźņØä ņłśĒ¢ēĒĢśņŚ¼ ņäØņ£Ā, ņäØĒāä ļ░Å ņ▓£ņŚ░ Ļ░ĆņŖżņØś ņŚ░ņåīļĪ£ļČĆĒä░ ņāØņä▒ļÉ£ ņØ┤ņé░ĒÖöĒāäņåīņØś ņĢĮ 90%ļź╝ ņĀ£Ļ▒░ĒĢśĻ│Ā ņØĖĻ░äņāØĒÖ£ņŚÉ ĒĢäņÜöĒĢ£ ņŚÉļäłņ¦Ćļź╝ ņĀ£Ļ│ĄĒĢ£ļŗż3ŌĆō5). ĻĘĖļ¤¼ļéś ņāüļŗ╣Ē׳ ļ╣äņŗ╝ ņØ┤ņé░ĒÖöĒāäņåī ņĀĆņןĻ│╝ ņÜ┤ņåĪ ļ╣äņÜ®ņ£╝ļĪ£ ņĀäĻĖ░ĒÖöĒĢÖ ļ░Å Ļ┤æĒÖöĒĢÖņĀüņØĖ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░®ļ▓ĢņØä ļīĆņĢłņ£╝ļĪ£ ņé╝Ļ│Ā ņ׳ļŗż. ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉņØä ņ£äĒĢ£ ņĀäĻĖ░ĒÖöĒĢÖņĀü ļśÉļŖö Ļ┤æĒÖöĒĢÖņĀüņØĖ ņĀæĻĘ╝ļ▓ĢņØĆ ņØ┤ņé░ĒÖöĒāäņåī ļČäņ×ÉņØś ņŚ┤ņŚŁĒĢÖņĀü ņĢłņĀĢņä▒ņŚÉ ņØśĒĢ┤ ņÜöĻĄ¼ļÉśļŖö ļŗżļŗ©Ļ│ä ļ░śņØæ Ļ│╝ņĀĢņØä ĒżĒĢ©ĒĢ£ļŗż. ņØ┤ ļ░śņØæņØĆ ļŖÉļ”░ ņÜ┤ļÅÖĒĢÖ ļ░Å ņŚÉļäłņ¦ĆņØś ņ¦æņĢĮņĀü Ļ░ÉņåīļĪ£ ļ¼╝ļČäĒĢ┤ņŚÉ ļ╣äĒĢ┤ ļ│Ąņ×ĪĒĢ£ ļ░śņØæņØä Ļ░Ćņ¦ĆļŖöļŹ░ ņØīņØ┤ņś© ļØ╝ļööņ╣╝ (CO2ŌłÆ)ņØä ņ£ĀņÜ®ĒĢ£ ņ£ĀĻĖ░ ĒÖöĒĢÖ ļ¼╝ņ¦łļĪ£ ļ│ĆĒÖśĒĢśĻĖ░ ņ¢┤ļĀĄĻĖ░ ļĢīļ¼ĖņŚÉ ĒÅēĒśĢ ņĀäņ£äļź╝ Ļ░ĆĒĢśĻ▒░ļéś ņØ┤ņé░ĒÖöĒāäņåīĻ░Ć ņäĀĒāØņĀüņØĖ ļ│ĆĒÖśņØä ĒĢĀ ņłś ņ׳ļŖö ņĀäņ£äļź╝ Ļ░ĆĒĢ┤ņĢ╝ ĒĢ£ļŗż6). ņĀäĻĖ░ ņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæņ£╝ļĪ£ ņØ┤ņé░ĒÖöĒāäņåīļź╝ ņØ╝ņé░ĒÖöĒāäņåī, ļ®öĒāäņś¼, ļ®öĒāä, ņŚÉĒāäņś¼ ļō▒ ņ£ĀņÜ®ĒĢ£ ņāØņä▒ļ¼╝ņØä ļ¦īļōżņ¢┤ļéĖļŗż7ŌĆō12). 1870ļģä ņĀäĻĖ░ ņ┤ēļ¦żļĪ£ ņĢäņŚ░ ņĀäĻĘ╣ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåīļź╝ ĒÅ╝ņé░ņ£╝ļĪ£ ļ│ĆĒÖśņŗ£Ēé© ņŚ░ĻĄ¼Ļ░Ć ņ▓śņØīņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłĻ│Ā, ĻĘĖ ļÆżļź╝ ļö░ļØ╝ ņŻ╝ņäØ, ņØĖļōÉ, ĒīöļØ╝ļōÉ, ņ╣┤ļō£ļ«┤ ļō▒ ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ĻĖłņåŹņØä ņØ┤ņÜ®ĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśņŚłļŗż13,14). ņĢłĒāĆĻ╣ØĻ▓īļÅä ņØ┤ļ¤¼ĒĢ£ ĻĖłņåŹļōżņØĆ ļ¦żņÜ░ ĻĘĆĒĢśĻ│Ā ļ╣äņŗĖ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉņŚÉ ļīĆĒĢ£ ļīĆļ¤ē ņé¼ņÜ®ņØ┤ ņĀ£ĒĢ£ļÉ£ļŗż. ļö░ļØ╝ņä£ ņןĻĖ░ņĀüņØĖ ņāØņé░ļĀźņØä ĒÖĢļ│┤ĒĢśĻĖ░ ņ£äĒĢ┤ ņÜ░ņłśĒĢ£ ĒÖ£ņä▒ļÅäņÖĆ ņĢłņĀĢņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ĒÆŹļČĆĒĢśĻ│Ā Ļ░ÆņØ┤ ņŗ╝ ņ┤ēļ¦żļź╝ ļ¦īļōżņ¢┤ ļé┤ļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļ®░ ĻĘĖ ņżæ ņØ┤ņ░©ņøÉ ļ¼╝ņ¦łņØĖ ĻĘĖļלĒĢĆ, ņĀäņØ┤ĻĖłņåŹņ╣╝ņĮöĻ▓ÉĒÖöĒĢ®ļ¼╝ (TMD), ĻĖłņåŹ-ņ£ĀĻĖ░ Ļ│©Ļ▓®(MOFs)ņØĆ ņĀäĻĖ░ĒÖöĒĢÖņĀü ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ņ┤ēļ¦żļĪ£ ņ£Āļ¦ØĒĢ£ Ēøäļ│┤ĻĄ░ņ£╝ļĪ£ ņŚ░ĻĄ¼ļÉśĻ│Ā ņ׳ļŗż22ŌĆō25).
ļ░śļÅäņ▓┤ ĻĖ░ļ░śņØś Ļ┤æņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ĻĖ░ņłĀņØĆ ņĀäĻĖ░ĒÖöĒĢÖņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ ļ░®ļ▓ĢĻ│╝ļŖö ņÖäņĀäĒ׳ ļŗżļźĖ ļ░®ļ▓Ģņ£╝ļĪ£ ņŚÉļäłņ¦ĆņÖĆ ĒÖśĻ▓Į ļ¼ĖņĀ£ļź╝ ĒĢ┤Ļ▓░ĒĢśĻ│Ā ņ׳ļŗż. 1978ļģä HalmannņØĆ Ēā£ņ¢æļ╣ø ņĪ░ļ¬ģņØä ņĪ░ņé¼ĒĢśņŚ¼ PĒśĢ ņØĖĒÖöĻ░łļź© (GaP) ņĀäĻĘ╣ņØä ņé¼ņÜ®ĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåīļź╝ ņØ╝ņé░ĒÖöĒāäņåīņÖĆ ļ®öĒāäņś¼ļĪ£ ļ│ĆĒÖśĒĢśļŖö ĻĖ░ņłĀņØ┤ ņ▓śņØīņ£╝ļĪ£ ņåīĻ░£ļÉ£ ļÆż, ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņ×ÉļōżņØĆ ņ×ÉņÖĖņäĀ ņĪ░ņé¼ ņŗ£ ĒÅ╝ņé░, Ēżļ”äņĢīļŹ░ĒĢśņØ┤ļō£, ļ®öĒŗĖ ņĢīņĮöņś¼ļĪ£ ļ│ĆĒÖśĒĢśĻĖ░ ņ£äĒĢ┤ ņØ┤ņé░ĒÖö ĒāĆņØ┤ĒāĆļŖä (TiO2), ņé░ĒÖö ņĢäņŚ░ (ZnO), ĒÖ®ĒÖö ņ╣┤ļō£ļ«┤ (CdS), ņØĖĒÖö Ļ░łļź© (GaP) ļō▒ ļŗżņ¢æĒĢ£ ļ░śļÅäņ▓┤ Ļ┤ĆļĀ© Ļ┤æņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ĒÜ©ņ£©ņØä ļåÆņØ┤ĻĖ░ ņ£äĒĢ£ ļģĖļĀźĒ¢łļŗż. ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ļ░śļÅäņ▓┤ ņżæ, TiO2ļŖö ļø░ņ¢┤ļé£ Ļ┤æ ļé┤ĻĄ¼ņä▒, ļé«ņØĆ ļÅģņä▒, ĒÆŹļČĆĒĢ£ ļ¦żņןļ¤ē, ĻĘĖļ”¼Ļ│Ā ņĀĆļĀ┤ĒĢśļŗżļŖö ņןņĀÉņ£╝ļĪ£ ļ¦ÄņØĆ ņŚ░ĻĄ¼Ļ░Ć ļÉśĻ│Ā ņ׳ņ¦Ćļ¦ī ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØś ļ¦żņÜ░ ļ╣ĀļźĖ ņ×¼ņĪ░ĒĢ®ņ£╝ļĪ£ ņŚ┤ņØ┤ļéś Ļ┤æņ×ÉņØś ĒśĢĒā£ļĪ£ ņŚÉļäłņ¦ĆĻ░Ć ļ░®ņČ£ļÉśņ¢┤ 3.2eVņØś Valance Band (VB)ņÖĆ Conduction Band (CB) Ļ░ä Ļ▒░ļ”¼ļĪ£ ņ×ÉņÖĖņäĀ Ēīīņןņ£╝ļĪ£ļ¦ī ņĀ£ĒĢ£ļÉ£ļŗżļŖö ļŗ©ņĀÉņØ┤ ņ׳ļŗż26). ņØ┤ļź╝ ĻĘ╣ļ│ĄĒĢśņŚ¼ Ļ│ĀĒÜ©ņ£©ņØś ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉņØä ņ£äĒĢ┤ņäĀ ņŗĀņåīņ×¼ņØś ņä▒ņןņØ┤ ļ░öĒāĢņØ┤ ļÉśņ¢┤ ņ┤ēļ¦żņØś ĒśĢĒā£ĒĢÖņĀü ĻĄ¼ņĪ░ņÖĆ ĒÖöĒĢÖ ņä▒ļČäņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ¦äĒ¢ēļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż.
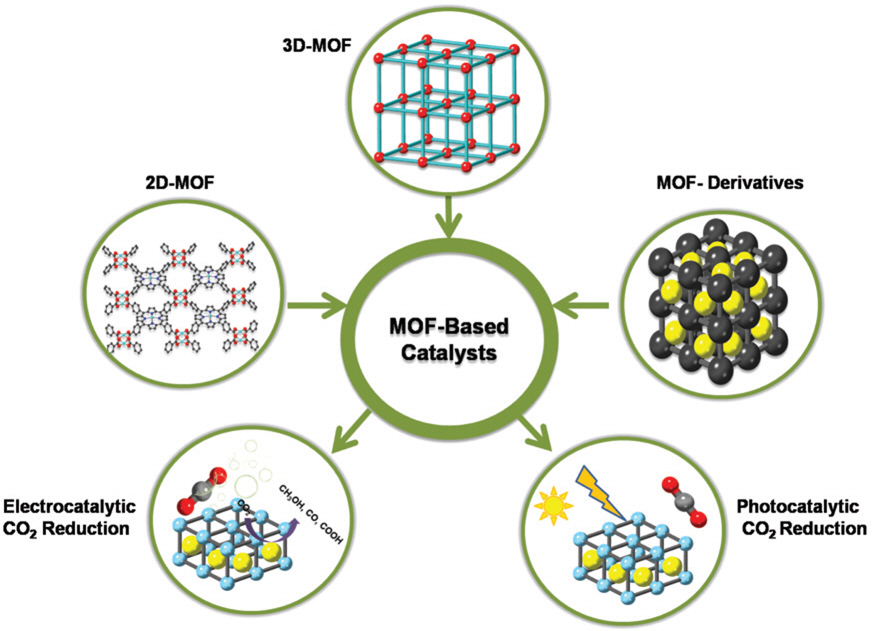
ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæņØś ņ£Āļ¦ØĒĢ£ Ēøäļ│┤ ņżæ ĒĢśļéśņØĖ MOFļŖö ļŗżņ¢æĒĢ£ ĻĖłņåŹ ņØ┤ņś© (e.g., CO2+, Zn2+, Ni2+, Cu2+, M2+)Ļ│╝ ņ£ĀĻĖ░ ļ¦üņ╗ż (carboxylate, sulfonate, phosphonate)ļĪ£ ņĀ£ņ×æĒĢśļ®░ ņĀüņØæņä▒Ļ│╝ ļ░śņØæņä▒ņØ┤ ĒÆŹļČĆĒĢ£ MOFļź╝ ļ¦īļōżņ¢┤ ļé╝ ņłś ņ׳ļŗż27). Ēśäņ×¼Ļ╣īņ¦Ć ļäōņØĆ Ēæ£ļ®┤ņĀüĻ│╝ ĻĄ¼ņĪ░ļź╝ ņĪ░ņĀĢĒĢĀ ņłś ņ׳ļŗżļŖö ĒŖ╣ņä▒ņ£╝ļĪ£ Ļ░ĆņŖż ĒØĪņłś30ŌĆō32), ņ┤ēļ¦ż33ŌĆō35), ņä╝ņä£36ŌĆō38) ļ░Å ņĢĮļ¼╝ ņĀäļŗ¼39) ļō▒ ļŗżņ¢æĒĢ£ ņØæņÜ® ļČäņĢ╝ņŚÉ ļīĆĒĢ┤ 2ļ¦īĻ░£ ņØ┤ņāüņØś MOFĻ░Ć ļ¼ĖĒŚīņ£╝ļĪ£ ļ░£Ēæ£ļÉśņŚłļŗż28ŌĆō29). MOFļŖö ļ¬©ļōĀ ļŗżĻ│Ąņä▒ ļ¼╝ņ¦łņŚÉņä£ Ļ░Ćņן ļåÆņØĆ ļ╣äĒæ£ļ®┤ņĀüĻ│╝ ņØ┤ņé░ĒÖöĒāäņåī ņĀĆņןņØä ļ│┤ņŚ¼ņŻ╝ļŖöļŹ░40ŌĆō43), 2010ļģä Furukawa40)ĻĘĖļŻ╣ņŚÉņä£ 3.6 m3 gŌłÆ1ņØś pore volumeĻ│╝ 2870 mg gŌłÆ1ņØ┤ļØ╝ļŖö ļø░ņ¢┤ļé£ ņØ┤ņé░ĒÖöĒāäņåī ĒØĪņ░® ļŖźļĀźņØä ļ│┤ņØ┤ļŖö MOF-210 ņĀ£ņ×æņŚÉ ņä▒Ļ│ĄĒĢśņŚ¼ ļ│┤Ļ│ĀļÉ£ ļ¬©ļōĀ ņŚ░ĻĄ¼ ņżæ ņĄ£Ļ│ĀņØś ņä▒ļŖźņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. MOFļŖö ĒÖ£ņä▒ ņ×Éļ”¼ņŚÉ ņØ┤ņé░ĒÖöĒāäņåī ļČäņ×ÉĻ░Ć Ļ▓░ĒĢ®ĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉņØä ņ┤ēņ¦äņŗ£ĒéżļŖöļŹ░, ĻĄ¼ņĪ░ņĀüņ£╝ļĪ£ ņĪ░ņĀĢņØ┤ Ļ░ĆļŖźĒĢśļŗżļŖö ĒŖ╣ņä▒ņ£╝ļĪ£ ĒŖ╣ņĀĢ ņÜ®ļÅäņŚÉ ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŖö ļ¦×ņČżĒśĢ MOFļź╝ ņĀ£ņ×æĒĢĀ ņłś ņ׳ļŖö ņןņĀÉņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż44ŌĆō46). MOFļŖö ĻĖłņåŹ ļģĖļō£ (metal node)ņÖĆ ņ£ĀĻĖ░ ļ¦üņ╗ż ļæś ļŗż ņ┤ēļ¦ż ņ×æņÜ®ņØä ļ│┤ņŚ¼ņŻ╝Ļ│Ā46), ņĀäņØ┤ ĻĖłņåŹ ļČĆņ£äļŖö ņłśņåī ļ░£ņāØ ļ░śņØæ (HER)47ŌĆō49), ņé░ņåī ĒÖśņøÉ ļ░śņØæ (ORR)50ŌĆō53), ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ (CO2 RR)ņØä ĒżĒĢ©ĒĢ£ ļŗżņ¢æĒĢ£ ļČäņĢ╝ņŚÉņä£ ĒÜ©ņ£© ņĀüņØĖ ņ┤ēļ¦żļĪ£ ĒÖ£ņÜ®ļÉśĻ│Ā ņ׳ļŗż. Fu ĻĘĖļŻ╣ņØĆ ņØ┤ņé░ĒÖöĒāäņåīļź╝ ĒÅ╝ņé░ņŚ╝ņ£╝ļĪ£ ļ│ĆĒÖśĒĢśĻĖ░ ņ£äĒĢ┤ ņ£ĀĻĖ░ ļ¦üņ╗żņŚÉ ņĢäļ»ĖļģĖĻĖ░ļź╝ ņČöĻ░ĆĒĢśņŚ¼ MIL-125(Ti)ņØś ĒŖ╣ņä▒ņØä ļ░öĻ┐ö ņ┤ēļ¦żļĪ£ ņé¼ņÜ®Ē¢łĻ│Ā54) ņĢäļ»ĖļģĖĻĖ░ļź╝ ņČöĻ░ĆĒĢ£ NH2-MIL-125(Ti)ļŖö ĻĖ░ņĪ┤ņØś MIL-125(Ti)ņØś ņ┤ēļ¦ż ņä▒ļŖźņØä ļīĆĒÅŁ Ļ░£ņäĀņŗ£ņ╝░ļŗż. Guo ĻĘĖļŻ╣55)ņØĆ ņĢäļ»ĖļģĖĻĖ░Ļ░Ć ņČöĻ░ĆļÉ£ UiO-68ņŚÉ ĻĖłņåŹ ļéśļģĖņ×ģņ×É ņĢłņĀĢĻĖ░ (metal nanoparticle stabilizer)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ Ļ┤æņ┤ēļ¦żļĪ£ņä£ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ņä▒ļŖźņØä ļåÆņśĆĻ│Ā, size engineering56)Ļ│╝ ņØ┤ĒśĢņĀæĒĢ® ĻĄ¼ņĪ░ ĒśĢņä▒57ŌĆō60), ņāłļĪ£ņÜ┤ ļ”¼Ļ░äļō£ ĻĄ¼ņĪ░61)ņÖĆ Ļ░ÖņØĆ ņāłļĪ£ņÜ┤ ļ░®ļ▓ĢņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļź╝ Ē¢łļŗż.
ļ│Ė ĻĖĆņØĆ ņØ┤ņé░ĒÖöĒāäņåīļź╝ ĒÖśņøÉņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ MOF ĻĖ░ļ░śņØś ņĀäĻĖ░ĒÖöĒĢÖ ņ┤ēļ¦żņÖĆ Ļ┤æņ┤ēļ¦żņŚÉ ļīĆĒĢ£ ņĄ£ĻĘ╝ ņŚ░ĻĄ¼ļź╝ ĒżĻ┤äņĀüņ£╝ ļĪ£ ņĀ£ņŗ£ĒĢśĻ│Ā(ĻĘĖļ”╝1), MOF ĻĖ░ļ░ś ņ┤ēļ¦żņŚÉ Ļ┤ĆļĀ©ļÉ£ ņāüņäĖĒĢ£ ļģ╝ņØśņÖĆ ņĀ£ņ×æ ļ░®ļ▓Ģ, ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæņØś ĻĖ░ļ│Ė ņøÉļ”¼ļź╝ ņÜöņĢĮĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæņØś ĻĖ░ļ│Ė
2.1 ņĀäĻĖ░ĒÖöĒĢÖņĀü ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ
ĻĖ░ļ│Ė ļ®öņ╗żļŗłņ”ś
ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņĀäĻĖ░ņ┤ēļ¦żļŖö ņĀäņ£äņŚÉ ļö░ļØ╝ ņØ┤ņé░ĒÖöĒāäņåīļź╝ ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ĻĘĆĒĢ£ ņāØņä▒ļ¼╝ļĪ£ ļ│ĆĒÖśņŗ£ĒéżļŖö ļ░śņØæņ£╝ļĪ£ Ēæ£1Ļ│╝ Ļ░ÖņØ┤ ļŗżņ¢æĒĢ£ ņĀäņ£äņŚÉņä£ņØś ļŗżņżæ ļ░śņØæņØä ļ│┤ņŚ¼ņżĆļŗż. ĻĘĖļ”╝ 2ļŖö ļ░śņØæņØä ĒåĄĒĢ┤ ļ®öĒāä, ļ®öĒŗĖņĢīļŹ░Ē׳ļō£, ĒÅ╝ņé░, ņŚÉĒŗĖļĀī ļō▒ ļŗżņ¢æĒĢ£ ņāØņä▒ļ¼╝ņØ┤ ļ¦īļōżņ¢┤ņ¦ĆļŖö Ļ▓āņØä ļ│┤ņŚ¼ņżĆļŗż. ĻĘĖļ¤¼ļéś ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņżæ ņłśņåī ļ░£ņāØ ļ░śņØæņØ┤ ļČłĻ░ĆĒö╝ĒĢśĻ▓ī ļ░£ņāØĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ņ┤ēļ¦ż ņä▒ļŖźņØä ņĀĆĒĢśņŗ£Ēé©ļŗż62). ļ░ĆļÅä ļ▓öĒĢ©ņłś ņØ┤ļĪĀ (DFT) Ļ│äņé░ņØĆ ĒÖöĒĢÖļ░śņØæ ļ®öņ╗żļŗłņ”śņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŖö ĒÜ©ņ£©ņĀüņØĖ ļ░®ļ▓Ģņ£╝ļĪ£ ņĀäĻĖ░ĒÖöĒĢÖņĀü Ļ┤ĆņĀÉņŚÉņä£ DFTļŖö ņżæĻ░ä ņŚÉļäłņ¦ĆņÖĆ ĒÖ£ņä▒ĒÖö ņŚÉļäłņ¦ĆņØś Ļ▓░ĒĢ® ņŚÉļäłņ¦Ćļź╝ Ļ▓░ņĀĢĒĢśļŖöļŹ░ ņé¼ņÜ®ļÉ£ļŗż. ņśłļź╝ ļōżņ¢┤ ņłśņåī ĒØĪņ░® ņ×Éņ£Ā ņŚÉļäłņ¦ĆļŖö ņłśņåī ļ░£ņāØ ļ░śņØæņØś ņ┤ēļ¦ż ĒÖ£ņä▒ņØä ĒīīņĢģĒĢśĻĖ░ ņ£äĒĢ┤ ņé¼ņÜ®ļÉ£ļŗż63). ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæņØĆ ļŗżņ¢æĒĢ£ ņāØņä▒ļ¼╝ņØä ļ¦īļōżņ¢┤ ņłśņåī ļ░£ņāØ ļ░śņØæņŚÉ ļ╣äĒĢ┤ ļ│Ąņ×ĪĒĢ£ ļ®öņ╗żļŗłņ”śņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņŚ┤ĒÖöĒĢÖ ļ¬©ļŹĖņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ļ®öņ╗żļŗłņ”śņØä Ļ▓░ņĀĢĒĢśĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼ ņżæņŚÉ ņ׳ļŗż64).
ĻĘĖļ”╝┬Ā2.
Graphical illustration of (a) electrocatalytic CO2 reduction reaction. Reproduced with permission from ref. [141]; Copyright 2020, Elsevier. (b) Photocatalytic CO2 reduction reaction.

Ēæ£┬Ā1.
The reduction potential of half reactions in electrocatalytic CO2 reduction reaction (under condition of pH 7 in aqueous solution versus a standard hydrogen electrode (SHE), 25┬░C, 1 atm gas pressure, and 1 M for other solutes) [141, 148]
ĻĘĖļ¤¼ļéś ļ│Ąņ×ĪĒĢ£ ņĀäĻĖ░ĒÖöĒĢÖ Ļ│ĄņĀĢņ£╝ļĪ£ ļ®öņ╗żļŗłņ”ś Ļ▓░ņĀĢņØ┤ ņēĮņ¦Ć ņĢŖņĢä ļ¬®Ēæ£ ņāØņä▒ļ¼╝ņØä ļ¦īļōżņ¢┤ļé┤ļŖö ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņĀäĻĖ░ ņ┤ēļ¦ż ņĀ£ņ×æņØ┤ ņżæņÜöĒĢśļŗż.
ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņĀäĻĖ░ ņ┤ēļ¦ż ļ®öņ╗żļŗłņ”śņØĆ ņäĖ Ļ░Ćņ¦Ć ņŻ╝ņÜöĒĢ£ ļŗ©Ļ│äļź╝ Ļ░Ćņ¦Ćļ®░ ņ¦äĒ¢ēļÉ£ļŗż. ņ▓½ ļ▓łņ¦Ė ļŗ©Ļ│äņŚÉņä£ ņØ┤ņé░ĒÖöĒāäņåīĻ░Ć ņ┤ēļ¦ż Ēæ£ļ®┤ņŚÉ ĒØĪņ░®ļÉśĻ│Ā, ĒØĪņ░®ļÉ£ ņØ┤ņé░ĒÖöĒāäņåīĻ░Ć ņĀäņ×Éļź╝ ļ░øņĢä C-O Ļ▓░ĒĢ®ņØä ļüŖĻ▒░ļéś ņ¢æņä▒ņ×É ņØ┤ļÅÖņ£╝ļĪ£ C-H Ļ▓░ĒĢ®ņØ┤ ĒśĢņä▒ļÉśļŖö Ļ▓āņØ┤ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņĀäĻĖ░ ņ┤ēļ¦żņŚÉņä£ Ļ░Ćņן ņżæņÜöĒĢ£ ļæÉ ļ▓łņ¦Ė ļŗ©Ļ│äņØ┤ļŗż. ļ¦łņ¦Ćļ¦ē ņäĖ ļ▓łņ¦Ė ļŗ©Ļ│äņŚÉņä£ļŖö ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØś ņØ┤ļÅÖņ£╝ļĪ£ ļ¦īļōżņ¢┤ņ¦ĆļŖö ņāØņä▒ļ¼╝ņØ┤ ņ┤ēļ¦ż Ēæ£ļ®┤ņŚÉņä£ Ēāłņ░® ļÉśļŖö Ļ▓āņØ┤ļŗż. ņĢ×ņäĀ ļ®öņ╗żļŗłņ”śņØä ĒåĄĒĢ┤ ļ¦īļōżņ¢┤ņ¦ĆļŖö ņāØņä▒ļ¼╝ ĒśĢņä▒ņØĆ ĻĘĖļ”╝ 3ņŚÉ ļéśĒāĆļāłļŗż. ņāØņä▒ļ¼╝ņØĆ ņØĖĻ░Ć ņĀäņĢĢ65), ņĀäĒĢ┤ņĢĪ66), ņĢĢļĀź67)Ļ│╝ Ļ░ÖņØĆ ļŗżņ¢æĒĢ£ ņÜöņØĖņŚÉ ņØśĒĢ┤ Ļ▓░ņĀĢņØ┤ ļÉśļŖöļŹ░ ĻĘĖ ņśłļĪ£ ThorsonņØĆ Ēü░ ņ¢æņØ┤ņś©ņØä ĒżĒĢ©ĒĢśļŖö ņĀäĒĢ┤ņ¦łņØä ņé¼ņÜ®ĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåīļź╝ ņØ╝ņé░ĒÖöĒāäņåīļĪ£ ļ¦īļō£ļŖö ņ┤ēļ¦ż ņä▒ļŖźņØä Ē¢źņāüņŗ£ņ╝░ļŗż68). Ogura ĻĘĖļŻ╣ņØĆ ClŌłÆ, BrŌłÆ, IŌłÆĻ│╝ Ļ░ÖņØĆ ĒĢĀļØ╝ņØ┤ļō£ ņØīņØ┤ņś©ņØ┤ ĻĄ¼ļ”¼ ņĀäĻĘ╣ņŚÉ ļīĆĒĢ£ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņĀäĻĖ░ ņ┤ēļ¦ż ĒÜ©ņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼ļź╝ Ē¢łļŗż69). ņØ┤ ļĢī, ņØīņØ┤ņś©ņØĆ ĻĄ¼ļ”¼ ņĀäĻĘ╣ņŚÉ ĒØĪņłśļÉśņ¢┤ ņĀäņ×É ņĀäļŗ¼ņŚÉ ņÜ®ņØ┤ĒĢ£ ņ┤ēļ¦żņĖĄņØä ĒśĢņä▒ĒĢśņŚ¼ ņĀäļźś ļ░ĆļÅäļź╝ ņ”ØĻ░Ćņŗ£ĒéżĻ│Ā ņłśņåī ļ░£ņāØ ļ░śņØæņ£╝ļĪ£ ņØ┤ņ¢┤ņ¦ł ņłś ņ׳ļŖö ņ¢æņä▒ņ×É ĒØĪņłśļź╝ ļ¦ēļŖöļŗż. ņé¼ņÜ®ĒĢśļŖö ņ┤ēļ¦żņŚÉ ļö░ļØ╝ ņØ┤ņé░ĒÖöĒāäņåīĻ░Ć ļ│ĆĒÖśļÉśļŖö ņāØņä▒ļ¼╝ņØ┤ ļŗ¼ļØ╝ņ¦ĆļŖöļŹ░ Ag, Au, Zn, Pd, Ga ņØĆ ņØ╝ņé░ĒÖöĒāäņåī ļ│ĆĒÖśņŚÉ ņĀüĒĢ®ĒĢśĻ│Ā Cd, Hg, In, Pb, Sn, TlņØĆ ĒÅ╝ņé░ ļ│ĆĒÖśņŚÉ ņĀüĒĢ®ĒĢśļŗż. ļŗżņ¢æĒĢ£ MOF ĻĖ░ļ░ś CO2 ĒÖśņøÉņØä ņ£äĒĢ£ ņĀäĻĖ░ĒÖöĒĢÖņ┤ēļ¦żĻ░Ć Ēæ£ 2ņŚÉ ļéśņÖĆņ׳ļŗż.
ĻĘĖļ”╝┬Ā3.
(a) Possible reaction mechanism for the electrocatalytic reduction of CO2 on transition metal and molecular catalysts. Reproduced with permission from ref. [142]; Copyright 2015 American Chemical Society. (b) Graphical illustration of the generation of MOFs from SBU and rigid linkers. Reproduced with permission from ref. [143]; Copyright 2017 Springer Nature.

Ēæ£┬Ā2.
Summary of MOFŌĆōbased electrocatalysts for CO2 reduction reaction
ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņ┤ēļ¦ż ĒÖ£ņä▒ļÅä ĒÅēĻ░Ć ļ¦żĻ░£ ļ│Ćņłś
ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņ┤ēļ¦ż ĒÅēĻ░Ćļź╝ ņ£äĒĢ┤ ņ×æļÅÖ ņĀäņĢĢ, ĒāĆĒÄĀ ĻĖ░ņÜĖĻĖ░, ņĀäĒÖś ļ╣łļÅä, Ēī©ļ¤¼ļŹ░ņØ┤ ĒÜ©ņ£©, ņĢłņĀĢņä▒ņØä ņØ┤ņÜ®ĒĢ£ļŗż.
ņ×æļÅÖ ņĀäņĢĢ: ņĀäĻĖ░ ņ┤ēļ¦ż ņä▒ļŖźņŚÉ ļīĆĒĢ£ ņ┤łĻĖ░ ĒÅēĻ░Ć ļ¦żĻ░£ļ│ĆņłśļĪ£ ņĀäĻĖ░ĒÖöĒĢÖ ņĖĪņĀĢ ņןļ╣äņŚÉ ļö░ļØ╝ ļŗ¼ļØ╝ņ¦äļŗż. Ļ░ĆĒĢ┤ņŻ╝ļŖö ņĀäņĢĢņŚÉ ļö░ļØ╝ ļ░śņØæņØ┤ ņāØĻĖ░ļŖö ņ¦ĆņĀÉņØä ņ×æļÅÖ ņĀäņĢĢņØ┤ļØ╝ ĒĢ£ļŗż71).
ĒāĆĒÄĀ ĻĖ░ņÜĖĻĖ░: ĒāĆĒÄĀ ļ░®ņĀĢņŗØņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĀäļźś ļ░ĆļÅäņÖĆ Ļ│╝ņĀäņ£ä ņé¼ņØ┤ņØś Ļ┤ĆĻ│äļź╝ ĻĖ░ņÜĖĻĖ░ļĪ£ ļéśĒāĆļéĖļŗż. ļ░śņØæ ļ®öņ╗żļŗłņ”śņØä ĒāĆĒÄĀ ĻĖ░ņÜĖĻĖ░ļź╝ ĒåĄĒĢ┤ ņ”Øļ¬ģĒĢĀ ņłś ņ׳Ļ│Ā ņóŗņØĆ ņĀäĻĖ░ ņ┤ēļ¦żļŖö ļé«ņØĆ ĒāĆĒÄĀ ĻĖ░ņÜĖĻĖ░ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż72).
ņĀäĒÖś ļ╣łļÅä (TOF): ņĀäĻĖ░ ņ┤ēļ¦żņØś Ļ│Āņ£Ā ĒÖ£ņä▒ļÅäņÖĆ ĒŖ╣ņĀĢ ņĀäņĢĢņŚÉņä£ ņĀäĻĖ░ ņ┤ēļ¦żņØś ņĀäĻĖ░ĒÖöĒĢÖ ļ░śņØæ ĒÖ£ņä▒ļÅäĻ░Ć ņ¢╝ļ¦łļéś ļ╣Āļź┤Ļ▓ī ļ░£ņāØĒĢśļŖöņ¦Ć Ļ▓░ņĀĢĒĢĀ ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ĒÖ£ņä▒ļČĆļČäņØś ĻĄ¼ņĪ░ņĀü ļ¬©ĒśĖņä▒ņ£╝ļĪ£ Ēæ£ļ®┤ ĒÖ£ņä▒ ļČĆļČäņØ┤ ņĀĢļ¤ēĒÖö ļÉĀ ņłś ņ׳ļŖö ņåīņłśņØś ĻĘĆĻĖłņåŹ (Pt, Pd)ņØä ņĀ£ņÖĖĒĢśĻ│Ā ņĀäĻĖ░ ņ┤ēļ¦żņØś ņĀäĒÖś ļ╣łļÅäļź╝ Ļ▓░ņĀĢĒĢśļŖö Ļ▓āņØĆ ļ¦żņÜ░ ņ¢┤ļĀĄļŗż.
Ēī©ļ¤¼ļŹ░ņØ┤ ĒÜ©ņ£© (FE): ņĀäĻĖ░ĒÖöĒĢÖ ļ░śņØæņŚÉņä£ ņĀäņ×É ņĀäļŗ¼ņØś ĒÜ©ņ£©ņØä ļéśĒāĆļéĖļŗż. ņóŗņØĆ ņä▒ļŖźņØä Ļ░Ćņ¦ä ņ┤ēļ¦żļŖö ņØ╝ņé░ĒÖöĒāäņåī, ļ®öĒāä, ļ®öĒāäņś¼ ļō▒ ņ£ĀņÜ®ĒĢ£ ņāØņé░ļ¼╝ņØä ļ¦īļōżņ¢┤ļé┤ļŖö Ļ▓ĮņÜ░ Ēī©ļ¤¼ļŹ░ņØ┤ ĒÜ©ņ£©ņØ┤ 80% ņØ┤ņāüņØä ļ│┤ņŚ¼ņżĆļŗż.
2.2 Ļ┤æņ┤ēļ¦ż ĒÖ£ņÜ® ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ
ĻĖ░ļ│Ė ļ®öņ╗żļŗłņ”śĻ│╝ ļ░śņØæ ļŗ©Ļ│ä
Ļ░Ćņŗ£Ļ┤æņäĀņØ┤ļéś ņ×ÉņÖĖņäĀņØä ņĪ░ņé¼ĒĢĀ ļĢī, ņĀüņĀłĒĢ£ ļ░┤ļō£Ļ░Ł ņŚÉļäłņ¦Ćļź╝ Ļ░Ćņ¦ä Ļ┤æņ┤ēļ¦żļŖö ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæņØ┤ ņØ╝ņ¢┤ļéśĻ│Ā ļ¼╝ņØ┤ ņé░ņåīļĪ£ ļ│ĆĒÖśļÉśļŖö ņé░ĒÖöņ×æņÜ®Ļ│╝ Ļ░ÖņØĆ ņØ╝ļĀ©ņØś ļŗżņżæ ņĀäņ×É ņĀäĻĖ░ ĒÖöĒĢÖ Ļ│╝ņĀĢņØ┤ ņØ╝ņ¢┤ļé£ļŗż. pH 7ņØ╝ ļĢī, ļ¼╝Ļ│╝ Ļ┤æņ┤ēļ¦żņØś ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ņŗ£ ļ░£ņāØĒĢśļŖö ņĀäĻĖ░ĒÖöĒĢÖ ļ░śņØæĻ│╝ ņØ┤ ļĢīņØś ņé░ĒÖöĒÖśņøÉ ņĀäņ£äļŖö Ēæ£3ņŚÉ ņĀ£ņŗ£ļÉśņŚłļŗż. ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉņ£╝ļĪ£ ņØ╝ņé░ĒÖöĒāäņåī, ļ®öĒāä, ĒÅ╝ņé░, ņŚÉĒŗĖļĀī, ĒÅ╝ņĢīļŹ░ĒĢśņØ┤ļō£ ļō▒ņØś ņāØņä▒ļ¼╝ņØä ļ¦īļōżņ¢┤ ļé┤ļŖöļŹ░74), ņØ┤ļ¤¼ĒĢ£ ņ×¼ņāØ Ļ░ĆļŖźĒĢ£ ĒāäĒÖöņłśņåī ņŚ░ļŻīņØś ņāØņä▒ņØĆ ņłśņÜ®ņĢĪņŚÉ ņĪ┤ņ×¼ĒĢśļŖö 2ŌłÆ, 4ŌłÆ, 6ŌłÆ, 8ŌłÆ ņĀäņ×Éļź╝ ņłśņÜ®ĒĢ£ Ļ▓░Ļ│╝ņØ┤ļŗż.
Ēæ£┬Ā3.
Summary of MOF-based photocatalysts for CO2 reduction reaction
ņØ╝ļ░śņĀüņ£╝ļĪ£ ļ¼┤ĻĖ░ ļ░śļÅäņ▓┤ļŖö ņĀäņ×É-ņĀäĻ│Ą ņīŹņØä ļČäļ”¼ĒĢśĻĖ░ņŚÉ ņČ®ļČäĒĢ£ ņŚÉļäłņ¦Ćļź╝ Ļ░Ćņ¦ä Ļ┤æņ×ÉņØś ĒØĪņłśņŚÉņä£ ņŗ£ņ×æĒĢśņŚ¼ ņØīņØś ņĀäĒĢśņØĖ ņĀäņ×É(eŌłÆ)Ļ░Ć ņ▒äņøīņĀĖ ņ׳ļŖö Ļ░Ćņן ļåÆņØĆ ņĀÉņ£Ā ļČäņ×É ĻČżļÅä (HOMO)ņŚÉņä£ ļ╣äņ¢┤ņ׳ļŖö Ļ░Ćņן ļé«ņØĆ ņĀÉņ£Ā ļČäņ×É ĻČżļÅä (LUMO)ļĪ£ ņØ┤ļÅÖļÉśļŖö Ļ│╝ņĀĢņØä Ļ▒░ņ╣£ļŗż. ļÅÖņŗ£ņŚÉ ņ¢æņØś ņĀäĒĢśļź╝ Ļ░Ćņ¦ä ņĀĢĻ│Ą(h+)ņØ┤ HOMOņŚÉ ņ£äņ╣śĒĢśņŚ¼ ņĀäĒĢś ļČäļ”¼ ņāüĒā£ ņāØņä▒ņØä ļéśĒāĆļéĖļŗż29). Ļ┤æņ£ĀļÅäļÉ£ MOF ļ¼╝ņ¦łņØĆ ļ¼┤ĻĖ░ļ¼╝ ļ░śļÅäņ▓┤ņÖĆ ļÅÖņØ╝ĒĢśņ¦Ćļ¦ī ļČäņ×É ĻČżļÅä ņØ┤ļĪĀņŚÉ ļö░ļØ╝ Conduction Band (CB)ņÖĆ Valence Band (VB)ļŖö Ļ░üĻ░ü LUMOņÖĆ HOMOņØ┤ļŗż11). Ļ┤æĒÖ£ņä▒ļÉ£ MOFņØś ņé░ĒÖö ĒÖśņøÉ ļ░śņØæņØĆ ļé«ņØĆ ņĀäĒĢś ņØ┤ļÅÖņ£╝ļĪ£ excitonņØ┤ Ļ┤æņ£ĀļÅä ļÉ£ Ļ││ņŚÉņä£ ļ░£ņāØĒĢ£ļŗż. ĻĖłņåŹ-ņśźņåī ļ│ĄĒĢ®ņ▓┤ņØś ĒÖśņøÉ ņĀäņ£äļŖö MOFņØś CBļĪ£ Ļ░äņŻ╝ĒĢśĻ│Ā ņé░ĒÖö ņĀäņ£äļŖö ņ£ĀĻĖ░ ļ¦üņ╗żņØś HOMOļĪ£ Ļ░äņŻ╝ĒĢ£ļŗż75).
MOFņØś ĒÜ©ņ£©ņØĆ ļŗżņØīĻ│╝ Ļ░ÖņØ┤ ļŗżņ¢æĒĢ£ ļ░®ļ▓Ģņ£╝ļĪ£ Ļ░£ņäĀĒĢĀ ņłś ņ׳ļŗż: (1) HOMOņØś ņŚÉļäłņ¦Ć ņżĆņ£äĻ░Ć CO2 ĒÖśņøÉ ņĀäņĢĢļ│┤ļŗż ļé«Ļ│Ā, LUMOņØś ņŚÉļäłņ¦Ć ņżĆņ£äĻ░Ć H2 O ņé░ĒÖö ņĀäņĢĢļ│┤ļŗż ļåÆņØä ļĢī, Ēā£ņ¢æļ╣ø ĒØĪņłśļź╝ ņ£äĒĢ£ VB-CB Ļ░ä ņĀüņĀłĒĢ£ ļ░┤ļō£Ļ░Ł ņŚÉļäłņ¦Ć(E H-L)ļź╝ Ļ░Ćņ¦łņłś ņ׳ļŗż; (2) ņ£ĀĻĖ░ ļ”¼Ļ░äļō£ņŚÉņä£ ĻĖłņåŹ ņżæņŗ¼ļČĆļĪ£ ņĀäĒĢśļź╝ ņēĮĻ▓ī ņĀäļŗ¼ĒĢśĻĖ░ ņ£äĒĢ┤ Ļ┤æņ×É ĒØĪņłś ņżæņŗ¼ ņŚŁĒĢĀņØä ĒĢśļŖö ņ£ĀĻĖ░ ļ¦üņ╗żļŖö ĻĖłņåŹ-ņśźņåī Ēü┤ļ¤¼ņŖżĒä░ļ│┤ļŗż ļåÆņØĆ LUMO ņŚÉļäłņ¦Ć ņżĆņ£äļź╝ Ļ░ĆņĀĖņĢ╝ĒĢ£ļŗż.
MOF ņ×¼ļŻīņØś Ļ┤æĒØĪņłśļŖö E H-LņØä ĒåĄĒĢ┤ ņśłņĖĪĒĢśĻ│Ā, HOMO ņÖĆ LUMOņØś ņŚÉļäłņ¦Ć ņżĆņ£ä ņ░©ļŖö ņØ┤ņé░ĒÖöĒāäņåī Ļ┤æņ┤ēļ¦ż ļ░śņØæņØä ņ¦Ćļ░░ĒĢ£ļŗż.
Ļ┤æņ┤ēļ¦ż ĒÖ£ļÅÖ Ļ▓░ņĀĢņÜöņØĖ
ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖśņØä ņ£äĒĢ£ ĒÜ©ņ£©ņĀüņØĖ Ļ┤æņ┤ēļ¦ż ņĀ£ņ×æņØä ņ£äĒĢ┤ņä£ļŖö ļ¬ć Ļ░Ćņ¦Ć ĻĖ░ņżĆņØä Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņ▓½ ļ▓łņ¦Ė, Ēā£ņ¢æņŚÉņä£ Ōł╝46% Ļ░Ćņŗ£Ļ┤æņäĀĻ│╝ Ōł╝4% ņ×ÉņÖĖņäĀņØ┤ ļéśņśżĻĖ░ ļĢīļ¼ĖņŚÉ Ļ┤æņ┤ēļ¦żņØś ņĀäņ×É ņŚ¼ĻĖ░ļź╝ ņ£äĒĢ£ ļ¼╝ņ¦ł ļ░śņØæļÅäĻ░Ć ļåÆņØĆ ņ×ÉņŚ░Ļ┤æ-Ļ░Ćņŗ£Ļ┤æņäĀ ņśüņŚŁņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņāüļīĆņĀüņ£╝ļĪ£ ļåÆņØĆ Ļ┤æņ┤ēļ¦ż ĒÜ©ņ£©ņØä ņ¢╗ņØä ņłś ņ׳ļŗż. ļæÉ ļ▓łņ¦Ė, Ļ┤æņ┤ēļ¦żļź╝ ņØ┤ņÜ®ĒĢ£ ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖśņØä ņ£äĒĢ┤ MOF Ļ┤æņ┤ēļ¦żļź╝ ņé¼ņÜ® ņŗ£, ĻĖłņåŹ ņ¢æņØ┤ņś©/Ēü┤ļ¤¼ņŖżĒä░ļŖö light-gathering sitesļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ ĒÜ©ņ£©ņĀü ņØĖ ĒØĪņłśņŚÉ ļÅäņøĆņØ┤ ļÉ£ļŗż. ļśÉĒĢ£ MOFņØś ņ£ĀĻĖ░ ļ”¼Ļ░äļō£ļŖö Ļ░Ćņŗ£Ļ┤æņäĀ ņśüņŚŁņŚÉņä£ Ļ┤æĒĢÖņĀü ĒØĪņłś ļŖźļĀźņØä Ļ░¢ņČöĻĖ░ ņ£äĒĢ┤ ņŚ¼ļ¤¼ ĒĢ®ņä▒ļ▓Ģņ£╝ļĪ£ ņĢäļ»ĖļģĖĻĖ░ļź╝ ņ£ĀĻĖ░ ļ”¼Ļ░äļō£ņŚÉ ļČĆņ░®ĒĢ£ļŗż. ļæÉ ļ▓łņ¦ĖļŖö Ļ┤æņ┤ēļ¦żņŚÉ ņØśĒĢ£ ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖś ņżæ ņĀäņ×É-ņĀĢĻ│Ą ņīŹņØś ļČäļ”¼ņØ┤ļŗż. MOF ņĀäņØ┤ ĻĖłņåŹņØś ņ¢æņØ┤ņś©Ļ│╝ ņ£ĀĻĖ░ ļ”¼Ļ░äļō£ļĪ£ Ļ┤æņŚ¼ĻĖ░ļÉśļŖö excitonņØś ļČäļ”¼ļŖö ņÜ®ņØ┤ĒĢśņ¦Ćļ¦ī ļÅÖņŗ£ņŚÉ ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØś ņ×¼Ļ▓░ĒĢ®ņ£╝ļĪ£ ņØĖĒĢ┤ Ļ┤æņ┤ēļ¦żņØś ņä▒ļŖźņØä ņĀĆĒĢśņŗ£Ēé©ļŗż. Ēśäņ×¼ ļÅäĒĢæļÉ£ TiO2, TiO2/semiconductors ĒĢśņØ┤ļĖīļ”¼ļō£ Ļ┤æņ┤ēļ¦ż, p-n ĒŚżĒģīļĪ£ ņĀæĒĢ® Ļ┤æņ┤ēļ¦ż, ņŚ╝ļŻī Ļ░ÉņØæ Ļ┤æņ┤ēļ¦ż ļō▒Ļ│╝ Ļ░ÖņØĆ semiconductors ĻĖ░ļ░ś Ļ┤æņ┤ēļ¦żņØś ĒÜ©ņ£©ņĀüņØĖ exciton ļČäļ”¼ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒÖ£ļ░£ĒĢśĻ▓ī ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŗż77). ņØ┤ļ¤¼ĒĢ£ ņŚ░ĻĄ¼ļŖö Ļ░Ćņŗ£Ļ┤æņäĀ ņśüņŚŁņŚÉņä£ Ē¢źņāüļÉ£ ņĀäĒĢś ļČäļ”¼ļĪ£ Ļ┤æņŚ¼ĻĖ░ļÉ£ exictonņØś ļ╣ĀļźĖ ņ×¼Ļ▓░ĒĢ®ņØä ņ¢ĄņĀ£ĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖśņØä ņ£äĒĢ£ ņĀäņ×Éļź╝ ĒÖ£ņä▒ĒÖöļź╝ ĒåĄĒĢ┤ MOF Ļ┤ĆļĀ© ļ¼╝ņ¦łņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ņŚÉ ļÅäņøĆņØä ņżĆļŗż.
ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉņØä ņ£äĒĢ£ ņĀäĻĖ░ĒÖöĒĢÖ ņ┤ēļ¦żņÜ® ĻĖłņåŹ ņ£ĀĻĖ░ Ļ│©Ļ▓® ļ¼╝ņ¦ł(MOF)
MOFļŖö ņĪ░ņĀł Ļ░ĆļŖźĒĢ£ ļ╣äĒæ£ļ®┤ņĀü, ĻĄ¼ņĪ░ ņĪ░ņ×æņŚÉ ņÜ®ņØ┤ĒĢ©, Ļ░äĒÄĖĒĢ£ ĒĢ®ņä▒ ļō▒ ļŗżļźĖ ļ¼╝ņ¦łļĪ£ ņĀ£ņ×æ ņŗ£ ņØ┤ņāüņĀüņØĖ ĻĄ¼ņĪ░ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¢┤ ņ¦Ćļé£ 10ļģäļÅÖņĢł MOFļŖö ņłśņåī ļ░£ņāØ ļ░śņØæņØś ņĀäĻĖ░ĒÖöĒĢÖ ņ┤ēļ¦ż, Ļ┤æņ┤ēļ¦żļĪ£ ņŚ░ĻĄ¼ļÉśņŚłļŗż. ļśÉĒĢ£, ņé░Ļ│╝ ņŚ╝ĻĖ░ ņĀäĒĢ┤ņ¦łņŚÉņä£ ņĀäĻĖ░ĒÖöĒĢÖ ļ░śņØæņØä ĒåĄĒĢ┤ ņłśņåī ļ░£ņāØĻ│╝ ņé░ņåī ļ░£ņāØ ļ░śņØæ ņ┤ēļ¦żņĀ£ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż.
3.1 2ņ░©ņøÉ MOF ļéśļģĖņŗ£ĒŖĖ
2ņ░©ņøÉ MOFļŖö ļ▓īĒü¼ ĒśĢĒā£ņØś MOFņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ļäōņØĆ Ēæ£ļ®┤ņĀü, ņ┤ēļ¦żņØś ņä▒ļŖźņØä ļåÆņØ╝ ņłś ņ׳ļŖö ĒÖ£ņä▒ ļČĆļČäņ£╝ļĪ£ņØś ņĀæĻĘ╝ņä▒ņØ┤ ņÜ®ņØ┤ĒĢ£ ļø░ņ¢┤ļé£ ĒŖ╣ņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. Wu ĻĘĖļŻ╣ņØĆ ņØ┤ņ░©ņøÉ ļŗłņ╝ł(Ni)- ņØ┤ļ»ĖļŗżņĪĖ(Im) ĻĖ░ļ░śņØś ņĀ£ņś¼ļØ╝ņØ┤ĒŖĖ ņØ┤ļ»ĖļŗżņĪĖ Ļ│©Ļ▓®ņ▓┤ (Zeolitic Imidazole Framework: ZIF)ļź╝ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņĀäĻĖ░ņ┤ēļ¦żļĪ£ ņé¼ņÜ®Ē¢łļŗż78). ņøÉņŗ¼ļČäļ”¼ĻĖ░ ĒÜīņĀäņłśņŚÉ ļö░ļØ╝ ņØ┤ņ░©ņøÉ Ni(Im)2 ļéśļģĖņŗ£ĒŖĖļź╝ ļŗżņ¢æĒĢ£ ļæÉĻ╗śļĪ£ ĒĢ®ņä▒ņØ┤ ņŗ£ņ╝£ 5nm ļæÉĻ╗śņØś ņØ┤ņ░©ņøÉ Ni(Im)2ņØś Ļ▓ĮņÜ░ ļåÆņØĆ ņØ╝ņé░ĒÖöĒāäņåī ņäĀĒāØļÅä (FE CO = 78.8% ŌłÆ0.85V vs. RHE)ļź╝ ļ│┤ņŚ¼ņŻ╝Ļ│Ā, ļ▓īĒü¼ ļæÉĻ╗śņØś Ni(Im)2ļŖö ļé«ņØĆ ņØ╝ņé░ĒÖöĒāäņåī ņäĀĒāØļÅä (FE CO = 33.7%)ļź╝ ļ│┤ņŚ¼ņżĆļŗż. ņØ┤ļŖö ļ▓īĒü¼ņŚÉņä£ ļéśļģĖ Ēü¼ĻĖ░ļĪ£ ļÉśļ®┤ņä£ Ēæ£ļ®┤-ĒÖ£ņä▒ ļČĆļČäņØś ļ░ĆļÅäĻ░Ć ņ”ØĻ░ĆļÉśļŖö ĒŖ╣ņä▒ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż. ļśÉĒĢ£ ņŗżĒŚśņŚÉņä£ 5ml ņłśņé░ĒÖö ņĢöļ¬©ļŖä(NH4 OH)ņØä 5nm ļæÉĻ╗śņØś ņØ┤ņ░©ņøÉ Ni(Im)2 ĒĢ®ņä▒ņŚÉ ņé¼ņÜ®ĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæņŚÉ ņĄ£Ļ│ĀņØś ĒŖ╣ņä▒ņØä ļ│┤ņŚ¼ņżĆļŗż.
Zhang79) ĻĘĖļŻ╣ņØĆ ĻĘĖļ”╝ 4aņÖĆ Ļ░ÖņØ┤ ZrBTB ļéśļģĖņŗ£ĒŖĖ ĻĖ░ņ¦łņŚÉ TCPP(Co) ((5, 10, 15, 20)-tetrakis (4-carboxyphenyl) porphyrin))ņŚÉ ņĀæļ¬®ĒĢśņŚ¼ 4768 hŌłÆ1(0.919 V vs. RHE)ņØś ļåÆņØĆ TOFļź╝ ļ│┤ņŚ¼ņŻ╝Ļ│Ā, 77% (0.769 V vs. RHE)ņØś ļåÆņØĆ FE COļź╝ ļ│┤ņŚ¼ņżĆļŗż(ĻĘĖļ”╝ 4b). TCPP(Co)/ZrBTB ļéśļģĖņŗ£ĒŖĖņØś ņ┤ēļ¦ż ĒÜ©ņ£©ņØä ļåÆņØ┤ĻĖ░ ņ£äĒĢ┤ p-(aminomethyl)benzoic acid (PABA), psulfobebzoic acid potassium (PSBA), p-sulfamidobenzoic acid (PSABA) ļō▒ ļŗżņ¢æĒĢ£ ĒÖöĒĢÖ ļ¼╝ņ¦łņØä ņĀæļ¬®ņŗ£ņ╝░ļŗż. TCPP(Co)/ZrBTB-PSABAņØĆ Ļ░Ćņן ļåÆņØĆ FE CO = 85.1%ņÖĆ 5315 hŌłÆ1ņØś TOFļź╝ ļ│┤ņŚ¼ņŻ╝ļŖöļŹ░ ņØ┤ļŖö ĒÖöĒĢÖļ¼╝ņ¦ł ļČäņ×ÉļōżņØ┤ Zr ļČĆļČäņØä ļŹ«ņ¢┤ ņłśņåī ņāØņé░ ļ░śņØæņØä ņĀĆĒĢ┤ĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæņØä ņ┤ēņ¦äņŗ£ņ╝£ ļéśņś© Ļ▓░Ļ│╝ņØ┤ļŗż.
ĻĘĖļ”╝┬Ā4.
(a) Crystal structure of TCPP(Co)/ZrBTB nanosheet. Gray is C, blue is N, red is O, bright green is Co, pale blue is Zr, and cyan is H; (b) and (c) CO Faradaic efficiency for different samples at different operating voltages. Reproduced with permission from ref. [79]; Copyright 2019 WILEY.

3.2 ņé╝ņ░©ņøÉ MOFs
ņĢäņŚ░ ĻĖ░ļ░ś MOFs
MOFsļŖö ĻĖłņåŹ ņ¢æņØ┤ņś©Ļ│╝ ņ┤ēļ¦ż ļČĆļČäņØä ĒÖ£ņä▒ĒÖöņŗ£ĒéżļŖö ņ£ĀĻĖ░ ļ”¼Ļ░äļō£ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳Ļ│Ā, ņ┤łļŗżĻ│Ąņä▒, ņĪ░ņĀł Ļ░ĆļŖźĒĢ£ ĻĄ¼ņĪ░, ņ┤ēļ¦ż ļ░śņØæ ņ┤ēņ¦ä ļō▒Ļ│╝ Ļ░ÖņØĆ ĒŖ╣ņä▒ņ£╝ļĪ£ ļ¦ÄņØĆ ļČäņĢ╝ņŚÉņä£ ņŚ░ĻĄ¼ļÉśĻ│Ā ņ׳ļŗż. ņĢäņŚ░ ĻĖłņåŹņØĆ Ļ░ĆĻ▓®ņĀüņØĖ ļČĆļČäĻ│╝ ņØ┤ņé░ĒÖöĒāäņåīļź╝ ņØ╝ņé░ĒÖöĒāäņåīļĪ£ ļ│ĆĒÖśĒĢśļŖö ĒŖ╣ņä▒ņ£╝ļĪ£ MOFsņØś ĻĖłņåŹ ļģĖļō£ļĪ£ ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖś ņĀäĻĖ░ņ┤ēļ¦żļĪ£ ņĀüĒĢ®ĒĢśļŗż. Wang ĻĘĖļŻ╣ņØĆ ņĢäņŚ░ ņĀ£ņś¼ļØ╝ņØ┤ĒŖĖ ņØ┤ļ»ĖļŗżņĪĖ Ļ│©Ļ▓®ņ▓┤ (ZIF) ĒĢ®ņä▒ņŚÉ ņä▒Ļ│ĄĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖś ņĀäĻĖ░ņ┤ēļ¦ż ņĀäĻĄ¼ņ▓┤ļĪ£ ņé¼ņÜ®ĒĢśņśĆļŗż80). WangņØĆ Zn2+Ļ░Ć ņ┤ēļ¦ż ļ░śņØæņØś ņżæņÜöĒĢ£ ĻĖ░ļŖźņØä ĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåīļź╝ ņØ╝ņé░ĒÖöĒāäņåīļĪ£ ļ│ĆĒÖś ņŗ£ 65%ņØś ļåÆņØĆ FE COļź╝ ļ│┤ņŚ¼ņżĆļŗżĻ│Ā ņäżļ¬ģĒĢśņśĆļŗż.
Jiang ĻĘĖļŻ╣ņØĆ ZIF ĻĄ¼ņĪ░ņŚÉ 2-methylimidazole, 2-nitroimidazole, benzimidazole, 4-methyl-5imidazolecarboxaldehyde ņÖĆ Ļ░ÖņØĆ ļŗżņ¢æĒĢ£ ņ£ĀĻĖ░ ļ¦üņ╗żļź╝ ĒĢ®ņä▒ņŗ£ņ╝£ Ļ░üĻ░ü ZIF-8, ZIF-108, ZIF-7, SIM-1ļź╝ ņĀ£ņ×æĒĢśņśĆļŗż81). 2-methylimidazoleņØä ņØ┤ņÜ®ĒĢ£ ZIF-8ņØĆ 81% (ŌłÆ1.1 V vs. RHE)ņØś ļåÆņØĆ FE COļź╝ ļ│┤ņŚ¼ņŻ╝Ļ│Ā, ZIF-108ņØĆ Ēü░ ņĀäļźśļ░ĆļÅä 12.8 mA cmŌłÆ2(ŌłÆ1.3 V vs. RHE)ļź╝ ļ│┤ņŚ¼ņżĆļŗż(ĻĘĖļ”╝ 5a). ļ░ĆļÅä ļ▓öĒĢ©ņłś ņØ┤ļĪĀ (DFT)ņ£╝ļĪ£ ĒÖöĒĢÖ Ļ│äņé░ņØä ņ¦äĒ¢ēĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ļČäņ×ÉĻ░Ć ņØ┤ļ»ĖļŗżņĪĖ ļ¦üņ╗żņØś C(sp2) ņøÉņ×Éļź╝ ĒØĪņłśĒĢ£ļŗżļŖö Ļ▓āņØä ĒÖĢņØĖĒ¢łļŗż(ĻĘĖļ”╝ 5a ļ░Å b). ZIFs ņĢäņŚ░ ĻĖłņåŹ ļģĖļō£ņØś * COOHņØś ņ×Éņ£Ā ņŚÉļäłņ¦ĆļŖö ZIFs ņ£ĀĻĖ░ ļ¦üņ╗ż ļ│┤ļŗż ļåÆĻ│Ā, * COOHņÖĆ * HņØś ņ×Éņ£ĀņŚÉļäłņ¦Ćļź╝ ĒåĄ ĒĢ┤ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæņØś 4Ļ░Ćņ¦Ć ņ┤ēļ¦ż ņżæ ZIF-8ņØ┤ Ļ░Ćņן ļåÆņØĆ ĒÜ©ņ£©ņØä ļ│┤ņŚ¼ņżĆļŗżļŖö Ļ▓āņØä ļ│┤ņŚ¼ņżĆļŗż(ĻĘĖļ”╝ 5c ļ░Å d). Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ ZIF-8ņØĆ Ļ░Ćņן ļé«ņØĆ * H ĒØĪņłś ņ×Éņ£ĀņŚÉļäłņ¦ĆļĪ£ ņØĖĒĢ┤ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņ┤ēļ¦żļĪ£ Ļ░Ćņן ļåÆņØĆ ņäĀĒāØņä▒ņØä ļ│┤ņŚ¼ņżĆļŗżļŖö Ļ▓āņØä ĒÖĢņØĖĒ¢łļŗż.
ĻĘĖļ”╝┬Ā5.
The Faradaic efficiency (a) and current density (b) for CO product on ZIF-7, SIM-1, ZIF-108, and ZIF-8 at various potentials; (c) Most durable absorption centers of *COOH on various imidazole linkers of ZIFs, which are marked by orange arrows; (d) Reaction mechanism on 2-methylimidazole linker; (e) Calculated free energy with solvent effect corrections for CO2 RR (e) and HER (f) by DFT method. Reproduced with permission from ref. [81]; Copyright 2018, Elsevier.

ņĮöļ░£ĒŖĖ(Co) ĻĖ░ļ░ś MOFs
ņĮöļ░£ĒŖĖ ĻĖ░ļ░ś ļ¼╝ņ¦łņØĆ ņĮöļ░£ĒŖĖ(Co)Ļ░Ć Co(ŌģĀ), Co(ŌģĪ), Co(Ōģó), Co(ŌģŻ)ļź╝ ĒżĒĢ©ĒĢ£ ļŗżņ¢æĒĢ£ ĒÖśņøÉ-ņé░ĒÖö ņāüĒā£ļĪ£ ņĪ┤ņ×¼ĒĢĀ ņłś ņ׳ļŖö heterogeneousĒĢ£ ĒŖ╣ņä▒ņ£╝ļĪ£ ņ£Āļ¦ØĒĢ£ ņ┤ēļ¦żļĪ£ ņŚ¼Ļ▓©ņ¦äļŗż. ņĮöļ░£ĒŖĖ ĻĖ░ļ░ś MOFsļŖö ņłśņåī ņāØņé░ ļ░Å ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ņĀäĻĖ░ ņ┤ēļ¦żļĪ£ ņé¼ņÜ®ņŗ£, ļ│Ėņ¦łņĀüņ£╝ļĪ£ ļé«ņØĆ ņĀäļÅäņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¢┤ ĒÖöĒĢÖ ļ░śņØæņŚÉ ņĀäļÅäņä▒ņØä Ļ░Ćņ¦ä Fluorine doped Tin Oxide(FTO), ĻĘĖļלĒĢĆ, Ēāäņåīņä¼ņ£Ā ļō▒ ņŚÉ ļÅäĒĢæĒĢśņŚ¼ ņé¼ņÜ®ĒĢ£ļŗż. Kornienko ĻĘĖļŻ╣ņØĆ FTOņŚÉ ņ¢ćņØĆ Al2(OH)2 TCPP-Co ņĖĄņØä ļÅäĒĢæĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ņ¢æĻĘ╣ņ×¼ļĪ£ ņØ┤ņÜ®Ē¢łļŗż82). ņĀäņ×É ĒĢśļéśņØś ĒÖśņøÉņ£╝ļĪ£ ņāØņä▒ļÉ£ Co(ŌģĀ)ļŖö ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņĀäĻĖ░ ņ┤ēļ¦ż ĒÖ£ņä▒ ņŚŁĒĢĀņØä ĒĢśņŚ¼ ņØ╝ņé░ĒÖöĒāäņåīņŚÉ ļīĆĒĢ┤ ļåÆņØĆ ņäĀĒāØņä▒ņØĖ 76%(ŌłÆ0.7 V vs. RHE)ņØś FE COļź╝ ļ│┤ņŚ¼ņżĆļŗż.
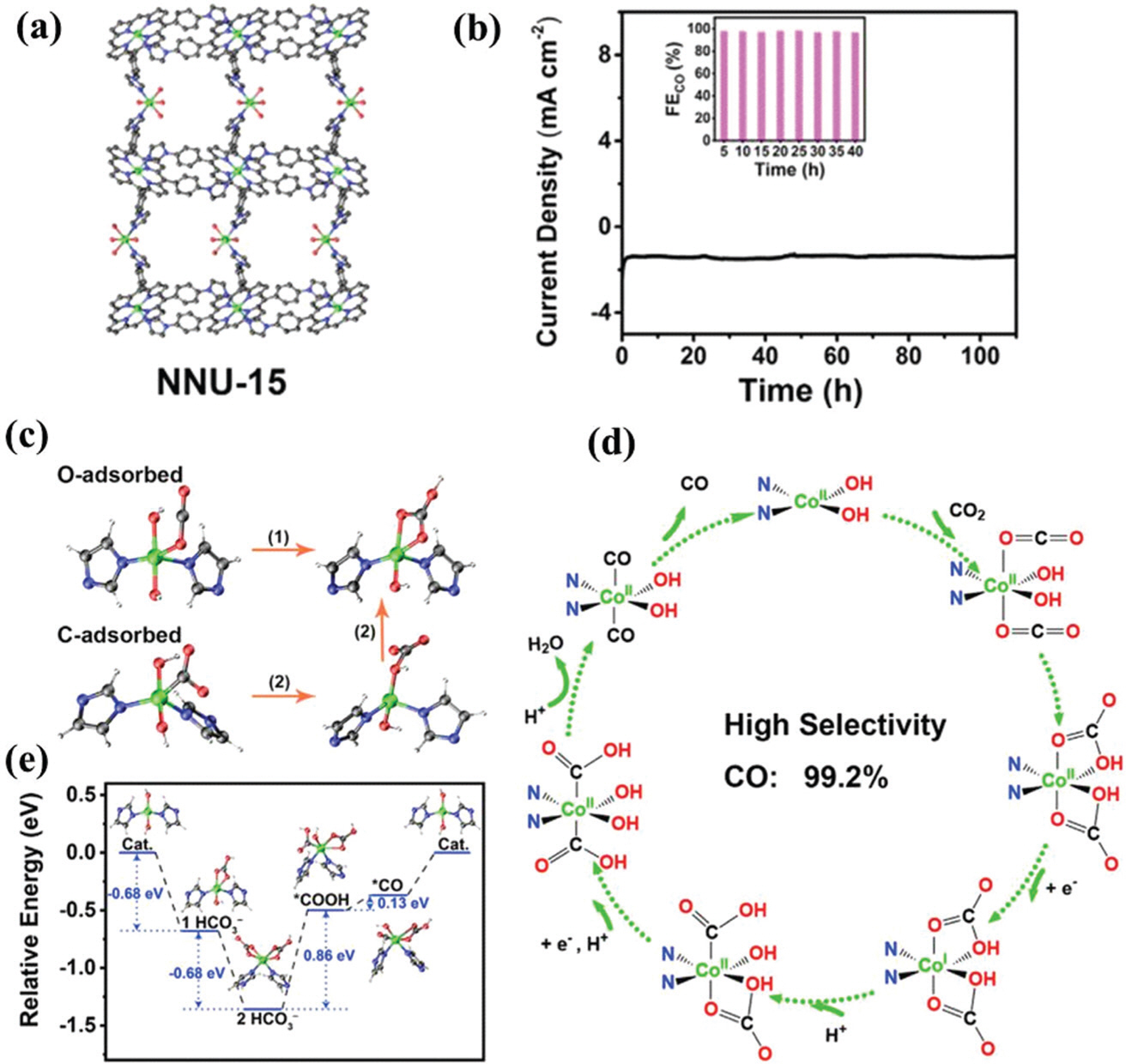
Huang ĻĘĖļŻ╣ņØĆ ĻĘĖļ”╝ 6aņŚÉ ļ│┤ņØ┤ļō» NNU-15 ļŗ©ņØ╝ Ļ▓░ņĀĢņØä ņĀ£ņ×æĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņ┤ēļ¦żļĪ£ ņé¼ņÜ®Ē¢łļŗż83). NNU-15ļŖö 99%(ŌłÆ0.6 V vs. RHE)ņØś FE COļĪ£ ņØ┤ņé░ĒÖöĒāäņåīļź╝ ņØ╝ņé░ĒÖöĒāäņåīļĪ£ ļ│ĆĒÖś ņŗ£ ĒāüņøöĒĢ£ ĒÜ©ņ£©ņØä ļ│┤ņŚ¼ņŻ╝Ļ│Ā 110ņŗ£Ļ░äņØ┤ ņ¦Ćļé£ ļÆżņŚÉļÅä ņ┤ēļ¦ż ņä▒ļŖźņØ┤ ņ£Āņ¦ĆļÉśļŖö ļåÆņØĆ ļé┤ĻĄ¼ņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż(ĻĘĖļ”╝ 6b). ņĮöļ░£ĒŖĖļŖö ņØ┤ņé░ĒÖöĒāäņåīļź╝ ĒØĪņłśĒĢśņŚ¼ HCO3ŌłÆļĪ£ ļ│ĆĒÖśņŗ£ĒéżĻ│Ā, Co(ŌģĀ)ļŖö ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņĀäĻĖ░ņ┤ēļ¦ż ņŚŁĒĢĀļĪ£ ņé¼ņÜ®ļÉ£ļŗż(ĻĘĖļ”╝ 5c ļ░Å d). ĻĘĖļ”╝ 6e ļŖö ņ×Éņ£ĀņŚÉļäłņ¦Ć ņĀäņØ┤ņāüĒā£ņŚÉ ļīĆĒĢ£ ņäżļ¬ģņØ┤ļŗż.
ĻĘĖļ”╝┬Ā6.
(a) Crystal structure of NNU-15; (b) Stability test of NNU-15 at a fixed potential of ŌłÆ0.6 V (vs. RHE); (c) Structural illustration for the absorption of CO2 on Co(II) site; (d) Reaction mechanism of CO2 conversion into CO; (e) The corresponding free energies for each step in CO2 RR. Reproduced with permission from ref. [83]; Copyright 2019, Elsevier.
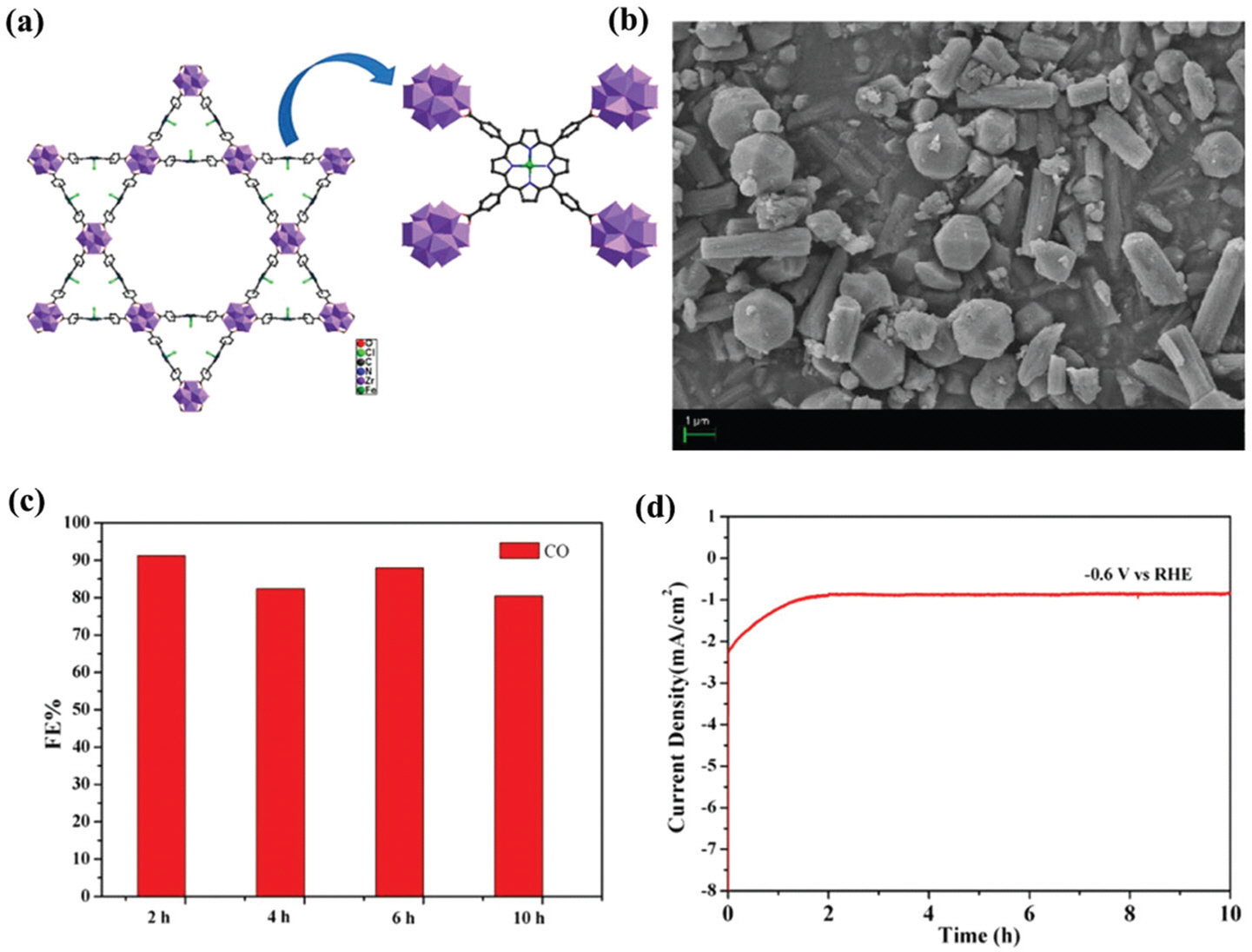
Wang ĻĘĖļŻ╣ņØĆ ņ¦ĆņåŹņĀüņØĖ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ metal-polyoxometalate MOF (M-PMOF) ĻĄ¼ņĪ░ (M = Co, Ni, Fe, Zn)ļź╝ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņ┤ēļ¦żļĪ£ ņØ┤ņÜ®Ē¢łļŗż(ĻĘĖļ”╝ 7a). ņ£äņØś 4Ļ░Ćņ¦Ć ĻĖłņåŹņØä ņé¼ņÜ®ĒĢ£ ņ┤ēļ¦ż ņżæ Co-PMOFļŖö Ļ░Ćņן ļåÆņØĆ ĒŖ╣ņä▒ (FE>94%)ņØä ļéśĒāĆļé┤Ļ│Ā(ĻĘĖļ”╝ 7b), ĻĘĖļ”╝ 7cņŚÉņäĀ ņ┤ēļ¦żņØś ņĢłņĀäņä▒ņØ┤ 35ņŗ£Ļ░ä ņØ┤ņāü ņ£Āņ¦ĆļÉ£ļŗżļŖö Ļ▓āņØä ļ│┤ņŚ¼ņżĆļŗż. ļśÉĒĢ£ WangņØĆ ĻĘĖļ”╝ 8a ļ░Å bņŚÉņä£ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ļŗ©Ļ│äņØś ņ×Éņ£Ā ņŚÉļäłņ¦Ćļź╝ Ļ│äņé░ĒĢśņŚ¼ Co-PMOFņØ┤ Ļ░Ćņן ļé«ņØĆ ņ×Éņ£ĀņŚÉļäłņ¦ĆļĪ£ ņØĖĒĢ┤ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉņŚÉ ņĄ£Ļ│ĀņØś ņ×¼ļŻīļ×Ć Ļ▓āņØä ļ│┤ņŚ¼ņżĆļŗż. ĻĘĖļ”╝ 8c ļ░Å dļŖö Co(ŌģĪ)Ļ░Ć Co(ŌģĀ)ļĪ£ ĒÖśņøÉļÉśņ¢┤ ņØ┤ņé░ĒÖöĒāäņåīņŚÉņä£ ņØ╝ņé░ĒÖöĒāäņåīļĪ£ ļ│ĆĒÖśļÉśļŖö ļ░śņØæ ļ®öņ╗żļŗłņ”śņŚÉ ļīĆĒĢ£ ņäżļ¬ģņØ┤ļŗż.
ĻĘĖļ”╝┬Ā7.
(a) A graphical illustration for construction of a series of structures of M-PMOFs (M = Co, Fe, Ni, Zn); (b) The Faradaic efficiency for CO product on various structures of M-PMOFs; (c) Stability test of Co-PMOF at a fixed potential of ŌłÆ0.8 V (vs. RHE). Reproduced with permission from ref. [144]; Copyright 2018, Springer Nature.

ĻĘĖļ”╝┬Ā8.
(a) The corresponding free energies for each step in CO2 RR; (b) Comparison of the free energy of reaction steps (ΔG1, ΔG2, and ΔG3 indicate the free energy of *COOH formation, *CO formation, and CO desorption, respectively) in CO2 RR on M-PMOFs; (c), (d) Reaction mechanism of CO2 conversion into CO on Co-PMOF catalyst. Reproduced with permission from ref. [144]; Copyright 2018, Springer Nature.

ņ▓Ā(Fe) ĻĖ░ļ░ś MOFs
ņ▓Ā ĻĖ░ļ░ś MOFsļŖö ņĮöļ░£ĒŖĖ ĻĖ░ļ░ś MOFņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ĒÜ©ņ£©ņĀüņØĖ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ņĀäĻĖ░ ņ┤ēļ¦żļĪ£ ņé¼ņÜ®ļÉ£ļŗż. Dong ĻĘĖļŻ╣ņØĆ PCN-222(Fe)/CļØ╝ļŖö ļ│ĄĒĢ®ņ▓┤ļź╝ ļ¦īļōżņ¢┤ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņ┤ēļ¦żļĪ£ ņé¼ņÜ®Ē¢łļŗż. PCN-222(Fe)ņØś Ļ▓░ņĀĢ ĻĄ¼ņĪ░ņÖĆ ĒśĢĒā£ĒĢÖ ĻĄ¼ņĪ░ļŖö ĻĘĖļ”╝ 9a ļ░Å bņŚÉ ļéśĒāĆļāłļŗż. ĻĘĖļ”╝ 9cļŖö ņ▓śņØī 2ņŗ£Ļ░ä ļÅÖņĢł ņ┤ēļ¦żņØś Ļ░Ćņן ļåÆņØĆ 91%ņØś FE CO ņÖĆ ļåÆņØĆ FECOļź╝ 10ņŗ£Ļ░äļÅÖņĢł ņ£Āņ¦ĆĒĢśļŖö Ļ▓āņØä ļ│┤ņŚ¼ņżĆļŗż. ņĀäĻĘ╣ņØś Ļ▓ĮņÜ░ļÅä 10ņŗ£Ļ░äļÅÖņĢł ņĢłņĀĢĒĢśļŗżļŖö Ļ▓āņØä ĻĘĖļ”╝ 9dņŚÉņä£ ļéśĒāĆļāłļŗż. Hod ĻĘĖļŻ╣ņØĆ Fe-MOF-525ļź╝ FTOĻĖ░ĒīÉ ņ£äņŚÉ ņä▒ņןņŗ£ņ╝£ ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖś ņ¢æĻĘ╣ņ£╝ļĪ£ ņé¼ņÜ®Ē¢łļŗż84). ņ┤ēļ¦żņŚÉ 2,2,2-trifluoroethanol(TFE)ļź╝ ņ▓©Ļ░ĆĒĢśņ¦Ć ņĢŖņĢśņØä ļĢī, 54%ņØś FE COļź╝ ļ│┤ņŚ¼ņŻ╝ņ¦Ćļ¦ī ņĀäĒĢ┤ņ¦łņŚÉ TFEļź╝ ņ▓©Ļ░ĆĒ¢łņØä Ļ▓ĮņÜ░ 60%ņØś FE COļź╝ ļ│┤ņØĖļŗż.
ĻĘĖļ”╝┬Ā9.
(a) A crystal structure of PCN-222(Fe); (b) SEM image of PCN-222(Fe); (c) The Faradaic efficiency for CO product of PCN-222(Fe)/C; (d) Stability test of Co-PMOF at a fixed potential of ŌłÆ0.6 V (vs. RHE). Reproduced with permission from ref. [145]; Copyright 2018, American Chemical Society.
ĻĄ¼ļ”¼(Cu) ĻĖ░ļ░ś MOFs
ņĢäņŚ░, ņĮöļ░£ĒŖĖ, ņ▓Ā ĻĖ░ļ░ś MOFsļŖö ņØ┤ņé░ĒÖöĒāäņåīļź╝ ņØ╝ņé░ĒÖöĒāäņåīļĪ£ ļ│ĆĒÖśņŗ£ĒéżļŖö ņ×¼ļŻīļĪ£ ņé¼ņÜ®ļÉśņ¦Ćļ¦ī ņØ┤ņÖĆ ļŗżļź┤Ļ▓ī ĻĄ¼ļ”¼ ĻĖ░ļ░ś MOFsņØś Ļ▓ĮņÜ░ ņØ┤ņé░ĒÖöĒāäņåīļź╝ ĒÅ╝ņé░, ņĢīņĮöņś¼, ĒāäĒÖöņłśņåīļĪ£ ļ│ĆĒÖśņŗ£ĒéżļŖö ņ×¼ļŻīļĪ£ ņé¼ņÜ®ļÉ£ļŗż. Hinogami ĻĘĖļŻ╣ņØĆ copper rubeanate MOF(CR-MOF)ļź╝ ĒĢ®ņä▒ĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ ņ┤ēļ¦ż ĒŖ╣ņä▒ņØä ņĖĪņĀĢĒ¢łļŗż85). CR-MOFļŖö HCOOH ĒśĢņä▒ņŚÉ ļåÆņØĆ ņäĀĒāØņä▒ņØä ļ│┤ņØ┤ļ®░ ņØ╝ļ░ś ĻĄ¼ļ”¼ņĀäĻĘ╣ļ│┤ļŗż 13ļ░░ ļ╣ĀļźĖ 13.4 ┬Ąmol/cm ņåŹļÅäļź╝ Ļ░Ćņ¦äļŗż. ĻĘĖ ņØ┤ņ£ĀļĪ£ CR-MOFņØś ņĀäņ×É ļ░ĆļÅäĻ░Ć ĻĄ¼ļ”¼ ĻĖłņåŹņŚÉ ļ╣äĒĢ┤ ļé«ņĢä ņØ┤ņé░ĒÖöĒāäņåīņÖĆņØś ņĢĮĒĢ£ Ļ▓░ĒĢ®ņØä ņØ┤ļüīņ¢┤ HCOOH ĒśĢņä▒ņØä ņ┤ēņ¦äņŗ£ĒéżĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. Kumar ĻĘĖļŻ╣ņØĆ ņÜ®ļ¦żĻ░Ć Cu3(BTC)2ņØś ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ĒŖ╣ņä▒ņŚÉ ņśüĒ¢źņØä ņŻ╝ļŖöĻ░ĆņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņŚ¼ ņ┤ēļ¦żļź╝ N, N-dimethylformamide (DMF)ņÖĆ tetrabutylammonium tetrafluoroborate (TBATFB) Ēś╝ĒĢ® ņÜ®ļ¦ż ļäŻņŚłņØä ļĢī, HCOOHļŖö 90%ņØś ņł£ļÅäņÖĆ 51%ņØś FEļź╝ ļ│┤ņŚ¼ņżĆļŗż(ĻĘĖļ”╝ 10)86). HCOOHĻ░Ć ņāØņä▒ļÉśļŖö ļ®öņ╗żļŗłņ”śņØĆ HCOOŌłÆĻ░Ć DMFņŚÉņä£ ņ¢æņä▒ņ×Éļź╝ ņ¢╗ņ¢┤ CO2ŃåŹ-ņØś ņØ┤ĒĢ®ņ▓┤ĒÖö Ļ│╝ņĀĢņ£╝ļĪ£ļČĆĒä░ ļ¦īļōżņ¢┤ņ¦äļŗż.
3.3 ņĀäĻĖ░ĒÖöĒĢÖ ņ┤ēļ¦żņÜ® MOF ļ│ĄĒĢ®ņ▓┤
ņĢ×ņä£ ņ¢ĖĻĖēĒ¢łļō»ņØ┤ MOFsļŖö ņØ┤ņé░ĒÖöĒāäņåīļź╝ ļŗżņ¢æĒĢ£ ĒÖöĒĢ®ļ¼╝ļĪ£ ļ│ĆĒÖśĒĢśļŖö ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ņ¦Ćļ¦ī, ļé«ņØĆ ņĀäĒĢś ņĀäļÅäļÅä ļĢīļ¼ĖņŚÉ ņĀäĻĖ░ ņ┤ēļ¦ż ņØæņÜ®ņŚÉ ņĀ£ĒĢ£ļÉśņŚłļŗż. ņØ┤ļź╝ ĻĘ╣ļ│ĄĒĢśĻĖ░ ņ£äĒĢ┤ MOFņØś ĒŖ╣ņä▒ņØä ļ░öĻ┐ö ņ┤ēļ¦ż ĒÖ£ļÅÖņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö ņŚ░ĻĄ¼Ļ░Ć ņŗ£ņ×æļÉśņŚłĻ│Ā, ĒŖ╣Ē׳ MOF ĻĄ¼ņĪ░ņŚÉ ņĪ░ņĀł Ļ░ĆļŖźĒĢ£ ĻĖ░Ļ│ĄņØä Ļ▓░ĒĢ®ņŗ£ĒéżĻ▒░ļéś core-shell ĻĄ¼ņĪ░ļĪ£ MOF ļ│ĄĒĢ®ņ▓┤ļź╝ ņĀ£ņ×æĒĢśņŚ¼ ĒÖ£ņä▒ ļČĆļČäņØś ņåÉņŗżņØä ļ¦ēņØīņ£╝ļĪ£ņŹ© ņä▒ļŖźņØä ļåÆņśĆļŗż87).
ĻĄ¼ļ”¼ļŖö ņ£ĀņÜ®ņä▒, ņŗ╝ Ļ░ĆĻ▓®, ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ĒÖöĒĢ®ļ¼╝ņØä ņāØņé░ĒĢĀ ņłś ņ׳ļŖö ĒŖ╣ņä▒Ļ│╝ ļéśļģĖ Ēü¼ĻĖ░ņØś ĻĄ¼ļ”¼ ļéśļģĖņ×ģņ×ÉĻ░Ć ņĀäĻĖ░ĒÖöĒĢÖņĀüņØĖ ņ¦æņĀüņØä ļ¦ēļŖö ņĀĆĒĢŁņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¢┤ ņĀäĻĖ░ĒÖöĒĢÖ Ļ│╝ņĀĢņŚÉņä£ ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖśņŚÉ ļīĆĒĢ£ ļåÆņØĆ ņäĀĒāØņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. Hupp ĻĘĖļ”ģņØĆ MOF(SIM)ņŚÉ ņÜ®ņĢĪņāü ņøÉņ×ÉņĖĄ ņ”Øņ░®ņØä ĒåĄĒĢ┤ Cu2+ļź╝ ĻĘĀņØ╝ĒĢśĻ▓ī ņ”Øņ░®ņŗ£ņ╝£ NU-1000ņØś ņ¢ćņØä ņĖĄņØä ņāØņä▒Ē¢łļŗż. ņĀäĻĖ░ĒÖöĒĢÖ ĒÖśņøÉņ£╝ļĪ£ ĒśĢņä▒ļÉśļŖö ĻĖłņåŹ ĻĄ¼ļ”¼ ļéśļģĖņ×ģņ×É ļŖö Cu-SIM NU1000ņØś ņ¢ćņØĆ ņĖĄņØś ņĀäĻĖ░ĒÖ£ņä▒ņ£╝ļĪ£ ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖśņØä ņ£Āļ░£ĒĢ£ļŗż87).
Luna ĻĘĖļŻ╣ņØĆ ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖśņØä ņ£äĒĢ┤ ļæÉ ļŗ©Ļ│äņØś layer-layer ļ░®ļ▓ĢĻ│╝ ņÜ®ļ¦żņŚ┤ ĒĢ®ņä▒ļ▓Ģņ£╝ļĪ£ MOF ņ×¼ļŻīļź╝ Au nanoarchitecture microelectrodes (AuNMEs) Ēģ£Ēöīļ”┐ņŚÉ ņ”Øņ░®Ē¢łļŗż. MOFņØś ņé¼ņÜ®ņ£╝ļĪ£ ņØ╝ņé░ĒÖöĒāäņåī ĒśĢņä▒ņØ┤ ņ¢ĄņĀ£ļÉśĻ│Ā AuNMEsņŚÉ ņåīļ¤ēņØś ļ®öĒāäĻ│╝ ņŚÉĒāäņØ┤ ļ░£ņāØĒ¢łļŗż. Ļ▓īļŗżĻ░Ć MOFņØś ļČäĒĢ┤ļĪ£ ņØ╝ņé░ĒÖöĒāäņåīļŖö ņĀäĻĖ░ĒÖöĒĢÖ ņŗ£ņŖżĒģ£ņŚÉņä£ ŌłÆ1.0 V(vs. RHE)ņØś ņĀäņĢĢņØä ņØĖĻ░ĆĒĢĀ ļĢī ņāØņä▒ļÉśņŚłļŗż88).
Buonsanti ĻĘĖļŻ╣ņØĆ Ag@Al-PMOF ĒĢśņØ┤ļĖīļ”¼ļō£ ĻĄ¼ņĪ░ļź╝ ņĀ£ņ×æĒĢśņŚ¼ ņĀäĻĖ░ņ┤ēļ¦ż ļ░®ļ▓ĢņØä ĒåĄĒĢ┤ ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖśņŚÉ ņé¼ņÜ®Ē¢łļŗż89). ĒĢ®ņä▒ĒĢ£ Ag@Al-PMOFļŖö ņØ┤ņé░ĒÖöĒāäņåīļź╝ ņØ╝ņé░ĒÖöĒāäņåīļĪ£ ļ│ĆĒÖś ņŗ£ Agļ¦īņØä ņé¼ņÜ®Ē¢łņØä ļĢī ļ│┤ļŗż ņłśņåī ļ░£ņāØ ļ░śņØæņØä ĻĖēĻ▓®ĒĢśĻ▓ī Ļ░Éņåīņŗ£ņ╝£ 2ļ░░ ļåÆņØĆ ĒÜ©ņ£©ņØä ļ│┤ņŚ¼ņżĆļŗż. ņØ┤ļ¤¼ĒĢ£ ĒĢ®ņä▒ņØĆ MOF ĻĄ¼ņĪ░ņŚÉņä£ ļéśļģĖ Ļ▓░ņĀĢņ£╝ļĪ£ņØś ņĀäĒĢś ņØ┤ļÅÖņØä ņ”Øņ¦äņŗ£ĒéżĻ│Ā, ļŗżĻ│Ąņä▒ņØś MOF ĻĄ¼ņĪ░ļŖö ļ¼╝ņ¦ł ņĀäļŗ¼ņØä Ļ░£ņäĀņŗ£Ēé©ļŗż.
Lan ĻĘĖļŻ╣ņØĆ MOFņØś ļé«ņØĆ electron-donatingĻ│╝ ņĀäņ×É ņĀäļÅäļÅäļź╝ Ļ░£ņäĀĒĢśĻĖ░ ņ£äĒĢ┤ MOF ĻĄ¼ņĪ░ņØś ņĀäĒĢś ļ░ĆļÅäļź╝ ņ”ØĻ░Ćņŗ£Ēé¼ ņłś ņ׳ļŖö metallocene (MCp2)ļź╝ ņØ┤ņÜ®Ē¢łļŗż. ĒŖ╣Ē׳ CoCp2@MOF545-CoļŖö ņØ┤ņé░ĒÖöĒāäņåīļź╝ ņØ╝ņé░ĒÖöĒāäņåīļĪ£ ļ│ĆĒÖś ņŗ£ ļåÆņØĆ ņäĀĒāØņä▒ņØĖ 97% (ŌłÆ0.7 V vs. RHE.)ņØś FE CO ļź╝ ļ│┤ņŚ¼ņżĆļŗż.
ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉņØä ņ£äĒĢ£ Ļ┤æņ┤ēļ¦żņÜ® MOF
Fujishima ĻĘĖļŻ╣ņØ┤ TiO2ļź╝ ļ░£Ļ▓¼ĒĢ£ ņØ┤ĒøäļĪ£ ņłśļ¦ÄņØĆ ļ░śļÅäņ▓┤ Ļ┤æņ┤ēļ¦żņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļ░£ņĀäļÉśĻ│Ā ņ¦äĒ¢ē ņżæņŚÉ ņ׳ļŗż9). ļ░śļÅäņ▓┤ Ļ┤æņ┤ēļ¦żļŖö VBņÖĆ CB Ļ░Ćņןņ×Éļ”¼ņØś ņĀłļīĆ ņ£äņ╣śņŚÉ ļö░ļØ╝ ļŗ¼ļØ╝ ņĀüņĀłĒĢ£ ļ░┤ļō£Ļ░Ł ņ£äņ╣śļź╝ Ļ░Ćņ¦ĆļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļŗż. MOFļŖö ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ, ļ¼╝ļČäĒĢ┤90), ņŚ╝ļŻī ļČäĒĢ┤91) ļō▒ Ļ┤æņ┤ēļ¦ż ĒÖ£ļÅÖņØä ĒĢśļŖö ņ£Āļ¦ØĒĢ£ ļ¼╝ņ¦łļĪ£ MOFņØś Ļ┤æņ┤ēļ¦ż ļ░śņØæņØĆ ligand-to-metal charge transfer (LMCT), localized metal-to-ligand charge transfer (MLCT), the ŽĆŌĆōŽĆ* transition of the aromatic ligandņÖĆ Ļ░ÖņØĆ ļ░śļ│ĄņĀüņØĖ ņäĖ Ļ░Ćņ¦Ć ļŗżļźĖ ļ░śņØæņØ┤ ņØ╝ņ¢┤ļéśļ®░ ļ░£ņāØĒĢ£ļŗż92). ļśÉĒĢ£ ĻĖłņåŹ Ēü┤ļ¤¼ņŖżĒä░ņÖĆ ņ£ĀĻĖ░ ļ¦üņ╗żņØś ņĪ┤ņ×¼ļĪ£ MOFļŖö Ļ┤æņłśņ¦æ ļČĆļČäņØä ņĀ£Ļ│ĄĒĢśņŚ¼ ļäōņØĆ Ļ┤æĒØĪņłś ļ▓öņ£äņÖĆ ņĀüņĀłĒĢ£ ļ░┤ļō£Ļ░Ł ņŚÉļäłņ¦Ć, Ē¢źņāüļÉ£ ņØ┤ņé░ĒÖöĒāäņåī ĒØĪņ░® ņÜ®ļ¤ē ļ░Å ĒÜ©ņ£©ņØä ļŗ¼ņä▒ĒĢĀ ņłś ņ׳ļŗż93).
ļ░śļÅäņ▓┤ņÖĆ ĻĘĆĻĖłņåŹņØä ĒżĒĢ©ĒĢ£ MOF ĻĖ░ļ░ś ĒĢśņØ┤ļĖīļ”¼ļō£ ļ│ĄĒĢ®ņ▓┤ Ļ┤æņ┤ēļ¦żļŖö Ēā£ņ¢æļ╣ø ņŖżĒÄÖĒŖĖļ¤╝ņØä ĒØĪņłśĒĢśļŖöļŹ░ ĒÜ©ņ£©ņĀüņØ┤ļŗż. MOF ĻĖ░ļ░ś ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ Ļ┤æņ┤ēļ¦żļŖö ļŗżņØīĻ│╝ Ļ░ÖņØĆ ņןņĀÉņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż: (i) MOFļŖö ļåÆņØĆ Ļ▓░ņĀĢņä▒Ļ│╝ ļŗżĻ│Ąņä▒ņ£╝ļĪ£ ĻĖłņåŹ Ēü┤ļ¤¼ņŖżĒä░ņÖĆ ņ£ĀĻĖ░ ļ¦üņ╗ż Ļ░ä Ļ┤æļ░£ņāØļÉ£ ņĀäņ×ÉņØś ņē¼ņÜ┤ ņĀäĒĢś ņØ┤ļÅÖņØ┤ Ļ░ĆļŖźĒĢśĻ│Ā ņØĖņĀæĒĢ£ ĻĖ░Ļ│ĄņŚÉņä£ļŖö ļ░śņØæņØś ļ¼╝ņ¦łņĀäļŗ¼ņØ┤ ņ┤ēņ¦äļÉ£ļŗż94). (ii) ņÜ░ņłśĒĢ£ ĒØĪņ░® ĒŖ╣ņä▒ņØä ĒåĄĒĢ┤ ĻĖ░Ļ│Ą ņ▒äļäÉ ņŻ╝ļ│ĆņŚÉ ļåÆņØĆ ļåŹļÅäņØś ņØ┤ņé░ĒÖöĒāäņåīļź╝ Ļ░Ćņ¦ł ņłś ņ׳ņ¢┤ ĒÖśņøÉņØś ĒÜ©ņ£©ņä▒ņØä ļåÆņØĖļŗż95). (iii)ļäōņØĆ ļ╣äĒæ£ļ®┤ņĀüņØä Ļ░Ćņ¦ä MOF ņØś ĻĄ¼ņĪ░ļŖö ĻĖłņåŹ ļéśļģĖ ņ×ģņ×Éļź╝ ņłśņÜ®ĒĢśļŖö ņĀäņ×É ņłśņÜ®ņ▓┤ņØś ņŚŁ ĒĢĀņØä ĒĢśņŚ¼ ļ│┤ļŗż ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ņĀäĒĢśļź╝ ļČäļ”¼ĒĢ£ļŗż96). ļö░ļØ╝ņä£ MOFņØś ĒØĪņ░®ļŖźļĀźņØĆ Ēæ£ļ®┤ņĀüņØä ļŖśļĀż Ļ░£ņäĀĒĢśĻ│Ā, ĻĖłņåŹ ļČĆņ£äņÖĆ ĒØĪņ░® ņŚöĒāłĒö╝ņØś ņ┤Øļ¤ēņØä ļŖśļĀż ņ┤ēļ¦ż ĒÖ£ņä▒ņØä ļåÆņØĖļŗż97). ņĢ×ņä£ ņ¢ĖĻĖēĒĢ£ ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ņןņĀÉņ£╝ļĪ£ MOFļŖö ņ£Āļ¦ØĒĢ£ ņØ┤ņé░ĒÖöĒāäņåī Ļ┤æņ┤ēļ¦żļĪ£ ņŚ░ĻĄ¼ļÉ£ļŗż.
ļŗżņØīņ£╝ļĪ£ ļéśņśżļŖö ļé┤ņÜ®ņØĆ Ēā£ņ¢æĻ┤æņäĀ ņĪ░ņé¼ ņŗ£ ļ░śļÅäņ▓┤, Ļ┤æņ”ØĻ░ÉņĀ£, ĻĖłņåŹ ļéśļģĖņ×ģņ×É ļ│ĄĒĢ®ņ▓┤ ņĀ£ņ×æĻ│╝ Ļ░ÖņØ┤ ļŗżļźĖ ņ×¼ļŻīņÖĆņØś ņĄ£ņĀüĒÖöļź╝ ĒåĄĒĢ┤ ņä▒ļŖźĻ│╝ ņĀäĒĢś ņĀäļŗ¼ ļŖźļĀźņØä Ē¢źņāüņŗ£ņ╝£ ņØ┤ņé░ĒÖöĒāäņåī ĒØĪņłś ņÜ®ļ¤ē, ĒÖ£ņä▒ ņ┤ēļ¦ż ņäĀĒāØņŚÉ ļīĆĒĢ£ MOFņØś ņØ┤ņé░ĒÖöĒāäņåī Ļ┤æĒÖśņøÉ ĒÜ©ņ£©ņØä Ē¢źņāüņŗ£ĒéżļŖö ļ░®ļ▓ĢņŚÉ ļīĆĒĢ£ ļ¬ć Ļ░Ćņ¦Ć ņśłļź╝ ļ│┤ņŚ¼ņżä Ļ▓āņØ┤ļŗż.
4.1 MOF Ļ┤æņ┤ēļ¦ż
ļø░ņ¢┤ļé£ ņØ┤ņé░ĒÖöĒāäņåī ĒÖöĒĢÖĒØĪņ░®Ļ│╝ ĒÖ£ņä▒ĒÖö ĒŖ╣ņä▒ņ£╝ļĪ£ MOF ļŖö ņØ┤ņé░ĒÖöĒāäņåī Ļ┤æĒÖśņøÉņŚÉ ļåÆņØĆ ĒÜ©ņ£©Ļ│╝ ņĢłņĀĢņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳Ļ│Ā, MOFņØś ļ░śļÅäņ▓┤ ņä▒ņ¦łņØĆ Ļ┤æņ£ĀļÅäļÉ£ ņĀäņ×ÉņØś ņē¼ņÜ┤ ņłśņ¦æĻ│╝ Ļ┤æņ┤ēļ¦ż ĒŖ╣ņä▒ņŚÉ ņśüĒ¢źņØä ļü╝ņ╣śļŖö ļ│Ėņ¦łņĀüņØĖ ĒŖ╣ņä▒ņØä Ļ▓░ņĀĢĒĢ£ļŗż98). MOFņØś ļŗżĻ│Ąņä▒ ĻĄ¼ņĪ░ļŖö ļåÆņØĆ ņØ┤ņé░ĒÖöĒāäņåī Ļ▓░ĒĢ® ņŚÉļäłņ¦Ćļź╝ Ļ░Ćņ¦ĆĻ│Ā ĒÖśņøÉ ļ░śņØæņØä ņ┤ēņ¦äĒĢĀ ņłś ņ׳ņ¢┤ ņÖĖļČĆ ĻĖłņåŹ ņ¢æņØ┤ņś©ņØĆ MOFņØś ņ£ĀĻĖ░ ļ¦üņ╗żļéś ĻĖłņåŹ ļģĖļō£ņŚÉ ņŻ╝ņ×ģļÉśņ¢┤ MOFņØś Ļ┤æņ┤ēļ¦ż ĒŖ╣ņä▒ņØä ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ņ”ØĻ░Ćņŗ£Ēé©ļŗżļŖö Ļ▓āņØä ņ”Øļ¬ģĒ¢łļŗż99).
ĻĖłņåŹ Ēü┤ļ¤¼ņŖżĒä░
MOFļŖö ļŗżĻ│Ąņä▒ņØś ņ£ĀĻĖ░ ļ¦üņ╗żņÖĆ ĻĖłņåŹ Ēü┤ļ¤¼ņŖżĒä░ļĪ£ ĒśĢņä▒ļÉśļ®░ 1ņ░©ņøÉ, 2ņ░©ņøÉ, 3ņ░©ņøÉ ĻĄ¼ņĪ░ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż100ŌĆō101). MOFņØś ĻĖłņåŹ Ēü┤ļ¤¼ņŖżĒä░ļŖö ņØ┤ņé░ĒÖöĒāäņåī ļØ╝ļööņ╣╝ ĒØĪņłśļź╝ ņ£äĒĢ£ ĒÖśņøÉ ņŚŁĒĢĀņØä ĒĢśĻ│Ā ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ Ļ┤æņ┤ēļ¦ż ĒÖ£ļÅÖņØä Ļ░£ņŗ£ĒĢ£ļŗż. ĒāĆņØ┤ĒāĆļŖä, ņ¦Ćļź┤ņĮöļŖä, ņ▓Ā ĻĖ░ļ░ś MOFļŖö ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ Ļ┤æņ┤ēļ¦żļĪ£ Ļ░Ćņן ĒÖ£ļ░£ĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļÉśĻ│Ā ņ׳ļŗż. ņØ┤ņÖĆ Ļ░ÖņØ┤ Ļ┤æĒÖ£ņä▒ ĻĖłņåŹ Ēü┤ļ¤¼ņŖżĒä░ļŖö Ļ┤æņŚ¼ĻĖ░ļÉ£ ņĀäņ×Éļź╝ ļČÖņ×ĪņĢäļæÉņ¢┤ Ļ┤æņ┤ēļ¦ż ļ░śņØæņØä Ļ░ĆņåŹĒÖöĒĢśļŖö ļ░śļÅäņ▓┤ ņŚŁĒĢĀņØä ĒĢśļ®░ ņØ┤ļŖö ņĀäņ×É-ņĀĢĻ│Ą ņīŹņØś ņ×¼ņĪ░ĒĢ® ņåŹļÅäļź╝ ļŹöņÜ▒ Ļ░Éņåīņŗ£Ēé©ļŗż102). MOFļŖö ĻĖłņåŹ ņØ┤ņś©Ļ│╝ ņ£ĀĻĖ░ ļ¦üņ╗żļŖö ĒŖ╣ņä▒ņØä ņēĮĻ▓ī ņĪ░ņĀłĒĢśĻ│Ā ņłśņĀĢĒĢĀ ņłś ņ׳ļŗżļŖö ņןņĀÉņ£╝ļĪ£ Ē¢źņāüļÉ£ ņä▒ļŖźņØä Ļ░Ćņ¦ł ņłś ņ׳Ļ│Ā, ĻĖłņåŹ ņØ┤ņś©ņØś ļŗżļźĖ ņøÉņ×ÉĻ░Ć ņāüĒā£(Ti4+/Ti3+, Zr4+/ Zr3+, Fe3+/Fe2+)ļź╝ Ļ░Ćņ¦ĆĻ▓ī ļĢīļ¼ĖņŚÉ ĒÜ©ņ£©ņĀüņØĖ Ļ┤æņ┤ēļ¦ż ĒÖśņøÉņØ┤ Ļ░ĆļŖźĒĢśļŗż.
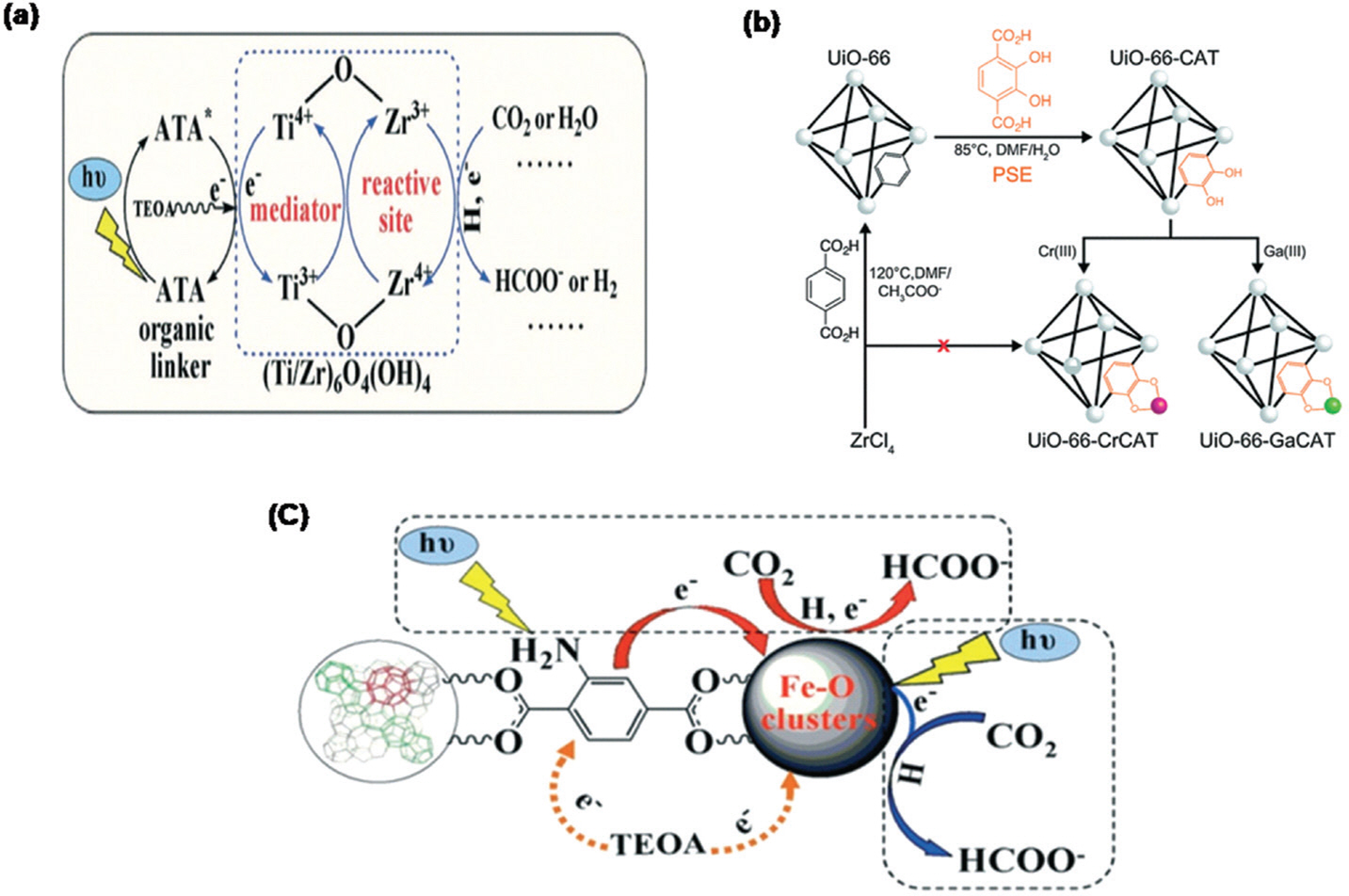
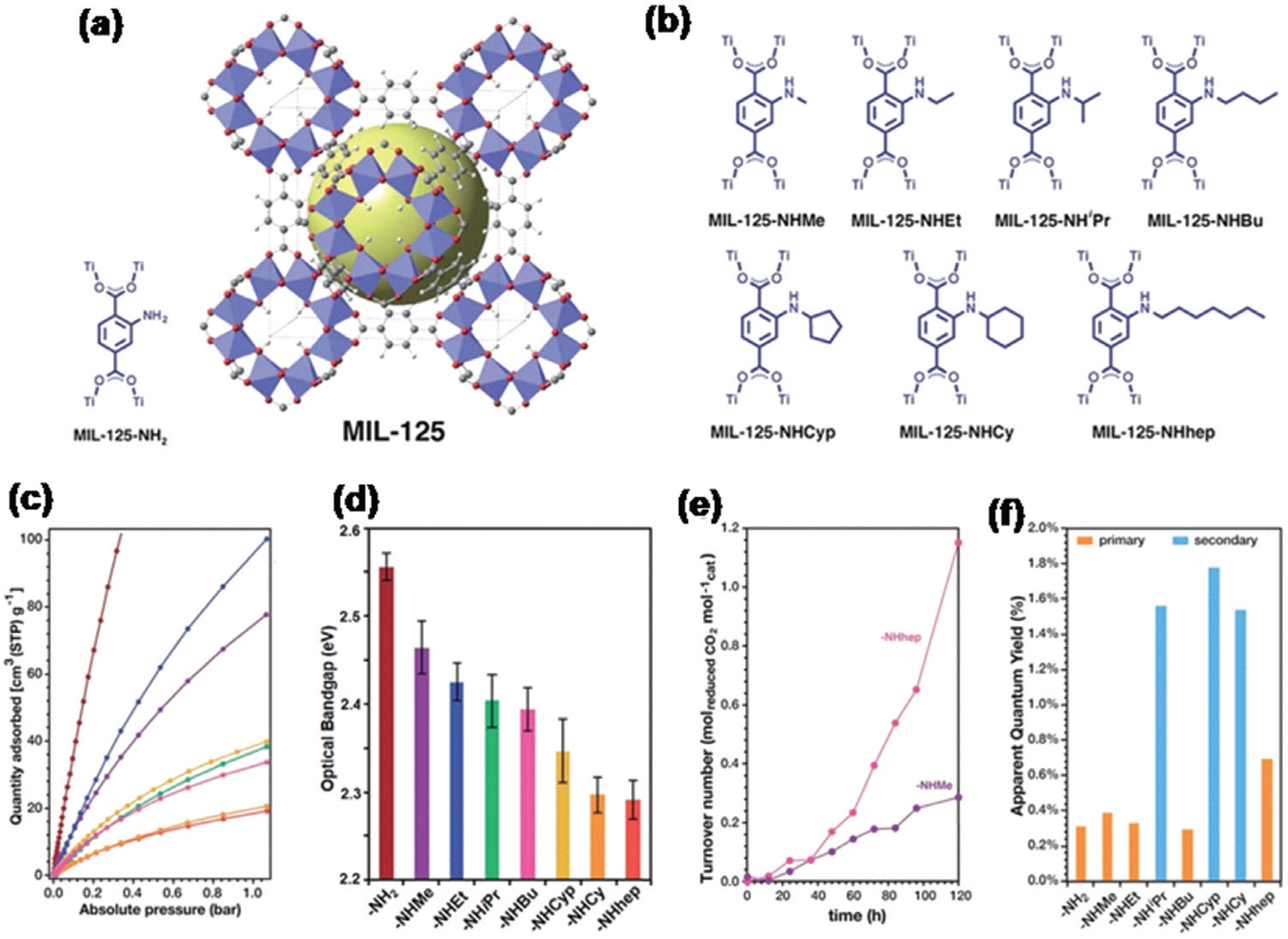
ļŗżņ¢æĒĢ£ ņøÉņ×ÉĻ░Ć ņāüĒā£(Ti4+/Ti3+, Zr4+/Zr3+)ļź╝ Ļ░Ćņ¦ä ņ¦Ćļź┤ņĮöļŖäĻ│╝ ĒāĆņØ┤ĒāĆļŖäņØĆ Ļ│ĀļŗżĻ│Ąņä▒Ļ│╝ ĒÖöĒĢÖ ļ░śņØæņŚÉņä£ņØś ļåÆņØĆ ņĢłņĀĢņä▒ņ£╝ļĪ£ ņØĖĒĢ┤ MOFņØś ĻĖłņåŹ ļģĖļō£ļĪ£ ņĀüĒĢ®ĒĢśļŗż103ŌĆō104). Ļ░Ćņן ļ¦ÄņØĆ ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉ£ ņ¦Ćļź┤ņĮöļŖä ĻĖ░ļ░ś MOF (UiO-66(Zr))ļŖö Zr6 O4(OH)4ņÖĆ benzene-1,4-dicarboxylic acid (BDC) ļ”¼Ļ░äļō£ļĪ£ ĒśĢņä▒ļÉ£ļŗż105). ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ UiO-66(Zr)ļŖö ņłśņåī ņāØņé░ ļ░śņØæņŚÉ ļīĆĒĢ£ Ļ┤æņ┤ēļ¦żļĪ£ ņóŗņØĆ Ļ▓░Ļ│╝ļź╝ ļ│┤ņŚ¼ņż¼ņ¦Ćļ¦ī, Ēā£ņ¢æļ╣ø ņĪ░ņé¼ĒĢĀ ņŗ£ ņ£ĀĻĖ░ ļ¦üņ╗ż (BDC)ņÖĆ Zr-O Ļ░ä ļ╣äĒÜ©ņ£©ņĀüņØĖ ņĀäņ×É ņĀäņØ┤ļĪ£ ņØĖĒĢ┤ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ Ļ┤æņ┤ēļ¦żļĪ£ ņóŗņ¦Ć ņĢŖņØĆ Ļ▓░Ļ│╝ļź╝ ļ│┤ņŚ¼ņżĆļŗż106). ņØ┤ņÖĆ ļŗ¼ļ”¼ ņØ╝ļČĆ ļ│┤Ļ│ĀņŚÉņä£ļŖö Ēā£ņ¢æļ╣ø ņĪ░ņé¼ ņŗ£ ĻĖłņåŹ-ĻĖłņåŹ ņĀäĒĢś ņĀäļŗ¼ņØä ĒåĄĒĢ£ MOF ņ¢æņØ┤ņś©ņØś ļČĆļČä ņ╣śĒÖśņ£╝ļĪ£ Ļ┤æņ┤ēļ¦ż ņä▒ļŖźņØä Ļ░£ņäĀĒ¢łļŗż107). 2017ļģä Tu ĻĘĖļŻ╣ņØĆ microwave-assisted ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ UiO-66(Zr)ņØś ņ¦Ćļź┤ņĮöļŖä-ņśźņåī Ēü┤ļ¤¼ ņŖżĒä░ņŚÉ ņ׳ļŖö Zr(IV) ĻĖłņåŹņØä Ti(IV) ĻĖłņåŹņ£╝ļĪ£ ļČĆļČä ņ╣śĒÖśĒĢśņŚ¼ (UiO-66(Zr/Ti)-M ņĀ£ņ×æĒ¢łļŗż108). ņ¦Ćļź┤ņĮöļŖä ĻĖłņåŹņØä ņØ╝ļČĆ ĒāĆņØ┤ĒāĆļŖä ĻĖłņåŹņ£╝ļĪ£ ņ╣śĒÖśņØä ĒĢśļ®┤ band-edge alignmentļź╝ ĒåĄĒĢ┤ MOFņØś ņĀäņ¦Ć ĒŖ╣ņä▒Ļ│╝ ņĀäĒĢś ņØ┤ļÅÖ ņåŹļÅäĻ░Ć Ļ░£ņäĀņØ┤ ļÉśņ¢┤ ņÜ░ņłśĒĢ£ ņä▒ļŖźņØä ļ│┤ņŚ¼ņżĆļŗż107). ļśÉĒĢ£ UiO-66(Zr/Ti)-M ĻĄ¼ņĪ░ļŖö ņ£ĀĻĖ░ ļ¦üņ╗ż (BDC)ņŚÉņä£ Zr-O Ēü┤ļ¤¼ņŖżĒä░ļĪ£ ņŚæņŗ£ĒåżņØś ņĀäĒĢś ņØ┤ļÅÖņŚÉ ļÅäņøĆņØä ņŻ╝ņ¢┤ ĒøīļźŁĒĢ£ Ļ┤æņ┤ēļ¦ż ĒÖ£ļÅÖņØä ļ│┤ņŚ¼ņżĆļŗż. ļŗżļźĖ ĻĖłņåŹ ņØ┤ņś©ļÅä ļŗżņ¢æĒĢ£ ņĀäļץņØä ĒåĄĒĢ┤ MOFņØś ņ¦Ćļź┤ņĮöļŖä ņØ┤ņś©ņØä ļīĆņ▓┤ĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ļ░śņØæ Ļ┤æņ┤ēļ¦żļĪ£ ļåÆņØĆ ĒŖ╣ņä▒ņØä ļ│┤ņŚ¼ņŻ╝ļŖöļŹ░, ņśłļź╝ ļōżņ¢┤ BDC ļ¦üņ╗ż ļīĆņŗĀņŚÉ NH2-BDCļź╝ ņé¼ņÜ®ĒĢśņŚ¼ NH2-UiO-66(Zr)109)ņØä ĒĢ®ņä▒ĒĢśĻ▒░ļéś Post-Synthetic Exchange (PSE)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ Ti4+ ņØ┤ņś©ņØä Zr4+ļĪ£ ņ╣śĒÖśĒĢśņŚ¼ ĒĢ®ņä▒ĒĢ£ NH2-UiO66(Zr/Ti)ņØä ĻĘĖļ”╝ 11aņŚÉņä£ ļ│┤ņŚ¼ņżĆļŗż. ĻĘĖļ”╝ 11bņØĆ Post-Synthetic Incorporation (PSI)ņ£╝ļĪ£ Cr3+ņÖĆ Ga3+ ĻĖłņåŹ ņØ┤ņś©ņØä ņ¦Ćļź┤ņĮöļŖä ņØ┤ņś©ņ£╝ļĪ£ ļīĆņ▓┤ĒĢśņŚ¼ UiO-66-CrCATņÖĆ UIO-66-GaCAT ĒĢ®ņä▒ņŚÉ ņä▒Ļ│ĄĒĢśļŖö Ļ▓āņØä ļ│┤ņŚ¼ņżĆļŗż110).
ĻĘĖļ”╝┬Ā11.
(a) Proposed enhanced mechanism for the photocatalytic reactions over NH2-UiO-66(Zr/Ti). Reproduced with permission from ref[107]; Copyright 2015, Royal Society of Chemistry. (b) Preparation of UiO-66-CrCAT and UiO-66-Ga-CAT through post-synthetic exchange (PSE) and metalation. Reprinted with permission from ref[110]; Copyright 2011, American Chemical Society. (c) Dual excitation pathways over amino-functionalized Fe-based MOFs. Reprinted with permission from ref[147]; Copyright 2017, Royal Society of Chemistry.
BDC ļ”¼Ļ░äļō£ņÖĆ Ti8 O8(OH)4 secondary building units (SBUs)ļĪ£ ĻĄ¼ņä▒ļÉ£ ņ┤łļŗżĻ│Ąņä▒ ĒāĆņØ┤ĒāĆļŖä MOFņØĖ MIL-125(Ti)ļŖö ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ Ļ┤æņ┤ēļ¦żļĪ£ ļäÉļ”¼ ņŚ░ĻĄ¼ ņżæņŚÉ ņ׳ļŗż. ĒĢ£ ņŚ░ĻĄ¼ļŖö ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ņ┤ēļ¦żļĪ£ MIL-125(Ti)ņØä ņé¼ņÜ®ĒĢśņŚ¼ Ēā£ņ¢æļ╣øņØä ņĪ░ņé¼ĒĢśĻ▒░ļéś ņĢäņäĖĒåĀļŗłĒŖĖļ”┤ ņÜ®ļ¦żņŚÉ ļäŻņØä Ļ▓ĮņÜ░ 2.41 ├Ś 10ŌłÆ6 molņØś ĒÅ╝ņé░ņŚ╝ņØä ņāØņé░ĒĢśļŖö Ļ▓āņØä ļ│┤Ļ│ĀĒ¢łļŗż. ļśÉĒĢ£ BDC ņ£ĀĻĖ░ļ¦üņ╗żļź╝ 2-aminoterephthalic acid (H2 ATA)ļĪ£ ņ╣śĒÖśĒĢśņŚ¼ ĒĢ®ņä▒ĒĢ£ MIL-125(Ti)ļŖö Ļ┤æņ┤ēļ¦żļĪ£ ĒÖ£ļÅÖņŚÉņä£ ļłłņŚÉ ļØäĻ▓ī Ē¢źņāüļÉ£ ĒŖ╣ņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗżļŖö Ļ▓āņØä ĒÖĢņØĖĒ¢łļŗż54).
ņ▓Ā ĻĖ░ļ░ś MOFsļŖö Fe-O Ēü┤ļ¤¼ņŖżĒä░ņØś ņĪ┤ņ×¼ļĪ£ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ Ļ┤æņ┤ēļ¦żļĪ£ ļ¦ÄņØĆ ņŻ╝ļ¬®ņØä ļ░øĻ│Ā ņ׳ļŖöļŹ░, ĒŖ╣Ē׳ Ļ░Ćņŗ£Ļ┤æņäĀņØä ņĪ░ņé¼ ņŗ£ Ļ┤æņŚ¼ĻĖ░ļÉ£ ņĀäņ×ÉĻ░Ć O2-ņŚÉņä£ Fe3+ļĪ£ ņ¦üņĀæ ņ£ĀļÅäļÉśņ¢┤ Fe2+ļź╝ ĒśĢņä▒ĒĢĀ ņłś ņ׳ļŗż111). ļŗżļźĖ ļ│┤Ļ│ĀņŚÉņäĀ Ļ░Ćņŗ£Ļ┤æņäĀ ņĪ░ņé¼ ņŗ£ ņ▓Ā ĻĖ░ļ░ś MOFļĪ£ MIL-101(Fe), MIL-53(Fe), MIL-88B(Fe)ļź╝ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ Ļ┤æņ┤ēļ¦żļĪ£ ņé¼ņÜ®Ē¢łļŗż112). ņäĖ Ļ░Ćņ¦Ć ņ┤ēļ¦ż ņżæ ĒŖĖļ”¼ņŚÉĒāäņś¼ņĢäļ»╝ņØ┤ ĒżĒĢ©ļÉ£ ņĢäņäĖĒåĀļŗłĒŖĖļ”┤ ņÜ®ļ¦żņŚÉņä£ ņāØņä▒ļÉśļŖö MIL-101(Fe)ļŖö 59.9 ┬ĄmolņØś ļåÆņØĆ molar rateļź╝ ļ│┤ņśĆļŗż. MIL-101(Fe)ņØĆ ļČł ĒżĒÖöļÉ£ ņ▓ĀņØś ņĪ┤ņ×¼ļĪ£ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ Ļ┤æņ┤ēļ¦ż ĒŖ╣ņä▒ņØä Ē¢źņāüņŗ£ĒéżĻ│Ā amine ĻĘĖļŻ╣ņØä ņØ┤ņÜ®ĒĢ£ļŗżļ®┤ ļŹö Ē¢źņāüļÉ£ ĒŖ╣ņä▒ņØä Ļ░Ćņ¦ł ņłś ņ׳ļŗżļŖö Ļ▓āņØä ĻĘĖļ”╝ 11cņŚÉņä£ ļ│┤ņŚ¼ņżĆļŗż. NH2-MIL-101(Fe)ļŖö MIL-101(Fe)ņŚÉ ļ╣äĒĢ┤ ņäĖ ļ░░ ļåÆņØĆ 178 ┬ĄmolņØś ĒÅ╝ņé░ņŚ╝ ņāØņé░ņØä ļ│┤ņŚ¼ņżĆļŗż.
ņ£ĀĻĖ░ ļ¦üņ╗ż
ņĢ×ņäĀ ņ¢ĖĻĖēĒĢ£ ĻĖłņåŹ Ēü┤ļ¤¼ņŖżĒä░ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņ£ĀĻĖ░ ļ¦üņ╗żņÖĆ ņ╗żļäźĒä░(amino-modification, photosensitizer-functionalization, electro-rich conjugated linking)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ MOF ņ×¼ļŻīņØś Ļ┤æņ┤ēļ¦ż ņä▒ļŖźņØä ņś¼ļ”¼ļŖö ļŗżņ¢æĒĢ£ ļ░®ļ▓ĢņØ┤ ņĪ┤ņ×¼ĒĢśļŖöļŹ░ Ļ┤æļ▓öņ£äĒĢ£ Ļ┤æĒØĪņłś, ļåÆņØĆ ņĀäņ×É ļ░ĆļÅä, Ļ┤æļ░£ņāØļÉ£ ņĀäĒĢś ņÜ┤ļ░śņ▓┤ņØś ļé«ņØĆ ņ×¼Ļ▓░ĒĢ® ņåŹļÅä, ņØ┤ņé░ĒÖöĒāäņåīņÖĆņØś Ļ░ĢĒĢ£ Ļ▓░ĒĢ® ļō▒ņØ┤ MOFņØś Ļ┤æņ┤ēļ¦ż ĒÖ£ļÅÖņØä Ļ▓░ņĀĢĒĢ£ļŗż93).
ņØ┤ļĪĀ ļ░Å ņŗżĒŚśņØä ĒåĄĒĢ┤ aromatic polycarboxylatesļź╝ MOF ņ£ĀĻĖ░ļ¦üņ╗żļĪ£ ņé¼ņÜ®ĒĢśļ®┤ ļåÆņØĆ ņĀäĒĢś ļ░ĆļÅäļĪ£ Ļ┤æļ░£ņāØ ņĀäņ×Éļź╝ ņēĮĻ▓ī ņĀ£Ļ│ĄĒĢ£ļŗż. ļśÉĒĢ£ NH2 ĻĘĖļŻ╣ņØä ņ£ĀĻĖ░ļ¦üņ╗żļĪ£ ņé¼ņÜ® ĒĢśļ®┤ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ Ļ┤æņ┤ēļ¦ż ĒŖ╣ņä▒ Ē¢źņāüņŚÉ ņŗżņ¦üņĀüņØĖ ļÅäņøĆņØ┤ ļÉ£ļŗż54). ļ▓żņĀĀ Ļ│Āļ”¼ņØś ŽĆ*-ņśżļ╣äĒāłĻ│╝ amineņØś ļ╣äĻ▓░ĒĢ® ņĀäņ×ÉņØś ņāüĒśĖņ×æņÜ®ņØ┤ anti-bondingņŚÉ ļīĆĒĢ£ Ļ┤æņ┤ēļ¦ż ļ░śņØæņØä ņ┤ēņ¦äĒĢ£ļŗż113). ļśÉĒĢ£, ĻĖłņåŹ ļéśļģĖņ×ģņ×ÉĻ░Ć ĻĄ¼ņ▓┤ĒÖöļÉśļŖö Ļ▓āņØĆ Ļ┤æļČäĒĢ┤ ĒÖ£ņä▒ņŚÉ ĒÖĢņŚ░ĒĢ£ Ļ░£ņäĀņØä Ļ░Ćņ¦ĆĻ│Ā ņś©ļŗż114).
Fu ĻĘĖļŻ╣ņØĆ Ēā£ņ¢æļ╣ø ņĪ░ņé¼ ņŗ£ amine ĻĘĖļŻ╣ņØä ņØ┤ņÜ®ĒĢśņŚ¼ MIL-125(Ti)ņØś ĒØĪņłśņÖĆ Ļ┤æĒÖśņøÉ ĒŖ╣ņä▒ņØä ļ░öĻŠĖņŚłļŗż54). ņØ┤ļ¤¼ĒĢ£ ļ░®ļ▓Ģņ£╝ļĪ£ MOFņŚÉņä£ ĒīīņāØļÉśņ¢┤ ļ¦īļōżņ¢┤ņ¦ä NH2-MIL-125(Ti)ļŖö ĻĖ░ņĪ┤ MIL-125(Ti)ņŚÉ ļ╣äĒĢ┤ 2ļ░░ ļåÆņØĆ ņÜ░ņłśĒĢ£ ĒÖ£ņä▒ņØä ļ│┤ņŚ¼ņŻ╝ļŖöļŹ░, ņØ┤ļŖö ņØ┤ņé░ĒÖöĒāäņåī ļČäņ×ÉņÖĆ ļ│ĆĒśĢļÉ£ amine ņ£ĀĻĖ░ ļ¦üņ╗ż Ļ░ä ņĀæņ┤ē ļĢīļ¼ĖņØ┤ļŗż. ļśÉĒĢ£ NH2-MIL-125(Ti)ļŖö 350ņØś ļäōņØĆ ĒØĪņłś ļ▓öņ£äļź╝ Ļ░Ćņ¦Ćļ®░ ĒŖĖļ”¼ņŚÉĒāäņś¼ņĢäļ»╝ņØ┤ ĒżĒĢ©ļÉ£ ņĢäņäĖĒåĀļŗłĒŖĖļ”┤ ņÜ®ļ¦żņŚÉņä£ 8.14 ┬Ąmol ņØś ļåÆņØĆ ĒÅ╝ņé░ņŚ╝ ņāØņé░ņØä ļ│┤ņŚ¼ņżĆļŗż. Logan ĻĘĖļŻ╣ņØĆ NH2-BDCņØś ļ”¼Ļ░äļō£ļź╝ nitrogen-alkyl ĻĘĖļŻ╣ņØ┤ ĒżĒĢ©ļÉ£ ļ”¼Ļ░äļō£ļĪ£ ļīĆņ▓┤ĒĢśņŚ¼ ņ▓┤ņØĖ ĻĖĖņØ┤(methylļČĆĒä░ n-heptyl)ņŚÉ ļö░ļźĖ ņśüĒ¢źņØä ņŚ░ĻĄ¼Ē¢łļŗż(ĻĘĖļ”╝ 12a)115). N-alkyl ņ╣śĒÖśņØś ņ▓┤ ņØĖ ĻĖĖņØ┤Ļ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ¢æņ×É ņłśņ£©Ļ│╝ ļ░śņØæņåŹļÅäĻ░Ć Ē¢źņāüļÉśņŚłļŗż(ĻĘĖļ”╝ 12c-f). ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļŖö UiO-66(Zr)ņØś BDCļź╝ NH2-BDCļĪ£ ņ╣śĒÖśĒĢśņŚ¼ ņ┤łļŗżĻ│Ąņä▒ NH2-UiO-66(Zr)ņØä ņä▒Ļ│ĄņĀüņ£╝ļĪ£ ņĀ£ņ×æĒĢśņśĆļŗż109). ņĀ£ņ×æļÉ£ NH2-UiO-66(Zr)ļŖö Ļ┤æĒØĪņłś ņĀäĒĢś ņØ┤ļÅÖņØä ĒÖĢļīĆĒĢśĻ│Ā ņØ┤ņé░ĒÖöĒāäņåī ĒØĪņ░® ļŖźļĀźņØä ņ”ØĻ░Ćņŗ£ņ╝£ ĒÖĢņŚ░ĒĢ£ Ļ┤æņ┤ēļ¦ż ĒÖ£ņä▒ņØä Ē¢źņāüņŗ£ņ╝░ļŗż.
ĻĘĖļ”╝┬Ā12.
a) Crystal structure of MIL-125(Ti) and b) molecular structures of a series of NH2-BDC linkers with N-alkyl groups. c) CO2 adsorptionŌĆō desorption isotherms and d) optical band gap width of a series of isostructural Ti-based MOF photocatalysts with different linkers. e) Kinetic plot for photocatalytic CO2 reduction over MIL-125-NHMe and MIL-125-Nhhep. f) Quan-tum yields of a series of isostructural Ti-based MOF photocatalysts with different linkers for photocatalytic CO2 reduction. Reproduced with permission from ref[115] Copyright 2017, Royal Society of Chemistry.
4.2 MOF ļ│ĄĒĢ®ņ▓┤ ĒÖ£ņÜ® Ļ┤æņ┤ēļ¦ż
ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ļ░£ņāØļÉ£ ņĀäĒĢśņØś ļČäļ”¼ņÖĆ ņØ┤ļÅÖņŚÉ Ļ░£ņäĀņØä ņŻ╝Ļ▒░ļéś ņĀäĒĢśņØś ņ×¼Ļ▓░ĒĢ®ņØä ņżäņØ┤ļŖö Ļ▓āņØ┤ ņØ┤ņé░ĒÖöĒāäņåī Ļ┤æĒÖśņøÉ ĒÜ©ņ£©ņØä ņ”ØĻ░Ćņŗ£ĒéżļŖöļŹ░ ņżæņÜöĒĢ£ Ļ▓āņØä ĒÖĢņØĖĒ¢łļŗż. MOFļŖö ļåÆņØĆ ņØ┤ņé░ĒÖöĒāäņåī ĒØĪņ░®, ļäōņØĆ Ēæ£ļ®┤ņĀü, ņĪ░ņĀł Ļ░ĆļŖźĒĢ£ ĻĄ¼ņĪ░, Ļ┤æĒĢÖņĀü ĒŖ╣ņä▒Ļ│╝ Ļ░ÖņØĆ ļø░ņ¢┤ļé£ ĒŖ╣ņä▒ņ£╝ļĪ£ ņØĖĒĢ┤ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ Ļ┤æņ┤ēļ¦żļĪ£ ņŚäņ▓Łļé£ ņ×Āņ×¼ļĀźņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. MOFņØś Ļ┤æĒÖśņøÉ ĒÖ£ņä▒ņØä Ļ░£ņäĀĒĢśĻĖ░ ņ£äĒĢ┤ ĻĖłņåŹ, Ēāäņåī, ļ░śļÅäņ▓┤, Ļ┤æņ”ØĻ░É ņĀ£ ļō▒ņØä MOF ĻĄ¼ņĪ░ņŚÉ ĒĢ®ņ│É ĒĢ£ ļ¼╝ņ¦łņŚÉņä£ ļŗżļźĖ ļ¼╝ņ¦łļĪ£ņØś Ļ┤æļ░£ņāØ ņĀäņ×É ņØ┤ļÅÖņØä ņ”ØĻ░Ćņŗ£ĒéżĻ│Ā, ĒØĪņ░®Ļ│╝ ĒÖ£ņä▒ ļČĆļČäņØä ņ”ØĻ░Ćņŗ£ņ╝£ ĒÜ©ņ£©ņĀüņØĖ ņĀäĒĢś ļČäļ”¼ Ļ│╝ņĀĢņØä ņØ┤ļüīņ¢┤ļéĖļŗż116ŌĆō119).
MOF-Ļ┤æņ”ØĻ░ÉņĀ£ ļ│ĄĒĢ®ņ▓┤
ļŻ©ĒģīļŖä(Ru), ļĀłļŖä(Re), Ir(ņØ┤ļ”¼ĒŖ¼) ĻĖ░ļ░ś polypyridine ĻĄ¼ņä▒ņØĆ MOFņØś ņĀäĒĢś ņØ┤ļÅÖ ļŖźļĀź Ļ░£ņäĀņØä ņ£äĒĢ┤ Ļ┤æļ▓öņ£äĒĢśĻ▓ī ņØ┤ņÜ®ĒĢśĻ│Ā ņ׳ļŗż110,120ŌĆō126). ņØ┤ļ¤¼ĒĢ£ Ļ┤æņ”ØĻ░ÉņĀ£ļŖö ĒÖ£ņä▒ ļČĆļČäĻ│╝ Ļ░ÉĻ┤æņä▒ ņóģņØä ļÅäņ×ģĒĢśņŚ¼ ņĀäņ×É-ņĀĢĻ│Ą ņīŹņØä ĒśĢņä▒ĒĢĀ ņłś ņ׳ļŖö ļ╣øņØä ļ¦īļōżņ¢┤ ļéĖļŗż127,128). BPDC ļ¦üņ╗żņÖĆ ļ╣äņŖĘĒĢ£ ĻĄ¼ņĪ░ņÖĆ ņĀäņØ┤ĻĖłņåŹ-ņ╣┤ļź┤ļ│┤ļŗÉ ļ│ĄĒĢ®ņ▓┤ņÖĆņØś ņĪ░ņĀĢņ£╝ļĪ£ 2,2-Bipyridine-5,5-dicarboxylic acid (5,5-dcbpy), 2,2-bipyridine-4,4-dicarboxylic acid (4,4-dcbpy)ļź╝ ņóģņóģ Ļ┤æņ”ØĻ░ÉņĀ£ ĒśĢĒā£ļĪ£ ņé¼ņÜ®ĒĢ£ļŗż. Li ĻĘĖļŻ╣ņØś ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ Ru(CO)2 Cl2ņÖĆ MOF-253 (Al(OH)(5,5-dcbpy))ļź╝ Ļ▓░ĒĢ®ĒĢśņŚ¼ MOF-253-Ru(CO)2 Cl2ļź╝ ņĀ£ņ×æĒĢśņśĆļŗż. Ēā£ ņ¢æļ╣ø ņĪ░ņé¼ ņŗ£ ņ┤ēļ¦żļŖö ĒŖĖļ”¼ņŚÉĒāäņś¼ņĢäļ»╝ņØ┤ ĒżĒĢ©ļÉ£ ņĢäņäĖĒåĀļŗłĒŖĖļ”┤ ņÜ®ļ¦żņŚÉņä£ 0.09 ┬ĄmolņØś ņłśņåīņÖĆ 0.67 ┬ĄmolņØś ĒÅ╝ņé░ņŚ╝, 1.86 ┬ĄmolņØś ņØ╝ņé░ĒÖöĒāäņåīļź╝ ļ¦īļōżņ¢┤ļéĖļŗż. ļ░śļ®┤, MOF-253ļŖö Ļ░ÖņØĆ ņĪ░Ļ▒┤ņŚÉņä£ ņāØņé░ļ¼╝ņØä ļ¦īļōżņ¢┤ ļé┤ņ¦Ć ļ¬╗Ē¢łļŗż124). Cohen ĻĘĖļŻ╣ņØĆ Mn I(CO)5BrņØś Mn I ļČĆļČäĻ│╝ MOF ņØś N,N-chelating ļČĆļČä Ļ░äņØś ņĪ░ĒĢ®ņ£╝ļĪ£ ņłśņĀĢļÉ£ bpyļź╝ ĒżĒĢ©ĒĢ£ UiO-67-dcbpyļź╝ ņĀ£ņ×æĒĢśņśĆļŗż129). 20ņŗ£Ļ░äņØś Ļ┤æņäĀ ņĪ░ņé¼ Ēøä, ļ¦īļōżņ¢┤ņ¦ä UiO-67-Mn(bpy)(CO)3BR Ļ┤æņ┤ēļ¦żļŖö BNAHņÖĆ Ru II(4,4-dcbpy)3ņŚÉņä£ 118ŌłÆ1ņØś turnover frequency (TOF)ņÖĆ 110 ┬▒ 13ņØś ĒÅ╝ņé░ņŚ╝ ĒśĢņä▒ņŚÉ ļÅäļŗ¼ĒĢśņśĆļŗż. ņØ┤ Ļ│╝ņĀĢņØĆ ļ¬ć Ļ░Ćņ¦Ć ļŗ©Ļ│äĻ░Ć ĒĢäņÜöĒĢ£ļŹ░, Ļ░Ćņŗ£Ļ┤æņäĀ ņĪ░ņé¼ ņŗ£ Ru II(4,4┬┤- dcbpy)3 Ļ┤æņ”ØĻ░ÉņĀ£ļŖö BNAHļĪ£ļČĆĒä░ ņŚ¼ĻĖ░ļÉ£ ņĀäņ×Éļź╝ ņłśņÜ®ĒĢśļ®░ Ļ┤æņ┤ēļ¦ż ĒÖśņøÉņØä ņŗ£ņ×æĒĢ£ļŗż. ņłśņĀĢļÉ£ MOF ĻĄ¼ņĪ░ņØś Mn+ ņØ┤ņś©ņØĆ Ru II(4,4┬┤- dcbpy)3ņŚÉņä£ ņĀäņ×Éļź╝ ņłśņÜ®ĒĢ┤ņŚ¼ ņØ┤ņé░ĒÖöĒāäņåīĻ░Ć ņēĮĻ▓ī Mn ļČĆļČäņŚÉ ļČĆņ░®ļÉśļ®░, TEOAņØś ļÅäņøĆņØä ļ░øņĢä ņĀäņ×Éļź╝ ņłśņÜ®ĒĢśĻ│Ā ĒÅ╝ņé░ņŚ╝ņ£╝ļĪ£ ĒÖśņøÉļÉśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż.
MOF-ļ░śļÅäņ▓┤ ļ│ĄĒĢ®ņ▓┤
ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ Ļ┤æņ┤ēļ¦ż ļ░śņØæņŚÉ ļø░ņ¢┤ļé£ ļ░śļÅäņ▓┤ Ļ┤æņ┤ēļ¦żļŖö MOF ņ×¼ļŻīņÖĆ Ļ▓░ĒĢ®ņØä ĒåĄĒĢ┤ ņØ┤ņé░ĒÖöĒāäņåī ĒżĒÜŹņŚÉ ņ׳ņ¢┤ ļåÆņØĆ ņä▒ļŖźņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¢┤ Ļ┤æņ┤ēļ¦żļĪ£ ņĄ£ņĀüņØś ņØ┤ņĀÉņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. Zhang ĻĘĖļŻ╣ņØĆ Ēā£ņ¢æļ╣ø ņĪ░ņé¼ ņŗ£ CO2 Ļ┤æĒÖśņøÉņØä ņ£äĒĢ£ ņĀäņ×É ļÅäļäłļĪ£ ZIF-8ņØä TiO2 Ļ┤æņ┤ēļ¦żļź╝ Ļ▓░ĒĢ®ņŗ£ņ╝░ļŗż130). ZIF-8/TiO2 ĒĢśņØ┤ļĖīļ”¼ļō£ ĻĄ¼ņĪ░ļŖö ZIF-8 ņ¢æņŚÉ ļö░ļØ╝ 1ŌĆō3ļŗ©Ļ│äļĪ£ ņä▒ņןņŗ£ņ╝£ Ļ░üĻ░ü Ti-MOF-1, Ti-MOF-2, Ti-MOF-3ļź╝ ņĀ£ņ×æĒ¢łļŗż. ĻĘĖ ņżæ, Ti-MOF-2ļŖö ņØ╝ļ░śņĀüņØĖ TiO2 ĒĢäļ”äņŚÉ ļ╣äĒĢ┤ ļåÆņØĆ ņØ╝ņé░ĒÖöĒāäņåī(0.53 ┬ĄmolgŌłÆ1 hŌłÆ1), ļ®öĒāä(0.18 ┬ĄmolgŌłÆ1 hŌłÆ1) ņāØņä▒ņØä ļ│┤ņŚ¼ņżĆļŗż.
Wang ĻĘĖļŻ╣ņØĆ CdS ļéśļģĖņ×ģņ×Éļź╝ Co-ZIF-8Ļ│╝ Ļ▓░ĒĢ®ņŗ£ņ╝£ Co-ZIF-9/CdSļź╝ ņĀ£ņ×æĒ¢łļŗż. Ēā£ņ¢æļ╣øņØä ņĪ░ņé¼ ņŗ£, ņĀ£ņ×æļÉ£ ņ┤ēļ¦żļŖö ņØ┤ņé░ĒÖöĒāäņåīļź╝ ņØ╝ņé░ĒÖöĒāäņåīļĪ£ ļ│ĆĒÖśņŗ£ĒéżļŖö Ļ┤æĒÖśņøÉ ņ┤ēļ¦ż ĒŖ╣ņä▒ņØä ļ│┤ņØĖļŗż131). Co-ZIF-9/CdS ņ┤ēļ¦żļŖö 50.4 ┬ĄmolņØś ņØ╝ņé░ĒÖöĒāäņåīņÖĆ 11.1 ┬ĄmolņØś ņłśņåī ļČäņ×Éļź╝ ņāØņé░ņŗ£ĒéżļŖöļŹ░, Ļ░ÖņØĆ ņĪ░Ļ▒┤ņŚÉņä£ CdS ļéśļģĖņ×ģņ×É (0.5├Ś10ŌłÆ6 molņØś ņØ╝ņé░ĒÖöĒāäņåī, 1.6├Ś10ŌłÆ6 molņØś ņłśņåī)ņŚÉ ļ╣äĒĢ┤ ļåÆņØĆ ĒÜ©ņ£©ņØä ļ│┤ņŚ¼ņżĆļŗż. ļ░śļÅäņ▓┤ CdSļŖö Ēā£ņ¢æļ╣ø ņĪ░ņé¼ ņŗ£ ņĀäĒĢś ņÜ┤ ļ░śņ▓┤ļź╝ ļ░£ņāØņŗ£ĒéżĻ│Ā Ļ┤æļ░£ņāØļÉ£ ņĀäņ×ÉļŖö MOF ļ¼╝ņ¦łņŚÉņä£ ĒØĪņ░®ļÉ£ ņØ┤ņé░ĒÖöĒāäņåīļź╝ ņØ╝ņé░ĒÖöĒāäņåīļĪ£ ĒÖśņøÉņŗ£ĒéżĻ│Ā, ļ░śņØæ ļÅÖņĢł ņŚ¼ĻĖ░ļÉ£ ņĀäņ×ÉņŚÉ ņØśĒĢ┤ ņłśņåī ļČäņ×ÉĻ░Ć ĒśĢņä▒ļÉ£ļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ ļ░śļÅäņ▓┤ņÖĆ MOF ņØ┤ĒśĢņĀæĒĢ® ņ┤ēļ¦ż ņĀ£ņ×æņØĆ Ļ┤æļ░£ņāØļÉ£ ņĀäĒĢśņØś ļČäļ”¼ņŚÉ ĒÜ©ņ£©ņĀüņØĖ ĒŖ╣ņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗżļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż119,132).
Shi ĻĘĖļŻ╣ņØĆ ņ¢æņĀäĒĢśņÖĆ ņØīņĀäĒĢśļź╝ Ļ░Ćņ¦ä ņĀĢņĀäĻĖ░ĒĢÖ ĒĢ®ņä▒ņØä ĒåĄĒĢ┤ UiO-66ņÖĆ ļ░śļÅäņ▓┤ carbon nitride nanosheets (CNNS)ļź╝ Ļ▓░ĒĢ®ņŗ£ņ╝£ UiO-66/CNNS ļ│ĄĒĢ®ņ▓┤ļź╝ ņĀ£ņ×æĒ¢łļŗż133). UiO-66/CNNS ļ│ĄĒĢ®ņ▓┤ ĻĄ¼ņĪ░ņØś CNNSņÖĆ UiO-66 Ēæ£ļ®┤ņØś ņāüņäĖĒĢ£ ņĀæĒĢ®ņØĆ Transmission Electron Microscopy (TEM)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØĒ¢łļŗż. ļ│ĄĒĢ®ņ▓┤ ĻĄ¼ņĪ░ļŖö ņØ╝ļ░śņĀüņØĖ CNNSņŚÉ ļ╣äĒĢ┤ ļåÆņØĆ ņØ┤ņé░ĒÖöĒāäņåī ĒØĪņ░® ļŖźļĀźņ£╝ļĪ£ ņØ╝ņé░ĒÖöĒāäņåīļź╝ ĒśĢņä▒ĒĢ£ļŗż. UiO-66/CNNSņØś ņØ┤ņé░ĒÖöĒāäņåī Ļ┤æĒÖśņøÉ ņןĻĖ░ ņĢłņĀäņä▒ņØä ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ decay curvesļź╝ ņØ┤ņÜ®Ē¢łļŗż. ļ│ĄĒĢ®ņ▓┤ņØś ļ░śņØæ ļ®öņ╗żļŗłņ”śņØĆ ļŗżņØīĻ│╝ Ļ░Öļŗż: CNNSņŚÉ ļ╣äĒĢ┤ ļé«ņØĆ LUMO ņŚÉļäłņ¦Ć ņżĆņ£äļź╝ Ļ░Ćņ¦ä UiO-66ņØĆ Ļ┤æļ░£ņāØļÉ£ ņĀäņ×ÉņØś ņē¼ņÜ┤ ņØ┤ļÅÖņ£╝ļĪ£ ļ│ĄĒĢ®ņ▓┤ņŚÉ ĒÆŹļČĆĒĢ£ ņĀäņ×Éļź╝ ņĀ£Ļ│ĄĒĢśņŚ¼ ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖś ĒÜ©ņ£©ņØä ļåÆņØĖļŗż.
ļ░śļÅäņ▓┤ graphitic carbon nitride (g-C3 N4)ļŖö MOF ņÖĆ ĒĢ®ņä▒ ņŗ£, ĒśĢĒā£ĒĢÖ, ĻĄ¼ņĪ░ĒĢÖņĀüņ£╝ļĪ£ ņØ┤ņé░ĒÖöĒāäņåī ļ│ĆĒÖś Ļ┤æņ┤ēļ¦ż ĒŖ╣ņä▒ņØä ļ░öĻŠ╝ļŗż. Wang ĻĘĖļŻ╣ņØĆ ļ®öņĪ░Ēżļ¤¼ņŖż g-C3 N4ļź╝ Ļ┤æņłśņ¦æņ▓┤, Co-ZIF-9ļź╝ ņ┤ēļ¦żļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ Co-ZIF-9/g-C3 N4 ļ│ĄĒĢ®ņ▓┤ļź╝ ņĀ£ņ×æĒ¢łļŗż134).
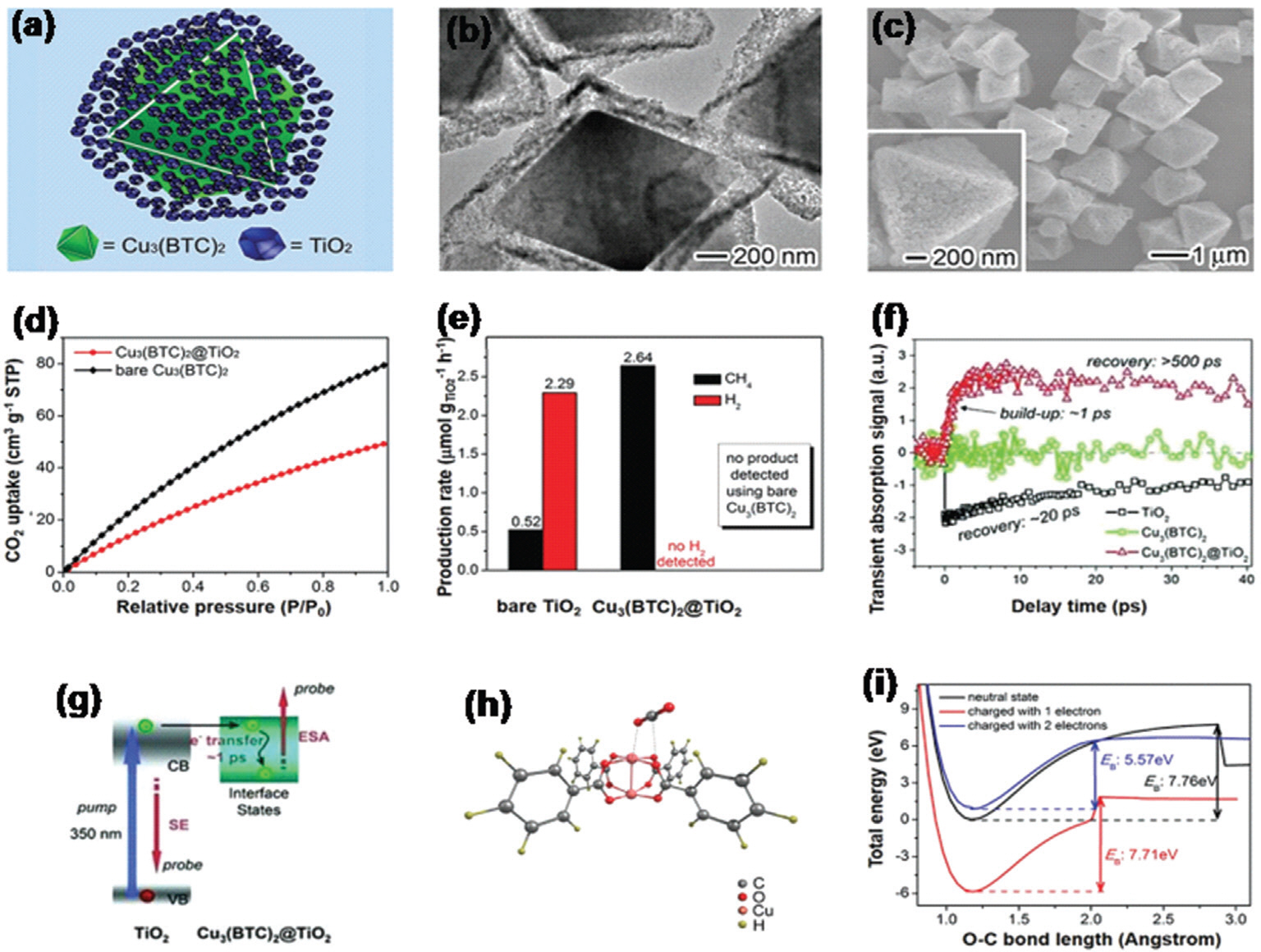
ņĢ×ņä£ ņ¢ĖĻĖēĒĢ£ (TiO2, CdS, g-C3 N4) ļ░śļÅäņ▓┤ ļ¼╝ņ¦łļ┐Éļ¦ī ņĢäļŗłļØ╝ ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ļ░śļÅäņ▓┤ ļ¼╝ņ¦łņØä MOFņÖĆņØś Ļ▓░ĒĢ®ņØä ĒåĄĒĢ┤ ļ│ĄĒĢ®ņ▓┤ļź╝ ņĀ£ņ×æĒĢ£ļŗż. Li ĻĘĖļŻ╣ņØĆ TiO2 ļéśļģĖņ×ģņ×Éļź╝ Cu3(BTC)2 (BTC = 1,3,5-benzenetricarboxylate(oc tahedral microcrystals) Ēæ£ļ®┤ņŚÉ ņä▒ņןņŗ£ņ╝£ core-shell ĻĄ¼ņĪ░ļź╝ Ļ░Ćņ¦ä ļ░śļÅäņ▓┤ ļ│ĄĒĢ®ņ▓┤ļź╝ ļ®öĒāäĻ░ĆņŖż ņāØņä▒ņØä ņ£äĒĢ┤ ĒĢ®ņä▒Ē¢łļŗż(ĻĘĖļ”╝ 13a-c)135). ņĀ£ņ×æļÉ£ TiO2-Cu3(BTC)2ļŖö ņØ╝ļ░ś Cu3(BTC)2ņÖĆ ļ╣äĻĄÉĒ¢łņØä ļĢī ļ│┤ļŗż ļø░ņ¢┤ļé£ ņØ┤ņé░ĒÖöĒāäņåī ĒØĪņ░® ļŖźļĀźņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. ĻĘĖļ”╝ 13eļź╝ ĒåĄĒĢ┤ Ēā£ņ¢æļ╣ø ņĪ░ņé¼ ņŗ£ TiO2-Cu3(BTC)2ņØś ņÜ░ņłśĒĢ£ Ļ┤æĒÖśņøÉ ĒŖ╣ņä▒Ļ│╝ ņäĀĒāØņä▒ņØä ļ│┤ņŚ¼ņżĆļŗż. ĻĘĖļ”╝ 13fļŖö TiO2ņÖĆ TiO2-Cu3(BTC)2 Ļ░ä Ļ│äļ®┤ņāüĒā£ ĒśĢņä▒ņØä ĒåĄĒĢ┤ ĒØĪņ░®Ļ│╝ Ļ┤æļ░£ņāØ ņøĆņ¦üņ×äņØä ĒÖĢņØĖĒĢśņŚ¼ ņĀäĒĢś ļČäļ”¼ņØś ĒÜ©ņ£© Ļ░£ņäĀņØä ļ│┤ņŚ¼ņżĆļŗż. ņóģĒĢ®ņĀüņ£╝ļĪ£ Ļ┤æĒÖśņøÉ ĒŖ╣ ņä▒ Ļ░£ņäĀņØä ņ£äĒĢ┤ ļ│ĄĒĢ®ņ▓┤ ļ¼╝ņ¦łņØś ņē¼ņÜ┤ ņĀäĒĢś ļČäļ”¼ļź╝ Ļ░ĆļŖźĒĢśĻ▓ī ĒĢśļŖö ņØ┤ņé░ĒÖöĒāäņåī ļČäņ×ÉņŚÉ ļīĆĒĢ£ ĒØĪņ░® ļŖźļĀźņØä ĻĘ╣ļīĆĒÖöĒĢ┤ņĢ╝ ĒĢ£ļŗż.
ĻĘĖļ”╝┬Ā13.
Cu3(BTC)2@TiO2 composite: a) schematic illustration, b) TEM image, and c) scanning electron microscopy (SEM) images. d) The comparison of Cu3(BTC)2 and Cu3(BTC)2@TiO2 for the adsorptionŌĆōdesorption isotherm. e) The comparison of TiO2, Cu3(BTC)2, and Cu3(BTC)2@TiO2 for the performance of photocatalytic CO2 conversion, f) ultrafast transient absorption, and g) photoexcited dynamics. h) The optimized structure of a CO2 molecule adsorbed on Cu3(BTC)2. i) Change of E B for CO2 reduction after the addition of a one or two-electron charge. Reproduced with permission from ref[135]. Copyright 2014, Wiley online library.
MOF-ĻĖłņåŹ ļ│ĄĒĢ®ņ▓┤
ĻĘĆĻĖłņåŹ ļéśļģĖņ×ģņ×ÉļŖö ļåÆņØĆ ņŚÉļäłņ¦Ć ņżĆņ£äļĪ£ ņØĖĒĢ┤ Ļ┤æļ░£ņāØ ņĀäĒĢś ņÜ┤ļ░śņ▓┤ņØś ļČäļ”¼Ļ░Ć Ļ░ĆļŖźĒĢśļŗż. ļéśļģĖ Ēü¼ĻĖ░ņØś ĻĘĆĻĖłņåŹņØä MOF ĻĄ¼ņĪ░ņÖĆ Ļ▓░ĒĢ®ņŗ£Ēéż Ļ┤æļ░£ņāØ ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØś ņ×¼Ļ▓░ĒĢ® ņåŹļÅäĻ░Ć Ļ░ÉņåīļÉśņ¢┤ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ņ┤ēļ¦żļĪ£ Ļ░üĻ┤æļ░øĻ│Ā ņ׳ļŗż136ŌĆō137).
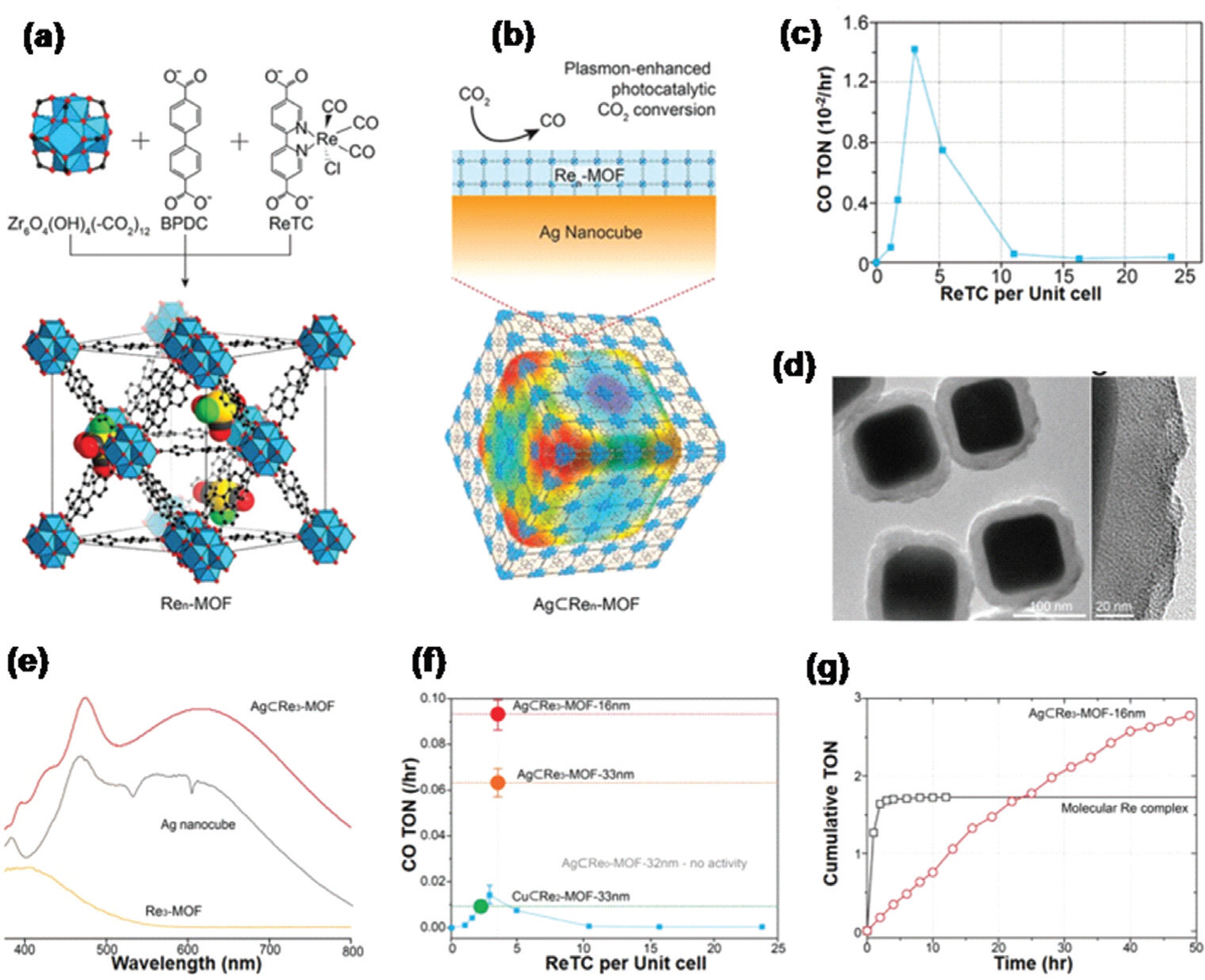
ChoiņÖĆ ĻĘĖņØś ļÅÖļŻīļŖö Ag ļéśļģĖĒüÉļĖīņÖĆ Re-complex Ļ┤æņ”ØĻ░ÉņĀ£ Ļ▓░ĒĢ®ņŗ£ņ╝£ Ļ┤æņ┤ēļ¦żļĪ£ ņØ┤ņÜ®Ē¢łļŗż138). ļ│ĄĒĢ®ņ▓┤ ņ┤ēļ¦żļŖö core-shell ĻĄ¼ņĪ░ļĪ£ AgŌŖéRe n-MOFļØ╝ļŖö ņØ┤ļ”äņØä ļČÖņŚ¼ņ¦ĆļŖöļŹ░ ĻĘĖļ”╝ 14a-hņŚÉņä£ņÖĆ Ļ░ÖņØ┤ nņØĆ ļŗ©ņ£ä ņģĆņØś Re I (5,5-dcbpy)(CO)3 Cl ņłśļź╝ ļéśĒāĆļéĖļŗż. Ļ┤æņ┤ēļ¦ż ĒÖ£ļÅÖņØĆ ļ│ĄĒĢ®ņ▓┤ ĻĄ¼ņĪ░ņØś shellņØś ļæÉĻ╗śņÖĆ Re complexņØś ļåŹļÅäņŚÉ ļö░ļØ╝ ļŗżļź┤ļ®░ Re3-MOFĻ░Ć 16nmņØś ļæÉĻ╗śļź╝ Ļ░Ćņ¦ł ļĢī ņØ╝ļ░ś Re3-MOFņŚÉ ļ╣äĒĢ┤ Ēā£ņ¢æ Ļ┤æņäĀ ņŖżĒÄÖĒŖĖļ¤╝ņŚÉņä£ ļ¦żņÜ░ Ļ░ĢĒĢ£ ņé░ļ×Ć Ēö╝Ēü¼ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¢┤ ņĄ£ļīĆ Ļ┤æĒÖśņøÉ ņä▒ļŖźņØä ļ│┤ņŚ¼ņżĆļŗż.
ĻĘĖļ”╝┬Ā14.
(a) Synthetic scheme of Re n-MOF. b) The structure of AŌŖéRe n-MOF. c) Photocatalytic conversion activities of Ren-MOF under visible-light irradiation. d, e) TEM images of AgŌŖéRen-MOF. f) The comparison of Ag nanocubes, Re3-MOF, and AgŌŖéRe3-MOF 16 nm for the UVŌĆōvisible spectrum. g) The comparison of AgŌŖéRe3-MOF-33 nm, CuŌŖéRe2-MOF-33 nm, AgŌŖéRe3-MOF-16 nm, and AgŌŖéRe0-MOF-32 nm for photocatalytic conversion activity. h) The comparison of AgŌŖéRe3-MOF-16 nm and Re complex for photocatalytic stability. Reproduced with permission from ref[138] Copyright 2017, American Chemical Society.
Li ĻĘĖļŻ╣ņØĆ Pt, AuņÖĆ Ļ░ÖņØĆ ĻĘĆĻĖłņåŹņØä NH2-MIL-125(Ti)ņŚÉ ļÅäĒĢæĒĢśņŚ¼ Ļ┤æņ┤ēļ¦żļĪ£ ņé¼ņÜ®Ē¢łļŗż139). NH2ļź╝ MIL-125(Ti)ņŚÉ ļÅäĒĢæĒĢ£ ņ┤ēļ¦żņØś Ļ▓ĮņÜ░ ĒÅ╝ņé░ņŚ╝ņØä ņāØņé░ĒĢ£ ļ░śļ®┤ ĻĖłņåŹņØä ļÅäĒĢæĒĢ£ NH2-MIL-125(Ti)ņ┤ēļ¦żļŖö ņłśņåī ļČäņ×ÉņÖĆ ĒÅ╝ņé░ņŚ╝ņØä ņāØņé░ĒĢ£ļŗż. ņØ┤ļŖö ĻĘĆĻĖłņåŹņØś ņĀäņ×Éļź╝ Ļ░ĆļæÉļŖö ļÅģĒŖ╣ĒĢ£ ņä▒ņ¦łļĪ£ ņØĖĒĢ┤ ņłśņåī ļ░£ņāØ ļ░śņØæņØä ņØ┤ļüīņ¢┤ļéĖļŗż. 8ņŗ£Ļ░äņØś Ēā£ņ¢æļ╣ø ņĪ░ņé¼ ņŗ£ NH2ļź╝ MIL-125(Ti)ņŚÉ ļÅäĒĢæĒĢ£ ņ┤ēļ¦żļŖö 10.75 ┬ĄmolņØś ĒÅ╝ņé░ņŚ╝ņØä ņāØņé░ĒĢśĻ│Ā Ptļź╝ NH2-MIL-125(Ti)ņŚÉ ļÅäĒĢæĒĢ£ ņ┤ēļ¦żļŖö 12.96 ┬ĄmolņØś ĒÅ╝ņé░ņŚ╝ņØä ņāØņé░ Ē¢łļŗż. ļ░śļ®┤ņŚÉ Auļź╝ NH2-MIL-125(Ti)ņŚÉ ļÅäĒĢæĒĢ£ ņ┤ēļ¦żņØś Ļ▓ĮņÜ░ 9.06 ┬ĄmolņØś ļé«ņØĆ ĒÅ╝ņé░ņŚ╝ ņāØņé░ ĒÜ©ņ£©ņØä ļ│┤ņśĆļŗż.
ĻĘĖļלĒĢĆĻ│╝ Ļ░ÖņØĆ Ēāäņåī ļ¼╝ņ¦łņØĆ MOFņÖĆ Ļ▓░ĒĢ® ņŗ£ Ļ┤æņ”ØĻ░ÉņĀ£ ņŚŁĒĢĀņØä ĒĢśņŚ¼ ĒÜ©ņ£©ņĀüņØĖ ņØ┤ņé░ĒÖöĒāäņåī Ļ┤æĒÖśņøÉ ņ┤ēļ¦ż ņĀ£ņ×æņØ┤ Ļ░ĆļŖźĒĢśļ®░ ņØ┤ļŖö MOFņØś Ļ┤æĒÖśņøÉ ņä▒ļŖźņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö ņĀäļץņØ┤ļŗż140).
Ļ▓░ļĪĀ
ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņØ┤ņé░ĒÖöĒāäņåī ņĀäĻĖ░ĒÖśņøÉ ņ┤ēļ¦ż, Ļ┤æĒÖśņøÉ ņ┤ēļ¦żļŖö ļ¦ÄņØĆ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ£ ļ░£ņĀäņØä Ļ▒░ļōŁĒĢśĻ│Ā ņ׳ņ¦Ćļ¦ī ņ┤ēļ¦żņØś ĒÜ©ņ£©ņä▒Ļ│╝ ņäĀĒāØņä▒ņØ┤ ļé«ĻĖ░ņŚÉ ņČöĻ░Ć ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢ£ ņāüĒā£ņØ┤ļŗż. ņ┤ēļ¦żņØś ļÅģĒŖ╣ĒĢ£ ĻĄ¼ņĪ░, ĒŖ╣ņä▒ ļ░Å ĻĄ¼ņä▒ņØĆ ņÜ░ņłśĒĢ£ ņØ┤ņé░ĒÖö Ēāäņåī ĒÖśņøÉ ņ┤ēļ¦ż ņŚ░ĻĄ¼ņŚÉ ņÜ░ņäĀņł£ņ£äĻ░Ć ļÉśņ¢┤ņĢ╝ ĒĢśļ®░ ņŚ░ĻĄ¼ņ×ÉļōżņØĆ ņØ┤ļĪĀ Ļ│äņé░ņØä ĒåĄĒĢ┤ ņāłļĪ£ ļ░£Ļ▓¼ļÉ£ ņ┤ēļ¦żņØś ļ░śņØæ ņżæĻ░äņ▓┤ņÖĆ ņŚÉļäłņ¦Ć ļ░®ļ▓ĮĻ│╝ ņŚ░Ļ┤Ć ņ׳ļŖö Ļ│╝ņĀäņĢĢņØä ĒÖĢņØĖĒĢśņŚ¼ ņ┤ēļ¦żļź╝ ņāØņé░ĒĢśĻ│Ā ņŚ░ĻĄ¼ĒĢśĻĖ░ ņ£äĒĢ£ ļÅäĻĄ¼ļĪ£ ņé¼ņÜ®ļÉ£ļŗż.
ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ Ļ┤æņ┤ēļ¦żļŖö ļ¼╝ļČäĒĢ┤ņŚÉ ņØ┤ņÜ®ļÉśļŖö Ļ┤æņ┤ēļ¦ż Ļ│ĄņŗØĻ│╝ ļ®öņ╗żļŗłņ”śņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņāłļĪ£ņÜ┤ ĻĄ¼ņĪ░ņÖĆ ĒŖ╣ņä▒ņØä Ļ░Ćņ¦ä ņ┤ēļ¦żļź╝ ņĀ£ņ×æĒĢśņŚ¼ ņ¦äļ│┤ņÖĆ ļ░£ņĀäņØä ņØ┤ļŻ©ņ¢┤ļé╝ ņłś ņ׳ņ£╝ļ®░ Ēśäņ×¼ MOFļŖö ņØ┤ņé░ĒÖöĒāäņåī ļČäņ×É ĒØĪņ░®ņØä ņ”ØĻ░Ćņŗ£Ēé¼ ņłś ņ׳ļŖö ļåÆņØĆ ļŗżĻ│Ąņä▒Ļ│╝ ņĀäņ×É ņØ┤ļÅÖņØ┤ ņēĮļŗżļŖö ĒŖ╣ņä▒ņ£╝ļĪ£ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ņ┤ēļ¦żņĀ£ļĪ£ ļ░£ņĀä ņżæņŚÉ ņ׳ņ¦Ćļ¦ī ļČĆņĪ▒ĒĢ£ Ļ░Ćņŗ£Ļ┤æņäĀ ĒØĪņłś ļŖźļĀź, ņ┤ēļ¦żņØś ļČłņĢłņĀäņä▒, ļé«ņØĆ ņäĀĒāØņä▒ņØĆ ĒÜ©ņ£©ņĀüņØĖ ņØ┤ņé░ĒÖöĒāäņåī ĒÖśņøÉ ņ┤ēļ¦ż ņĀ£ņ×æņØä ņ£äĒĢ┤ ĒĢ┤Ļ▓░ĒĢ┤ļéśĻ░ĆņĢ╝ ĒĢĀ ļ¼ĖņĀ£ņØ┤ļŗż.