나트륨 이온전지 양극활물질 연구 개발 동향
Recent Progress of Cathode Materials for Na-ion batteries
Article information
Trans Abstract
Recently, many researchers focus on Na-ion batteries as an alternative to Li-ion batteries, owing to their low cost and high natural abundance. However, they suffer from low electrochemical performance and large volume expansion, which makes difficult to industrial application. Therefore, various strategies have been proposed to address the current issues, such as particle-size control, surface-coating, and application of electrode material with various crystal structures. Herein, we briefly introduce and discuss the recent research with development trend of cathode material for Na-ion batteries.
1. 서론
화석연료의 사용 증가로 인해 온실효과, 대기오염과 같은 환경문제에 대한 심각성이 대두됨에 따라, 친환경 및 지속 가능한 에너지 생산 및 이를 효율적으로 저장할 수 있는 에너지 저장 매체 개발에 대한 관심이 커지고 있는 상황이다[1]. 1990년도 초, SONY에 의해 최초로 상업화에 성공한 리튬 이온전지는 우수한 전기화학적 성능을 기반으로 노트북, 핸드폰과 같은 소형전자기기용 에너지 저장 매체로 사용되어 왔으며, 최근에는 전기자 동차와 같은 중대형 매체로 활용이 확대됨에 따라 리튬 이온전지가 큰 관심을 받고 있다[2,3]. 이로 인해 리튬 이온전지의 더욱 높은 성능의 에너지 저장 매체에 대한 필요성이 커지고 있으며 그 수요 또한 지속적으로 성장하고 있다. 하지만, 리튬 원자재의 매장량이 희소하며, 이러한 자원 또한 일부 국가에만 한정되어 있는 관계로, 현재 소형 전자기기를 넘어 대용량 에너지 저장 매체로의 적용을 위해 폭발적으로 성장하고 있는 리튬 이온전지의 수요를 공급이 따라가기 어려운 상황이다[1,4]. 현재까지도 리튬 자원의 시장 가격이 큰 폭으로 상승하고 있어, 폭발적으로 성장하는 에너지 저장 매체의 수요를 충족시키기 위해서는 보다 저렴하면서 리튬 이온전지와 비슷한 성능을 낼 수 있는 차세대 에너지 저장 매체의 개발이 요구된다.
현재 가격적 측면 및 성능적 측면에서 리튬 이온전지를 대체할 수 있는 차세대 에너지 저장 매체로 나트륨 이온전지가 가장 많이 거론되고 있다. 나트륨은 우리가 가장 손쉽게 얻을 수 있는 자원 중 하나로, 리튬 대비 저렴한 장점이 있다. 또한, 나트륨 이온의 경우 리튬 이온과 동일한 +1의 산화수를 갖는 알칼리 이온으로, 이러한 까닭에 나트륨 이온전지의 작동 메커니즘은 리튬 이온전지와 유사하여, 다른 차세대 에너지 저장 매체 대비 나트륨 이온전지의 경쟁력이 높은 상황이다[5,6]. 하지만 이러한 장점에도 불구하고, 나트륨 이온전지의 상용화를 위해서는 해결되어야 하는 문제점들이 존재한다. 첫 번째는 리튬 이온(~0.76 Å) 대비 큰 이온 반경을 가지는 나트륨 이온(~1.02 Å)에 의한 문제점이다[7,8]. 양극활물질의 경우 이온의 삽입(Intercalation)과 탈리(Deintercalation)에 의해 에너지 저장 및 사용이 결정되므로, 결정구조 내 이온이 얼마나 쉽게 이동할 수 있는지 와 더불어 이온의 삽입/탈리 시 발생하는 결정구조 변화에 의해 전기화학적 특성이 결정된다. 리튬 이온 대비 이온 반경이 큰 나트륨 이온을 기반으로 하는 양극활물질의 경우 리튬 이온 기반 양극활물질에 비해 충/방전 시 결정구조 내 이온의 확산 및 저장이 상대적으로 어려워지므로, 고속 충/방전 시 이론 특성보다 떨어지는 전기화학적 특성을 나타낸다. 또한 나트륨 이온 거동은 리 튬 이온 거동 대비 보다 큰 격자 팽창 및 수축을 동반하므로, 장기간 동안 연속적인 충/방전에서 나트륨 이온 기반 양극활물질은 리튬 기반 양극활물질보다 더 큰 구조 변형을 겪게 되고 이는 결과적으로 수명특성의 저하를 야기한다. 두 번째로, 나트륨의 상대적으로 높은 산화/환원 전위로 인한 낮은 에너지 밀도의 문제점이 있다. 표준 수소 전극을 기준으로 나트륨 금속에 대한 산화/환원 전위(Na+/Na)는 –2.71V로 리튬 금속에 대한 산화/환원 전위(Li+/Li)인 –3.04V 보다 높으며, 이에 따라 나트륨 금속의 산화/환원 전위 기준 전위차를 통해 결정되는 나트륨 이온전지의 구동 전압이 리튬 이온전지보다 낮아지게 된다[6,9,10]. 결과적으로 같은 양극활물질을 활용하더라도 나트륨 이온전지가 더 낮은 에너지 밀도를 보이게 된다. 따라서, 이러한 나트륨 이온전지의 문제점을 해결하기 위해서는 높은 성능을 갖는 양극활물질 개발이 필수적인 상황이다.
현재까지 각국의 많은 연구자들에 의해 층상형계 전이금속 산화물, 다중음이온 기반 화합물, 프러시안 블루 (Prussian blue) 기반 화합물, 불화물, 황화물 등 다양한 나트륨 이온전지용 양극활물질이 보고되었다. 본 글은 다양한 나트륨 이온전지용 양극활물질에 대한 최근 연구를 포괄적으로 제시하고(Fig. 1 및 Table 1), 해당 소재의 합성 방법, 다양한 분석 방법 및 전기화학적 특성에 대한 내용들에 대하여 다루고자 한다.
2. 층상형계 전이금속 산화물
층상헝계 전이금속 산화물 기반 양극활물질의 일반적인 화학식은 Na x(TM)O2(TM: 전이금속)으로, 여타 양극활물질과 비교 했을 때 단위 질량 당 높은 이론 용량을 가진다는 장점이 있다[11,12]. 층상형계라는 표현에 걸맞게 결정 구조 내 나트륨 이온 거동이 빠르게 일어날 수 있는 2차원의 이온 확산 경로를 가지고 있어, 고속 충/방전에서의 율속 특성이 우수하다는 장점 또한 가지고 있다. 나트륨 이온 기반 층상형계 전이금속 산화물은 크게 O3와 P2 형태로 나누어지는데, 여기서 O는 팔면체(Octahedral), P는 사방정(Prismatic)을 의미한다.
또한 O3 구조의 경우 결정구조 내 c축을 기준으로 산소 이온의 a(=b) 축 위치가 …ABCABC…의 순서로 적층되어 있으며, P2 구조의 경우 산소 이온이 …ABBA…의 순서로 적층되어 있다(Fig. 2)[12]. 이러한 결정구조 형태는 나트륨 이온층(O-Na-O)의 높이와, 전이금속층(O-TM-O)의 높이 비율에 의해 결정이 되며, ~1.62를 기준으로 하여 이보다 클 경우 P2 형태, 작을 경우 O3 형태의 구조를 가지게 된다[12,13]. 이러한 기준에 따라 일반적으로 O3 형태의 구조를 기반으로 하는 양극활물질은 Na x(TM)O2(2/3 < x ≤ 1)와 같은 조성을 보이며, P2 형태의 구조를 기반으로 하는 양극활물질은 Na x(TM) O2(x ≤ 2/3)와 같은 조성을 갖는다. 초기 합성 과정에서 화학양론적 나트륨 이온 비율 차이에 의해 서로 다른 구조를 가지는 O3 구조 및 P2 구조 기반 양극활물질들은 비슷한 전이금속의 조성을 가지고 있을지라도 충/방전 시 서로 다른 전기화학적 특성 및 구조변화를 나타낸다.
2.1 O3기반 층상형계 양극활물질
O3기반 층상형계 양극활물질은 높은 이론 용량과 더불어 고에너지밀도와 우수한 사이클 특성을 갖는 것으로 알려져 있으며[12,14], 대표적인 O3기반 층상형계 양극활물질은 NaCrO2, NaMnO2, NaFeO2, 등이 있다. J. Kim 연구팀(J. Kim et al., 2022)[1]은 NaCrO2이 충전 될 때, 나트륨 이온의 탈리 과정에서 발생하는 Cr의 나트륨 층으로 이동(Cr migration) 현상을 억제하고 기존 용량의 한계를 극복하고자 고상법을 이용하여 0.14몰의 Sb5+가 고용된 Na0.72 Cr0.86 Sb0.14 O2를 합성하였다. 이는 기존 1.5-3.6V의 작동전압을 갖는 NaCrO2에 비해 높은 cut-off 전압인 1.5-4.1V의 전압범위에서 가역적인 충/방전의 진행이 가능하였으며, 175mAh g−1의 높은 방전용량을 보고하였다. J. Tarascon 연구팀(J. Tarascon et al., 2022)[15]은 고상법을 통해 Mn을 기반으로 한 NaLi1/3 Mn2/3 O2를 합성하여 산소의 산화/환원 반응(oxygen redox)를 유도하였다. NaLi1/3 Mn2/3 O2는 1.5-4.5V의 전압범위에서 190mAh g−1의 높은 방전 용량을 보였으며, 충/방전이 진행되는 동안 1/3몰의 리튬이 전이금속층과 나트륨 이온층을 가역적으로 이동하여, 비가역적인 상변이가 일어나지 않게 된다고 보고되었다.
2.2 P2 기반 층상형계 양극활물질
P2 기반 층상형계 양극활물질은 일반적으로 O3 기반 층상형계 양극활물질 대비 높은 이온전도도, 충/방전 과정에서 안정한 구조변화를 보이는 것으로 알려져 있으나[16], 나트륨의 낮은 함량으로 인한 저조한 용량을 해결하기 위해 많은 연구가 진행되었다[12,17]. Y. Sun 연구팀(Y. Sun et al., 2019)[18]에 의해 보고된 Na0.55[Ni0.1 Fe0.1 Mn0.8]O2는 고상법에 의해 합성되었으며, 초기 나트륨 함량인 0.55몰보다 많은 양의 나트륨을 삽입시켜서 초기 충전용량인 ~125mAh g−1보다 높은 ~221.5mAh g−1의 방전용량을 보였다. 이때 각 0.1, 0.1, 0.8몰의 Ni, Fe, Mn이온의 Ni2+/Ni3+, Fe3+/Fe4+와 Mn3+/Mn4+ 산화환원 반응을 통해 0.55몰 이상의 나트륨 이온의 가역적인 삽입/탈리가 이루어 졌다고 보고되었다. H. Zhou (H Zhou et al., 2020)[19]그룹은 3d 전이금속이 아닌 4d 전이금속인 Ru를 기반으로 한 양극활물질을 보고하였다. 보고된 Na0.66 Li0.22 Ru0.78 O2의 충전 시 초기 용량은 Ru4+/Ru5+ 산화환원반응에 의해 나타났지만, 이후 고전압 영역에서는 산소의 산화환원반 응에 의해 발생되었다. 방전이 진행되었을 때도 동일한 현상을 보였으며 그 결과 ~158mAh g−1의 방전용량을 보였다. 또한, 50mA g−1의 전류밀도에서 500사이클 동안 91% 이상의 높은 방전용량 유지율을 나타내어 우수한 구조안정성을 보였다.
3. 다중음이온 양극활물질
다중음이온 양극활물질은 일반적인 전이금속 산화물의 단일 음이온 O2-를 대신하여 XO4y-(X=S, P 등, y=2, 3)가 결정구조 내에 포함되며, X-O의 강한 공유결합으로 인해 구조적 안정성 및 화학적 안정성이 높다는 장점을 가지고 있다[20,21]. 또한 결정구조 내에서 높은 전기음성도를 갖는 X와 TM이 O를 공유하고 있으며, 이로 인해 전이금속과 산소의 결합이 약화되며, 결합 오비탈과 반결합 오비탈의 차이를 줄이게 된다[9,22–24]. 결과적으로 충/방전간 전이금속의 산화/환원 준위의 증가 및 타 소재 대비 높은 작동 전압을 보이게 되는데, 이러한 현상을 유도 현상(inductive effect)이라 한다[9,25,26]. 연구 초기에는 층상형계 기반 양극활물질에 비해 복잡한 이온 확산 통로 및 낮은 전기 전도도로 인해 어려움이 있었으나, 다양한 원소의 도핑, 표면 개질, 카본함량 증가 및 미세입자 조절 등을 이용하여 전기화학적 특성을 향상시키는 연구가 진행되고 있다.
다 중 음 이 온 양 극 활 물 질 은 일 반 적 으 로 NASICON(Natrium super ion conductor), olivine, pyrophosphate, mixed phosphate, fluorophosphate, fluorosulfate, bisulfate 등으로 분류된다(Fig. 3).
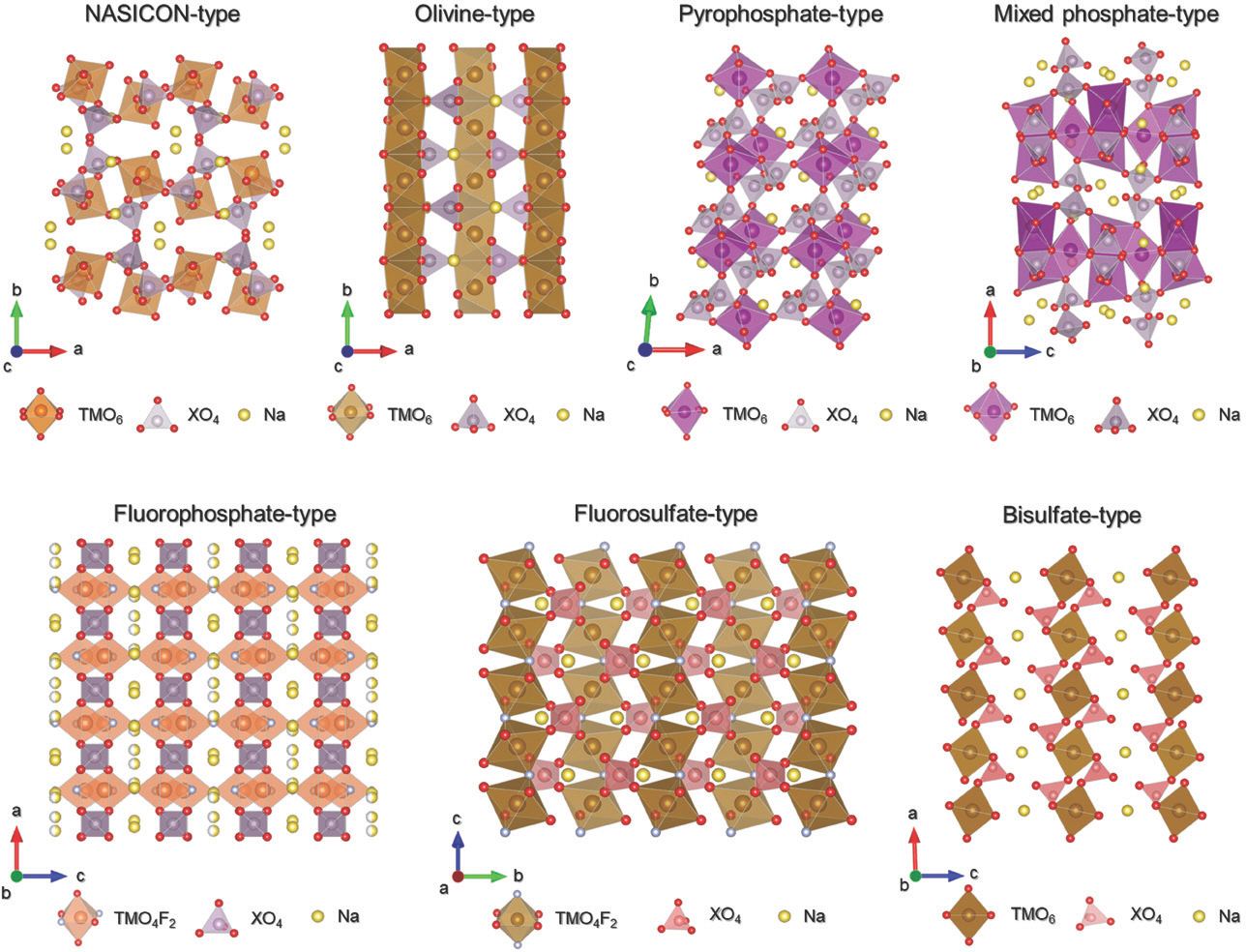
Crystal structure of NASICON, olivine, pyrophosphate, mixed phosphate, fluorophosphate, fluorosulfate, and bisulfate-type polyanion based cathode.
3.1 NASICON구조 양극활물질
NASICON구조 양극활물질은 3D 구조를 갖고 있으며, TMO6 팔면체와 XO4 사면체가 각각의 꼭지점에서 산소를 공유하며 3차원적 골격을 형성하고 있다. J. Kim 연구팀(J. Kim et al., 2018)[27]은 전도성 고분자 poly(3,4-ethylenedioxythiophene)(PEDOT)을 이용하여 단사정계 Na2.4 V2(PO4)3 입자 표면에 코팅을 진행하여 우수한 전기화학적 특성을 보고하였다. 전도 성 고분자 PEDOT이 코팅된 Na2.4 V2(PO4)3/poly(3,4-ethylenedioxythiophene)(NVP/PEDOT)은 PEDOT 이 코팅되지 않은 Na2.4V2(PO4)3에 비해 1.75배 이상인 143.3mAh g−1의 높은 방전 용량을 보였으며, 10C의 전류밀도에서 109.8mAh g−1의 방전용량을 보였다. 또한 I. Belharouak 연구팀(I. Belharouak et al., 2020)[28]은 기존 NaFe2(PO4)(SO4)2에 V을 첨가하여 혼합 다중음이온 양극활물질인 NaFe2-x V x(PO4)(SO4)2(x=0.2, 0.4, 0.6, 0.8, 1)을 성공적으로 얻어냈다. 그 중 NaFe1.6 V0.4(PO4)(SO4)2은 C/10의 전류밀도에서 90mAh g−1의 방전용량을 보였으며, 10C 전류밀도로 충/방전을 진행한 이후 다시 C/10으로 진행하여도 높은 용량 유지율을 보였다.
3.2 Olivine 양극활물질
Olivine 구조를 갖는 양극활물질 중 대표적인 예로 NaFePO4[29]가 있다. 서로 꼭지점을 공유하는 FeO6 팔면체와 PO4 사면체가 모서리를 공유하는 구조를 갖고 있으며, PO4와 모서리를 공유하는 FeO6에서 약간 의 왜곡이 발생한다[2,14]. 또한 NaFePO4는 저온에서 준안정한 사방정계 구조를 이루고 있지만(t-NaFePO4), 480℃ 이상의 온도에선 열역학적으로 안정한 m-NaFePO4로 비가역적인 상전이가 일어나며 나트륨 확산을 위한 통로가 사라지기 때문에 양극활물질로 적합하지 않다[2]. M. Casas-Cabanas 연구팀(M. Casas-Cabanas et al., 2020)[30]이 보고한 t-NaFePO4는 1.5-4.0V의 전압범위에서 ~132mAh g−1의 방전 용량을 보였으며, 200 사이클 이후에도 ~101mAh g−1 의 높은 용량 유지를 보였다.
3.3 Pyrophosphate 양극활물질
Pyrophosphate 양극활물질은 다중음이온으로 P2 O7을 활용한다. Y. Lai 연구팀(Y. Lai et al., 2018)[31]은 졸겔 방법을 이용하여 합성한 Pyrophosphate 양극활물질 Na3.12 Mn2.44(P2 O7)2 카본 복합체(NMP/C)를 보고하였다. Na3.12 Mn2.44(P2 O7)2는 MnO6 팔면체와 PO4 사면체로 이루어진 삼사정계의 구조를 가지며, Mn2 P2 O22와 Mn2 P4 O20의 중심 대칭 단위로 결합되어 있고, 코너 를 공유하면서 3차원 구조를 형성하고 있다. 합성 과정에서 시트르산 (C6 H8 O7)을 넣어 카본 복합체 형성을 유도하였으며, 상의 변화는 관측되지 않았다. NMP/C는 1.5-4.5V의 전압 범위와 C/10의 전류밀도 조건에서 114mAh g−1의 방전 용량을 보였으며 카본 복합체를 형성하고 있지 않은 Na3.12 Mn2.44(P2 O7)2(~50mAh g−1)와 비교하였을 때 우수한 전기화학적 특성을 보였으며, 2C 의 전류밀도에서 300사이클 이후 초기 용량 대비 86%에 해당하는 우수한 용량 유지율을 보였다.
3.4 Mixed phosphate 양극활물질
Mixed phosphates의 일반적인 화학식은 Na4 M3(PO4)2 P2 O7 (M = Co, Mn, Ni, Fe)이며 1996년 M. A. Monge 그룹에 의해 Na4 Co3(PO4)2 P2 O7으로 구조가 처음으로 소개되었다[32]. 이 구조는 모서리와 꼭지점을 공유하는 MO6 팔면체와 PO4 사면체로 구성된 사방정계 구조를 이루고 있으며, PO4는 bc평면을 따라 인접한 MO6 팔면체와 한 모서리와 두 꼭지점을 공유하여 유사 층상구조를 형성한다. 이 층들은 차례로 a축을 따라 P2 O7과 연결되어 4몰의 나트륨 이온을 위한 이온 확산 통로를 만든다. 최근 Y. Cao 연구팀(Y. Cao et al., 2019)[33]에서는, Fe를 기반으로 한 Na4 Fe3(PO4)2 P2 O7/C nanospheres를 보고하였다. 주형법(template method)를 활용하여 합성을 진행하였으며, 비이온성 삼중 블록계면활성제(nonionic triblock surfactant Pluronic-F127 (Mw = 12600, PEO106 PPO70 PEO106))를 이용한 카본 코팅을 통해 전기화학적 특성 향상을 도모하였다. Na4 Fe3(PO4)2 P2 O7/C nanospheres는 1.5-4.2V의 전압범위와 0.2C의 전류밀도 조건에서 이론용량(129mAh g−1)에 매우 근접한 128.5mAh g−1의 방전용량을 구현하였으며, 10C의 전류밀도에서 1000사이클 동안 충/방전을 진행한 결과 초기용량 대비 63.5%의 용량 유지율을 보였다.
3.5 Bisulfate 양극활물질
Bisulfate 양극활물질은 SO42-다중음이온을 기반으로 Na2 TM(SO4)2의 구조를 갖는데, PO4 기반의 양극활 물질 보다 상대적으로 높은 산화/환원 준위를 보이는 것으로 알려져 있다[22]. 또한, bisulfate는 흡습성이 강하기 때문에 Na x TM(SO4)2·nH2 O (n=0, 2, 4)의 형태로 수화가 진행되며 수화가 진행된 bisulfate 양극활물질을 합성한 뒤 탈수를 조절하여 만들기도 한다[21,34]. J. Kim 연구팀(J. Kim et al., 2018)[9]은 Na0.97 KFe(SO4)2를 나트륨 이온전지 양극활물질로 소개하였다. KFe(SO4)2를 저온 공정 방식을 이용하여 합성한 뒤 전기화학적 방식을 통해 0.97몰의 나트륨을 삽입시켜 Na0.97 KFe(SO4)2를 만들었다. 1.5-4.3V의 전압범위 및 C/10의 전류밀도 조건에서 0.97몰의 나트륨이온이 가역적인 삽입/탈리가 이루어지며, 이론용량에 매우 근접한 85mAh g−1의 방전 용량을 보였으며, 10C의 전류밀도에서 이론 용량 대비 53%의 높은 방전 용량을 보였다. 사이클 특성 또한 2C의 전류밀도에서 200사이클 후에도 첫 사이클 대비 99% 이상의 높은 용량 유지율을 보였다.
3.6 Fluorophosphate 및 fluorosulfate 양극활물질
Fluorophosphate는 F의 높은 전기음성도로 인해 기존 phosphate 및 sulfate 양극활물질에 비해 더 높은 TM의 산화/환원 준위를 가질 수 있다[35,36]. Fluorophosphate의 경우 대표적으로 NaVPO4 F가 있으며, P. Balaya 연구팀(P. Balaya et al., 2018)[37]의 경우 주형법을 통해 합성을 진행하였다. P. Balaya 연구팀은 약 5wt%의 카본 함량을 통해 2.0-4.2V의 전압 범위 및 C/10의 전류밀도 조건에서 133mAh g−1의 높은 방전 용량을 얻었으며, 1C의 전류밀도에서 2500사이클 이후 초기 방전 용량 대비 82%의 우수한 용량 유지율을 보였다. 이외에도 V을 기반으로 한 양극활물질로 Na3 V2 O2x(PO4)2 F3-2x 등의 양극활물질이 보고되었다. 또한 J. Kim 연구팀(J. Kim et al., 2019)[38]에서 Fe를 기반으로 한 Na2 FePO4 F에 전도성 고분자 화합물인 PEDOT을 코팅 시킨 Na2 FePO4 F-PEDOT을 보고하였다. Na2 FePO4 F-PEDOT은 0.2C의 전류밀도에서 이론용량에 근접한 123.1mAh g−1의 용량을 보였으며, 10C의 전류밀도 조건에서 코팅이 되어있지 않은 Na2 FePO4 F대비 10배 이상 높은 76.1mAh g−1의 용량을 보였다. 또한 1C에서 700사이클 후에도 초기용량 대비 70%이상의 용량 유지율을 보였다.
H. K. Liu 연구팀(H. K. Liu et al., 2018)[39]은 fluorosulfate NaFeSO4 F에 탄소나노튜브(carbon nano tube: CNT)를 코팅한 NaFeSO4 F-CNT를 보고하였는데, NaFeSO4 F-CNT는 C/10의 전류밀도 조건에서 110mAh g−1의 방전용량을 보였으며, 1C의 전류밀도에서 200사이클 이후 초기용량 대비 91% 이상의 용량 유지율을 보였다.
4. 프러시안 블루 양극활물질
프러시안 블루 유사체 (Prussian blue analogue: PBA)는 초기 염료로 발명된 프러시알 블루의 파생 구조로 금속 유기 구조체 (Metal Organic Framework)의 일종이다[40]. 이온전지용 양극활물질로 사용가능성이 보고된 이후 프러시안 블루 또는 프러시안 블루 유사체라는 명칭으로 폭넓게 명명되고 있다[41,42]. PBA 는 NaxMN[MC(CN)6]·nH2O의 형태를 띄고 있으며(MN: −CN-의 질소 부분에 결합되어있는 전이금속, MC: −CN-의 탄소부분에 결합되어 있는 전이금속), 두 종류의 전이금속이 시안화물 리간드와의 배위결합을 통해 서로 연결되어(MC-CN-MN) 3차원 면심입방구조 구조를 형성한다[41]. 두 종류의 전이금속 중 MN에 따라 비용량이 크게 결정되는데, MN가 활성 전이금속일 경우 MC 전이금속과 함께 전기화학반응에 참여하게 되고 더 높은 비용량을 가질 수 있다. 하지만, MN의 산화환원 반응이 일어나게 되면 상변화가 동반되기 때문에 구조열화의 가능성이 높아지게 되어 전기화학적 성능저하에 큰 영향을 미치게 된다[43,44].
S. Chou 연구팀(S. Chou et al., 2020)[45]은 공침법에 의해 Na2-x Fe[Fe(CN6)]·nH2 O를 합성하여 전기화학적 특성을 보고하였다. 나트륨의 함량에 따라 1차 입자의 크기에 영향을 미치는 것을 이용하여 능면체 Na1.73 Fe[Fe(CN)6]·3.8H2 O를 만들었으며, 2.0-4.0V 의 전압 범위 및 10mA g−1의 전류밀도 조건의 첫 방전용량에서 ~116mAh g−1의 비용량을 보였으며, 100mA g−1의 전류밀도에서 500사이클 이후 71%에 달하는 높은 용량 유지율을 보였다. 또한 H. Liu 연구팀은 능면체 Na1.73 Fe[Fe(CN)6]·3.8H2 O의 이용하여 파우치 Full-cell을 만들어 1000회의 사이클 후에도 78%의 용량 유지율을 보임으로 인해 Na1.73 Fe[Fe(CN)6]·3.8H2 O의 뛰어난 전기화학적 성능 및 실제 사용가능성을 입증하였다.
5. 전환반응(Conversion reaction)기반 양극활 물질
현재 많은 나트륨 이온전지 양극활물질은 나트륨이온의 삽입/탈리 반응 기반의 전기화학적 반응을 통해 충/방전이 진행되지만, 이로 인해 일반적으로 전이금속 이온의 산화/환원 반응에 의해 가용 전자수가 정해지기 때문에 초고용량의 실현이 매우 어렵다[46,47]. 하지만 금속이온의 전환반응을 기반으로 할 경우, 더 많은 전자를 전기화학적 반응에 참여시킴으로써 높은 에너지 밀도를 가질 수 있기에 전환반응 기반 양극활물질은 차세대 이차전지 소재의 하나로 기대되고 있다[48]. 또한 금속 불화물, 황화물 및 다중 음이온 화합물은 높은 전기음성도를 갖는 F, S 및 XO4(X=P, S 등)로 인해 전환반응이 일어나는 금속에 높은 산화/환원 준위를 제공할 수 있다[46]. 하지만 이러한 양극활물질들은 대부분 낮은 이온, 전자 전도도로 인해 떨어지는 출력밀도, 전환반응이 일어나는 금속의 석출과 융해, 나트륨 화합물 형성 시 발생하는 큰 부피 팽창으로 인한 낮은 사이클 안정성에 대한 문제가 제기되어 왔다[49]. 이를 해결하기 위해 일반적으로 입자의 나노 사이징으로 인한 표면적 증가와 더불어 전도성 물질 코팅 및 혼합 공정을 통한 전자 전도도의 향상, 부피 변화의 완충 등이 반드시 필요하다.
5.1 불화물 기반 전환반응 양극활물질
F는 모든 원소 중 가장 높은 전기음성도를 가지고 있으며, 이로 인해 불화물 기반 전환반응 양극활물질의 금속이 상대적으로 높은 산화/환원 준위를 가질 수 있다[50]. 대표적인 불화물 기반 전환반응 양극활물질은 FeF2, FeF3, Na-CF x, FeOF 등이 있으며[25,51–55], J. Liu 연구팀(J. Liu et al., 2017)[56]은 전도성 향상을 위해 증기-고체 불소화 반응으로 탄화된 Fe-MOF로부터 비정질 FeF3/C 나노복합체를 합성하였다. FeF3/C 나노복합체는 1.5-4.5V의 전압 범위 및 15mA g−1의 전류밀도 조건에서 302mAh g−1 이라는 높은 방전용량을 보였으며, 75mA g−1의 전류밀도에서 100사이클 이후 초기용량대비 44%의 용량 유지율을 보였다. 또한 S. Okada 연구팀(S. Ocada et al., 2017)[57]은 양극활물질 자체에 나트륨을 함유한 불화물인 NaMF3/C (M=Fe, Mn, Co)을 성공적으로 합성하여, 기존의 나트륨을 함유하고 있지 않아 전극 소재로 활용하기 어려운 대부분의 불화물 기반 전환반응 양극활물질의 한계를 극복할 수 있는 방안을 제시했다. 이 중 NaFeF3/C는 2.0-4.3V의 전압범위 및 0.1mA cm−1의 전류밀도에서 0.85몰의 나트륨 이온에 의한 ~169mAh g−1의 가역적인 용량을 낼 수 있다고 보고되었다.
5.2 황화물 기반 전환반응 양극활물질
황화물 기반 전극소재는 높은 이론 용량과 약한 전이금속이온과 황의 결합으로 전환반응이 용이하다[46]. 대표적인 황화물 기반 전환반응 양극활물질은 FeS2, Cu7 S4, 등이 있으며, 2007년 H. J. Ahn 연구팀(H. J. Ahn et al., 2007)[58]은 Na/FeS2 전지 양극활물질로 FeS2을 첫 보고하였으며, 최근 H. Li 연구팀(H. Li et al., 2019)[59]은 나트륨 이온전지 뿐만 아니라 포타슘, 알루미늄 이온전지용 양극활물질로 적용 가능한 FeS2@C hybrids를 보고했다. FeS2@C hybrids는 FeCl3·6H2 O와 요소를 전구체로 이용하여 수열 합성법을 포함한 4단계의 합성과정을 거쳐 만들었으며, 나트륨 이온전지용 양극활물질로 사용하였을 때 100mA g−1의 전류밀도에서 ~670mAh g−1의 높은 비용량을 보였으며, 고전류밀도인 10 A g−1의 조건에서도 ~512mAh g−1의 비용량을 보여 고출력특성을 보였다. B. Lu 연구팀(B. Lu et al., 2018)[60]은 Cu를 기반으로 한 양극활물질을 보고하였다. U-Cu7 S4NPs@G(ultrafine Cu7 S4 nanoparticles anchored on graphene nanosheets) 는 그래핀 나노시트에 sulfur(S) 파우더를 섞은 뒤 열처리를 통해 고르게 분산시키고 Cu foil 상에 도포한 뒤, 전기화학적 반응을 통해 나트륨 이온을 삽입하는 과정을 거쳐 만들었다. 0.8-2.8V의 전압범위 및 100, 500, 1000, 2000mA g−1의 전류밀도에서 각각 552.8, 401.9, 331.5, 277.1mAh g−1의 가역적인 비용량을 보였으며, 500mA g−1의 전류밀도에서 2000사이클 이상 충/방전을 반복하여도 유의미한 용량의 감소는 보이지 않았다.
5.3 다중음이온 기반 전환반응 양극활물질
대부분의 전환반응 기반 양극활물질은 높은 용량을 가지고 있음에도 불구하고, 전기화학적 반응이 매우 낮은 전압구간에서 이루어지기 때문에 음극으로 많이 보고되었다. 그렇기 때문에 전기화학적 반응의 주된 요소인 전이금속의 산화/환원이 발생하는 준위를 높이기 위한 연구가 진행되어왔는데, 그중 가장 뛰어난 결과를 보인 것이 다중음이온을 접목한 양극활물질이다. 다중음이온 기반 전환반응 양극활물질은 기존 다중음이온 기반 양극활물질과 동일하게 유도 현상으로 인한 산화/환원 준위의 상승이 일어나게 되고[9,22–24], X-O의 강한 공유결합으로 인해 구조적, 화학적 안정성이 높아져 충/방전시 발생하는 구조변화를 효과적으로 억제할 수 있다[20,22,61].
J. Kim 연구팀(J. Kim et al., 2019 and 2020)[62,63]은 Cu를 기반으로 한 다중음이온 기반 전환반응 양극활물질로 Cu2 P2 O7과 CuSO4을 소개하였다. J. Kim 연구팀은 다중음이온 기반 전환반응 양극활물질과 카본을 high energy ball-milling을 진행하여 섞는 과정을 통해, 입자 크기 감소 및 카본 코팅을 진행하여 낮았던 전기/이온 전도도를 증가시켰다 (Fig. 4). 그 중 P2 O7을 이용한 Cu2 P2 O7은 0.9-3.9V의 전압 범위 및 C/30와 C/5의 전류밀도에서 ~355mAh g−1, ~223mAh g−1의 높은 방전 용량 및 우수한 출력특성을 보였으며, 1C의 전류밀도에서 300사이클 이후 초기 용량 대비 75%의 용량유지율을 보였다. 또한 SO4를 이용한 CuSO4는 1.2-4.1V의 전압범위에서 2.7V의 평균 산화/환원 준위를 가지며, C/30의 전류밀도에서 이론 용량에 매우 근접 한 ~335mAh g−1의 방전 용량을, 5C에서는 ~204mAh g−1의 방전 용량을 나타내어 높은 출력특성을 보였다. 사이클 특성은 2C 전류밀도에서 측정되었는데, 300사이클 이후 초기용량 대비 78%의 용량 유지율을 통해 높은 사이클 특성을 달성하였다고 보고하였다.
6. 결론
나트륨 이온전지는 현재 상용화된 리튬 이온전지에 비해 나트륨의 낮은 산화/환원 준위 및 큰 이온 반경으로 인해 상대적으로 낮은 에너지밀도와 출력특성 등의 단점을 가지고 있어, 이러한 단점들을 극복하기 위한 다양한 연구전략이 시도되어 왔다. 높은 전기음성도를 갖는 음이온의 사용 및 다중음이온을 통한 유도효과로 전이금속의 산화/환원준위를 높이는 전략을 이용하기도 하며, 층상형계 및 프러시안블루와 같이 다양한 구조를 갖을 수 있는 나트륨 양극활물질의 특징을 이용한 다양한 연구가 진행되고 있다. 특히 층상형계 기반 양극활물질은 넓은 이온확산통로로 인한 높은 출력특성 및 에너지밀도 측면에서 상대적으로 유리하지만, 나트륨 이온의 삽입/탈리 과정에서 발생하는 상전이로 인해 수명 특성에서 매우 취약하기 때문에 이를 개선하고자 하는 연구가 반드시 필요하다.
나트륨 이온전지의 가장 큰 강점은 원자재의 풍부한 매장량을 바탕으로 한 낮은 생산비용 및 이를 통한 높은 가격 경쟁력인데, 이러한 이점을 극대화할 수 있도록 철 및 망간 계열과 같은 저렴한 전이금속 기반의 물질군들에 대한 연구 개발이 유망할 것으로 여겨진다. 지속적인 연구개발을 통해 나트륨 이온전지 양극활물질의 단점을 극복하는 동시에 장점을 극대화한다면, 머지않은 미래에 나트륨 이온전지가 리튬 이온전지 시장의 적지 않은 부분을 대체할 수 있을 것이라고 여겨진다.
References
Biography

◉◉고 원 석
◉ 2020년 세종대학교 나노신소재공학과 석사
◉ 2020년 - 2021년 세종대학교 나노신소재공학과 박사과정
◉ 2021년 - 2022년 성균관대학교 에너지과학과 박사과정

◉◉박 현 영
◉ 2018년 세종대학교 나노신소재공학과 석사
◉ 2018년 - 2021년 세종대학교 나노신소재공학과 박사과정
◉ 2021년 - 현재 성균관대학교 에너지과학과 박사과정

◉◉김 종 순
◉ 2004년-2008년 KAIST 신소재공학과 학사
◉ 2008년-2011년 KAIST 신소재공학과 석사
◉ 2011년-2014년 서울대학교 재료공학부 박사
◉ 2014년-2017년 한국원자력연구원 선임연구원
◉ 2017년-2021년 세종대학교 나노신소재공학과 조교수
◉ 2021년-현재 성균관대학교 에너지과학과 조교수

◉◉구 본 영
◉ 2022년 한양대학교[ERICA] 재료화학공학과 학사
◉ 2022년 - 현재 성균관대학교 에너지과학과 석박통합과정

◉◉강 정 민
◉ 2021년 세종대학교 나노신소재공학과 석사
◉ 2021년 - 현재 성균관대학교 에너지과학과 박사과정




