1. 서론
선택적 촉매 환원 (selective catalytic reduction; SCR) 반응은 배기가스에 포함된 NO X (X = 1 or 2)에 NH3 환원제를 주입하여 N2와 H2 O로 변환시키는 반응이다.[1–3] SCR 반응성능은 사용되는 촉매의 산 (acid properties) 및 산화/환원 특성 (redox properties)에 의하여 개선가능하되, 주요 반응식은 아래와 같다.[4–6] (식 (1))
SCR촉매로 사용되는 금속산화물 (metal oxide)들은 금속 양이온 (metal cation)과 산소 음이온 (oxygen anion)으로 구성되어 있다. 구체적으로, 금속 양이온종 (M n+)에 인접한 산소 음이온종 (O2-)은 촉매 표면을 배회하고 있는 양성자 (proton; H+)와 결합할 경우 M n+-O2--H+를 형성할 수 있다.[7] M n+-O2--H+는 브뢴스테드 산점 (brö nsted acid site; BA−-H+)으로 작용할 수 있으며 NH3와의 상호작용을 통해 BA−-NH4+를 형성한다.[8–10] 반면, 금속 양이온종 (M n+)이 산화될 경우 금속의 오비탈에 포함된 전자 (electron)를 잃게 되어 구조적 결함 (structural defect)을 지닌 금속 양이온종 (defective metal cation; M(n-1)+)으로 변화될 수 있다.[9, 11] 이러한 금속 양이온종들은 루이스 산점 (Lewis acid site; LA)으로 작용할 수 있으며 NH3가 루이스 산점에 흡착될 경우, LA-NH3가 형성된다.[12, 13]
한편, 금속 산화물을 구성하고 있는 산소종은 격자산소종 (lattice oxygen species), 표면활성산소종 (labile oxygen; O), 표면이동산소종 (mobile oxygen; O M) 3가지로 분류될 수 있다. SCR 반응 중 표면활성산소종이 소모되는데, 이는 산소원자 결함 (oxygen vacancy; O V)의 생성을 수반한다 (M n+-O2--M n+ → M(n-1)+-O V+M(n-1)+ + 1/2(O M)2).[7, 9, 14] 표면이동산소종은 SCR 반응이 지속적으로 진행될 수 있도록 표면활성산소종을 재생시키는 전구물질로 사용될 수 있다.[15, 16]
중요하게도, 대표적인 SCR 반응 메커니즘(mechanism)인 Eley-Rideal-type (E-R-type) model의 경우, 반응 경로는 BA−-NH4+ 혹은 LA-NH3가 반응에 참여하는 2가지의 경우로 나뉘어 진다. NH3가 브뢴스테드 산점에 흡착될 경우, BA−-NH4+가 Oα=M n+와 결합하여 BA-NH4+…Oα=M n+를 형성하고 이와 NO(g)가 반응하여 중간생성물 (intermediate species)을 형성한 뒤 N2와 H2 O로 분해된다.[7, 9] 반면, NH3가 루이스 산점에 흡착될 경우, LA-NH3와 Oα=M n+가 상호작용하여 LA-NH2 및 M n+-OH를 형성되는데, LA-NH2와 NO가 상호작용하여 중간생성물을 형성한 뒤 N2와 H2 O로 분해된다.[11, 12]
한편, 합성용매가 담지체의 기공에서 제거될 시, 합성용매와 담체 사에에 발생하는 표면 장력 (surface tension) 및 삼투압 현상 (capillary effect)이 담지된 금속 산화물들의 뭉침현상을 야기할 수 있다. 초임계 CO2 추출법 (supercritical CO2 extraction)은 표면 장력 및 삼투압 현상을 약화하여 담지된 금속 산화물들의 뭉침현상을 완화할 수 있다.[17, 18] 이는 초임계 CO2 추출법이 촉매 내 활성점을 고분산 시킬 수 있는 효과적인 방법임을 의미한다. 따라서, 촉매 제조 시 초임계 CO2 추출법을 사용하여 NH3 및 NO X가 접근할 수 있는 활성점의 수를 증가시키되, 표면활성산소종 및 표면이동산소종의 양을 증가시켜 바람직한 SCR 반응을 유도할 수 있다.[11]
망간 산화물 (Mn oxide)을 구성하고 있는 산소 음이온과 결합된 망간 양이온 (Mn n+)은 다양한 산화가로 존재할 수 있는 특성 (multi-valent nature)을 가지고 있다. 이를 바탕으로 망간 산화물 형성 시 다양한 결정상 (phase; e.g., tetragonal α-MnO2, tetragonal β-MnO2, orthorhombic γ-MnO2, cubic α-Mn2 O3, tetragonal α-Mn3 O4)을 생성시킬 수 있다. 예를 들어, α/β/γ-MnO2 결정상과 α-Mn2 O3 결정상의 경우, Mn4+ 및 Mn3+이 각각 octahedral [Mn4+(O2-)6]8- 및 [Mn3+(O2-)6]9-의 기하학적 구조 (geometry)에 내재되어 있다.[19–21] 반면, α-Mn3 O4 결정상의 경우, Mn2+ 및 Mn3+의 망간 양이온으로 구성되어 있으며, 각각 tetrahedral [Mn2+(O2-)4]6- 및 octahedral [Mn3+(O2-)6]9-의 기하학적 구조에 내재되어 있다.[22, 23] 또한, 형성된 망간 산화물들은 구조적으로 유연 (flexibility)하므로, 뒤틀린 (distorted) 구조를 띌 수 있다. 망간 산화물은 풍부한 구조적 결함을 바탕으로 제어 가능한 루이스 산점 및 산소 원자 결함 특성을 제공하므로, 바람직한 SCR 반응성능을 구현할 수 있다.
안티모니 산화물 (Sb oxide)은 SCR 반응 시 산화/환원 특성 및 배기가스 내에 포함된 SO2에 대한 저항성을 향상시킬 수 있다.[7, 9, 24] 이에 기반하여 안티모니 산화물 첨가를 통한 SCR 촉매의 산화/환원 특성 및 SO2 저항성을 향상시킨 연구가 많이 보고되었다.[7, 9, 2, 5, 26] 한편, 안티모니 산화물은 orthorhombic Sb2 O3, orthorhombic Sb2 O4, monoclinic Sb2 O5 결정상으로 존재할 수 있다. Sb2 O3 결정상 의 경우, 안티모니 양이온종이 Sb3+로 존재하며, tetrahedral [Sb3+(O2-)4]5-의 기하학적 구조에 내재되어 있다.[27] 또한, Sb2 O4의 안티모니 양이온종은 tetrahedral [Sb3+(O2-)4]5- 및 octahedral [Sb5+(O2-)6]7-의 기하학적 구조에 내재된 Sb3+ 및 Sb5+로 구성되어있다.[25] Sb2 O5 결정상의 안티모니 양이온종은 octahedral [Sb5+(O2-)6]7-의 기하학적 구조에 내재된 Sb5+이다.[28] 이와 같이 안티모니 산화물은 서로 다른 3가지 결정상으로 존재할 수 있으며, 각각의 결정상 마다 Sb3+/5+-O2-들로 이루어진 local geometry 의 결함 (defect)이 다를 수 있으며, 이러한 결함들이 표면에 노출될 경우, 촉매의 산화/환원 특성 및 SO2 저항성에 큰 영향을 줄 수 있다. 그럼에도 불구하고, 안티모니 산화물의 결정학적 특징이 촉매의 표면특성 및 SCR 반응성능에 미치는 영향에 대하여 탐구한 예는 찾기가 힘들다.[7, 11, 29–32]
본 연구에서는 상술된 내용을 바탕으로 초임계 CO2 추출법을 사용하되, TiO2에 망간 산화물이 담지된 촉매 (Mn)를 모델촉매로 사용하였다. 또한, 촉매 합성법을 다변화하여 TiO2에 담지되는 안티모니 산화물이 서로 다른 결정상 (Sb2 O3 혹은 Sb2 O5)을 가지는 촉매들을 제조하였다. 안티모니 산화물의 결정상들, 구체적으로 tetrahedral [Sb3+(O2-)4]5-에 내재된 Sb3+ (Sb2 O3) 및 octahedral [Sb5+(O2-)6]7-에 내재된 Sb5+ (Sb2 O5)가 촉매표면 특성 및 SCR 반응성능에 미치는 영향을 면밀히 관찰하였다. 이를 위하여, tetrahedral [Sb3+(O2-)4]5-와 octahedral [Sb5+(O2-)6]7- 2가지의 기하학적 구조를 모두 포함하는 Sb2 O4 결정상은 배제하였다.
2. 실험 방법
2.1 촉매 합성
TiO2, Sb-TiO2-I 및 Sb-TiO2-P의 합성
TiO2를 초임계 CO2 추출법 (supercritical CO2 extraction)을 이용하여 합성하였다.[11] 6.9 g의 H2 SO4 (Daejung, ≥ 98.0 %)가 첨가된 37.5 mL의 증류수에 11.25 g의 TiOSO4 (Aldrich, ≥ 29.0 % Ti basis)를 첨가한 후, 50 o C에서 TiOSO4를 완전히 용해하였다. TiOSO4가 용해된 용액에 75 g의 CO(NH2)2 (Junsei, 98.0 %)와 500 mL의 증류수를 첨가한 후, 110 o C에서 18시간 동안 교반 하였다. 형성된 중간생성물의 온도를 25 o C로 식힌 후, 2 L의 증류수로 진공 여과 (vacuum filtration) 및 세척하고 대기조건에서 3시간 동안 건조 하여 Ti(OH)2 침전물을 얻었다. Ti(OH)2 침전물의 기공 (pore)에 있는 H2 O를 CHCl3로 교체 해주기 위해 300 mL의 CHCl3 (Daejung, ≥ 99.5 %)에 48시간동안 노출시킨 후 여과 및 세척하여 고형물을 얻었다. 이 고형물을 60-70 o C 및 90-100 atm의 온도와 압력 조건의 초임계 CO2 (Shinyang, 99.99 %) 유체 하에 약 30분간 노출시켰다. 얻어진 Ti(OH)2 고형물을 400 o C에서 3시간 동안 하소 (calcination)하여 TiO2를 수득하였다.
TiO2에 담지된 안티모니 산화물의 결정상을 변화시키기 위해 서로 다른 합성 방법(함침법 혹은 초임계 CO2 추출법)을 사용하였다. 함침법을 사용하여 합성한 경우, 200 g의 CH3 COOH (J. T. Baker, ≥ 97.0 %)에 0.4 g 의 Sb(CH3COO)3 (Alfa Aesar, 97.0 %)을 첨가하여 완전히 용해하였다. 이 후 3.8 g의 TiO2를 첨가하여 18 시간 동안 교반하였다. rotary evaporation으로 아세트산을 제거한 후, 얻어진 고형물을 400 o C에서 3시간 동안 하소 (calcination)하여 수득한 지지체를 Sb-TiO2-I로 명명하였다. 침전법(초임계 CO2 추출법)을 이용하여 합성한 경우, 200 g의 CH3 COOH에 0.4 g Sb(CH3 COO)3를 첨가한 후 완전히 용해하였다. 이 후, 3.8 g의 TiO2를 첨가하고 NH4 OH (Daejung, 25.0-30.0 %)를 이용하여 액상 혼합물의 pH를 8로 조절한 후 3시간 동안 유지하였다. pH= 8로 조절된 액상 혼합물을 2 L의 증류수로 여과 및 세척하여 CHCl3에 48시간동안 노출 시켰다. 이를 여과 및 세척하여 초임계 CO2 유체 하에서 약 30분간 노출 후 400 o C에서 3시간 동안 하소 (calcination)하여 수득한 지지체를 Sb-TiO2-P로 명명하였다
Mn, Mn-Sb-I 및 Mn-Sb-P 촉매의 합성
250 mL의 증류수에 2.0 g의 Mn(NO3)2· H2 O (Aldrich, 98 %)를 첨가한 후 30분 동안 교반하였다. NH4 OH를 사용하여 액상 수용액의 pH를 10으로 조절한 후 3시간동안 유지하였다. pH= 10으로 유지된 액상 혼합물에 3.4 g의 TiO2, Sb-TiO2-I 또는 Sb-TiO2-P 를 첨가 및 18시간 동안 교반하였다. 얻어진 액상 혼합물을 2 L의 증류수로 여과 및 세척하여 CHCl3에 48시간동안 노출시켰다. 이를 여과 및 세척하여 초임계 CO2 유체에 30분간 노출시킨 후 400 o C에서 3시간 동안 하소 (calcination)하여 촉매들을 수득하였다. TiO2를 지지체로 사용하여 제조된 촉매를 Mn, Sb-TiO2-I를 사용하여 제조된 촉매를 Mn-Sb-I, Sb-TiO2-P를 사용하여 제조된 촉매를 Mn-Sb-P로 명명하였다.
2.2 실험 방법
특성 분석 실험 방법
원자 흡광 분석법(plasma-atomic absorption spectrometry; ICP-AAS) 실험은 촉매에 포함된 Mn 과 Sb의 양을 확인하기 위해 수행하였으며, ICS 3000 (Thermo Fisher Scientific)을 사용하여 실험하였다.
N2 물리흡착(N2 isotherm) 실험은 NOVA 2200e (Quantachrome Instruments)를 사용하여 진행하였으며, Brunauer-Emmett-Teller (BET) 와 Barrett-Joyner-Halenda (BJH) 이론을 기반으로 촉매의 기공 표면적 (surface area)과 기공 부피 (pore volume)를 확인하기 위해 수행하였다. 기공 표면적은 상대 압력 (relative pressure) 0.05-0.30 범위내의 실험 값들을 통해 계산하였다.[33, 34]
주사전자현미경 사진 (scanning electron microscopy; SEM image)은 10 kV의 전압 조건에서 Inspect F50 (FEI)를 사용하여 관찰하였다. 전자투과현미경 사진 (high-resolution transmission electron microscopy image; HRTEM image) 및 전자회절분석 패턴 (selected area electron diffraction pattern)은 300 keV의 가속전압 조건에서 Titan 80-300 TM (FEI)를 사용하여 얻었다.
NH3 탈착 (temperature-programmed desorption; TPD) 실험은 on-line mass spectrometer (HPR20, Hiden Analytical)와 연결된 Autochem II (Micromeritics)를 사용하여 수행하였다. 촉매 표면에 10 vol. % O2/He (Shinyang, 99.99 %)을 주입하며 300 ℃에서 1시간 동안 유지하면서 촉매 표면에 물리흡착된 불순물들을 제거하였다. He (Shinyang, 99.99 %)를 주입하면서 150 ℃로 식힌 후, 5 vol. % NH3/He에 1시간 동안 노출하여 NH3를 촉매 표면에 흡착하였다. 이 후, He를 주입하며 10 ℃ min−1의 속도로 온도를 700 ℃로 승온하여 온도에 따라 탈착된 NH3의 signal (m/z ~ 17)을 관찰하였다.
H2 환원 (temperature-programmed reduction) 실험은 Autochem II (Micromeritics)를 이용하여 수행하였다. 촉매 표면에 물리흡착된 불순물을 제거하기 위해 10 vol. % O2/He를 주입하며 300 ℃에서 1시간 동안 유지하였다. He를 주입하며 50 ℃로 식힌 후, 10 vol. % H2/He (Shinyang, 99.99 %)를 주입하며 10 ℃ min−1의 속도로 온도를 700 ℃까지 승온하여 온도 별 촉매 환원 특성을 관찰하였다.
반응 실험 방법
전기로 내에 수직으로 배치한 내경 0.4 cm의 석영관 반응기 내부에 직경 300-425 µm로 체거름된 촉매를 충진하여 SCR 반응 실험을 진행하였다. 촉매 부피와 양은 0.5 mL 및 0.31 g으로 고정하였다. 실험 시 800 ppm NOX, 800 ppm NH3, 500 ppm SO2, 3 vol. % O2, 6 vol. % H2 O 및 N2가 포함된 반응유체를 사용하였으며, 총 유량 (total flow rate)을 500 mL min−1으로 설정하여 공간 속도 (space velocity) 60,000 hr−1의 조건하에서 반응 실험을 진행하였다. 각 가스들의 농도를 측정하기 위해 ZKJ-2 (Fuji Electric Co.), Ultramat 6 (Siemens Co) 및 NH3/NO2 검지관 (GASTEC Co.)을 사용하였다. SCR 반응성능 (NO X conversion; X NOX) 및 N2 선택도 (N2 selectivity, SN2)는 식 (2)와 (3)로 정의하여 계산하였다.
3. 실험 결과 및 토의
3.1 Mn, Mn-Sb-I, Mn-Sb-P 촉매들의 물리적 특성
구분되는 안티모니 산화물 결정상이 포함된 촉매를 합성하기 위하여 합성 방법 (함침법(I) 혹은 침전법(P))을 다변화하여, Sb-TiO2-I 및 Sb-TiO2-P를 제조하였다. 안티모니 산화물의 유/무 및 결정상에 따른 영향을 면밀하게 관찰하기 위하여, Mn, Mn-Sb-I 및 Mn-Sb-P 3가지 촉매들 모두 동일한 양의 망간을 TiO2에 담지하였다. 또한, Mn-Sb-I 와 Mn-Sb-P의 경우, 안티모니 산화물의 양에 따른 영향을 배제하고자 동일한 양의 안티모니를 담지하였다. 각각의 촉매에 포함된 금속들의 양을 원자 흡광 분석법을 통해 확인한 결과, 3가지 촉매 모두 비슷한 양의 망간 (9.1 (±0.3) % for Mn; 9.2 (±0.4) % for Mn-Sb-I; 9.1 (±0.3) % for Mn-Sb-P) 이 촉매에 포함되어 있음을 확인하였다(Table 1). 안티모니의 경우, 약 3.4 wt. %의 동일한 양이 Mn-Sb-I 및 Mn-Sb-P 촉매에 포함되어 있음을 확인하였다 (Table 1). 또한, 각각의 촉매들에 포함된 금속 산화물의 결정학적 특징을 관찰하기 위하여 이들의 X-선 회절 분석 패턴 (X-ray diffraction pattern; XRD pattern)을 수득하였다. Mn, Mn-Sb-I, Mn-Sb-P 촉매들의 X-선 회절 분석 패턴에서는 anatase 결정상의 tetragonal TiO2를 의미하는 회절 패턴 이외의 다른 금속 산화물의 회절 패턴은 관찰되지 않았다 (not shown). 반면, 전자회절분석 패턴을 통해 Mn, Mn-Sb-I, Mn-Sb-P 촉매들에 포함된 금속 산화물들의 표면 결정상을 관찰한 결과, Mn, Mn-Sb-I, Mn-Sb-P 촉매 모두 담지체로 사용된 tetragonal TiO2 결정상의 (1 0 1) 면(facet)이 관찰되었다 (Fig. 1. A-C). 이 중 Mn 촉매의 전자회절분석 패턴에서는 tetragonal α-MnO2 (yellow circle), cubic α-Mn2 O3 (green circle), tetragonal α-Mn3 O4 (blue circle) 및 tetragonal TiO2 (red circle) 결정상들의 면들이 모두 관찰되었다 (Fig. 1. A). 흥미롭게도 Mn-Sb-I 촉매의 전자회절분석 패턴의 경우, tetragonal α-MnO2 (yellow circle), tetragonal α-Mn3 O4 (blue circle) 및 orthorhombic Sb2 O3 (cyan circle) 결정상들의 면들이 관찰되었으나, Mn-Sb-P 촉매의 경우, cubic α-Mn2 O3 (green circle), tetragonal α-Mn3 O4 (blue circle) 및 monoclinic Sb2 O5 (cyan circle) 결정상들의 면들이 관찰되었다 (Fig. 1. B-C). 이는 합성 방법(함침법 또는 침전법)을 변화시킴에 따라 형성될 수 있는 안티모니 산화물의 결정상이 Sb2 O3 혹은 Sb2 O5 결정상으로 달라질 수 있음을 의미한다. 또한, 안티모니 산화물이 첨가됨에 따라 기공 표면적과 기공 부피가 각각 약 10 m2 g CAT −1 및 0.1 cm3 gCAT −1 만큼 감소함을 확인하였다 (Table 1). Mn, Mn-Sb-I, Mn-Sb-P 촉매들의 전자회절분석 패턴, 기공 표면적 및 기공 부피를 바탕으로 Mn, Mn-Sb-I, Mn-Sb-P 촉매 모두 망간 산화물 및 안티모니 산화물들이 TiO2 담지체에 잘 분산되어 있음을 확인하였다.
Table 1.
Properties of the catalysts.
| Mn | Mn-Sb-I | Mn-Sb-P | |
|---|---|---|---|
| Mna (wt. %) | 9.1 (± 0.3) | 9.2 (± 0.4) | 8.7 (± 0.4) |
| Sba (wt. %) | − | 3.4 (<± 0.1) | 3.4 (<± 0.1) |
| SBET, N2 b, c (m2 gCAT−1) | 147.3 (± 0.7) | 137.1 (± 0.7) | 137.1 (± 0.4) |
| VPORE, N2 b, d (cm3 g CAT−1) | 0.3 (<± 0.1) | 0.2 (<± 0.1) | 0.2 (<± 0.1) |
Fig. 1.
SAED patterns of the catalysts (A for Mn; B for Mn-Sb-I; C for Mn-Sb-P). In (A-C), red circles denote to surface facets of the tetragonal TiO2 (anatase; JCPDF No. 01-071-1166). Yellow, green, blue circles indicate tetragonal α-MnO2 (JCPDF No. 01-072-1982), cubic α-Mn2 O3 (JCPDF No. 00-041-1442) and tetragonal α-Mn3 O4, respectively. Hence, cyan, magenta circles indicate orthorhombic Sb2 O3 (JCPDF No. 00-011-0689) and monoclinic Sb2 O5 (JCPDF No. 01-071-0587), respectively. HRTEM images of Mn (D), Mn-Sb-I (E) and Mn-Sb-P (F). SEM images of Mn (G), Mn-Sb-I (H), Mn-Sb-P (I).
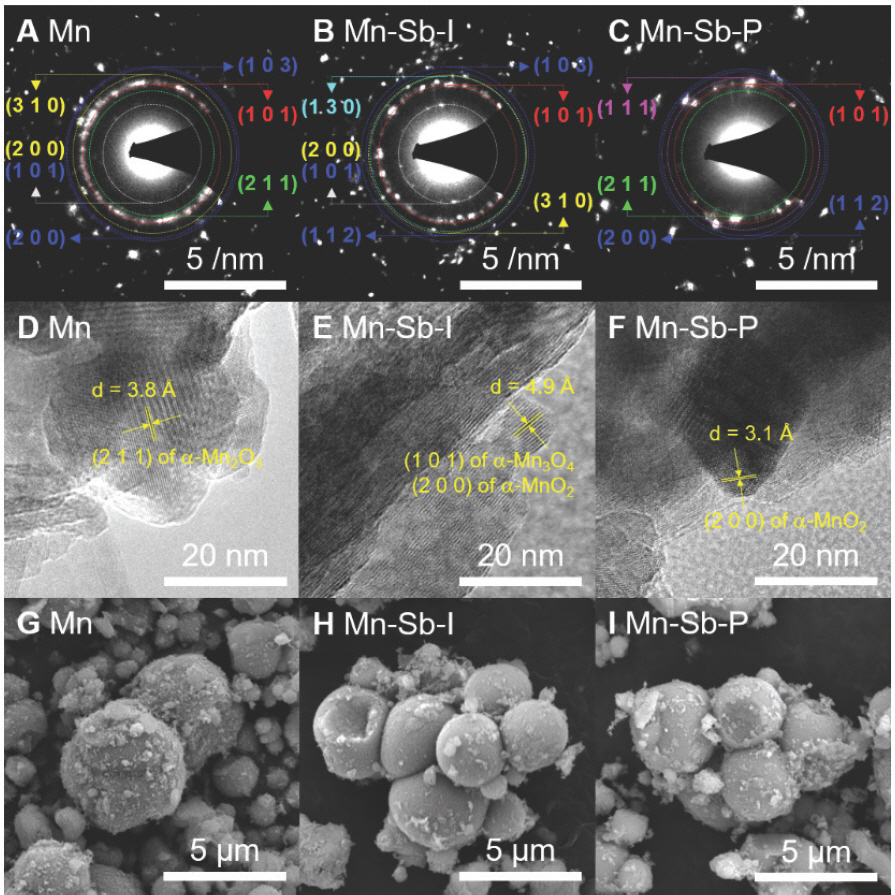
주사투과현미경 사진 및 주사전자현미경 사진을 통해 촉매들의 입자 형태 (morphology)를 관찰하였다. Mn, Mn-Sb-I, Mn-Sb-P 촉매들의 주사투과현미경 사진 관찰 결과, 망간 산화물들의 면을 확인할 수 있는 고유한 격자 줄무늬 (lattice fringe)가 관찰되었다 (Fig. 1. D-F). Mn 촉매의 경우, α-Mn2 O3 결정상의 (2 1 1) 면이 관찰되었으며, Mn-Sb-I 촉매는 α-MnO2 결정상의 (2 0 0) 면 혹은 α-Mn3 O4 결정상의 (1 0 1) 면이 관찰되었다. 또한, Mn-Sb-P 촉매의 경우 α-MnO2 결정상의 (2 0 0) 면이 관찰되었다. 또한, 주사전자현미경 사진을 통하여 Mn, Mn-Sb-I, Mn-Sb-P 촉매들이 비슷한 입자 형태를 가지고 있음을 확인하였다 (Fig. 1. G-I).
3.2 Mn, Mn-Sb-I, Mn-Sb-P 촉매들의 산 특성
X-선 광전자 분광 스펙트럼 (X-ray photoelectron spectrum; XP spectrum)을 이용하여 촉매 표면에 존재하는 금속 양이온종들의 산화 상태 및 금속 산화물들의 구조적 결함(루이스 산점)의 정량화를 시도하였다. 중요하게도, Fig. 1. A-C의 전자회절분석 패턴을 통해 다양한 망간 산화물 결정상 (tetragonal α-MnO2, cubic α-Mn2 O3, tetragonal α-Mn3 O4)들이 Mn, Mn-Sb-I, Mn-Sb-P 촉매에 포함되어 있음을 확인하였다 (Fig. 1. A-C). 예를 들어, α-MnO2 결정상이 구조적 결함이 있을 경우 망간 양이온은 Mn2+/3+의 산화 상태를 가질 수 있다. 또한, 구조적 결함이있는 α-Mn2 O3 결정상 및 α-Mn3 O4 결정상의 경우, Mn2+의 산화 상태를 가질 수 있다. Mn, Mn-Sb-I, Mn-Sb-P 촉매표면에는 다양한 결정상을 가진 망간 산화물들이 분산되어 있으므로, Mn 2p 영역의 X-선 광전자 분광 스펙트럼을 이용하여 촉매 표면의 망간 산화물들에 내재된 구조적 결함을 정량할 수 없다.
Sb 3d 영역의 X-선 광전자 분광 스펙트럼을 이용하여 촉매표면의 안티모니 양이온들의 산화 상태를 확인할 수 있다. 하지만, Sb 3d5/2 영역과 O 1s 영역이 중첩 (525.0-535.0 eV)되므로 안티모니 양이온들의 산화 상태를 정확히 관찰하기에 어려움이 있다.[35, 36]
그럼에도 불구하고, 서론에서 논의된 바, NH3는 루이스 산점 및 브뢴스테드 산점 모두에 흡착 (LA-NH3 및 BA−-NH4+)할 수 있고, 이들은 SCR 반응을 진행시킬 수 있다.[7, 11] Mn, Mn-Sb-I, Mn-Sb-P 촉매에 포함되어 있는 금속 산화물들의 촉매 1 g 당 루이스 산점 및 브뢴스테드 산점 개수(N NH3; mmol NH3 g CAT −1)를 정량하기 위하여 NH3 탈착 실험을 수행하였다. SCR 반응 시 각 촉매들의 NH3 흡착 특성을 보다 면밀하게 관찰하기 위해 SCR 성능의 차이가 가장 크게 나타나는 150 o C에서 NH3를 촉매 표면에 흡착한 뒤, 이를 탈착하여 Mn, Mn-Sb-I, Mn-Sb-P 촉매들의 N NH3 값들을 비교하였다 (Fig. 2.). 그 결과, Mn, Mn-Sb-I, Mn-Sb-P 촉매들 모두 비슷한 N NH3값들(약 3.1 mmol NH3 g CAT −1)을 나타내었다. 이를 바탕으로 안티모니 산화물의 첨가 및 촉매 내에 존재하는 안티모니 산화물의 결정상의 차이에 따른 산점의 개수 변화는 미미한 것으로 판단된다.
3.3 Mn, Mn-Sb-I, Mn-Sb-P 촉매들의 산화/환원 특성
표면이동산소종은 SCR 반응 중 표면활성산소종이 소모될 시, 산소를 추가 공급하여 표면활성산소종의 전구 물질 역할을 수행한다. 그럼에도 불구하고, SCR 반응에 직접적으로 참여하는 것은 표면활성산소종이므로, 촉매의 산화/환원 특성을 파악하기 위해 촉매에 포함된 표면활성산소종의 양을 관찰하는 것은 매우 중요하며, 촉매의 산화/환원 특성을 결정지을 중요한 인자로 작용할 수 있다.
촉매의 표면활성산소종을 상대적으로 비교 하기 위해 O 1s 영역의 X-선 광전자 분광 스펙트럼을 많이 이용한다. 하지만, 앞서 논의된 바, Sb 3d5/2 영역과 중첩 (525.0-535.0 eV)되어 O 1s 영역의 X-선 광전자 분광 스펙트럼을 통해 Mn, Mn-Sb-I, Mn-Sb-P 촉매들에 포함되어 있는 표면활성산소종의 양을 비교하는 것이 무의미하다. 따라서, 촉매에 포함되어 있는 표면활성산소종의 상대적인 양을 관찰하기 위해 H2 환원 실험을 수행하였다 (Fig. 3. A-C).
Fig. 3.
Profiles of H2-TPR of Mn (A), Mn-Sb-I (B) and Mn-Sb-P (C). In (A-C), open circles indicate Oα, Mn4+, Mn3+, Mn3+/2+, Mn2+, Sb5+, Sb3+ and Ti4+ species of the catalysts.
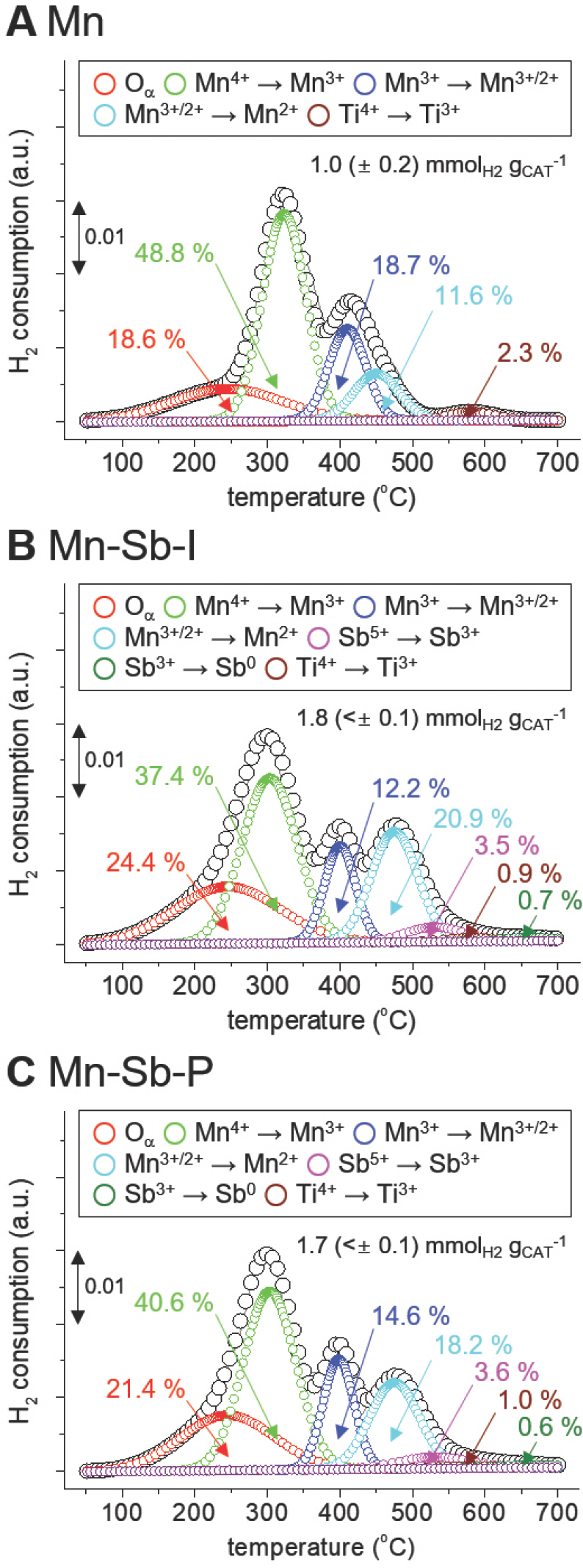
H2 환원 실험을 통해 도출된 결과는 촉매 1 g 당 촉매 내에 존재하는 표면활성산소종, 표면이동산소종, 산소 원자 결함, 망간산화물, 안티모니 산화물 및 TiO2를 환원시키는데 소모되는 H2의 양 (N H2; mmol H2 g CAT 를 의미한다.[7, 9] Mn 촉매의 경우, 1.0 (± 0.2) mmolH2 −1) g CAT −1의 NH2 값을 나타내었으며, Mn-Sb-I 및 Mn-Sb-P 촉매들은 각각 1.8 (<± 0.1) mmol H2 g CAT −1 및 1.7 (<± 0.1) mmol H2 g CAT −1의 비슷한 값을 보였다. 또한, 안티모니 산화물의 첨가로 인해 Mn-Sb-I, Mn-Sb-P 촉매가 Mn 촉매 대비 큰 N H2를 보였다. Mn-Sb-I, Mn-Sb-P 의 경우 촉매에 포함되어 있는 금속 산화물들의 양이 비슷하여 N H2 또한 비슷한 값을 보였다.
한편, H2 환원 실험으로부터 얻은 결과를 5개 혹은 7개의 peak으로 분리하여 보다 면밀하게 관찰하였다 (Fig. 3. A-C). 분리된 peak는 각각 표면활성산소종, 망간 산화물 (Mn4+ → Mn3+, Mn3+ → Mn3+/2+, Mn3+/2+ → Mn2+) 안티모니 산화물 (Sb5+ → Sb3+, Sb3+ → Sb0) 및 TiO2 (Ti4+ → Ti3+)가 환원되는 것을 의미한다[37–41]. 각 촉매들의 표면활성산소종의 양은 Mn-Sb-I (24.4 %) > Mn-Sb-P (21.4 %) > Mn (18.6 %)의 경향을 보였으며, Mn-Sb-I 촉매가 상대적으로 가장 많은 양의 표면활성산소종을 가지고 있는 것으로 나타났다 (Fig. 3. A-C). 이는 안티모니 산화물이 첨가됨에 따라 촉매 내 표면활성산소종의 양이 증가된 것을 의미한다. 또한, Sb2 O3 결정상이 포함된 촉매의 경우 더 많은 표면활성산소종을 가질 수 있음을 증명한다.
3.4 SCR 성능 평가
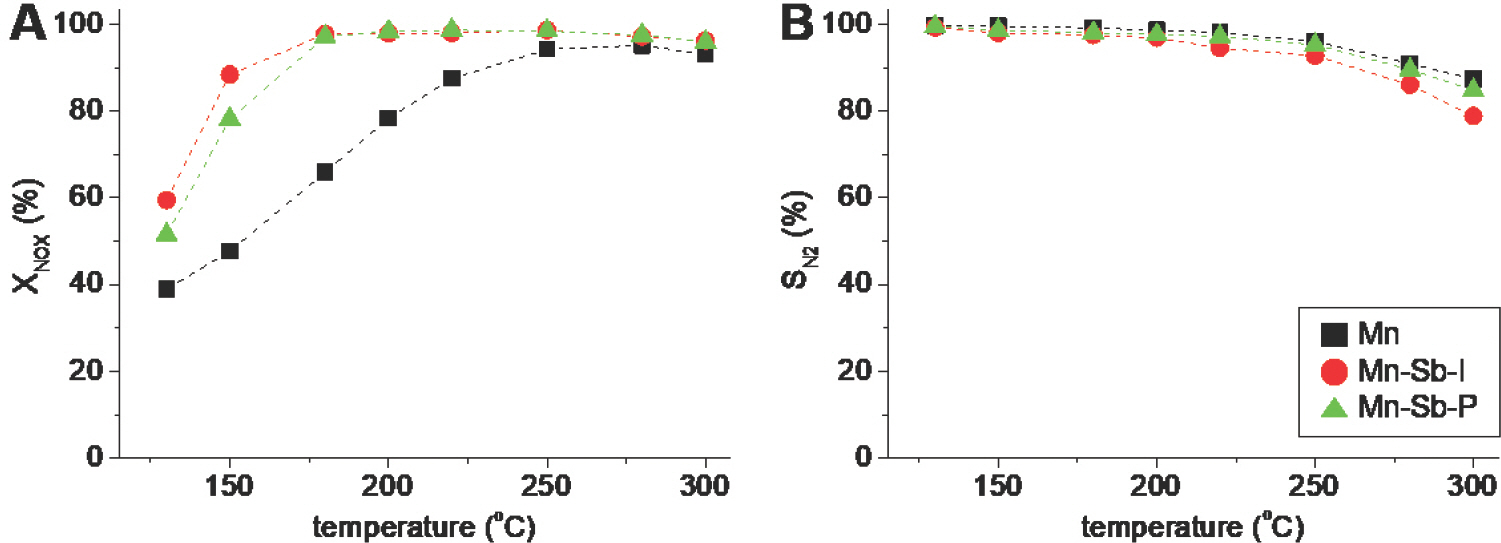
6. vol. % H2 O가 포함된 배기가스 모사 반응 유체 조건 하에서 Mn, Mn-Sb-I, Mn-Sb-P 촉매의 성능 평가를 수행하였다. 300 o C 이하의 온도 영역을 설정하여 저온 영역의 SCR 성능 (X NOX (%))을 관찰하였다 (Fig. 4. A). 실험 결과, Mn-Sb-I (88.4 %) > Mn-Sb-P (78.2 %) > Mn (47.8 %) 촉매 순으로 Mn- Sb-I 촉매가 가장 높은 SCR 성능을 나타내었다 (at 150 o C). 또한, Fig. 4. B에 제안된 조건에서 SCR 반응 시 Mn. Mn-Sb-I, Mn-Sb-P 촉매들의 각 온도 별 N2 선택도 (N2 selectivity; SN2)를 나타내었다. 200 o C 이하의 온도 영역에서는 약 100 %의 N2 선택도를 나타내었으나, 250 o C 이상의 온도 영역에서는 점차 N2 선택도가 감소하는 결과를 보였다. 이는 NH3 산화 반응에 의해 생성된 부산물 (e.g., NO, NO2, N2 O)에 기인한 것으로 판단된다.[11, 42, 43] 비록, 250 o C 이상의 온도 영역에서 Mn, Mn-Sb-I, Mn-Sb-P 촉매의 N2 선택도가 감소하는 경향을 나타내었으나, 촉매 모두 약 80 % 이상의 N2 선택도를 보였다. NH3 탈착 실험 (at 150 o C) 결과 (Fig. 2.)를 바탕으로 도출된 각 촉매들의 N NH3 값들이 유사하였다. 이는 Mn, Mn-Sb-I, Mn-Sb-P 촉매들의 N NH3가 단위 시간 당 SCR 성능 차이를 유발하는 인자로 작동하지 않는 것을 의미한다. 한편, H2 환원 실험 결과 Mn-Sb-I 촉매가 상대적으로 가장 많은 표면활성산소종을 가진 것으로 나타났다 (Fig. 3.). 이는 Mn-Sb-I 촉매가 단위 시간 및 촉매 1 g 당 SCR 반응 시 사용될 수 있는 표면활성산소종이 가장 많은 것을 의미하며 이를 바탕으로 가장 높은 SCR 성능을 보인 것으로 판단 된다.
Fig. 4.
NH3-SCR performance (X NOX) versus reaction temperature (A) and N2 selectivity (S N2) versus reaction temperature (B) of the catalysts at 130-300 ℃. Reaction condition: catalysts sieved to sizes of 300-425 µm; 800 ppm NO X; 800 ppm NH3; 3 vol. % O2; 6 vol. % H2 O; balanced by N2; total flow rate of 500 mL min−1; space velocity of 60,000 hr−1.
3.5 SO2 저항성 평가
SO 2는 H 2 O 및 NH 3와 반응하여 황산암모늄 (ammonium sulfate; (NH4)2 SO4) 및 황산수소암모늄 (ammonium bisulfate; (NH4)HSO4)를 형성한다 (≤260 o C) (식 4-6).[9, 11, 44]
SCR 반응 시 반응유체에 포함된 SO2 혹은 SO2, H2 O 및 NH3가 반응하여 형성된 황산암모늄 및 황산수소암모늄은 촉매 표면을 피독시켜 촉매의 SCR 성능을 저하시킨다.[37, 45, 46] 이를 방지하기 위해서는 촉매 표면에 SO2에 대한 회피능 부여 혹은 황산암모늄 및 황산수소암모늄의 생성을 억제하여 황산암모늄 및 황산수소암모늄이 형성될 수 있는 반응유체 조건 하에서 SCR 성능 저하 정도가 적은 촉매 표면을 구현하는 것이 중요하다.
한편, 안티모니 산화물은 SO2에 대한 저항성을 향상시키는 특성을 가진 것으로 보고되었다. 하지만, 안티모니 산화물의 결정상에 따른 SO2 저항성 차이를 보고한 예는 없다. 따라서, 안티모니 산화물의 결정상에 따른 SO2 저항성 차이를 관찰하기 위해 안티모니 산화물이 첨가되지 않은 촉매 (Mn), 첨가된 안티모니 산화물이 Sb2 O3 결정상으로 존재하는 촉매 (Mn-Sb-I) 및 Sb2 O5 결정상으로 존재하는 촉매 (Mn-Sb-P)의 SO2 저항성 평가를 진행하였다 (Fig. 5.).
Fig. 5.
Profiles of X NOX (%) versus time on stream of the catalysts at 150 ℃. Reaction condition: catalysts sieved to sizes of 300-425 µm; 800 ppm NO X; 800 ppm NH3; 0 ppm (0-1 hour) or 500 ppm (1-8 hour) SO2; 3 vol. % O2; 6 vol. % H2 O; total flow rate of 500 mL min−1; space velocity of 60,000 hr−1, balanced by N2.
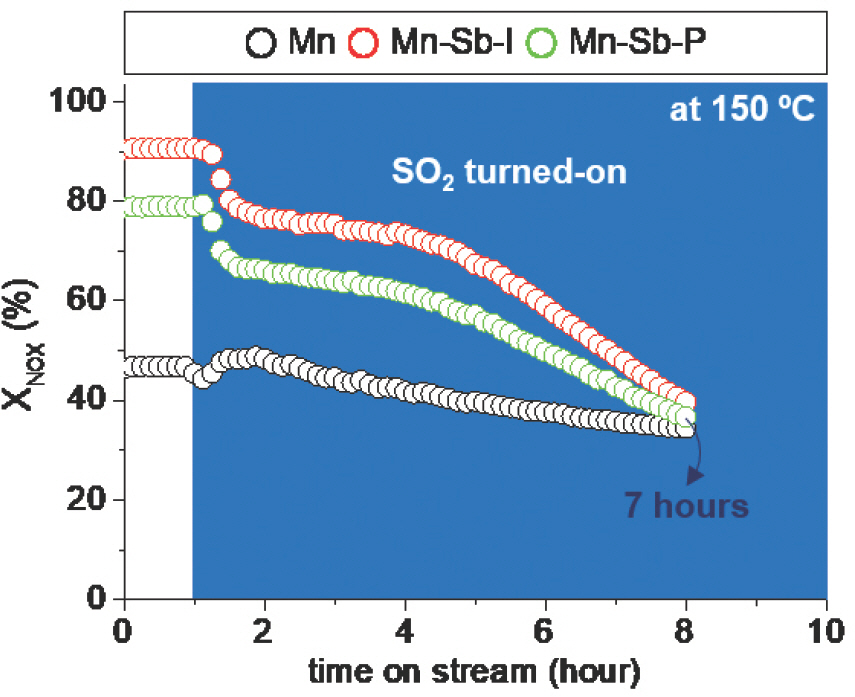
60,000 hr−1의 공간속도에서 SO2 저항 평가를 진행하였으며, SO2가 포함되지 않은 반응유체 하에서 (at 0-1 hour) 모든 촉매가 SCR 활성 평가 (Fig. 4.) 실험 결과와 비슷한 SCR 활성 (at 150 o C)을 나타내었다 (Fig. 5.). 반면, 500 ppm SO2가 포함된 반응 유체 가 주입 (at 1-8 hours)됨에 따라 Mn, Mn-Sb-I, Mn-Sb-P 촉매 모두 황산암모늄 및 황산수소암모늄의 형성에 의한 촉매 표면 피독에 기인한 SCR 성능 감소가 나타났다. 그럼에도 불구하고, 500 ppm SO2가 주입된 후 7 시간 동안 안티모니 산화물이 첨가된 Mn-Sb-I > Mn-Sb-P > Mn 순으로 높은 SCR 성능을 유지하는 것을 확인하였다. 이는 촉매에 안티모니 산화물이 첨가됨에 따라 SCR 성능 저하를 야기하는 SO2, 황산암모늄 및 황산수소암모늄에 대한 저항성이 향상되었음을 의미한다. 또한, Sb2 O3 결정상을 포함한 Mn-Sb-I 촉매가 Sb2 O5 결정상을 포함한 Mn-Sb-P 촉매 대비 SO2, 황산암모늄 및 황산수소암모늄에 대해 더 큰 저항성 가지고 있음을 증명한다.
4. 결론
본 연구에서는 함침법 (Mn-Sb-I) 혹은 침전법 (Mn-Sb-P)을 사용하여 결정상이 다른 안티모니 산화물이 포함된 촉매들을 제조하였다. 또한, 안티모니 산화물이 첨가되지 않은 촉매 (Mn)를 합성하여 촉매 내 안티모니 산화물의 유/무 및 촉매 내 존재하는 안티모니 산화물의 결정상의 차이에 따른 산 특성, 산화/환원 특성, SCR 반응 성능 및 SO2/황산암모늄/황산수소암모늄 저항성을 관찰하였다.
촉매 내 안티모니 산화물의 유/무 및 안티모니 산화물의 결정상의 차이는 루이스 산점 및 브뢴스테드 산점의 개수 증가에 영향을 미치지 않았다. 하지만, 안티모니 산화물이 포함된 Mn-Sb-I 및 Mn-Sb-P 촉매가 안티모니 산화물이 포함되지 않은 Mn 촉매 대비 상대적으로 많은 표면활성산소종을 가지고 있는 것으로 드러났다. 또한, Sb2 O3 결정상이 포함된 촉매 (Mn-Sb-I)가 Sb2 O5 결정상이 포함된 촉매 (Mn-Sb-P) 대비 더 많은 표면활성산소종을 가지고 있음을 확인하였다. 이는 단위 시간 및 촉매 1 g 당 SCR 반응 진행에 사용될 수 있는 표면활성산소종이 Mn-Sb-I > Mn-Sb-P > Mn 촉매 순으로 많음을 의미한다. 이를 바탕으로, 안티모니 산화물이 첨가됨에 따라 높은 SCR 성능을 보였으며, Sb2 O3 결정상이 포함된 촉매가 Sb2 O5 결정상이 포함된 촉매 대비 높은 SCR 성능을 나타내었다 (≤250 o C).
또한, SO2 저항성 평가 결과, 안티모니 산화물이 첨가됨에 따라 SO2, 황산암모늄 및 황산수소암모늄에 대한 저항성이 향상되었으며, 촉매 내 Sb2 O3 결정상을 포 함한 촉매 (Mn-Sb-I), Sb2 O5 결정상을 포함한 촉매 (Mn-Sb-P) 대비 SO2, 황산암모늄 및 황산수소암모늄에 대해 더욱 개선된 저항성을 나타내었다. 이는 안티모니 산화물 결정상의 제어를 통해 SCR 촉매 수명을 향상시킬 수 있음을 나타낸다. 하지만, ‘왜 Sb2 O3 결정상이 포함된 촉매가 Sb2 O5 결정상이 포함된 촉매 대비 우수한 저항성을 나타내는가?’에 대한 규명이 필요하며 현재 연구를 진행 중에 있다.











