서론
에너지 저장 및 변환 기술은 범-지구적으로 증가하 고 있는 에너지 요구량에 맞물려 활발히 연구되고 있다. 특히, 1991년 상용화 이후 현재에 리튬 이차전지(Lithium ion batteries: LIBs)는 에너지 저장 매체로 서 전지 시장을 이끌고 있으며 스마트 폰·노트북 용 소형 전지, 전기 자동차 용 중형 전지 및 대용량 에너지 저장 장치(Energy Storage Systems; ESSs)까지 활용되고 있다.1–4) 그러나, 제한적이고 편재화된 원자재의 매장량과 그에 따른 높은 단가, 비-수계 전해질의 낮은 안전성, 리튬의 폭발 가능성 등으로 인해 LIB의 한계점 또한 꾸준히 지적되고 있는 상황이다. 안정성과 가격경쟁력이 우수한 이차전지 시스템에 대한 수요가 증가함에 따라, 수계이차전지(Aqueous rechargeable batteries; ARBs)가 경쟁력있는 차세대 이차전지 중 하나로 평가받고 있다.5) 특히, 수분 제어시설이 필요없는 환경에서 물을 기반으로 하는 전해질을 이용해 셀을 제작할 수 있기 때문에 기존의 엄격한 LIBs 설비 환경(수분 20 ppm 이하, 전해액 순도 > 99.9%)에서 기인하는 생산 단가를 크게 낮출 수 있다는 장점은 주목할 만하다. 또한 대부분의 수계 전해질은 비-수계 전해질에 비해 102∼103 배 가량 높은 이온전도도를 갖고 있어 고속 충·방전이 가능한 전기화학적 시스템을 제공한다. 이와 같은 장점에도 불구하고, 수계 전해질의 좁은 전기화학적 구동 범위(이론적: ≈1.23 V, 실험적: 1.6∼1.8 V)안에서 작동할 수 있는 소재를 찾아야 하기 때문에 ARB용 양·음극 소재를 발굴하는데 큰 어려움을 겪고 있다 (그림 1).6) 또한, 수계 전해질에서 구동할 수 있는 전극 소재가 있다고 하더라도, 소재와전해질 사이의 계면에서 발생하는 연속적인 산화·환원 반응은 전지 성능의 심각한 열화를 동반한다. 따라서, 기존 LIB에 사용된 전극 소재들이 수계 전해질에서 겪는 열화 반응을 종합적으로 이해하고, 열화 반응을 억제할 수 있는 전략 탐색 및 안정한 계면을 형성할 수 있는 소재를 연구하는 것은 ARB 성능을 향상시키는데 있어 필수적이라고 할 수 있다. 본 총설 논문에서는 기존의 비-수계 이차전지 소재들이 수계 전해질에서 겪는 열화 메커니즘을 소개하고, 층상이중수산화물(Layered double hydroxide; LDH)를 이용한 차세대 ARB 시스템에 대한 연구 동향을 살펴보고자 한다.
수계 전해질에서 LIB소재의 열화 메커니즘 및 해결 방안
2.1. 음극 소재의 열화 반응: 용존 산소 제거의 중요성
리튬 이온을 매개로 하는 수계 전지를 구축하는데 있어 가장 먼저 시도한 접근법은 LIB 시스템에서 사용 중인 소재를 활용하는 것이다. 1994년 Dahn et al.은 리튬 망가니즈 스피넬(LiMn2 O4; LMO)과 브론즈 상 바나듐 산화물(VO2(B))을 각각 양·음극으로 활용한 1.5V 급 ARB 시스템을 보고했다 (VO2(B)5M LiNO3 LMO,식 (1)-(2)).1)
그러나 VO2(B) 음극의 열화 및 Mn3+의 얀-텔러 뒤틀림(Jahn–Teller distortion), 불균등화 반응(Disproportionation reaction) 등으로 인한 Mn이온 용출 등 LMO 양극의 열화로 인해 제한된 수명 특성(100사이클 후 초기 용량의 ∼50% 유지)을 보였다.
Dahn et al. 연구에 영향을 받아, 다양한 양·음극 소재들의 조합으로 ARB 시스템이 보고되었다. LiV3 O81M Li2 SO4 LiNi0.81 Co0.19 O2 (Kӧ hler et al.), LiTi2(PO4)35M LiNO3 LMO (Chen et al.) 등이 대표적인 예라 할 수 있다.7,8) 특히, 바나듐 이온(V4+, V5+) 혹은 티타늄 이온 (Ti4+) 기반의 브론즈 상 혹은 NASICON(Sodium super ion conductor) 상을 갖는 소재들은 다른 후 전이금속 이온들(예: Ni2+/3+, Co+3)에 비해 상대적으로 낮은 작동 전압을 갖고 있기 때문에음극으로 활용한 점을 눈 여겨 볼만하다.
이들 음극 소재가 잘 발달된 작동 전압특성을 보임에도 불구하고 그림 1에서 확인할 수 있듯이, 리튬을 삽입·탈리를 하는 “전지 반응”과 물을 분해시키는 “수소 발생 반응(Hydrogen evolution reaction)”은 서로 경쟁관계에 있게 된다. 이 과정에서 대부분의 음극 소재는 심각한 열화를 겪게 되는데, 이 과정을 Xie et al.에서 열역학적으로 증명하였다.6) 이 열화 과정은 리튬이온이 삽입된 음극 소재(Lithiated anode)가 수계 전해질의 용존 산소에 의해 화학적으로 산화되기 때문이며, 간단한 ① Ar 전해질 퍼징(=용존 산소 제거)과 ② 전해질의 pH 조절을 통해 해소할 수 있었다. 이를 통해 최적화된 LiTi2(PO4)31M Li2 SO4 (pH=13 with LiOH) LiFePO4(LFP) ARB 셀은 1,000회 충·방전 후에도 열화가 없는 성능을 보였다.
2.2. LIB 양극 소재의 열화 반응: 용존 산소 제거, 구동 온도 및 pH 최적화
후 전이금속이온(Mn3+/4+, Co3+/4+, Ni2+/3+/4+)의 레독스 반응을 이용하는 LIB 양극 소재의 경우, 대체로 리튬 금속 대비 ∼4 V (vs. Li/Li+)의 전압을 갖고 있으므로 pH=7의 중성 수계 전해질(예: 1M LiNO3)에서 표준 수소 전극 대비∼0.96 V (vs. SHE)의 전압을 갖게 된다 (그림 1). 따라서, 상대적으로 안정적인 전기화학 반응을 할 것으로 예상했으나, 소재의 구조에 따라 서로 다른 열화 메커니즘이 보고되었다.9–12) 층상 구조(Layered structure)를 갖는 소재 (LiTMO2, TM=Ni, Co, Mn, Al, etc., 예: LiCoO2; LCO)는 수계 전해질에 있는 프로톤(H+)이 리튬이온과 함께 삽입(Co-intercalation)되고 그 결과 입자 표면이 Li x Co2 O4의 스피넬 상으로 열화된다.13) 상기 언급한 스피넬 구조를 갖는 LMO의 경우 얀-텔러 뒤틀림 및 불균등화 반응으로 인한 Mn이온 손실 및 격자 변형으로 열화가 일어난다. 올리빈 구조를 갖는 LFP의 경우 염기 분위기에서 분해가 되지만, 표면에 보호층(예: 카본)을 코팅함으로써 열화를 방지할 수 있다.14)
최근 Chung et al.에서 LFP와 LCO 단결정(Single crystal)을 활용하여 온도와 용존 산소가 열화 과정에 미치는 영향을 체계적으로 분석했다.15) 용존 산소가 LFP 표면의 열화에 미치는 영향은 거의 없었으나, 전해질의 온도를 상온에서 40 o C로 올릴 경우 급격하게 인(P)이 용출되며 표면에 Fe3 O4가 형성되는 방식으로 열화가 진행됨을 투과전자현미경으로 확인했다. 이에 비해, LCO의 경우 온도보다는 용존 산소가 더욱 크게 영향을 미치는 것으로 나타났다. 투과전자현미경 분석과 함께 Ab initio 계산을 통해 확인한 결과, Li이온 및 Co이온이 용출되는 과정에서 Co이온이 사면체 자리(Tetrahedral site)로 이동하는 특이한 현상을 보고했다 (그림 2). 전해질의 온도와 용존 산소 조절이 ARB 구동에 미치는 영향을 원자 수준에서의 이해를 제공했다는 점에서 이와 같은 연구는 의미있다고 할 수 있다.
Fig. 2.
Atomic-scale STEM images of LCO showing the mi-gration of Co atoms into tetrahedral site in the progress of Li and Co atom dissolution. Adapted from Chung et al. Adv Funct Mater 2018;28:1804564, with permission of Wiley Press [15].

Choi et al.에서 한 번의 열처리 공정으로 LCO표면을 스피넬 상 Co3 O4로 개질할 수 있는 방법론을 제시했다 (그림 3).16) 리튬이 2 at% 정도 모자란 환경에서 적절한 조건의 열처리를 하면, 열역학적으로 저온에서 안정한 Co3 O4가 식힘 과정 동안 LCO 표면에 매우 균일하게 형성되는 것을 확인할 수 있었고, 이 개질층이 LCO가 수계 전해질과의 직접적인 접촉을 억제함으로써 향상된 ARB 성능을 확인할 수 있었다. 특히, 향상된 쿨롱 효율은 스피넬 층이 프로톤의 동시 삽입 반응을 효과적으로 억제함으로써 리튬 이온의 탈리·삽입을 더욱 원활하게 해준다는 것을 의미하기 때문에 더욱 주목할 만한 부분이다. 이와 같은 결과는 LCO 소재 또한 표면에 효과적인 코팅층(다른 전이금속 산화물, 카본, 폴리머 등)을 도입하면 향상된 ARB 성능을 기대할 수 있다는 점을 시사한다는 점에서 의미가 있다.
Fig. 3.
(A) Schematic synthetic routes for LiCoO2 surrounded by spinel-Co3 O4 (Li0.98 CoO2) and bare LiCoO2. (B) Atomic-resolution STEM image for Li0.98 CoO2. (C-D) Comparative galvanostatic profiles of Li0.98 CoO2 and LiCoO2 in (C) aqueous and (D) non-aqueous electrolytes. Reproduced from Choi et al. ACS Appl Energy Mater 2018;1:5726–34, with permission of American Chemical Society Press[17]

층상 이중 수산화물을 활용한 ARBs
상기 2절에서 확인할 수 있듯이, 많은 연구에도 불구하고 LIB 소재를 ARB 전극으로 활용하는 것은 전해질과의 불안정한 계면 형성으로 인해 쉽지 않음을 확인할 수 있었다. 그러므로, 전해질과 안정한 계면을 형성할 수 있는 ARB 전극 소재를 탐색하는 것은 합리적인 전략이라고 할 수 있다. 바닷가나 냇가에서 발견되는 소재들이 대부분 수화물(Hydrated compounds)라는 것을 생각해보면 전이 금속을 기반으로 하는 수화물은 전해질과 안정한 계면을 형성할 수 있기 때문에 좋은 ARB 소재 후보군이라고 할 수 있다.17) 본 3절에서는 수화물 중 하나인 층상 이중 수산화물(Layered double hydroxide; LDH)를 활용한 ARB 연구들을 리뷰하고자 한다.
3.1. 수산화물 구조에 대한 총설
일반적인 전이금속 산화물(TM x O y, TM=Ni, Co, Mn, Fe, etc.)과는 다르게, 수산화물(Hydroxide)는 전이금속이 수산기(OH−)에 의해 배위된 구조체를 지칭한다.18) 일반적으로 수산화물은 수산기가 풍부한 수용액에서 침전(Precipitation)을 통해서 얻을 수 있으며, 합성 조건에 따라 단결정·다결정 구조 등 다양하게 얻을 수 있다. 수산화물을 산화 분위기에서 어닐링하면 수산기가 열분해되어 산화물을 얻을 수 있기 때문에, 종종 다양한 산화물 소재의 전구체(Precursor)로 활용된다.19)
수산화물(Hydroxide)는 크게 알파상(α-phase) 과 베타상(β-phase)으로 나눌 수 있다 (그림 4).18–22) 일반적으로, 잘 알려진 β-phase 수산화물은 브루사이트 광물 구조(Brucite, Mg(OH)2)를 기반으로 하고 있다. 전이금속이 여섯 개의 수산기로 둘러쌓인 팔면체(Octahedron)가 선공유(Edge-sharing)을 통해 2차원 층을 형성하고, 이 전이금속 층(Slab)들은 ABAB방식으로 적층되어 Trigonal 결정 구조 (P-3m, a o=b o≈3.1Å, c o≈4.7Å, γ=120 o)를 형성한다. 전이금속 층 사이에는 층과 층을 이어주는 약한 힘이 존재하는데, 이 힘의 본질(분산력 vs. 수소결합)에 대해서는 여전히 많은 논란이 있 다.23,24) 수산기의 특징을 고려할 때 수소 결합으로 이해하는 것이 합리적이라 생각할 수 있으나 수산기의 기하학적인 결합구조(Geometric configuration)를 고려해보면, A층의 산소와 B층의 수소 사이의 거리가 수소 결합이 일어나는 일반적인 결합 길이에 비해 다소 길다는 점을 알 수 있다. 그러나, 점진적 가압 조건에서 수행한 분광 분석에 의하면 O-H stretching의 frequency 가 가압 조건에서 점차 감소했는데, 이는 전형적인 수소 결합에서 일어나는 특징이다.25) 이와 같은 결과들을 바탕으로 생각할 때 β-phase 수산화물의 층간 사이의 결합력은 많은 논란이 있지만, 실험 환경에 따라 분산력과 수소결합이 함께 작용할 수 있다고 결론 내릴 수 있다.
Fig. 4.
Crystal structure of (A) α-phase and (B)β-phase hydroxides viewed along the [110] direction. Adapted from Choi et al. Adv Funct Mater 2017;27:1605225, with permission of Wiley Press[37]
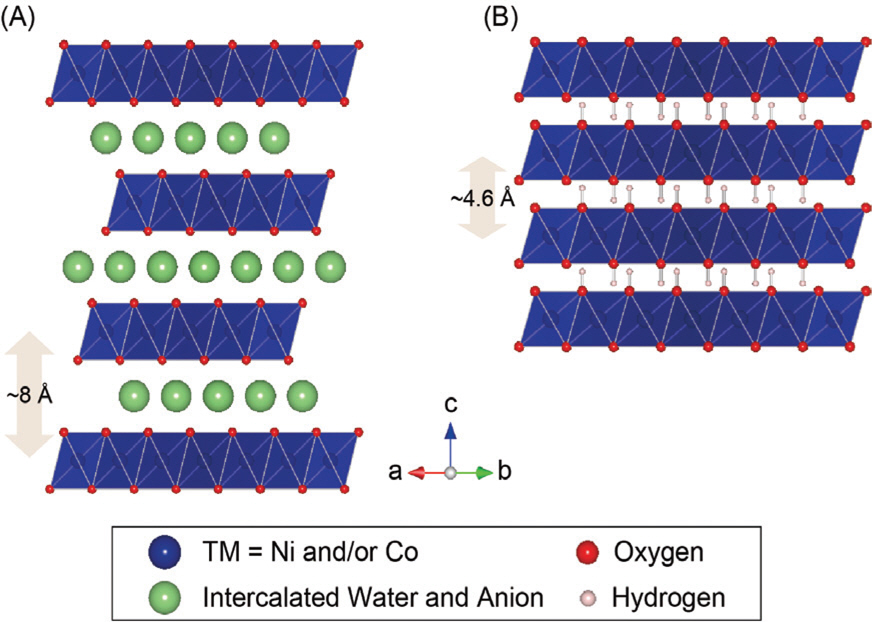
β-phase 수산화물의 약한 층간 결합으로 인해, 합성 과정에서 다양한 층간 삽입물(Intercalant)들이 들어갈 수 있다. 이때, 음이온(Cl−, NO3−, CH3 COO−, SO42- 등)과 함께 결정수(Crystal water)가 전이금속 층 사이에 존재한 채 결정화가 되면 α-phase 수산화물을 얻을 수 있게 된다. α-phase 수산화물은 삽입된 음이온과 결정수로 인해, β-phase 수산화물에 비해 층간 거리가 늘어나고 ABCABC순서로 적층 방식이 바뀌게 되며 Rhombohedral 구조(R-3m, a o=b o≈3.1Å, c o ≈24Å, γ=120o)를 갖는다. α-phase 수산화물 구조를 갖는 대표적인 광물인 Hydrotalcite ((Mg0.75 Al0.25) (OH)2[(CO3)0.1250.5(H2 O)])에서 이름을 차용해 해당 구조를 명명하고 있고 흔히 LDH라고 부른다. 화학식에서 알 수 있듯이, 음이온이 들어간 양만큼의 전이금속이 3가(Trivalent)로 산화되어 전체적인 전하 보상이 일어나는 것을 알 수 있다. 음이온을 상대적으로 쉽게 치환할 수 있기 때문에 면간 거리(Interlayer spacing, i.e., c o)를 다양하게 조절할 수 있고 그에 따라 물리화학적 특성도 조절 가능하다. 일반적으로 질산염(NO3이온(Cl−)을 기반으로 하는 LDH가 가장 보편적으로 합성·보고되고 있다.19)
3.2. 수산화물을 활용한 수계이차전지 구성 및 평가: 집전체 선택의 중요성
상기 3.1절에서 언급한 바와 같이 LDH는 β-phase 수산화물와 달리 결정수를 갖고 있기 때문에 충·방전 과정에서 캐리어 이온과 호스트 구조(Host framework)간의 반발력을 최소화시킬 수 있다는 장점이 있다. 또한, 반복된 사이클에서 생기는 구조 변형을 결정수가 효과적으로 완화시켜줄 수 있기 때문에 다양한 전이금속(Ni, Co, Al, Ti 등)을 기반으로 하는 단일 TM기반 혹은 다성분계TM 기반 LDH를 전극으로 하는 고성능 ARB 가 보고되었다.21,26–35) LDH가 염기성 수용액 전해질에서 전지 반응을 하기 때문에, 대부분의 연구는 염기성 전해질에서 수행되었다. 그러나, 비슷한 조성·합성방법·측정 조건에도 불구하고 LDH들은 서로 상이한 용량(Capacity, mAh/g)을 보였다. 이와 같은 이유에 대해서, Xing et al.은 집전체의 기생 용량을 지목했다.36) 높은 용량을 보고한 논문의 경우 니켈 폼(Ni foam) 혹은 니켈 포일(Ni foil)을 집전체로 활용했는데, 이 경우 니켈 집전체 표면이 전기화학적으로 용량에 기여할 수 있는(Electroactive) 니켈 산화물(NiO) 혹은 니켈 수산화물(β-Ni(OH)2)로 상전이하여 전극 소재의 용량을 과장(Exaggeration)시킬 수 있다는 점을 X선 광전자 분광기(XPS)와 순환전류주사법(Cyclic voltammetry) 등을 통해 밝혔다. 특히, 해당 연구에서는 염기성 수용액 전해질에서 용량에 기여하지 않는 집전체(예: 티타늄 포일 혹은 플래티넘 포일)를 사용해야 신뢰성있는 연구 결과를 얻을 수 있다는 점을 지목했다는 점에서 시사하는 바가 크다고 할 수 있다.
Choi et al.은 카본 페이퍼를 염기성 전해질에서 기생 용량 없는 집전체로 제시했다 (그림 5).37) 해당 카본 페이퍼는 표면 산화·환원 반응이 없을 뿐만 아니라 약 5wt%가량 Polytetrafluoroethylene (PTFE) 표면 방수처리로 인해 물과의 친화도가 매우 낮아 1M NaOH에서 0.6 V vs. Hg/HgO (=1.7 V vs. reversible hydrogen electrode)까지 무시할만한 물 분해 전류를 보였기 때문에 전극의 전기화학 반응을 관찰하기에 적합한 것으로 보고했다. 또한 가격적인 측면에서도 카본 페이퍼가 Xing et al.에서 제안한 금속 포일보다 훨씬 우수하기 때문에 염기성 수용액에서 LDH를 평가하기에 가장 적합하다고 할 수 있다. 다만, 고전류 측정 시, 카본 전극의 다소 높은 면저항 특성(400mm*400mm*0.2 mm, 80 mΩ/cm (두께 방향), 5.8 mΩ/cm (평면 방향))으로 인해 소재의 고속 충·방전 특성을 관찰하기 어렵다는 단점이 있다. 해당 특성이 중요한 측정의 경우 티타늄 포일 등을 활용할 수 있다.
3.3. 전이금속 선택의 중요성
LDH를 기반으로 하는 ARB전극 소재는 대부분 Ni 을 공통적으로 포함하고 있다. 그 이유는 Ni은 Ni2+에서 Ni4+까지 넓은 레독스(Redox) 범위로 인해 다른 전이금속에 비해 높은 가용 용량을 확보할 수 있기 때문이다. 그러나, Ni로만 이뤄진 LDH(이하, Ni-LDH)는 높은 초기 용량에도 불구하고 충·방전 중에 거치게 되는 중간 상태인 Ni3+로 인해 심각한 얀-텔러 뒤틀림을 겪게 되고, 이로 인해 Ni 전이금속 층이 심각한 격자 변형을 겪게 된다.38) LDH의 층간 삽입물은 격자 변형 과정에서 점차 용출되고, 그 결과 높은 용량을 낼 수 있는 LDH상(그림 4A)이 β-Ni(OH)2(그림 4B)로 상전이를 거쳐 열화된다.
이와 같이 Ni-LDH의 열화를 억제하고자, 알루미늄(Al3+)이나 코발트(Co3+)같이 금속-산소 팔면체를 안정화시킬 수 있는 금속이온들을 Ni자리에 도핑·치환하는 전략이 활발히 이용됐다.28,32) Chen et al.은 Ni-LDH 가 염기성 용액(6M KOH)에 담지(Aging)시켜놓아도 β-Ni(OH)2로 열화가 발생하는 것을 확인했다.32) 그러나, Ni을 Al으로 치환을 하면 위와 같은 열화가 현저히 억제되는 것을 확인했고, 20.4 at%의 Al 치환이 가장 최적화된 조성(Ni0.8 Al0.2-LDH)으로 제시했다. Ni0.8 Al0.2-LDH는 1C와 2C 조건에서 각각 391 mAh/g과 354 mAh/g의 용량을 보였고 약 100회 충·방전 이후에도 용량 손실이 없음을 확인할 수 있었다. 특히, Al3+를 도입하면 충·방전 곡선이 Ni-LDH보다 조금 더 위로 이동한다(Upshift)는 점을 주목할 만하다. 이는 Al3+의 치환으로 인해 Ni2+와 Al3+가 함께 공유(share)하는 산소는 Ni2+의 전자 구름을 더욱 강하게 당기게 되고, 그 결과 Ni2+/3+ 및 Ni3+/4+의 산화 반응이 일어나기 어려워지기 때문에 해당 레독스 커플(Redox couple)이 Upshift 한 것이다. 이는 일반적인 완전 전지(Full Cell)에서 에너지 밀도(Wh/kg)를 높일 수 있는 유용한 전략이 될 수 있다. 그러나, 0.4 V vs. Hg/HgO의 전압은 물이 분해되어 산소가 발생되는 전압보다 0.136 V 가량 높기 때문에 안정적인 ARB 구동을 할 수 있는 양극 소재 합성 전략이라고 보기는 어려울 것이다.
이와 같은 관점에서 Ni자리에 Co를 치환하는 전략 은 Ni의 작동전압을 아래로 이동(downshift)시킬 수 있을 뿐만 아니라, 매우 안정적으로 Ni2+/3+/4+ 레독스 커플을 활용할 수 있기 때문에 유용하다고 할 수 있다. 대표적인 사례로 Choi et al.은 Ni의 절반을 Co로 치환한 Ni0.5 Co0.5-LDH (NC-LDH)를 보고했고 NC-LDH의 전기화학적 특성을 Ni-LDH와 Co-LDH와 함께 비교했다.37) Ni-LDH는 앞서 언급한 경우와 마찬가지로 초기의 높은 방전용량(∼276 mAh/g)에도 불구하고 100 사이클 이후 β-Ni(OH)2으로 구조 열화가 발생했다. 이에 반해, Co-LDH의 경우 β-Co(OH)2으로 열화하기보다는 비정질화되는 것을 확인하였다. Ni-LDH와 다른 Co-LDH의 구조 열화 메커니즘은 Co와 O의 에너지 상태 밀도 준위(Density of States)로 이해할 수 있다. Co2+/3+ 레독스 커플은 e g 레벨에서 작동하지만, Co3+/4+ 레독스 커플은 t2g 레벨에서 작동하기 때문에 격자 산소의 2p 오비탈과 겹치게 된다. 이때 열역학적으로 격자 산소가 산화하는 것이 더욱 선호되어 격자 산소 용출이 일어나게 되고 (O2- → 0.5O0↑) Co-LDH는 비정질화가 일어나게 된다. Ni과 Co가 반씩 존재하는 NC-LDH 의 경우, Co는 Co3+로 고정되어 전기화학적으로 전이금 속 층의 구조적 안정화를 가해주는 한편 Ni이 2+에서 4+까지 산화수 변화를 하는 동안 생기는 격자 변형을 완화해주기 때문에 고용량(206 mAh/g at 2 A/g), 고출력(1분 충·방전 시, 185 mAh/g), 장수명 특성(2000회 충·방전 후, 초기용량 89% 유지)을 동시에 가질 수 있음을 확인할 수 있었다 (그림 6).
Fig. 6.
The galvanostatic charge–discharge profiles and rate capabilities of (A, B) Ni-LDH, (C, D) NC-LDH, and (E, F) Co-LDH. G) The cycling performance of the three compounds at 5 A g−1. Reproduced from Choi et al. Adv Funct Mater 2017;27:1605225, with permission of Wiley Press [37]
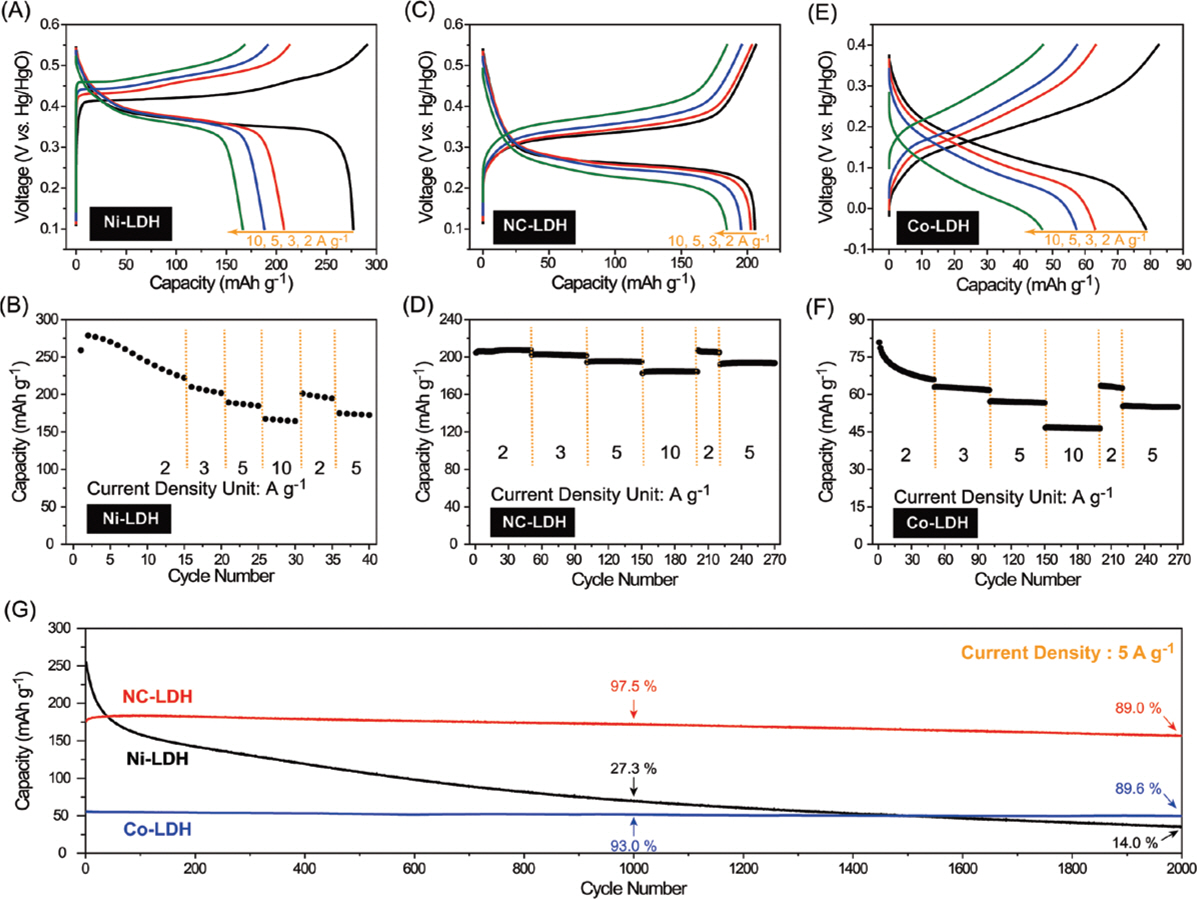
NC-LDH의 경우, Ni을 50% 가량 Co로 치환함으로써 작동전압을 Ni-LDH에 비해 0.1 V 가량 아래로 내릴 수 있었다 (0.412→0.312 V vs. Hg/HgO). 이는 1M NaOH에서 물이 분해되어 산소가 발생되는 전압(0.264 V vs. Hg/HgO)에 비해 약 0.05 V 높은 수치로서 수계 이차전지 구성 시, 에너지 밀도를 최적화할 수 있는 작동 전압인 것을 확인할 수 있다.
Ni을 기반으로 하는 LDH는 높은 용량에도 불구하고 얀-텔러 뒤틀림으로 인한 구조적 안정성이 확보되지 않은 소재이다. 전이금속 층을 안정화시킬 수 있는 금속 이온을 치환·도핑하는 전략은 매우 유용하나, Ni의 레독스 커플은 도입된 전이금속에 의해 쉽게 에너지 준위가 바뀔 수 있다. 따라서, 치환하고자 하는 전이금속이 전이금속 층을 안정화시키는 영향뿐만 아니라, Ni의 레 독스 커플에 미치는 영향을 함께 고려하여 선택할 필요가 있다.
3.4. NC-LDH1M NaOH Fe x O y를 이용한 1.1 V급 ARB
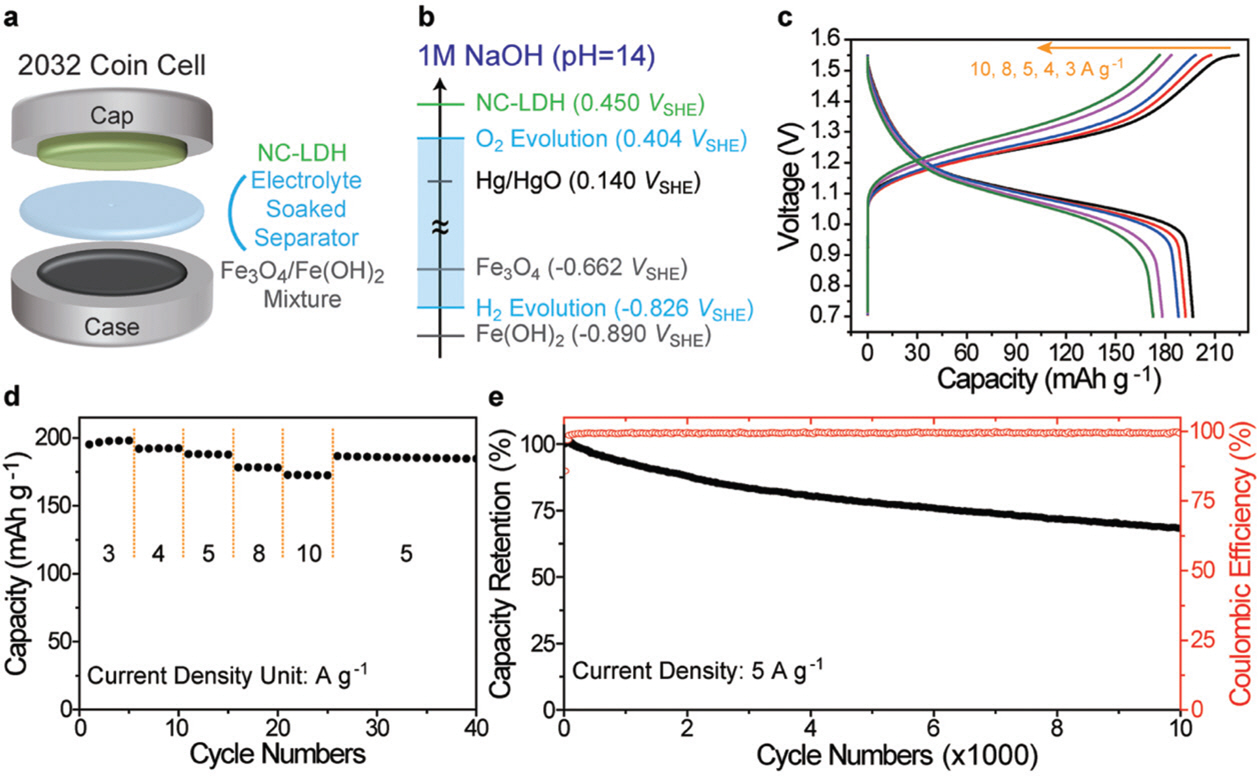
Choi et al.은 NC-LDH와 Fe3 O4/Fe(OH)2 복합체를 각각 양극, 음극으로 하여 ARB 완전 전지를 보고했다.39) NC-LDH는 0.450 V (vs. SHE)에서 작동전압을 갖고, Fe3 O4는 수소발생전압보다 0.164 V 높은 −0.662 V (vs. SHE)에서 작동전압을 갖기 때문에 약 1.1 V의 작동전압을 갖는 ARB를 구성할 수 있었다 (그림 7). 정전류 주사법을 통해 확인한 결과, 양/음극 모두 안정적인 반쪽 전지 반응을 할 수 있기 때문에 완전 전지 구성에서도 안정적인 ARB 작동을 할 수 있었다. 1분만에 172 mAh/g의 용량을 충전할 수 있어 급속 충전이 가능한 ARB 시스템을 제시할 수 있었으며, 1만회 충·방전 이후에도 초기 용량의 70%를 유지한다는 점은 주목할만한 부분이라고 할 수 있다.
Fig. 7.
ABR cell consisting of NC-LDH1M NaOH Fe3 O4 and its electrochemical performance. Adapted from Choi et al. Adv Energy Mater 2018;18:1703572, with permission of Wiley Press [39]
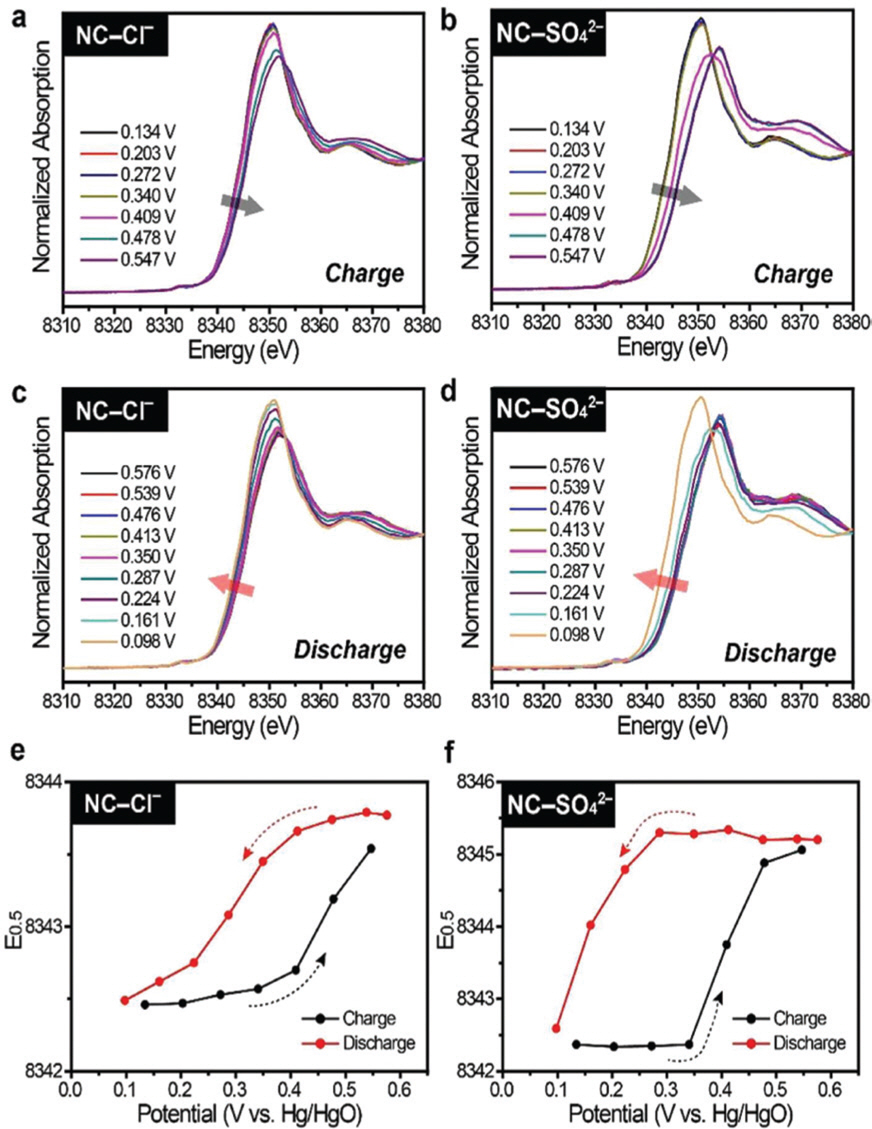
Choi et al.은 X선 회절 및 흡수 미세구조 분석을 활용하여 LDH 소재가 충·방전 과정에서 생기는 새로운 현상을 보고했다. 기존의 LDH 충전 메커니즘은 아래 식(3)과 같이 수소 이온이 탈리되는 방식으로 일어난다고 이해되고 있었다.
그러나 실시간 X선 회절 분석을 통해 확인해본 결과, 충전과정에서 (003)회절 피크의 강도가 약해지고 10Å과 5Å에 해당하는 새로운 회절 피크가 생기는 것을 발견했다. 새로운 회절 피크가 건조·탈수 과정 이후에 사라진다는 점을 통해 새롭게 생겨난 회절 피크는 충전 과정에서 생긴 결정수에 의해 생겨난 것으로 이해할 수 있었고, c축 방향으로의 새로운 정렬화(Ordering)에 기인한다고 판단할 수 있었다 (그림 8).
Fig. 8.
(A) Ex situ XRD analysis of NC-LDH at different charge–discharge states. (B) Graphical illustration of the phase transition during electrochemical oxidation from NC-LDH (hydroxide) to NC-oxyhydroxide. Adapted from Choi et al. Adv Energy Mater 2018;18:1703572, with permission of Wiley Press [39]
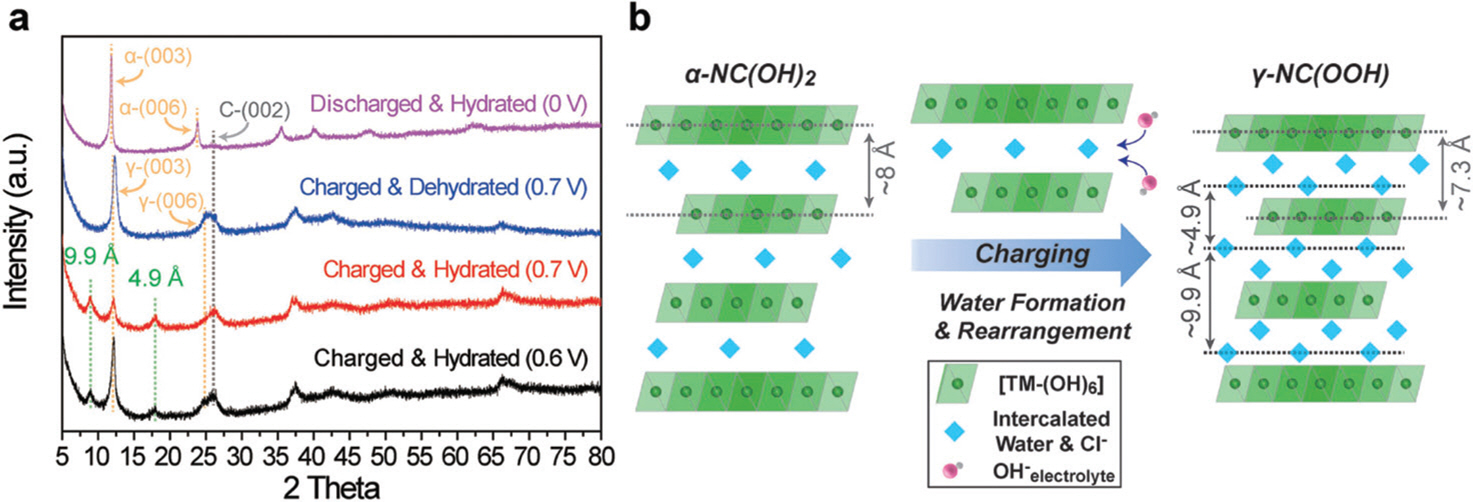
실시간 X선 분석의 결과를 토대로 Choi et al.은 전해질의 수산기(OH−)이 층간으로 삽입(Intercalation)되어 LDH 격자 안에서 프로톤과 반응하고 그 결과 물 분자가 격자 내에서 결정화되며 결정수(Crystal water)를 생성하고, 이 결정수들이 초격자(Superlattice)형태로 재배열하면서 충전과정에서 생기는 격자 변형을 효율적으로 완화시킬 수 있다는 점을 LDH 소재의 충전 메커니즘으로 제시했다 (그림 8B), 식 (4))
이와 같은 메커니즘은 지난 30여년간 잘못 이해된 LDH 소재의 충·방전 메커니즘을 명확한 결정학적인 근거로 재정립할 수 있었다는 점에서 중요한 발견이라고 할 수 있다.
3.5. NC-LDH1M NaOH Zn를 이용한 1.7 V급 ARB
상기 3.1절에서 언급한 바와 같이 LDH는 층간에 존재하는 층간 삽입물을 이용해 c축 방향으로의 면간 거리를 쉽게 제어할 수 있다. 이와 같은 면간 거리 제어는 라우릴 황산 이온(Dodecyl sulfate; (C12 H25 SO4)−1)을 이용해 LDH를 만들고, 다른 음이온들로 치환(Anion exchange)함으로써 얻을 수 있다. Kim et al.은 이와 같은 방법을 통해 다른 종류의 음이온을 갖는 Ni-LDH 들을 ARB 양극 소재로 평가했다.34) 그러나, 집전체를 니켈 폼을 사용함으로써 Ni-LDH들의 용량에 미치는 면간 거리의 영향이 올바르게 파악되지 못했다.
Lee et al.은 음이온 치환법이 아닌 서로 다른 음이온(질산 이온 (NO3(CH3 COO−; AcO), 염화 이온(Cl−))을 활용해 다른 종류−), 황산 이온(SO4)2-, 아세테이트 이온의 음이온을 갖는 NC-LDH를 합성했고 이들을 ARB 양극소재로 활용했다 (그림 9).40) 음극은 아연 금속(Zn)의 Zn/Zn(OH)2 레독스 커플을 이용해 약 1.7 V급의 작동전압을 갖는 ARB를 보고할 수 있었다. Cl과 NO3를 음이온으로 갖는 NC-LDH에 비해 AcO와 SO4를 음이온 으로 갖는 NC-LDH는 약 25 mAh/g 가량 높은 용량을 보였다. 그러나, 3 A/g의 전류 밀도로 1천회 충·방전 이후 Cl과 NO3를 음이온으로 갖는 NC-LDH는 약 76%의 초기 용량을 유지했고, AcO와 SO4를 음이온으로 갖는 NC-LDH는 약 63%의 초기 용량을 유지하는 것을 통해 용량-수명 특성 간에 Trade-off 관계가 있음을 보고했다.
Fig. 9.
Comparative galvanostatic charge/discharge curves of NC-LDH compounds with different anions measured at a current density of 3 A/g. Adapted from Lee et al. ChemSusChem 2020;13:6546–51, with permission of Wiley Press [40]

이와 같은 Trade-off는 음이온의 유효 전하 (Effective charge), 음이온의 유효 크기(Effective size) 등과는 무관하며 오로지 결정화도(Crystallinity)에 의해 결정된다는 점을 실시간 X선 흡수 분석을 통해 밝혔다 (그림 10). 결정성이 좋은 NC-LDH(음이온: Cl−)의 경우 Ni의 레독스 반응이 일어날 때 생기는 격자 변형을 쉽게 수용하지 못하기 때문에 Ni 산화수 변화폭이 상대적으로 적어 가용 용량이 낮은 반면, 결정성이 낮은 NC-LDH(음이온: SO42-)는 Ni 산화수 변화폭이 상대적으로 커서 가용 용량이 큰 것을 알 수 있다. 결정화도에 따라 충·방전 과정에서 생기는 격자 변형을 수용하는 방식이 달라 수명 특성에 영향을 미치는 것을 확인할 수 있었다. NC-LDH(음이온: Cl−)의 경우, 충·방전 과정에서 점진적으로 Ni의 산화수가 변하지만, NC-LDH(음이온: SO42-)는 급격하게 Ni의 산화수가 변하는 것을 알 수 있다. 이를 통해 Cl과 NO3를 음이온으로 갖는 NC-LDH들이 점진적으로 격자 변형을 수용할 수 있기 때문에 더 좋은 수명 특성을 갖는 것으로 이해할 수 있다.
결론
본 총설에서는 LIB소재들을 ARB에 적용했을 때, 수계 전해질과의 부반응(Side reaction)에서 생기는 열화 메커니즘과 LDH를 활용한 차세대 ARB 시스템의 연구동향에 관해서 리뷰했다. LIB 소재들은 수계 전해질에서 단순히 물과의 부반응을 통해서 열화가 일어나는 것이 아닌, 용존 산소·작동 온도·작동전압(=충전 정도) 등 복합적인 요인에 의해 열화가 일어난다. 따라서, 습지, 바닷가, 냇가 등에서 발견되는 대부분의 미네랄 구조가 수화물임을 생각해보면 수화물 구조를 활용해 ARB 전극 소재를 개발하는 것은 합리적인 선택이라고 할 수 있다. 이러한 관점에서 결정수와 음이온을 전이금속 층 사이에 갖고 있는 LDH는 ARB 전극으로서 많은 장점을 갖고 있는 소재라고 할 수 있다. 특히, Ni의 넓은 산화수 범위(Ni2+↔Ni4+)를 활용하여 많은 가용 용량을 확보하고 Ni3+의 얀-텔러 뒤틀림을 완화시킬 수 있는 다른 전이금속을 치환하면 고용량·장수명 특성을 확보한 LDH소재를 디자인할 수 있다. 이때, 치환된 전이금속에 의해 Ni의 레독스 커플 에너지가 변하기 때문에 물의 전기화학적 가용 범위를 고려한 적절한 최적화가 필요할 것이다. 전이금속의 영향뿐만 아니라, 층 간에 위치한 음이온 또한 LDH의 전기화학적 성능에 영향을 미친다. 특히, 음이온의 가수, 크기 등이 전기화학적 성능에 직접적인 영향을 미치기보다는 음이온의 선택에 따 른 결정수와 전이금속 층의 결합력에 의한 결정화도 정도가 전반적인 전기화학적 성능에 크게 영향을 미치는 것으로 생각된다. 끝으로, NC-LDH 양극과 철 산화물(Fe3 O4)/아연 금속(Zn)을 음극으로 이용해 1.1 V급/1.7 V급 ARB 시스템을 제시하며 LIB 수준에 근접한 고성능 ARB 시스템의 현 주소도 살펴보았다. 본 총설에서 언급한 ARB에 관한 동향은 앞으로 다양한 ARB용 수화물 소재 및 ARB 시스템 연구 등에 활용할 수 있을 것으로 기대된다.