서론
리튬 이차전지 기술은 휴대폰, 노트북 등 소형 IT 기기에서 친환경 전기차 (EV), 전력저장장치용 대용량 이차전지 (ESS) 시장으로 확대되고 있으며, 앞으로 다가올 4차산업의 핵심인 초연결/초지능을 가능하게 하는 차세대 에너지 혁명(스마트그리드)의 핵심역할인 에너지 저장장치로써 중추적인 역할을 할 것으로 전망되고 있다.[1] 이에 따라 고용량/고출력/고안전성/장수명 이차전지 개발과 상용화를 위한 기술적 한계를 극복하기 위해 새로운 소재의 개발과 주요 구성부품의 성능향상 관련 기술개발 경쟁이 더욱 가속화되고 있다.[2] 현재 리튬 이차전지의 에너지 밀도는 250 Wh kg−1 및 600 Wh L−1 수준이고, 이론적인 한계치는 350 Wh kg−1 및 800 Wh L−1 으로 예상된다.[3] 전기자동차를 예를 들면 700 km 주행거리를 갖기 위해서는 500 Wh kg−1 및 1000 Wh L−1 에너지 밀도가 요구되며, 따라서 무게와 부피 두 측면에서 더 높은 에너지 밀도의 리튬 이차전지 개발이 필요하다.[4] 나아가 현재 리튬 이차전지의 유기 액체전해질은 가연성, 부식, 온도 취약성 등 안정성 이슈를 해결해야 한다.[5] 특히 전기자동차 및 ESS와 같이 대규모 셀이 탑재되는 시스템의 경우, 불에 타지 않는 배터리를 개발하는 것이 최우선 과제이다.[6] 이러한 높은 안전성 및 용량을 만족시키기 위해 최근 전고체전지 개발이 각광받고 있다.[7]
전고체전지 (All-Solid-State Battery)는 액체 전해질을 고체 전해질로 대체한 것으로, 안전성, 고에너지 밀도, 고출력, 장수명 등 전지의 성능 관점에서 유리하고, 제조공정의 단순화, 전지의 대형화/콤팩트화 및 저가화 등의 관점에서도 유리하여, 최근 주요 자동차 업체 (테슬라, 도요타, 현대자동차 등) 및 국내외 이차전지 업체 (CATL, 삼성SDI, LG에너지솔루션, SK온)에서 차세대 이차전지로 연구개발이 활발히 이루어지고 있다.[8] 불연성을 갖는 고체전해질은 높은 열적 안정성을 제공하고, 발화의 주 원인인 유기 액체전해질을 제거하여 폭발의 위험을 원천 차단할 수 있다.[9] 또한, 고체전해질을 사용하면 다수의 단일 셀들을 하나의 고전압 스택으로 적층이 가능하여, 기존 리튬 이온전지에서 각 셀마다 적용되었던 패키징 공정을 제거함으로써, 배터리 팩의 부피를 줄이고 부피용량을 증가시킬 수 있다.[10] 일반적으로 고체전해질은 넓은 전기화학적 안정성 창 (0 – 5 V vs. Li/Li+)을 갖고 있는 것으로 알려져 있으며, 이에 따라 기존 액체전해질 기반 리튬 이온전지에서는 전해질 분해 문제로 사용이 어려웠던 고전압용 양극 소재를 적용함으로써, 고에너지밀도 달성도 가능하다.[11] 나아가 고체전해질은 자체적으로 분리막 역할을 수행하며, 기존의 고분자로 구성된 분리막 대비 높은 기계적 강도를 지녀 충방전시 발생하는 리튬 덴드라이트 성장으로 인한 셀 열화 및 쇼트 문제를 억제할 수 있다.[12] 따라서 기존 리튬 이온전지에서는 적용이 어려웠던 리튬 금속을 음극 소재로 활용 가능하다.[13] 실제로 배터리 개발 로드맵을 살펴보면, 리튬 음극, 고체전해질, 고용량 양극으로 구성된 전지가 고용량 배터리 개발을 위한 최종 목표로 제시되고 있다.[14]
고체전해질을 적용한 고용량 이차전지를 개발하기 위해서는 (1) 상온에서의 고체전해질의 낮은 이온전도도, (2) 전극/전해질 고체 계면에서의 높은 계면저항을 해결해야 한다.[15] 기존에는 고체전해질의 이온전도 특성을 개선하기 위한 소재 개발 연구가 주로 진행되었으며, 몇몇 고체전해질 소재가 액체전해질의 상온 이온전도도인 5 – 10 mS cm−1에 근접한 이온전도도 값을 나타내는 것으로 밝혀졌다. 대표적인 고체전해질로서 산화물계에서는 NASICON (Na superionic conductor) 타입의 Li1+x Alx Ti2-x(PO4)3 (LATP) 및 Li1+x Alx Ge2-x(PO4)3 (LAGP)와 Garnet 타입의 Li7 La3 Zr2 O12 (LLZO)가 0.1-5 mS cm−1의 이온전도도를 나타내고 있다.[16–18] 대표적인 황화물계 고체전해질은 아지로다이트 (argyrodite)계 Li5.5 PS4.5 Cl1.5 와 thio-LISICON (Li superionic conductor) 타입의 Li10 GeP2 S12 및 Li9.54 Si1.74 P1.44 S11.7 Cl0.3 가 각각 10, 12, 25 mS cm−1 의 이온전도도를 나타내어, 상용 리튬 이온전지 대비 동등 이상 수준의 전고체전지가 실제 구현 가능함을 증명하였다.[19–21] 특히 액체 전해질에서의 리튬이온 전달율 (Li+ transference number)이 0.5 아래인 반면[22], 고 체전해질에서의 리튬이온 전달율은 거의 1에 근접하는 값을 가지기 때문에 대표적인 고체전해질의 실질적인 이온전도도는 액체전해질보다 오히려 높은 수준이라고 할 수 있다.
한편, 고체전해질/전극 계면에서의 높은 저항은 전지의 전체성능을 떨어뜨리는 주요 원인이며, 고체전해질과 고체전극이 만나는 고체-고체 계면에서 발생하는 현상은 기존의 액체전해질을 사용한 액체-고체 계면에서 발생하는 현상과는 다르기 때문에 이에 관련된 작동기작을 이해하기 위한 기초적인 연구가 필요하다.[23] 예를 들면 고체-고체 계면에서는 리튬 이온의 확산과 활물질의 산화환원 반응이 두 소재의 맞닿은 지점에서만 발생하며 따라서 효과적인 이온 및 전하 전달을 위해서는 고체-고체 접촉계면의 유지가 필요하다. 또한 황화물계 고체전해질의 경우 고전압 양극과의 계면에서 분해반응이 일어나며, 이를 막기 위해서는 완충층 (buffer layer) 을 양극 입자 표면에 코팅해야 한다.[24] 나아가 충방전 싸이클에 따라 리튬 음극에 의해 고체전해질이 환원되는 반응이 발생하며, 계면저항을 서서히 증가시켜 셀 성능이 감소하게 된다.[25] 산화물 전해질의 경우 양극 소재와의 접촉을 향상시키기 위해 고온 소결 공정이 추가로 필요하며, 이때 계면에서의 소재간 상호 확산으로 계면저항이 증가하게 된다.[26] 따라서 고체전해질 자체의 이온전도도가 높더라도 고체전해질과 전극 사이의 계면 저항이 높으면 셀 성능은 오히려 감소하게 되며,[27] 차세대 고용량 전고체전지를 개발하기 위해서는 기존의 고체전해질 소재 연구와 더불어 고체전해질/전극 계면 이슈를 다루는 연구가 병행되어야 한다. 특히 고체 계면에서의 발생하는 물리적, 화학적, 전기화학적 현상을 근본적으로 이해하고, 이를 바탕으로 효과적인 개선방안을 도출하는 연구가 필수적이다.[28]
현재까지 밝혀진 고체전해질/전극의 높은 계면 저항 의 원인은 크게 4가지로 (1) 고체전해질과 전극 (Li 음극 또는 고전압 양극) 사이의 화학적, 전기화학적인 불안정으로 인한 낮은 호환성, (2) 고체전해질과 전극 사이의 낮은 접촉면적, (3) 충/방전시 전극의 부피 팽창으로 인한 고체전해질/전극 계면 압력 (stress) 변화 및 박리 현상, (4) 고체전해질/전극 복합막 형성시 발생하는 상호 확산 (mutual diffusion)으로 인한 비활성층 형성이 있다.[29,30] (Fig. 1) 이를 해결하기 위해 화학적인 측면에서는, 양극 계면의 경우 입자 표면에 완충층을 코팅하고, 음극 계면의 경우 고체전해질과 리튬 금속 사이에 계면상 (interphase)을 형성하는 방향으로 연구가 진행되고 있다.[31,32] (Fig. 2) 나아가 기계적인 이슈에 대응하기 위해, 양극 입자 미세구조/결정 제어, 리튬 음극 접촉 개선용 중간층 (interlayer) 도입 연구도 활발히 연구되고 있다. 본 투고문에서는 전고체전지에서 발생하는 고체전해질/전극 계면 문제를 해결하기 위한 주요 방법론에 대해 설명하고, 관련 최근 연구 사례들을 정리하여 소개하고자 한다.
Fig. 1.
Origins for high interfacial resistance in all-solid-state batteries. Reproduced from Ma et al. J Phys D Appl Phys 2021;54:183001, with permission of Institute of Physics Publishing[30].
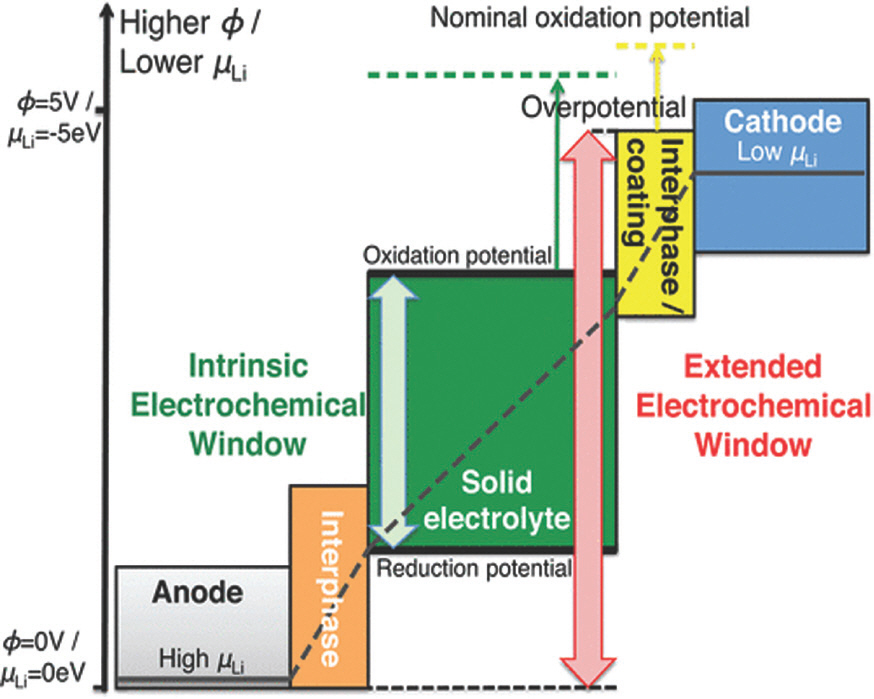
Fig. 2.
Schematic illustration for the electrochemical window of each components in all-solid-state batteries. Adaped from Zhu et al. ACS Appl Mater Interfaces 2015;7:23685-93, with permission of American Chemical Society[32].
본론
2.1. 양극 입자 코팅: 고체전해질/양극 계면 호환성 개선
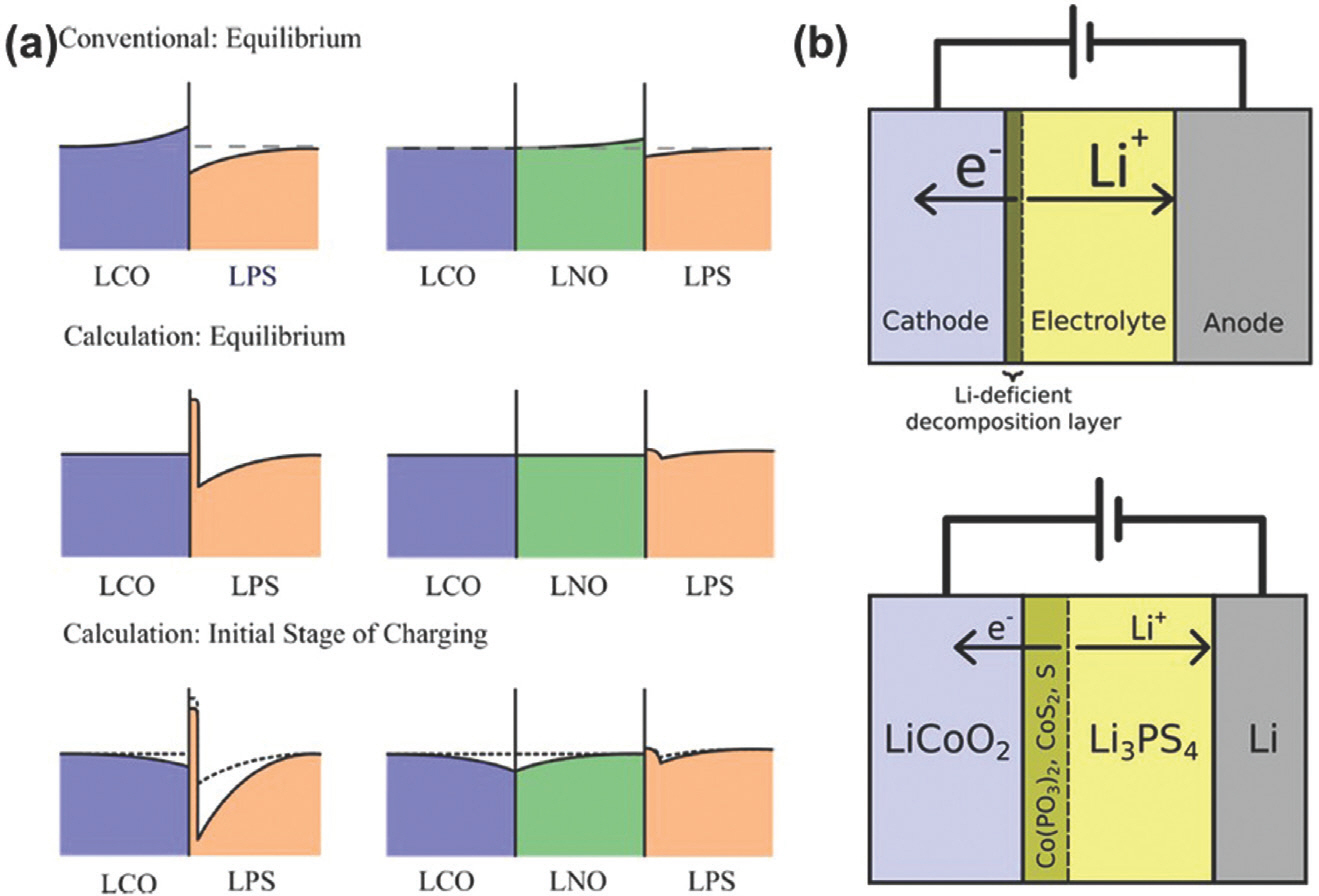
고체전해질의 화학적 및 전기화학적 불안정성은 고체전해질/양극 계면 저항을 증가시키는 주된 원인이다. 예를 들면, 고체전해질과 양극의 전위차로 인해 Li 이온이 고체전해질에서 양극으로 빠져나가면서, 양극과 접촉한 지점의 고체전해질에서는 Li 이온이 부족한 공핍층 (space-charge layer)이 형성되며, 전고체전지의 율속성능 (rate-capabilitey)이 급격히 감소한다.[33] (Fig. 3a) 일반적으로 공핍층은 소재의 내부와 소재의 표면에 인접한 다른 상 사이에 자연스럽게 형성되는 다리 역할을 하며, 이종 소재 시스템에서의 전도도를 결정한다. 산화물 양극 소재는 높은 이온전도도를 갖는 혼합 전도체 (Mixed ionic–electronic conductors; MIEC)이며, 황화물 고체전해질의 경우 Li 이온 전도체이다. 따라서 산화물 양극 소재와 고체전해질 소재가 접촉하면 Li 이온에 대한 전기화학적 구배가 형성되어 Li 이온이 고체전해질에서 양극으로 이동하게 된다. 이 때, 양극 소재내에서의 공핍층은 전자 전도로 인해 완화되기 때문에 Li 이온들이 계속해서 양극 소재 쪽으로 이동하게 되고, 이로 인해 고체전해질 내의 공핍층은 점점 두꺼워지며 계면 저항이 증가한다.[29] 실제로, Chen 그룹은 아지로다이트계 Li6 PS5 Cl 고체전해질과 LiCoO2 양극 계면에서 충전에 따른 공핍층의 변화를 실시간으로 관찰하였다.[34] 나아가 황화물 고체전해질의 경우 좁은 전기화학적 안정성 창 (1.7 – 3 V)을 갖기 때문에 충전에 의한 산화반응시 산화물 양극 소재와 맞닿은 지점에서 리튬과 전자가 빠져나가면서 Co(PO3)2, CoS2, S 등으로 분해된다.[25] (Fig. 3b) 따라서 고체전해질의 분해를 막기 위해서는 양극 소재 표면을 완화층으로 코팅하는 공정이 필요하다.
Fig. 3.
Schematic illustrations for the interfacial Li concentration of the LiCoO2/Li2 S-P2 S5 interface and LiCoO2/LiNbO3/Li2 S-P2 S5 interface. Reproduced from Haruyama et al. Chem Mater 2014;26:4248-55, with permission of American Chemical Society[33]. (b) Schematic illustrations for the decomposition of solid electrolyte at the interface between solid electrolyte and cathode during charging. Reproduced from Richards et al. Chem Mater 2016;28:266-73, with permission of American Chemical Society[25].
이론적으로 완화층은 전해질 표면에도 코팅될 수 있으나, 고체전해질/양극 복합 구조에서 완화층이 고체전해질에 코팅될 경우 고체전해질 입자 사이 이온 이동에 방해가 되기 때문에 양극 소재에 코팅하는 것이 일반적 이다. 전고체전지에 적용되는 완화층은 기존 액체전해질 기반 리튬 이온전지의 양극용 코팅층과 다른 요구 조건을 갖고 있다. 리튬 이온전지에 사용되는 양극 코팅층의 경우, 1) 전자전도가 높아야 하고, 2) 불필요한 표면 작용기가 없어야 하며, 3) 액체전해질의 산도 (acidity)를 낮추는 HF 스케빈저 (scavenger) 역할, 4) 양극의 전이금속이 액체전해질로 용출되는 것을 막는 역할, 5) 액체전해질의 분해반응을 막기 위한 물리적인 보호 역할을 수행해야한다.[35] 한편, 이상적인 전고체전지용 양극 완화층의 경우, 1) 양극의 작동 전압을 높히면서 고체전해질의 전기화학 안정성 창과도 겹칠 수 있는 넓은 전기화학적 안정성, 2) 고체전해질과 양극 모두에 화학적으로 반응을 일으키지 않는 화학적 안정성, 3) Li 이온 전도성, 4) 낮은 전자 전도성을 만족시켜야 한다.[36]
현재까지 전고체전지 고체전해질/양극 계면 저항을 줄이기 위해 다양한 조성의 완화층이 연구되어 왔으며, 특히 금속 산화물 (Li2 SiO3, Li4 Ti5 O12, Li3x La2/3-x TiO3, Li2 ZrO3, LiAlO2, Li3 BO3, Li3 PO4, LiNbO3, LiTaO3) 이 전고체전지 양극 완화층으로 적합하였다.[35] 전고체전지에 가장 널리 사용되는 LiNbO3 양극 완화층 조성을 예로 살펴보면, 약 3 – 5 nm 두께의 LiNbO3 완화층을 LiNi0.8 Co0.1 Mn0.1 O2 (NCM811) 양극에 코팅시, 셀 용량, 율속성능 및 싸이클 안정성이 모두 향상되었다.[37] LiNbO3 완화층이 코팅된 양극은 완화층이 없는 양극에 비해 낮은 계면 저항을 나타내었고, 50번의 충방전 싸이클 이후에도 낮은 저항값을 유지하였다.[37] 한편, 현재까지 다양한 고체전해질과 양극 후보군이 개발되고 있고, 각 조성에 따라 전기화학 안정성 창도 다르기 때문에, 각 고체전해질/양극 조합에 적합한 완화층 조성 개발이 필요하다. 최근 Ceder 그룹에서는 범밀도함수 (density functional theory; DFT) 기반 시뮬레이션을 활용하여 고체전해질과 양극 조성의 조합에 따른 최적의 완화층 조성을 계산하였다.[36] (Fig. 4) 그 결과 다가음이온 (polyanionic) 산화물 조성이 전기화학적/화학적 안정성이 우수하면서 높은 이온전도도를 유지할 것이라 예측하였다. 대표적으로 황화물 고체전해 질에서는 borates 계열(LiBa(B3 O5)3)과 phosphates 계열(LiH2 PO4, LiTi2(PO4)3, LiPO3) 조성이, LLZO 산화물 고체전해질에서는 borates 와 oxides 계열 (Li2 ZrO3, LiNbO3, LiTaO3) 조성이 완화층으로 적합할 것이라고 제안하였다. 이후 후속연구를 통하여 실제 Li3 PS4 고체전해질/LiNi0.5 Co0.2 Mn0.3 O2 (NCM 523) 양극 조합에서 Li3 B11 O18 완화층이 Li2 ZrO3 완화층보다 높은 싸이클 안정성을 나타냄을 실험적으로 확인하였다.[38] 특히, Li2 ZrO3 완화층의 경우 첫 싸이클 이후 Li이 추출되면서 ZrO2로 상분리가 일어나는 현상이 관찰되었으며, 이는 Li2 ZrO3 의 낮은 산화 안정성 (3.42 V)에 기인한다. 반면 Li3 B11 O18 완화층은 높은 산화 안정성 (4.45 V)를 갖기 때문에 NCM 양극 기반 배터리 충방전 전위 구간 (2.5 – 4.3 V)에서 안정하였다.
Fig. 4.
(a) Electrochemical stability windows of solid electrolytes and buffer layers. (b) Reaction energies at cathode/solid electrolyte, cathode/buffer layer, and buffer layer/solid electrolyte interfaces. Reproduced from Xiao et al. Joule 2019;3:1252-75, with permission of Cell Press[36].

일반적으로 완화층은 전기화학적/화학적 안정성은 높지만 상대적으로 낮은 이온전도도를 갖고 있기 때 문에 최대한 얇고 균일하게 코팅되어야 한다. Sun 그룹은 원자층 증착법 (atomic layer deposition; ALD)을 활용하여 양극 입자에 LiNbO3를 얇고 균일하게 코팅하는 방법을 보고하였다.[39] 나아가 ALD 증착 cycle 을 조절하여 완화층의 두께를 2, 5, 10 nm로 바꾼 결과, 5 nm 두께의 LiNbO3 완화층이 코팅된 NCM811 양극입자가 Li10 GeP2 S12 기반 전고체전지에서 가장 우수한 특성을 나타내었다.[40] 그 외에도 다양한 코팅방법 – 공침법 (co-precipitation coating), 건식법 (dry coating), 액상법 (liquid phase coating), 솔-겔법 (sol-gel coating), 화학기상증착법 (chemical vapor deposition; CVD) – 이 보고되었으나,[41] 대부분 완화층의 두께가 불균일하게 증착되는 단점이 있다. 현재까지 대량생산에 적합하면서도 얇고 균일한 완화층을 코팅할 수 있는 방법은 유동층코팅기술 (spray fluidized bed coating)로 알려져 있으며, 높은 장비 단가로 인해 전고체전지용 소재 가격을 올리는 주요 원인이다.
양극 입자 코팅 기술의 지속적인 발전을 통해 전고체전지의 성능이 개선되고 있으나, 여전히 기존 리튬 이온전지에 비해 싸이클 안정성은 상대적으로 낮다. 특히 황화물 기반 전고체전지의 경우 초기 쿨롱 효율 (coulombic efficiency)이 많이 떨어지는 편이며, 이는 황화물 고체전해질 고유의 낮은 안정성에 의해 충전시 분해반응이 일어나기 때문이다. Kanno 그룹에서 Li10 GeP2 S12 황화물 고체전해질과 4.3 V에서 작동하는 LiNi0.5 Mn1.5 O4 고전압 양극을 갖는 전고체전지를 측정한 결과, LiNbO3 완화층이 코팅되더라도 충방전에 따라 셀 성능이 지속적으로 감소하는 것을 확인하였으며, 이는 황화물 고체전해질이 고전압 충전조건에서 분해되기 때문이었다. 특히 완화층과 고체전해질이 맞닿은 부분보다 도전재와 고체전해질이 맞닿은 부분에서 고체전해질의 분해반응이 활발히 일어남을 관찰하였다. 이는 완화층의 조성과 코팅 방법을 최적화하더라도 고전압 양극을 사용하거나, 전고체전지의 작동전압을 높이는 것이 어려움을 의미한다.
이를 해결하기 위해 최근 전기화학적 안정성 창이 넓은 할라이드 (halide) 고체전해질을 양극용 고체전해질로 활용하는 연구가 활발히 진행되고 있다.[42] Asano 그룹은 Li3 YCl6 및 Li3 YBr6 할라이드 고체전해질이 상온에서 1 mS cm−1 수준의 이온전도도를 갖으면서 약 4.2 V 까지 안정하다는 것을 발견하였다.[43,44] 이러한 할라이드를 양극용 고체전해질로 적용한 결과 LiCoO2 양극 표면에 완화층을 따로 코팅하지 않았음에도 불구하고, 초기 쿨롱 효율이 94%를 나타내었고, 100 싸이클 동안 용량이 거의 일정하게 유지됨을 확인하였다.[43] 그러나 상대적으로 높은 구동전압과 용량을 갖는 NCM811과 할라이드 고체전해질을 조합했을 경우, 여전히 싸이클에 따라 셀이 열화되는 현상이 관찰되었으며, 이를 극복하기 위해서는 LiNbO3 완화층 코팅이 여전히 필요함이 보고되었다.[45] 또한 할라이드 전해질은 상대적으로 높은 환원 준위를 갖기 때문에 리튬 음극과 접촉시 바로 분해반응이 일어나는 문제점이 있어, 양극용 고체전해질로만 사용이 한정된다.[46]
2.2. 양극 입자 미세구조/결정 제어: 접촉면적 개선 및 박리 현상 완화
전고체전지는 고체전해질과 전극이 모두 고체이기 때문에 두 고체 소재가 맞닿은 부분에서만 Li 이온이 이동할 수 있다. 따라서 전고체전지의 성능을 개선하기 위해서는 고체전해질과 전극 사이의 접촉을 향상시키는 것이 무엇보다 중요하다. 황화물 고체전해질은 높은 이온전도도를 가짐과 동시에 기계적으로 무른 성질을 가지기 때문에, 상온에서 압착과 성형이 가능하다는 장점이 있다. 황화물 고체전해질의 탄성계수는 20 GPa 정도로 측정되며, 이는 산화물 소재와 고분자 소재의 중간정도의 값이다. 실제로 산화물 고체전해질인 LLZO의 경우 상온에서 가압하여 펠렛을 제조하였을 때 입자끼리 뭉치지 못하고 빈공간이 존재하는 것을 볼 수 있다.[47] (Fig. 5a) 반면 황화물 고체전해질인 Li2 S-P2 S5 조성의 경우, 상온에서 펠렛 제작시 입자끼리 잘 뭉치면서 입자 사이의 빈공간이 상대적으로 많이 줄어드는 것을 볼 수 있다. (Fig. 5b) 이는 펠렛 성형시 높은 압력을 가함에 따라 탄성계수가 낮은 황화물 소재가 변형이 되기 때문이다. (Fig. 5c-d) 이러한 황화물 고체전해질의 무른 성질을 활용하면 고체전해질과 양극 입자 사이의 접촉도 개선할 수 있다. Tatsumisago 그룹은 펄스 레이저 증착법 (pulsed laser deposition; PLD)을 통해 양극 표면을 황화물 고체전해질로 코팅한 후 가압하여 펠렛 단면을 관찰하였다.[47] (Fig. 5e) 그 결과, LiCoO2 양극 입자 표면을 Li2 S-P2 S5 황화물 고체전해질이 잘 감싸면서 황화물 고체전해질 입자끼리 서로 연결된 이상적인 복합 양극을 확보하였다. (Fig. 5f) 이는 황화물 고체전해질의 무른 성질을 활용하면 상온 가압을 통해 접촉 면적이 개선된 전고체전지를 제작할 수 있음을 의미한다.
Fig. 5.
(a-d) Cross-sectional SEM images of (a) Li7 La3 Zr2 O12 pellet, (b) Li2 S-P2 S5 pellet, (c) Li2 S-P2 S5 powders compressed at 74 MPa, and (d) Li2 S-P2 S5 powders compressed at 360 MPa. (e) Schematic illustration of composite cathode consisting of cathode particles coated with a sulfide solid electrolyte. (f) A cross-sectional SEM image of compressed composite cathode consisting of LiCoO2 particles coated with Li2 S-P2 S5 solid electrolyte. Reproduced from Sakuda et al. Sci Rep 2013;3:2261, with permission of Springer Nature[47].

PLD를 활용하면 원하는 조성의 분자 구조를 유지하면서 증착할 수 있어, 황화물 고체전해질의 높은 이온전도도를 유지하면서 코팅이 가능하다는 장점이 있으나, 고가의 레이저 및 진공 챔버를 활용하기 때문에 가격 및 양산 측면에서 적합하지 않다. 이를 해결하기 위해 양극 입자에 황화물 고체전해질을 코팅하는 방법이 지속적으로 연구되고 있고, 대표적으로 액상법을 활용한 코팅 기 술이 활발히 연구되었다.[48] 예를 들면, 황화물 고체전해질을 에탄올에 녹이고, 해당 용액에 양극 입자를 넣고 교반하고 건조함으로써, 양극 입자에 황화물 고체전해질을 코팅하는 기술이 연구되었다.[49] 나아가 황화물 고체전해질이 녹은 용액을 기존 리튬 이온전지에 적용되는 양극 시트에 떨어뜨려, 마치 액체전해질이 양극 입자 사이로 스며들 듯 황화물 고체전해질을 양극 입자 사이로 침투 (infiltration)시키는 기법도 개발되었다.[50] 용 액법을 활용한 고체전해질 코팅 기술은 값싸고 대량생산이 가능하다는 장점이 있으나, 1) 고체전해질이 용액에 녹으면서 황화물 소재가 데미지를 받고 결정 구조가 변형되어 이온전도도가 낮아지는 문제, 2) 유기 용매의 건조 시 탄소 오염 (carbon corrosion) 문제로 인해 전고체전지의 성능 개선에 한계가 있다.[51]
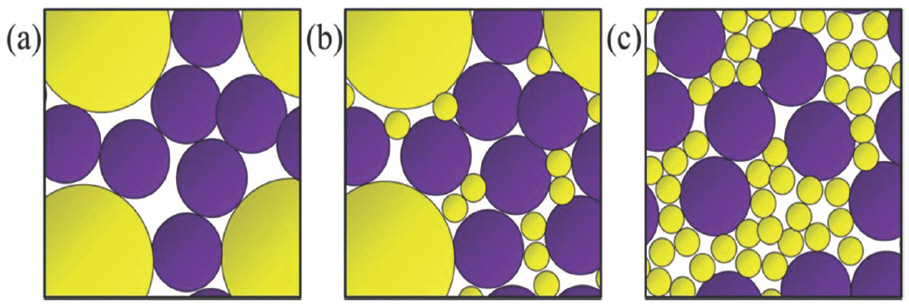
고체 입자로 이루어진 성형체의 공극률을 줄이고 충진율을 개선하는 손쉬운 방법은 다양한 크기의 고체 입자를 활용하는 것이다.[52] (Fig. 6) 이는 자갈이나 모래만 사용하면 빈공간이 많이 존재하지만 자갈과 모래를 섞을 경우 빈공간이 최소화되는 고전적인 원리와 같다. 따라서 고체전해질과 양극의 접촉면적을 개선할 수 있는 대안으로 고체전해질과 양극 입자의 형상을 제어하는 방법이 연구되어 왔다. Strauss와 Brezesinski 그룹은 평균 4, 8, 16 ㎛ 지름을 갖는 LiNi0.6 Co0.2 Mn0.2 O2 (NCM622) 양극 입자를 Li2 S-P2 S5 황화물 고체전해질 시스템에 적용하여 양극 입자 크기의 영향을 분석하였다.[53] 그 결과, 양극 입자의 크기가 작아질수록 접촉 면 적이 증가하고 전자 전도 경로가 증가함을 확인하였다. 나아가 Takeuchi 그룹은 양극 입자의 크기 (5 또는 9 ㎛)와 고체전해질 입자의 크기 (4 또는 16 ㎛)에 따른 영향을 관찰하였다.[54] 유사하게, 작은 양극 입자와 작은 고체전해질을 사용하였을 때 상대적으로 균일하고 공극이 적은 복합양극을 얻을 수 있었다. 그에 따라 충방전 전류를 0.5C 및 2C로 높였을 때도 0.05C에서 얻었던 용량과 비슷한 수준의 방전용량을 확보하였다. 입자의 형상을 제어하면 접촉면적을 개선할 수 있을 뿐 아니라, 고체전해질과 양극 입자로 구성된 복합 양극에서 양극 입자의 함량비를 최대로 늘릴 수 있어 전고체전지의 용량과 출력의 향상이 가능하다.[55] Ceder 그룹은 양극 입자의 크기 (5 또는 12 ㎛), 고체전해질 입자의 크기 (1.5, 3, 5, 8 ㎛) 뿐 아니라 복합 양극내 양극 입자의 함량 (60 – 80 wt.%)도 변화시키면서 전고체전지의 성능 변화를 관찰하였다.[56] 그 결과, 양극 입자의 크기가 크고 (12 ㎛) 고체전해질 입자의 크기가 작을 경우 (1.5 ㎛), 고함량 양극 조건 (80 wt.%)에서도 이론값에 근접한 방전용량을 확보할 수 있었다. 이는 양극과 고체전해질 입자의 크기 비가 커질수록 고체전해질 입자 사이의 연결 이 강화되어 이온 이동 경로가 확보되기 때문이다. 최근의 시뮬레이션 연구에 따르면, 양극과 고체전해질 입자 크기의 비율은 Li 이온 경로의 굴곡률 (tortuosity)을 결정하며[57], 이는 고율 방전 (high-rate discharge) 특성에 영향을 준다.[58]
Fig. 6.
Schematic illustrations of composite cathode structure: (a) coarse solid electrolyte used, (b) bimodal solid electrolyte mixture used, (c) fine solid electrolyte used (yellow: solid electrolyte particle, purple: cathode particle). Adapted from Park et al. J Electrochem Soc 2019;166:A5318-22, with permission of Institute of Physics Publishing[52].
전고체전지는 고체-고체 접촉에 기반하고 있기 때문에, 접촉 면적/공극률 외에도 다양한 기계적인 이슈를 해결해야 한다. 특히 충/방전시 양극 입자의 부피 팽창으로 인해 고체전해질/전극 계면에 압력이 변화하면서 고체 계면이 박리되는 현상이 발생한다. 일반적으로 양극 입자는 1 ㎛ 정도 크기의 일차 입자가 서로 뭉쳐서 10 ㎛ 정도 크기를 갖는 이차 입자로 구성된다. Sun 그룹은 양극 이차 입자 내의 일차 입자가 불규칙하게 뭉쳐있을 때 충/방전에 따라 양극 입자의 부피가 변화면서 고체전해질과 양극 입자가 분리될 뿐 아니라 양극 내의 일차 입자끼리도 분리되는 현상을 관찰하였다.[59](Fig. 7) 고체전해질은 양극 입자 표면에서만 접촉할 수 있기 때문에 내부에 격리된 이러한 일차 입자는 사용 불가능하게 된다. 이를 해결하기 위해, 막대 모양의 일차 입자가 이차 입자 표면을 향해 방사형으로 배열된 다결정 입자 를 합성한 결과, 충/방전에 따른 부피팽창에도 일차 입자가 서로 붙어있어서 싸이클에 따른 안정성이 개선되었다. 이는 양극 입자의 형상이 전고체전지의 성능 개선에 중요한 역할을 함을 의미한다.
Fig. 7.
Schematic illustration for the different microstructural and interfacial changes of the commercial-grade Li[Ni0.80 Co0.16 Al0.04]O2 (NCA80) and full-concentration gradient Li[Ni0.75 Co0.10 Mn0.15]O2 (FCG75) cathodes in all-solid-state batteries. Adapted from Jung et al. Adv Energy Mater 2020;10:1903360, with permission of Wiley-VCH Verlag GmbH & Co. KGaA[59].
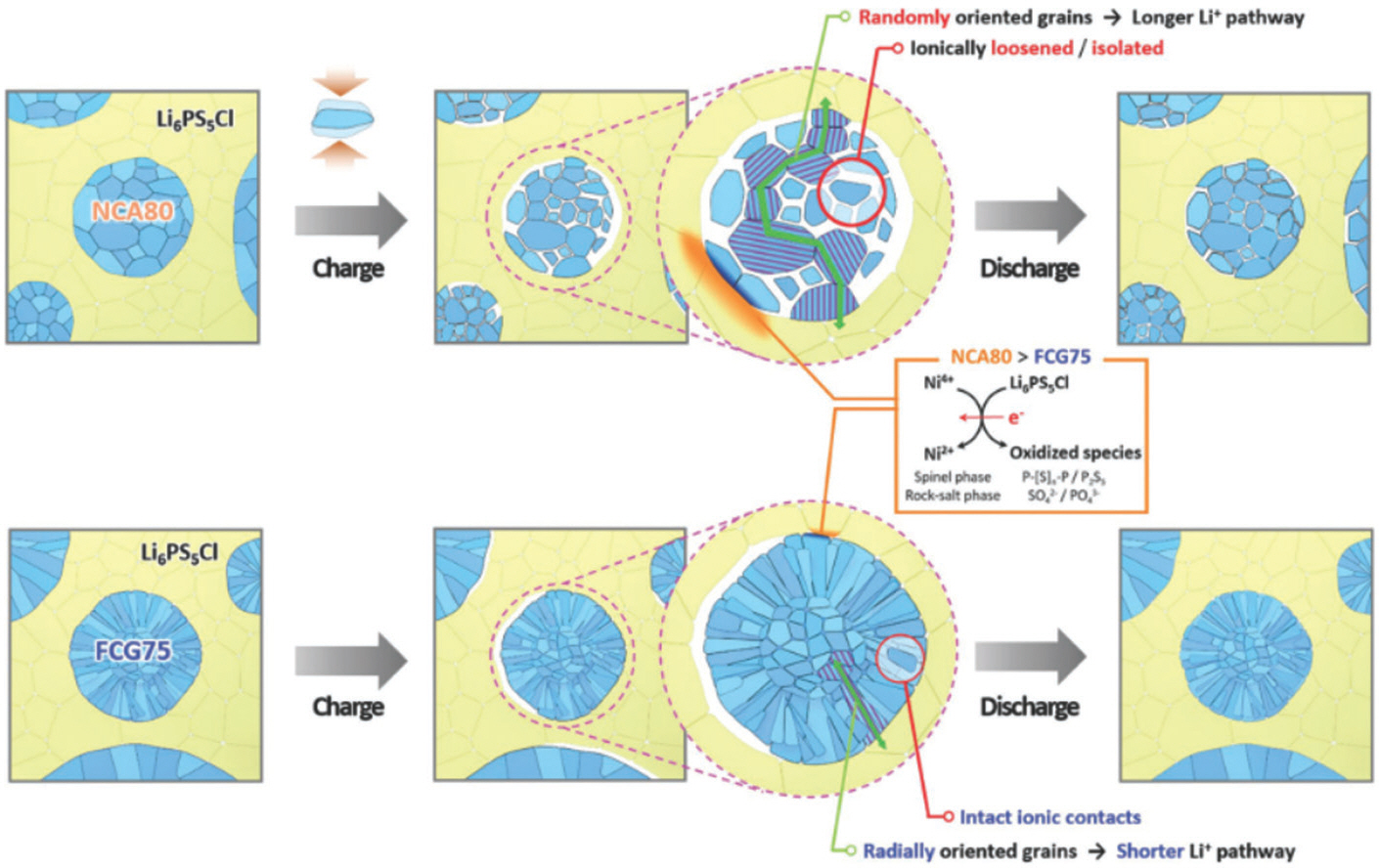
실제로 다결정 입자는 충/방전에 따른 크랙 문제로 인해 액체전해질 기반 리튬이온전지에서도 충/방전 안정성을 감소시키는 원인으로 지목된다. 이를 해결하기 위해, 단결정 양극 입자를 리튬 이온전지에 적용하는 연구가 진행중이며, 단결정 입자의 입자 온전성 (particle integrity), 열적/고전압 안정성 (thermal/high-voltage stability), 등방성 부피팽창 (isotropic volume expansion)이 싸이클 안정성을 증가시킨다고 보고되었다.[60] 이러한 연구흐름에 따라 최근 전고체전지에서도 단결정 양극 입자를 적용하는 연구가 진행되었다.[61] Sun 그룹은 단결정 양극 입자를 전고체전지에 사용하였을 때 다결정 입자 대비 Li 이온 확산 계수가 6 – 14배 증가함을 관찰하였다.[62] 이는 다결정 입자의 경우 리튬 이온이 내부의 일차 입자에서 표면의 고체전해질까지 이동하면서 많은 결정 입계 (grain boundary)를 통과하는 반면, 단결정 입자는 내부에 결정 입계가 존재하지 않기 때문이다. 나아가 전고체전지는 고체전해질의 소결을 위해 매우 높은 압력을 가하게 되는데, 다결정 양극 입자의 경우 고압에서 파단이 일어나며, 이로 인해 기계적인 접촉 손실이 발생한다. 반면, 단결정 입자는 구조적 무결성 (microstructural integrity)을 갖기 때문에 전고체전지 제작 시 이러한 미세 크랙 (microcrack)이 형성되지 않았다.[63] 앞서 언급한 양극용 고체전해질인 할라이드 소재와 단결정 양극을 조합한 결과, 추가적인 완화층이나 고체전해질을 양극 표면에 코팅하지 않아도 200 싸이클까지 초기 용량을 유지하는 전고체전지가 개발되었으며, 이는 할라이드 고체전해질의 높은 산화 내성 (oxidation tolerance)과 단결정 양극 입자의 구조적 무결성 조합에 따른 시너지 효과에 기인한다.[64]
2.3. 계면상 형성: 고체전해질/음극 계면 호환성 개선
액체전해질 대신 고체전해질을 사용함으로써 무게가 늘어나는데도 불구하고, 전고체전지의 에너지밀도가 증가할 것이라고 예측하는 이유 중 하나는 가볍고 용량이 큰 리튬 음극을 적용할 수 있기 때문이다. 리튬 금속은 이론적으로 3,860 mAh g−1 용량을 가지며 음극 중 가장 낮은 산화환원 준위 (−3.04 V vs. NHE)를 갖기 때문에 상용화된 흑연 음극 대체재로써 사용시 에너지밀도를 약 70% 가량 개선할 것으로 예상된다.[65] 그러나 앞서 언급하였듯이, 고체전해질과 리튬 금속이 직접 접촉할 경우 고체전해질의 화학적/전기화학적 불안정성으로 인해 고체전해질/음극 계면의 저항이 증가한다. 특히 충방전 싸이클에 따라 고체전해질이 환원되는 반응이 발생하며, 계면저항이 지속적으로 증가하여, 셀 성능을 떨어뜨리는 주된 원인이 된다. 이를 해결하기 위해 계면상 (interphase)을 리튬 음극과 고체전해질 사이에 도입하는 연구가 활발히 진행되었다.
황화물 고체전해질의 경우 매우 좁은 전기화학적 안정성 창을 갖기 때문에 (Fig. 4), 리튬 음극의 직접 적용이 이론적으로 불가능하다. 화학적/전기화학적으로 상대적으로 안정하면서 이온전도도가 높은 (3 – 10 mS cm−1) 아지로다이트계 Li6 PS5 Cl 조성의 경우도 리튬 음극과 직접 접촉시, 계면 반응이 서서히 진행된다.[66] 이를 해결하기 위해 전고체전지 연구 초기에는 인듐 (In) 금속을 리튬 금속 대신 사용하였다. 인듐 금속은 상온에서 리튬 금속과 손쉽게 합금을 이루는 조성으로, 이때의 화학적 확산 계수는 리튬 자체의 확산 계수보다도 크다. 또한 리튬이 인듐 내부로 삽입되며 형성되는 합금 형성 반응은 산화환원 준위가 0.6 V이다. 따라서 인듐 금속을 음극으로 활용시 황화물 고체전해질의 환원을 일으키는 열역학적인 구동력 (thermodynamic driving force)이 낮아지게 된다.[67] 실제로 Li2 S-P2 S5 황화물 고체전해질 표면에 In을 진공 증착하고, Li 음극과 Li4 Ti5 O12 양극을 적용한 결과, 전고체전지가 120 사이클동안 안정하게 구동되었다.[68] 현재까지도 황화물 고체전해질을 연구하는 경우, 인듐 호일 (In foil) 또는 리튬과 인듐 입자가 1:60의 무게비로 섞인 음극 입자를 사용하고 있으며, 특히 황화물 고체전해질 또는 고체전해질/양극 계면 연구를 수행하는 경우 음극 계면에서의 분해 반응을 최소 화하기 위해 인듐 금속을 음극으로 사용하고 있다. 그러나 In-Li 합금 반응의 산화환원 준위가 리튬 자체의 산화환원 반응 대비 0.6 V 높기 때문에, 셀의 작동전압이 낮아지고, 이로 인해 에너지밀도가 감소하는 한계가 존재한다.
높은 작동전압을 유지하면서 음극 계면의 안정성을 높이는 가장 효율적인 방법은 리튬과 고체전해질 사이에 계면상을 형성하는 것이다. 이 때 계면상은 고체전해질 및 리튬 음극에 모두 안정하도록 전기화학적 안정성 창이 적절한 범위를 가져야 한다. (Fig. 2) 또한 전자전도도는 낮고 이온전도도는 높은 소재여야 한다. 만약 계면상이 전자전도도와 이온전도도가 모두 높은 MIEC 성질을 가질 경우, 충/방전시 리튬과 전자가 같은 방향으로 이동하게 되어 부반응을 촉진시킨다.[69] (Fig. 8) 실제로 이온전도도가 높은 Li10 GeP2 S12 황화물 고체전해질의 경우 리튬 금속과 접촉시 분해되면서 Li-Ge 으로 구성된 고체-전해질 계면상 (Solid electrolyte interphase; SEI) 을 음극 계면에 형성하게 되는데, 이는 리튬과 전자 전도도가 모두 높은 소재이다.[15] 따라서 충방전 싸이클이 진행되면서 지속적으로 음극 계면에서 분해반응이 진행되어 SEI가 점점 두꺼워진다. 반면, 리튬 금속과 호환성이 가장 높다고 알려진 LiPON 고체전해질의 경우, 리튬 금속과 접촉시 초기에 Li3 P, Li2 O, Li2 N 으로 구성된 SEI가 음극 계면에 형성되며, 이는 리튬 이온전도도는 높지만 전자전도도는 낮은 조성이다. 따라서 충방전에 따라 SEI가 더 이상 성장하지 않고 얇 은 두께를 유지하게 되어, 초기의 낮은 계면 저항을 계속 유지하게 된다. 따라서 황화물 고체전해질과 리튬 음극 사이에 이온전도도만 높은 계면상이 형성되도록 하는 연구가 진행되었다. 대표적으로, Li2 S-P2 S5에 LiI 조성을 30 mol% 포함시킨 고체전해질을 합성한 결과, 이온전도도는 높지만 전자전도도는 낮은 LiI가 포함된 SEI가 음극 계면에 형성되면서 계면 안정성이 개선되었다.[70] 마찬가지로, 황화물 고체전해질에 산소나 P2 O5를 도핑하면, 안정적인 음극 SEI가 형성되었다.[71,72] Wang 그룹은 Li2 S-P2 S5과 리튬 음극 사이에 LiFSI 염을 포함한 액체전해질을 소량 첨가한 결과, LiF가 다량 함유된 음극 SEI가 형성되어 음극 계면이 안정해짐을 확인하였다.[73]
Fig. 8.
Schematic illustrations for different types of interfaces between Li electrode and solid electrolyte. Adapted from Zhu et al. J. Mater. Chem. A 2016;4:3253, with permission of Royal Society of Chemistry[69].

고체전해질을 도핑하거나, 액체전해질을 활용하여 초기에 자발적인 SEI를 형성하는 방법은 기존 리튬 이온전지에서 음극 계면에 SEI를 형성하는 활성화 공정 (formation)과 유사하며, 추가적인 공정이 필요하지 않아 양산에 적합하다. 그러나 액체전해질과 달리 고체전해질은 고체-고체 접촉에 의해 반응이 진행된다는 점에서 초기에 SEI를 균일하게 형성시키기 어려우며, 분해된 고체전해질에 의해 셀 저항이 증가한다는 단점이 있다. 이에 대한 대안으로 리튬 음극에 인공적인 SEI 를 형성하는 연구가 진행되었다. Sun 그룹은 리튬 호일을 Li2 S8 용액과 SiCl4 용액에 교대로 담그면서 리튬 호일 표면에 150 nm의 얇은 Lix SiSy 층을 형성하였다.[74] 그 결과, 100 싸이클 동안 87%의 용량유지율을 확보하였다. 특히 Lix SiSy 층은 높은 이온전도도를 갖을 뿐 아니라 공기 중에도 안정해 Li 금속을 공기 중에서 취급할 수 있는 장점이 있다.
2.4. 중간층 도입: 고체전해질 표면 리튬 젖음성 개선
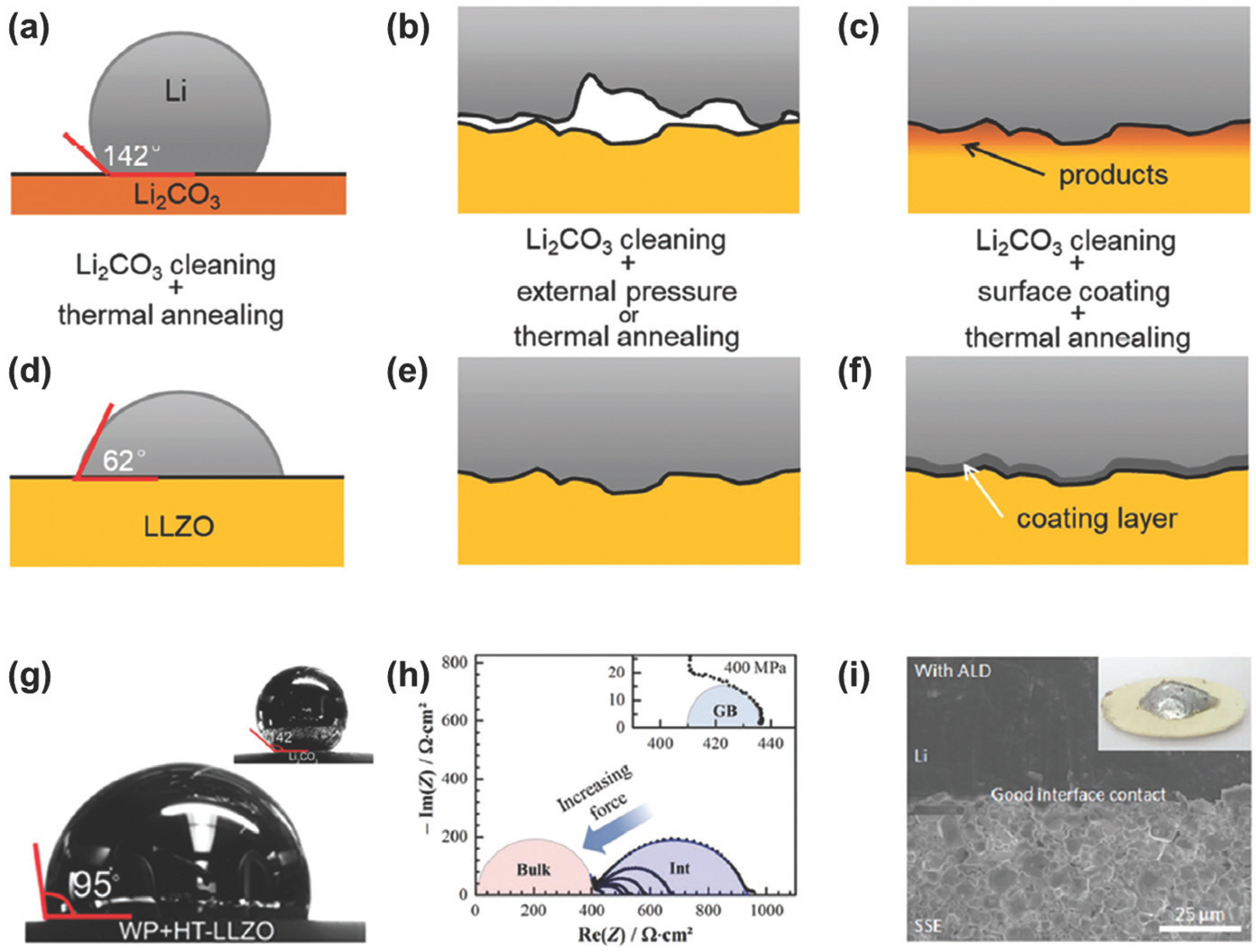
제일원리계산 (first-principle calculations)에 따르면, 대부분의 고체전해질은 리튬에 대해 열역학적으로 불안정한 반면, Garnet 타입의 LLZO 산화물 고체전해질은 리튬에 안정한 수준의 낮은 환원 준위를 나타낸다. 나아가 LLZO는 산화물 고체전해질 중 가장 높은 수준의 이온전도도를 나타낸다. (0.1 – 1 mS cm−1) 따 라서 화학적으로 안정한 중간층 없이 리튬 음극과 결합할 수 있는 유망한 고체전해질로 여겨진다. 그러나 일반적으로 산화물 고체전해질은 리튬 금속과의 계면 젖음성이 낮으며, 이는 리튬 호일과 LLZO 사이의 물리적인 접촉을 어렵게 한다. 이로 인해 고체전해질과 음극 사이의 접촉이 제한되며, 계면 저항이 증가하고 충/방전시 리튬 이온의 착/탈리 거동이 불균일하게 형성되어 안정성이 감소하게 된다. LLZO 표면에 자발적으로 형성되는 Li2 CO3 부동층 (passivation layer)을 제거하면 리튬에 대한 젖음성이 조금 증가하나, 여전히 용융 리튬과 LLZO 사이의 접촉각이 95도 정도로 높은 수준이다.[75] (Fig. 9) 따라서 LLZO 고체전해질과 리튬 음극 사이 계면의 물리적인 호환성을 높이기 위해 중간층이 도입되었다. LLZO 표면에 ALD로 Al2 O3를 20 nm 정도 두께로 증착하면, 용융 리튬과 접촉시 Lix Al2 O3+x/2로 변하면서 용융 리튬에 대한 젖음성이 급격하게 향상된다.[76] (Fig. 9) 이는 Lix Al2 O3+x/2 조성이 6 – 11.4 eV nm−2 수준의 리튬 결합 에너지 (binding energy)를 가지기 때문이며, 기존 Li2 CO3가 1.6 eV nm−2 정도의 결합 에너지를 갖는 것을 고려할 때 매우 높은 값이다.[77] 즉, LLZO와 리튬 사이에 도입되는 중간층은 리튬과 반응성이 높은 것을 특징으로 하며, 같은 원리로 Si, Al, Ge, Ag, ZnO, SnO2, SnF2, MoS2, AgNO3, Cu3 N, Cu6 Sn5 조성이 표면 젖음성을 개선함이 밝혀졌다.[78]
Fig. 9.
(a-c) Origin of the interface resistance between Li metal and garnet solid electrolyte from (a) poor wettability of Li to Li2 CO3 surface, (b) insufficient contact, and (c) side reactions. (d–f) Strategies for reducing the interfacial resistance and (g-i) the corresponding experimental results by (d, g) surface cleaning, (e, h) external pressure, and (f, i) ALD coating of Al2 O3. Reproduced from Wang et al. Adv Energy Mater 2020;10:2001318, with permission of Wiley-VCH Verlag GmbH & Co. KGaA[77].
LLZO의 전기화학적 안정성 창은 0.05 – 2.9 V (vs Li/Li+) 이며, 음극에 대해 높은 안정성을 나타내는 반면 고전압 양극과 조합하기에는 부족하다. 한편, NASICON 타입의 LATP와 LAGP의 경우 LLZO와 동등한 수준의 이온전도도를 갖으면서 상대적으로 높은 산화환원 준위 (2.7 – 4.27 V vs Li/Li+)를 나타낸다. 이는 고전압 양극과의 조합뿐 아니라 공기 중에서 대량 생산/취급이 가능함을 의미한다. 그러나 높은 환원 준 위와 산화물 세라믹의 낮은 젖음성으로 인해 NASICON 타입의 고체전해질은 음극과의 계면에서 화학적 및 기계적 이슈를 모두 해결해야 한다. LAGP 고체전해질이 리튬 금속과 접합하면 격자 내 Ge4+가 환원되면서 표면에 GeO 조성을 포함한 MIEC 층을 형성한다. 앞서 설명하였듯이 MIEC는 충방전이 반복될수록 두꺼워진다. 나아가 고체전해질 내의 Ge 환원은 부도체인 AlPO4 이차상 석출과 상분리에 의한 변형 및 크랙 형성을 유도한다.[79] 또한 리튬 금속과의 낮은 접착 특성은 음극 계면에서의 불균일한 리튬 증착을 유도하여, 궁극적으로 셀 성능이 급격히 저하된다. 이를 해결하기 위해 LLZO와 마찬가지로 중간층 도입 연구가 진행되었으며, 특히 Ge 박막을 LAGP 표면에 60 nm 두께로 증착할 경우, Ge의 추가 환원을 막으면서도 Li-Ge 합금 반응으로 리튬 음극과의 접착성도 높임으로써, 화학적/기계적 이슈를 모두 개선할 수 있었다.[80]
결론
차세대 에너지저장 장치로 주목받고 있는 전고체전지의 높은 성능 구현을 위해 고활성 및 고안정성 고체전해질/전극 계면 개발은 필수적이다. 본 투고문에서는 고도화된 계면 개발을 위해 양극 및 음극 계면에서 발생하는 현상에 대해 설명하고, 이를 해결하기 위한 최신 연구 방법론 및 결과들에 대해 소개하였다. 특히 고체전해질/전극 계면에서의 화학적 이슈 및 물리적 이슈를 정의하고, 각각의 이슈를 대응하기 위해 어떻게 접근했는지에 대해 고찰하였다. 기존의 리튬 이온전지의 액체-고체 계면과 달리 전고체전지의 고체-고체 계면은 제한된 반응 면적과 화학적/전기화학적/기계적 변화를 동시에 고려해야 하며, 이를 만족하는 해결책을 제시하기 위해서는 계면 현상에 대한 충분한 이해가 선행되어야 한다. 예를 들어 본문에서 다루지는 않았지만, 최근 고도분석 및 시뮬레이션을 통해 고체전해질의 높은 기계적 강도에도 불구하고 고체전해질 내부로 리튬 덴드라이트가 침투하는 현상이 고체전해질 표면의 미세크랙 및 내부의 높은 전자전도도 때문임이 규명되었다. 그에 따라 앞으로는 고체전해질의 전자전도도를 낮추는 방향으로 연구가 진행될 것이라 예상된다. 마찬가지로 전고체전지의 계면 문제도 실제로 최근 고도화되고 있는 계면 분석 기법과 소재 시뮬레이션을 통해 복잡한 고체 계면 현상에 대한 실타래가 풀리고 있으며, 이에 따라 복잡한 계면 현상을 해결할 수 있는 통합솔루션도 개발될 것이라 예상된다. 나아가 아직까지 전고체전지 계면 기술은 실험실 수준의 작은 규모에서 증명된 연구 초기 단계이며, 앞으로 이를 어떻게 양산화 시킬 것인지, 또한 기존에 투자된 리튬 이온전지 설비와 어떻게 연계시킬 것인지에 대한 연구도 지속적으로 진행될 것으로 판단된다.









