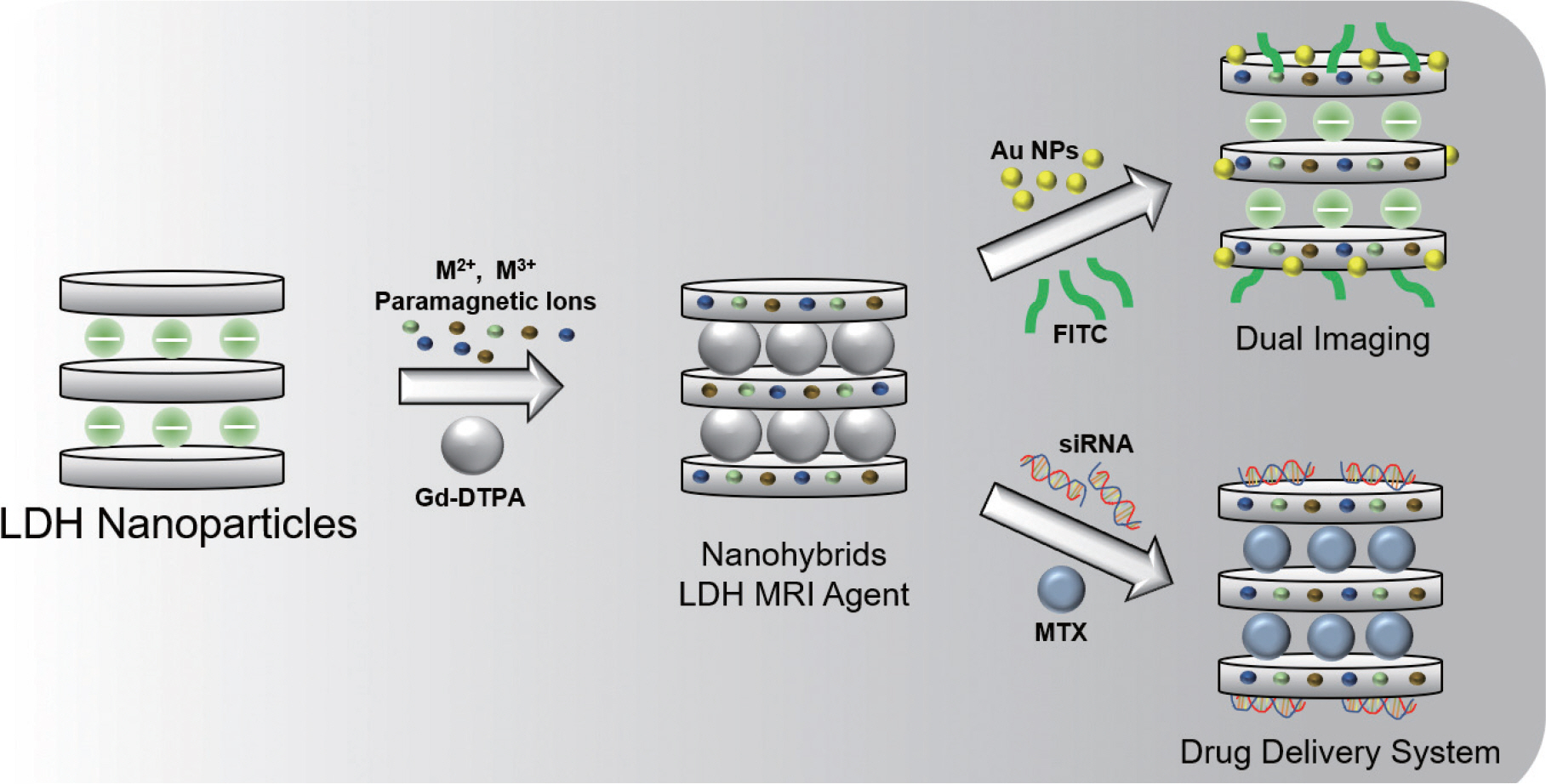
서 론
Layered Double Hydroxides (LDHs)는 2차원 층상형 구조의 세라믹 물질로서 2가 혹은 3가의 금속 수산화물의 호스트층과 호스트 층 사이에 음이온이 삽입된 게스트층으로 이루어지며, 일반적으로 화학식 [M2+1-x M3+x(OH)2] x+[A n-]x/n·mH2 O] (M2+, M3+ 는 호스트 층의 2가, 3가 금속이온, A n- 게스트 층의 음이온)으로 표현된다.1) 생체 적합성 및 인체 내 생분해성이 우수한 LDH는 바이오세라믹 나노하이브리드 소재 제조에 있어서 이상적인 물질로서 국내외에서 관련 연구가 활발히 진행되고 있는데 이는 고유한 2차원 층상형 구조를 바탕으 로 호스트층 내의 3가 금속이온의 존재로 인해 층 자체가 양전하를 띠고 있어 층간의 게스트층에 다양한 음이온성 물질을 도입하고 안정화 시킬 수 있으며 금속 수산화물층을 구성하는 금속의 구성과 층 전하 밀도 등이 쉽게 조절 가능하기 때문이다.2–7) 이를테면, LDH의 게스트층에 조영제 물질을 도입하여 안정화 시켜 나노 조영제를 제조하거나, 금속 수산화물 호스트층 내에서 적절한 격자 조작을 통하여 조영제 효과를 갖고 있는 금속이온으로 치환하여 안정적인 조영제를 합성하거나 표면기능화를 통하여 다양한 바이오이미징 조영제로 활용하는 다양한 연구들이 보고되었다.8–10) 자기공명영상(magnetic resonance imaging, MRI)은 자기장을 이용하여 인체 내 물분자속의 수소원자핵의 핵스핀 이완을 측정하여 영상화 하는 기술이다.11) 장기 및 뇌, 그리고 특정 부위에서 일어난 출혈을 정확하게 감별할 수 있으며, 타 영상 진단 장비에 비해 X-ray를 사용하지 않아 인체에 무해해 1900년대 후반부터 세계적으로 널리 사용해 왔다.8) MRI는 통상 2 가지로 구분할 수 있으며 스핀-격자 완화시간(spin-lattice relaxation)을 뜻하는 T1 신호, 스핀-스핀 완화시간(spin-spin relaxation)을 뜻하는 T2 신호로 나뉜다. 이러한 MRI 영상의 민감도 증폭을 통한 해상도 증진을 위 하여 투여되는 조영제 역시 T1 조영제와 T2 조영제로 구분되며, T1 조영제는 물과 비교하여 상대적으로 밝은 신호 효과(bright or positive contrast effect), T2 조영제는 어두운 신호 효과(dark or negative contrast effect)를 나타내기에 양성 조영제, 음성 조영제라고 불리기도 한다.
T1 조영제는 수소원자핵의 스핀-격자 이완을 촉진할 수 있는 Gd3+, Dy2+, Mn2+ 등의 2가 혹은 3가 상자성 금속이온 또는 상기 이온들을 기반으로 하는 착화합물이 사용될 수 있으며, Gd-DTPA (gadolinium (III) diethylenetriamine pentaacetic acid), Gd-DOTA (macrocyclic gadoteric acid)등이 T1 조영제로 사용되는 착화합물의 대표적인 예이다.12) T2 조영제는 스핀-스핀 이완을 촉진할 수 있는 산화철 나노 입자, FePt 나노 입자와 같이 초상자성을 띄는 물질이 주로 사용되고 있다.13) 최근 연구동향을 살펴보면 조영제 물질의 독성의 완화, 조영효과의 상승, 조영효과와 더불어 다중기능화를 위하여 나노 사이즈의 바이오-무기물질을 기반으로 하는 나노하이브리드 조영제에 관한 연구가 활발히 진행중이며, 긍정적인 연구결과를 보이고 있다.14–16) 본 리뷰에서는 층상형 구조를 갖고 있는 대표적인 세라믹 물질인 LDH 나노하이브리드 소재와 바이오 이미징이 융합된 LDH 기반 MRI 조영제의 연구동향에 대해 기술하였다. LDH 나노하이브리드 기반 MRI 조영제의 합성방법, 특징 및 조영 효과 등을 서술하고 MRI T1 조영제, MRI/CT(Computed Tomography), MRI/형광이미징(Fluorescence imaging) 등 듀얼 이미징 조영제, MRI 및 동시 약물전달 이 가능한 듀얼 어플리케이션 시스템 관련 최신 연구동향에 대해 구체적인 예를 들어 설명을 한 후, 이와 더불어, LDH 기반 MRI 조영제의 장점 및 이후 더 효과적인 질병의 진단, 치료를 위해 연구자들이 관심을 가져야 할 연구에 대하여 논해보고자 한다.
본론
2.1. LDH 나노하이브리드 기반 MRI 조영제
Gd3+와 DTPA5-의 착화합물로서 일반적인 화학식 C14 H18 GdN3 O10를 가지는 Gd-DTPA는 상자성의 특성을 가질 수 있는 7개의 비공유 전자를 가지며, 분자의 화학적 안정성과 Gd 단일원소보다 낮은 독성을 보여 1988년 미 식품의학국(FDA)의 승인을 받아 전 세계적으로 MRI T1 조영제로 사용되고 있다. 하지만, 음이온성의 Gd-DTPA 분자는 음전하를 띄는 세포막과 유기적으로 상호작용하지 못하고 신장을 통해 빠르게 체외로 배출된다.12) 때문에 질병의 진단을 위해 Gd-DTPA의 특성을 개선하려는 연구가 국내외적으로 활발히 진행되어 왔다. 이중, LDH는 음이온을 삽입할 수 있는 게스트층을 가지고 있어 Gd-DTPA를 LDH에 삽입시키려는 연구 또한 진행되었다.8,17)
국내 최진호 교수 연구팀은 2008년 Gd-DTPA를 ZnAl-LDH 게스트 층에 층간 삽입하여 세포 친화성과 표적 특이성을 향상시킨 생체 나노하이브리드 MRI T1 조영제를 개발하여 보고하였다.8)
공침법에 의해 Gd-DTPA/LDH가 성공적으로 합성되었음을 확인하기 위하여 XRD 분석을 진행하였고, 샘플 ZnAl-LDH와 비교하였을 때 결정의 c축이 3.7Å에서 9.9Å으로 격자가 확장되었다. 이는 부피가 큰 Gd-DTPA 분자가 성공적으로 층간 삽입되었음을 증명하였 다. 또한 FT-IR 스펙트럼 분석을 통해 LDH에 삽입된 Gd-DTPA 분자가 전형적인 흡수 피크를 나타냄을 확인할 수 있었다. 이외에도 TG-DTA 열분석, ICP-AES 분석, 원소분석 등을 통하여 합성된 물질의 최종 화학식은 [Zn0.7 Al0.26(OH)2][(Gd-DTPA)0.096(NO3)0.092·0.4H2 O] 이며, Gd-DTPA/LDH에서 Gd-DTPA의 함량은 34wt% 로 확인되었다. SEM 이미지 분석을 통하여 합성된 Gd-DTPA/LDH는 균일한 육각 모양의 혈소판 형태를 띄며, 120 nm의 균일한 입자크기를 갖는다. 문헌에 따르면 생체 내 투여되는 입자의 크기가 50 nm보다 작으면 과잉흡수, 300 nm보다 크면 혈관 차단 등의 치명적인 부작용이 발생하는데,18) 합성된 물질은 생체 내 투여에 적합한 입자크기를 갖는다(Fig. 2A). 최종적으로 MRI 조영제로서의 성능을 확인하기 위하여 T1 자기 이완맵에서 시판중인 Gd 복합체 조영제와 비교분석 한 결과, Gd-DTPA/LDH는 Gd 복합체 자체와 유사한 MRI 조영효과를 보이는 것이 증명되어 Gd-DTPA의 단점을 개선시킨 나노하이브리드 조영제로 보고되었다.
비슷한 시기 Lu 연구팀에서는 MgAl-LDH를 제조한 후 이온교환법을 통해 Gd-DTPA를 층간에 삽입하였다. TEM 이미지를 통하여 육각형의 판상형으로 성장하는 LDH결정이 부피가 큰 Gd-DTPA분자의 영향으로 가로 30-60 nm, 세로 50-150 nm 정도의 직사각형 형상을 보임을 확인하였고(Fig. 2B), Gd-DTPA분자의 함량이 증가함에 따라 T1 이완도가 증가하는 결과를 보여 Gd-DTPA/LDH 조영제로서의 가능성을 보였다.17)
조영제 개발에 있어서 명확한 이미지를 제공하는 조영제는 물론 중요하다. 하지만 보통의 조영제의 경우 목표물만을 효과적으로 조영 할 수 있지는 않다. 하여 목표지향적으로 질병 부위에서 보다 우수한 조영효과를 나타내는 조영제 관련 연구가 각광을 받고 있다. 예를 들면, pH 에 민감한 반응을 보이는 조영제는 약산성의 종양서식 미세환경에서 주변세포와는 구분되는 보다 우수한 조영효과를 보여 질병 진단 및 치료에 효과적이다.9)
Xu 연구팀에서는 그간, 약한 산성 조건에서 낮은 민감 성을 보여 암세포 조영에 낮은 효율을 보이던 Mn 기반 조영제의 단점을 보완한 pH 초민감도 Mn 기반 LDH 나노입자를 합성하였고, 권위있는 유명 학술지인 Advanced materials에 보고 하였다.9)
MgCl2와 AlCl3 용액을 공침법으로 합성한 MgAl-LDH에 호스트층에서 일부 Mg2+ 이온을 Mn2+ 이온으로 치환하여 성공적으로 MgMnAl-LDH를 합성하였다. 이후 특성평가를 위해 원소 맵핑, TEM 이미지, STEM 이미지, XRD 패턴 분석 등이 이루어 졌다(Fig. 3A). XRD 패턴분석에서 MgMnAl-LDH는 (003), (006), (009), (015), (018), (110), (113)면에서 X선 회절이 일어났고, 이는 MgAl-LDH와 비교하여 유사한 결과를 보여준다. 저자는 이러한 결과를 Mn 이온(유효 이온반경: 83 pm)이 Mg 이온(유효 이온반경: 72 pm)을 대신하여 성공적으로 치환되었으며, MgMnAl-LDH의 층간 간격은 0.783 nm로, MgAl-LDH의 층간 간격(0.776 nm)과 거의 유사하며, 결정 구조를 변화시키지 않는다고 설명하였다.
Fig. 3.
A. (a) TEM image, (b) STEM image, (b1), (b2), (b3), (b4) element mapping, (c) XRD patterns of three samples, B. (a) T 1 relaxivity graph according to pH condition, (b) Bonding structure change diagram of MgMnAl-LDH according to the pH (pH 7.4 to 5.0), C. In vivo MRI T 1 imaging of BSA/Mn-LDH.15)
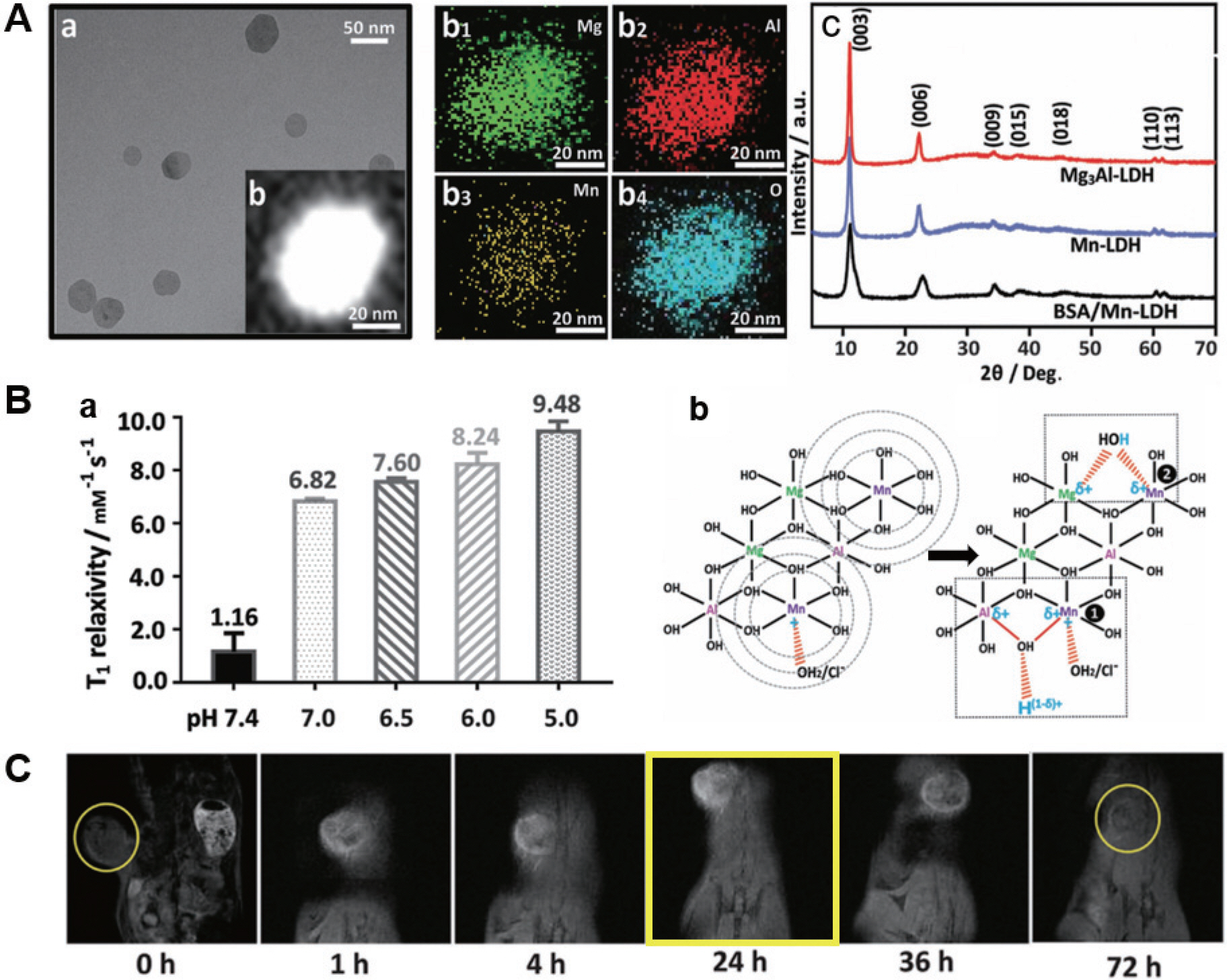
pH에 따른 세포 내 T1 가중이완도를 측정하기 위해 실제 생체내의 pH 농도 (정상체액 pH ≈ 7.4, 종양서식 미세환경 pH = 6.5-7.0, early endosome pH ≈ 6.0, late endosome/lysosome ≈ 5.0)와 유사한 5개의 다른 pH 완충액 조건(pH = 7.4, 7.0, 6.5, 6.0, 5.0)에서 실험을 진행하였는데, 37℃에서 4시간동안 배양하였을 때 시판되는 Gd-DTPA 복합체(약 3.4 mM−1 s−1)보다 훨씬 우수한 이완도(pH 5.0, 9.48 mM−1 s−1, pH 7.0, 6.82 mM−1 s−1)를 보였고((Fig. 3B(a)) 기 보고된 Mn 기반 나노 입자의 이완도 보다 높은 값을 나타내어 pH 에 극히 민감한 특성을 보여주었으며, 종양조직을 영상화 하는데 매우 효과적이라고 보고되었다. 저자는 이러한 현상을 pH 변화에 따른 Mn 이온의 미세구조 변화로 설명하고 있다(Fig. 3B(b)). 생체 내 적합성을 확인하기 위하여 독성평가도 진행되었는데, MgMnAl-LDH 나노입자의 농도가 최대 200 μgmL−1인 조건하에 72시간 배양 시 세포 생존율은 90% 이상으로 관찰되어 Gd 기반 조영제에 비해 낮은 독성을 보였다. 생체 내 생리환경에서의 나노 입자 응집을 막기 위해 MgMnAl-LDH에 BSA(소혈청 알 부민)를 코팅하여 실험을 진행하였고 코팅 전후 결정구조 및 pH에 민감하게 반응하는 등 특성에는 영향을 미치지 않는 것으로 확인되었다. 이를 통한 생체 내 MRI T1 이미지에서 기존 Gd 기반 조영제에 비해 대폭 연장된 최대 72시간까지 조영효과를 보였다. 정맥 내 주사 1시간 후 종양 부위에서 명확한 T1 강화 신호가 관찰되었고 24시간 이후 가장 명확한 이미지가 관찰되었다(Fig. 3C). 이러한 특성을 바탕으로 본 연구에서 개발된 MgMnAl-LDH 나노 조영제는 종양 부위에 효율적으로 내재화될 수 있고, 생체 내에서 기존 Gd 기반 조영제(2시간 미만) 대비 2일 이상의 긴 기간 동안 효과적으로 MR 영상을 관찰할 수 있어 질병의 치료 및 모니터링에 획기적인 대안을 제시할 수 있을 것으로 전망된다.
2.2. LDH 나노하이브리드 기반 듀얼 이미징 조영제
나노기술의 급속한 발전으로 다양한 나노 재료가 개발되면서 표적성을 향상시키고 비특이적 성질을 줄일 수 있는 새로운 분자영상 조영제의 개발로 이어져 급격히 발전해 왔다. 바이오 이미징 기술은 MRI 외에도 대표적으로 핵영상(positron emission tomography, PET), 형광이미징, CT 등 민감도와 공간 분해능이 서로 다른 다양한 영상법을 통해발전을 거듭해왔다.19–22) 하지만, 단일 이미징 방식으로는 정확도가 떨어져 오진 가능성 등 한계가 있다. 하여 다양한 질환의 보다 정확한 진단을 위하여 이러한 영상기법들을 조합하는 듀얼 이미징 (MRI/CT, MRI/PET, PET/CT, 형광이미징/MRI 등)이 중요한 수단으로 부각되어 많은 연구가 진행되고 있다.23–27) LDH의 화학적, 생물학적, 구조적특징은 듀얼 이미징을 제공할 수 있는 충분한 가능성을 가지고 있으며, 이를 바탕으로 LDH 기반 듀얼 이미징 조영제 연구가 활발히 진행되고 있다. Jianlin Shi 연구팀은 Gd-LDH/Au nanoparticle (NP) 나노복합체를 합성하여 CT/MRI 듀얼 이미징을 제공할 수 있는 LDH 기반 나노 조영제를 합성하였다고 보고하였다.16) 공침법을 통하여 MgAl-LDH의 호스트층에 Gd3+ 이온을 도핑 하였고, Au NPs를 Gd-LDH 표면에 침착 시킨 후 환원시켜 Gd-LDH/Au NP를 합성하였고 SEM 이미지(Fig. 4B) 및 기타 분석을 통하여 그 특성을 평가하였으며, 일반적인 CT, MRI 조영제보다 현저히 높은 조영효과를 보이는 우수한 듀얼 이미징 조영제임을 입증하였다.
Fig. 4.
A. Diagram of Gd-LDH/Au NP nanoparticles, B. SEM image of Gd-LDH/Au NP, C. T1 relaxivity plot of aqueous suspension of Gd-LDH/Au NP, in vivo T1−imaging 2hours after administration, D. CT value plots of aqueous solutions of iobitridol and Gd-LDH/ Au NP at different concentrations, in vivo CT imaging 2hours after administration.16)
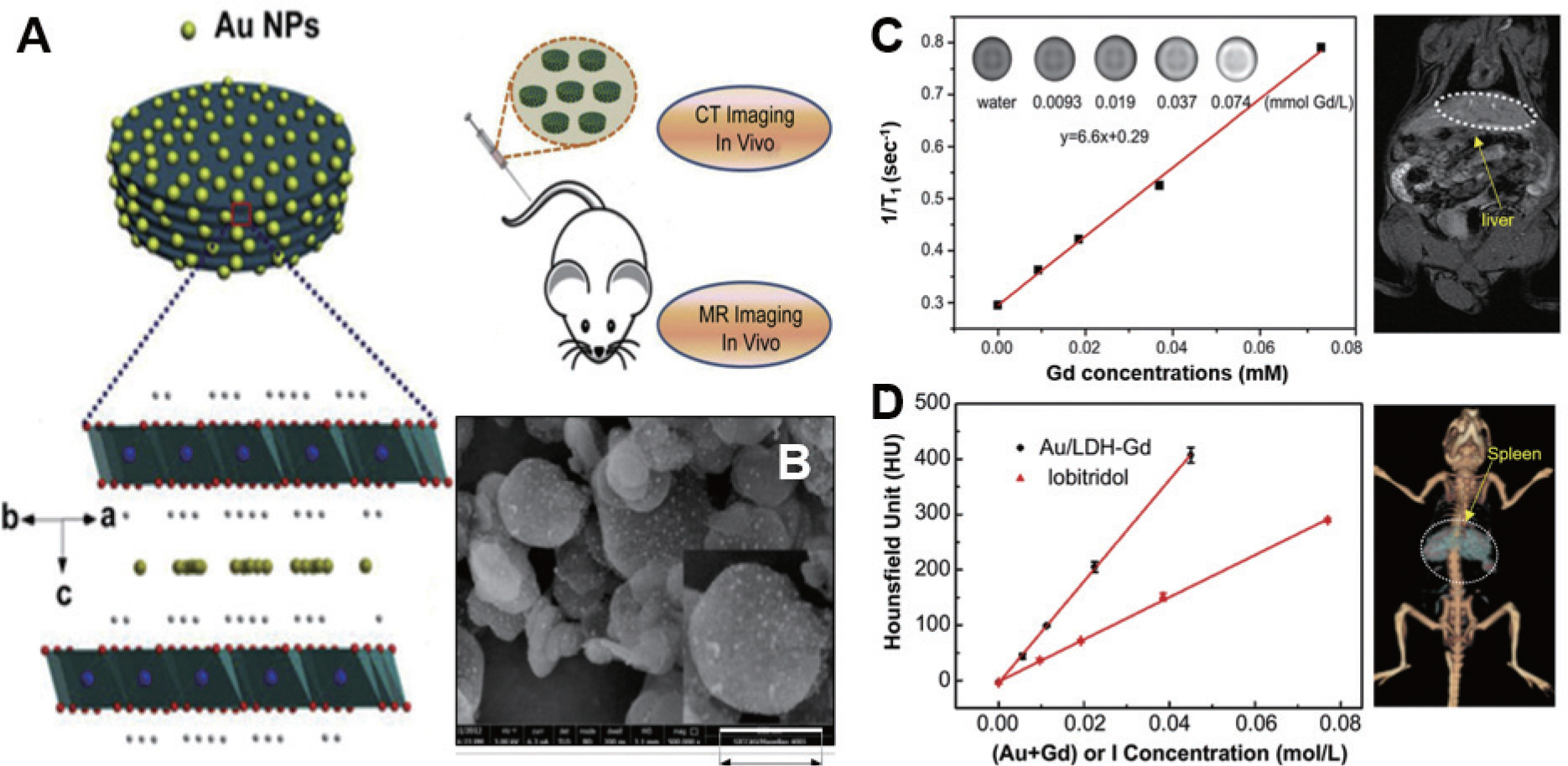
합성된 Gd-LDH/Au NPs 복합체는 Au NPs 합성과정에서 산 에칭 영향으로 Gd-LDH(48.0 m2/g) 대비 2배 이상 높은 비표면적(112.9 m2/g)을 가지게 되며, 이로 인해 도핑 된 Gd 이온이 물분자내 수소원자핵에 쉽게 접근할 수 있으며, 스핀-격자 완화시간에 영향을 미쳐 MRI 이미징 효과를 향상시킨다고 한다. 실제 데이터를 살펴보면, Gd-LDH/Au NP의 r1값은 6.6 mM−1 s−1으로서, Gd-LDH(2.4 mM−1 s−1)보다 월등히 높은 값을 보인다(Fig. 4C). 해당 연구에서는 입자크기가 약 3.4 nm인 Au NP을 Gd-LDH 표면에 기능화 시켜 CT 조영제로서의 활용 가능성을 제시하였다. 또한, 문헌에 따르면 높은 원자번호를 갖는 Gd 이온은 CT영상에서 높은 감쇠능력을 가질 수 있다고 한다.28) 이를 고려하여 보고된 Gd-LDH/Au NP 나노조영제는 시판되는 CT 조영제 iobitridol와 비교하여 동일한 농도에서 약 2.5배 높은 HU값을 보임으로서 향상된 CT 이미징 조영제 효과를 나타냈다(Fig. 4D).
생체 내 CT/MRI 듀얼 이미징 효과를 입증하기 위하여 동물실험을 추가로 진행하였다. 유방암 murine 4T1 종양에 개발한 나노조영제를 정맥주사한 후 CT/MRI 이미징을 통하여 주사 전, 주사 각각 1시간, 4시간 후의 영상을 획득하여 분석한 결과 CT 영상효과를 정량적으로 나타내는 HU값이 28.9에서 각각 60.2, 80.2로, MR T1 강조 신호가 4688.7에서 각각 4904.5, 5166.7로 뚜렷한 향상 효과를 나타냈다.
최근 연구에 따르면 Gd3+ 이온을 도핑 한 LDH에 Fluorescein isothiocyanate (FITC)를 표면 흡착하여 MRI/형광 듀얼 이미징을 제공하는 연구가 진행되었다. 성공적으로 합성된 Gd-LDH/FITC는 만족스러운 MRI 및 형광이미징을 제공하여 질병의 진단 및 치료에서 시너지 효과를 낼 수 있는 듀얼 이미징 소재로 보고되었다.29)
Gd-DTPA/FITC는 2002년 그들 그룹에서 발표한 SNAS (separate nucleation and aging steps) 방법을 통하여 합성되었다.30) 콜로이드 분쇄기에서 매우 빠른 혼합 및 핵 생성 과정을 거친 다음 에이징 시키는 방법을 통한 이 합성법은 일반적인 공침법에 의해 합성된 LDH 와 비교하여 매우 치밀한 결정을 가질 수 있다. Mg(NO3)2·6H2 O, Al(NO3)3·6H2 O, Gd(NO3)3·9H2 O, DOX, NaOH, FA 등을 사용하여 콜로이드 분쇄기에서 1분간 혼합하였고 이후 3neck-bottle로 옮겼다. 이 과정에서 FITC 용액이 첨가되었고, 24시간동안 60℃에서 수열합성 하였다. 이후 원심분리 및 건조과정을 거친 후 최종 합성물이 완성되었다.
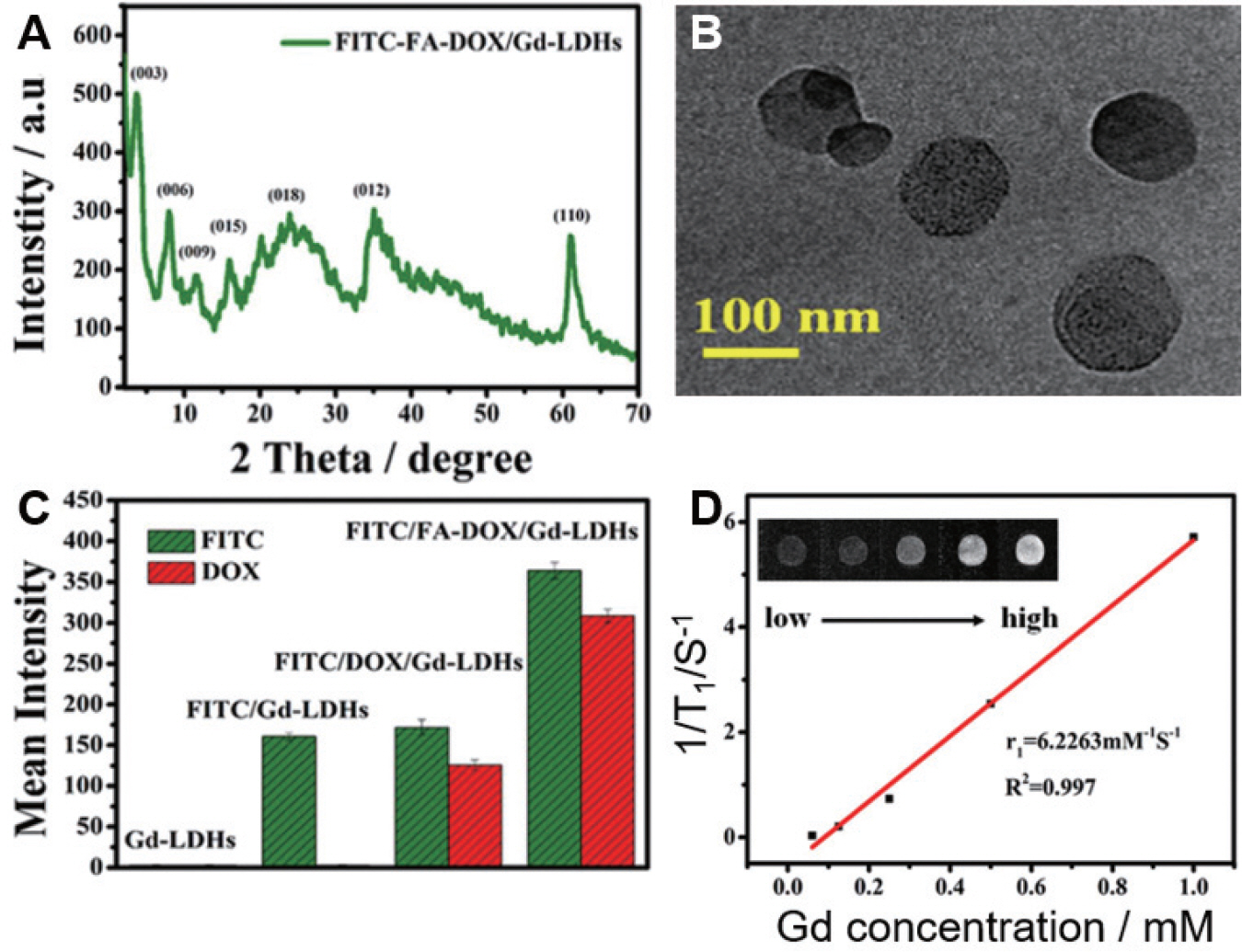
XRD 분석을 통해 Gd-LDH/FICT가 2θ 10.18°에서 (003)면 회절이 일어나므로 FICT가 표면에 잘 흡착되었음을 확인하였다(Fig. 5A). 또한, DOX와 FA의 혼입 후 결정의 (003)면이 2θ 10.18°에서 4.19°로 이동하면서 층간간격이 0.86 nm에서 2.21 nm로 확장되어 FA와 DOX 가 층간에 삽입되었음을 확인하였다. SEM 및 HRTEM 이미지에서 보여주다시피 합성된 Gd-LDH/FITC는 육각형의 모양을 띄며 약 100 nm 크기의 균일한 입자크기를 갖는다(Fig. 5B). 형광이미징 성능평가에 앞서 FITC 분자의 응집으로 인한 fluorescence quenching (형광 감도를 감소시키는 일련의 과정)이 예상되었기 때문에 FITC의 양을 다르게 한 몇 가지의 샘플이 준비되었는데, Gd(2.5%)-LDH/FITC(5.0%)의 샘플이 농도범위 15 ~400 μg/mL에서 최대의 형광성능을 보였으며, 양자화된 FITC 자체에 비해 1.63배 우수한 형광성능을 보였다. 또한, Fig. 5C에서 볼 수 있듯이 DOX는 붉은색의 형광이미징을 보였고, FA의 층간삽입은 양호한 세포표적 효과를 보여주어 FA가 삽입되지 않은 샘플과 비교하였을 때 약 2.11배의 강한 형광이미징을 보였다. Gd3+이온의 7개의 비공유전자는 수소 원자핵의 종 방향 이완성을 향상시키는데 도움이 된다.16,31) 그림에서 볼 수 있듯이 MRI T1 이미지는 Gd3+ 이온의 농도에 따라 증가되었으며, 이는 곧 종 방향 이완속도(1/T1)와 Gd3+ 농도 사이의 선형 관계를 나타내며, r1값은 6.22 mM−1 S−1로 측정되어 MR 및 형광이미징 모두 효과적인 이미지를 얻을 수 있으며, FA에 의한 세포표적화 기능을 겸비한 DOX의 효율적인 약물전달이 가능하여 다기능성 나노하이브리드 물질로 주목받고 있다.
Fig. 5.
A. XRD pattern of Gd-LDH/FITC, B. HRTEM image, C. Fluorescence sensitivity comparison of 4 samples, D. T1 relaxivity by Gd concentration of Gd-LDH/FITC. 27)
2.3. LDH 나노하이브리드 기반 MRI 및 동시 약물 전달
앞서 서론에서 언급하였듯이 LDH는 호스트층 사이의 게스트층의 층간삽입, 호스트 층을 이루는 금속원소의 치환 및 표면 기능화가 가능한 2차원 층상형 구조특징과 우수한 생체 내 생분해성 및 생체 적합성으로 바이오 세라믹분야에서 나노하이브리드 물질로 주목받고 있다. 1999년 국내의 연구팀으로부터 LDH의 게스트층에 DNA를 삽입하여 최초의 바이오 세라믹 나노하이브리드 물질로 발표한이래32) 수많은 연구자들이 바이오물질의 층간삽입을 시도하였으며, 암 등의 질병을 치료하기 위한 약물 도입을 통한 약물전달 시스템 관련 연구 또한 지속적으로 진행되고 있다.33–36) 바이오 이미징과 동시 약물전달의 다기능 하이브리드는 물론 흥미로운 주제였고, 많은 연구결과가 보고되었다.
2017년 호주의 Xu 연구팀에서는 MnAl-LDH에 siRNA를 흡착하여 Mn원소를 통한 MRI T1 조영제 기능과 더불어 유전자 전달이 가능한 다기능성 물질을 합성했다고 보고했다.37) MnAl-LDH를 운반체로 하는 siRNA 는 단독으로 행동하는 siRNA보다 높은 암세포 사멸효과를 보여 효과적인 운반체로 확인되었고, Mn원소에 의한 T1 이미지 조영효과는 시판되는 Gd 착화물 조영제(r1=3.4 mM−1 S−1)보다 높은 r1=4.47 mM−1 S−1로 우수한 조영효과 를 보이는 유전자 전달 물질로 보고되었다.
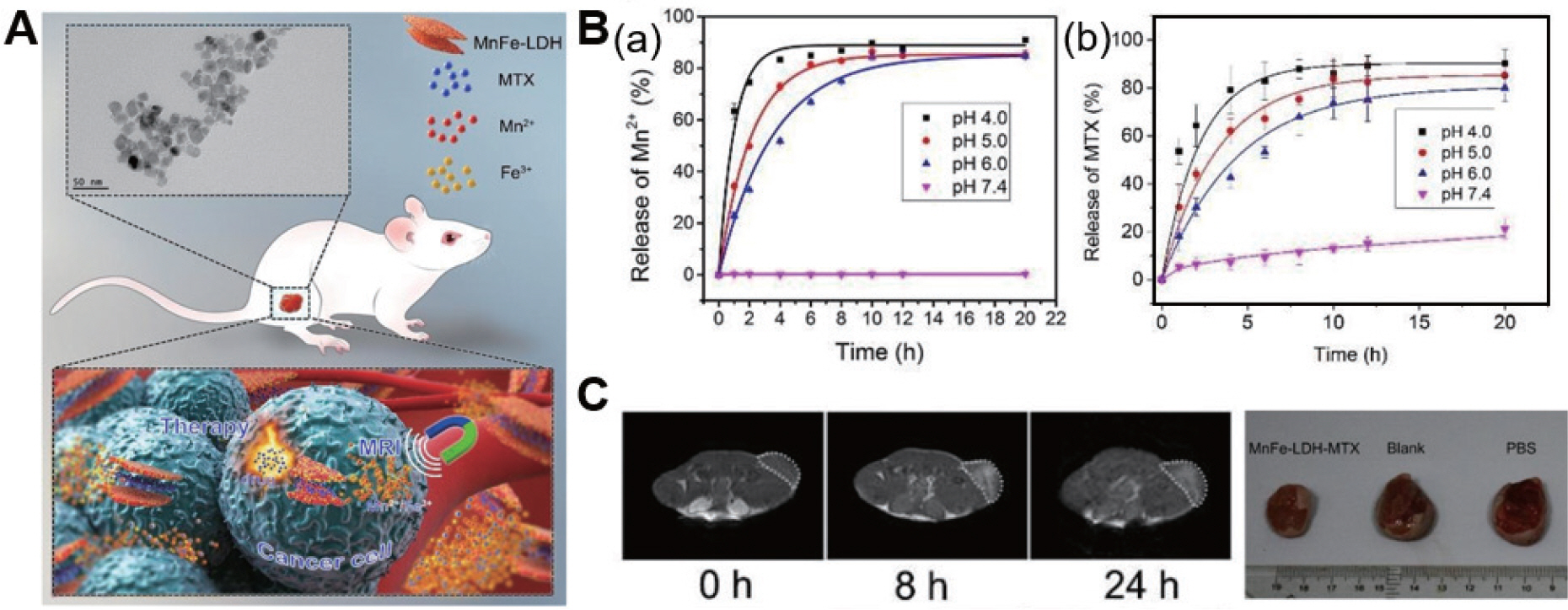
중국의 Yang 연구팀은 MnFe-LDH를 공침법에 의하여 합성하였고. 항암제인 MTX (Methotrexate)를 층간삽입한 MTX/MnFe-LDH를 발표하였다.38) 합성된 MTX/MnFe-LDH는 pH에 민감하게 반응하는 효과적인 나노치료플렛폼이라고 보고하였다.
Mn2+: Fe3+=3:1의 몰 비로 합성된 MnFe-LDH는 XRD및 TEM, AFM, XPS, EDX, ICP-MS등의 분석을 거쳐 그 구조 및 특성이 명확하게 판별되었다. XRD 및 TEM 이미지(Fig. 6A), AFM분석결과 합성물은 19.9±2.9 nm의 육각 판상형의 구조 및, 7.1 Å의 층간간격. 전체 2.6 nm의 높이를 가진다. XPS 스펙트럼 분석에서 Mn원소와 Fe원소의 광전자선을 나타내어 성공적인 합성을 재차 확인하였으며 EDX 분석에서 매우 균일한 원소분포를 보였다. 또한 EDS 및 ICP-MS분석을 통해 약 Mn: Fe=2.83:1의 질량비를 갖는 것이 확인되었다. MTX를 층간삽입한 이후 XRD패턴은 (003)면이 0.71 nm에서 1.4 nm로 증가함을 보여주어 MTX이 성공적으로 삽입되었음을 증명했다. HPLC분석에 의해 W MTX/W[Fe+Mn]는 10.05%로 확인되었다. MTX/MnFe-LDH의 pH에 따른 거동을 확인하기 위해 상이한 pH 조건에서 실험을 진행하였다. MRI 조영제로서의 성능을 확인한 결과 pH 7.4에서 0.083±0.015 mM−1 s−1의 미약 한 값을 나타냈지만, pH 6.0, pH 5.0, pH 4.0에서 각각 7.83±0.11 mM−1 s−1, 8.28±0.10 mM−1 s−1, 8.47±0.090 mM−1 s−1의 값을 나타내어 시판중인 Gd 복합체보다 향상된 조영효과를 보여주는 pH 반응성 MRI 조영제로서의 성능을 확인하였다. 산성환경은 LDH에서 Mn2+, Fe3+이온의 방출을 유발하며 방출된 이온과 주변 물분자의 효율적인 상호작용이 가능하게 하여 기인한 결과이다(Fig. 6B(a)). 마찬가지로 HPLC 분석을 통해 MTX/MnFe-LDH의 pH에 따른 약물방출 거동을 확인하였다. 그 결과로 pH 7.4에서 20시간 처리하였을 때 MTX 21%만 방출되었다. 하지만 pH 6.0, pH 5.0, pH 4.0에서 80%, 85%, 90%의 약물이 방출되어 양호한 결과를 보였다(Fig. 6B(b)). 또한, MTT assay를 통하여 실시된 세포실험에서 MTX 자체보다 낮은 독성을 보였다. Fig. 6C에서 보이듯 동물실험에서 확인된 조영효과는 투여 8시간 후에 가장 명확한 영상을 취득할 수 있었고 최대 24시간까지 그 조영효과가 유지되었다. S180 종양에 대하여 20일간 투여 후 분명한 종양성장억제효과를 보여 우수한 pH 반응성 T1 MRI 이미징을 이용한 진단 및 동시 MTX 약물 전달이 가능한 진단·치료플렛폼으로의 다양한 응용가능성을 보여주었다.
Fig. 6.
A. Schematic of MTX/MnFe-LDH with TEM image, B.(a) Release of Mn2+ ions by time and pH, (b)Release of MTX by time and pH, C. MRI T1 image after administration of MTX/MnFe-LDH in S180 tumor cells and tumor size comparison after 20 days of administration.38)
결론
본 리뷰에서는 세라믹 LDH 나노하이브리드 소재와 질병의 예방, 진단, 치료에 크게 밀접해 있는 바이오 이미징 기술 중 하나인 MRI를 결합시킨 LDH 기반 MRI 조영제의 연구동향에 대해 소개하였다. LDH의 구조적 특징과 우수한 생체적합성, 생분해성은 MRI 조영효과를 가질 수 있는 조영제 물질을 도입하여 나노 조영제를 제조하기에 적합했고 도입된 조영제 물질이 단독으로 작용할 때보다 더 나은 효과를 보였다. 또한, CT/MRI, 형광이미징/ MRI 등의 듀얼 이미징을 통하여 더 명확인 이미지를 제공하기 위한 연구결과는 충분한 가능성을 보이고 있으며 MRI 조영효과 및 동시약물전달은 새로운 진단•치료플랫폼을 형성하여 다양한 응용 가능성을 보여주면서 활발한 연구가 진행되고 있다.
질병의 예방, 진단, 치료에 있어서 명확한 바이오 이미징은 매우 큰 의미를 가지며, 많은 연구자, 의학계열 종사자들이 해결해야 할 과제 중 하나이다. 보다 우수한 조영효과를 보이는 조영제, 한가지의 조영제로 듀얼 이미징이 가능해 각각의 단점을 극복하고 장점을 극대화할 수 있는 조영기술, 질병의 진단 및 동시 치료 플랫폼은 정확한 질병의 조기 진단을 실현하고 질병의 치료과정을 모니터링하며, 나아가 맞춤형 치료법 개발을 가속화할 수 있는 발판을 제공할 수 있을 것으로 전망되며 LDH는 이를 가능하게 할 수 있는 획기적인 세라믹 물질로서 기대가 된다.